Method Article
مقايسة النواة الدقيقة على الدم الكامل المحفوظ بالتبريد
In This Article
Summary
نقدم هنا بروتوكولا محسنا لمقايسة النواة الدقيقة المكونة من كتلة السيتوكينات على عينات الدم الكاملة المحفوظة بالتبريد. هذه الطريقة المثلى للحفظ بالتبريد للدم الكامل لتحليل النواة الدقيقة هي تقنية موثوقة لأخذ العينات على نطاق واسع والدراسات متعددة المراكز ويمكن استخدامها في المقايسات الأخرى المتعلقة بالدم أيضا.
Abstract
مقايسة النواة الدقيقة في كتلة السيتوكينات في المختبر (CBMN) هي تقنية مستخدمة على نطاق واسع في أبحاث البيولوجيا الإشعاعية ، وقياس الجرعات البيولوجية ، ودراسات السمية الجينية ، واختبار الحساسية الإشعاعية في المختبر . تعتمد هذه الطريقة الوراثية الخلوية على اكتشاف النوى الدقيقة في الخلايا ثنائية النواة الناتجة عن شظايا الكروموسومات المتخلفة أثناء انقسام الخلايا. عينات الدم الكاملة الطازجة هي أكثر أنواع العينات المفضلة لفحص CBMN. ومع ذلك ، فإن عيوب العمل مع عينات الدم الطازجة تشمل المعالجة الفورية بعد جمع الدم والعدد المحدود من التحليلات المتكررة التي يمكن إجراؤها دون أخذ عينات دم إضافية.
نظرا لأن الحاجة إلى عينات دم جديدة يمكن أن تكون صعبة من الناحية اللوجستية ، فإن مقايسة CBMN على عينات الدم الكاملة المحفوظة بالتبريد ستكون ذات فائدة كبيرة ، خاصة في دراسات المرضى واسعة النطاق. تصف هذه الورقة بروتوكولا لتجميد عينات الدم الكاملة وإجراء فحص CBMN على عينات الدم المجمدة هذه. تم تجميد عينات الدم من المتطوعين الأصحاء وإذابتها في نقاط زمنية مختلفة ثم إخضاعها لبروتوكول فحص النواة الدقيقة المعدل. توضح النتائج أن هذا الإجراء الأمثل يسمح بأداء مقايسة CBMN على عينات الدم المجمدة. قد يكون بروتوكول الحفظ بالتبريد الموصوف مفيدا جدا أيضا للمقايسات الوراثية الخلوية الأخرى ومجموعة متنوعة من المقايسات الوظيفية التي تتطلب تكاثر الخلايا الليمفاوية.
Introduction
منذ اكتشافه ، كان استخدام الإشعاع المؤين (IR) موضع نقاش بين الباحثين بسبب آثاره الضارة على الكائنات الحية. عادة ما يتجلى التأثير الضار من خلال تلف الحمض النووي مثل الفواصل المزدوجة التي تقطعت بها السبل (DSBs) ، ويؤدي الفشل في إصلاح هذه DSBs إلى انحرافات وطفرات كروموسومية ، وهي سمات مميزة مهمة للسرطان 1,2. يمكن فحص هذه الانحرافات الكروموسومية بواسطة المقايسات الخلوية مثل مقايسة النواة الدقيقة لكتلة السيتوكينات (CBMN). النوى الدقيقة هي شظايا كروموسومية متخلفة لا يمكن دمجها في النوى البنوية، ومن ثم تترك وراءها أثناء الانقسام الميتوزي.
CBMN هي تقنية وراثية خلوية شائعة الاستخدام وموثوقة لتقييم تلف الكروموسومات لدى الأفراد المعرضين للإشعاع المؤين في الجسم الحي أو في المختبر. يمكن استخدام الدم الكامل الطازج أو خلايا الدم أحادية النواة المحيطية المعزولة (PBMCs) في اختبار CBMN. الدم الكامل الطازج هو في الغالب المادة البيولوجية المفضلة لأن عزل ومعالجة PBMCs يمكن أن يستغرق وقتا طويلا ويرافقه فقدان بلازما المصل التي تعمل كوسيط داعم لبقاء الخلايا ونموها. لتحقيق محصول جيد من الخلايا ثنائية النواة ، يجب معالجة الدم الكامل الطازج مباشرة بعد جمعه. ومع ذلك ، يمكن أن تكون الحاجة إلى المعالجة الفورية صعبة من الناحية اللوجستية أثناء ضيق الوقت. علاوة على ذلك ، عندما يفترض الحصول على العديد من العينات على مدى فترة طويلة أو جمعها في نقاط بعيدة عن مراكز المعالجة ، يمكن أن يكون تخزين عينات الدم الطازجة عاملا مقيدا 3,4.
علاوة على ذلك ، للسماح بتحليل MN المتكرر في نفس الفرد / المريض ، سيكون تجميد عينات الدم مفيدا. تتمثل إحدى طرق تخزين الخلايا الليمفاوية للتطبيق اللاحق لمقايسة CBMN في تجميد PBMCsالمعزولة 5,6. ومع ذلك ، تتطلب هذه التقنية عدة خطوات معالجة قبل تجميد PBMCs. لذلك ، فإن الحفظ بالتبريد للدم الكامل سيمثل بديلا بسيطا وفعالا من حيث الوقت للحفظ بالتبريد ل PBMCs المعزولة. لا يتوفر سوى القليل من المعلومات المتعلقة باستخدام الدم الكامل المجمد للمقايسات الوراثية الخلوية أو المقايسات التي تتطلب تكاثر الخلايا الليمفاوية. تشير ورقة واحدة فقط إلى استخدام الدم الكامل المحفوظ بالتبريد لتحليل الطورالاستوائي 7.
نظرا لأن الحفظ بالتبريد للدم الكامل سيوفر العديد من المزايا في مجال المراقبة الحيوية وقياس الجرعات الحيوية وتقييم الحساسية الإشعاعية ، فقد قامت مجموعتنا بتحسين بروتوكول الحفظ بالتبريد للدم الكامل الذي يسمح بتطبيق اختبار CBMN8. لقد أثبتنا أن الخلايا الليمفاوية الموجودة في مزارع الدم الكاملة المحفوظة بالتبريد تحتفظ بسلامتها الجينومية وقدرتها على الانتشار لمدة 1 سنة على الأقل. في ورقة الطرق هذه ، نصف بالتفصيل إجراء الحفظ بالتبريد وبروتوكول فحص CBMN ، والذي تم تحسينه بواسطة Beyls et al.8 ، والإبلاغ عن النتائج التي تم الحصول عليها لعينات الدم المجمدة ل 30 فردا سليما. بالنسبة لفحص CBMN ، تم تشعيع مزارع الدم في المختبر بجرعات 0.5 و 1 و 2 Gy لتقييم استجابة MN في الخلايا الليمفاوية لعينات الدم الكاملة المحفوظة بالتبريد.
Protocol
في هذه الدراسة ، تم جمع عينات الدم عن طريق بزل الوريد من 30 متبرعا صحيا تتراوح أعمارهم بين 17 و 65 عاما. تم إعادة استخدام بيانات MN من 20 متبرعا من ورقة Beyls et al.8 يتوافق جمع عينات الدم مع المبادئ التوجيهية للجنة الأخلاقيات في مستشفى جامعة غنت (رقم التسجيل: 2019/1565) ، بلجيكا. تم الحصول على موافقة خطية مستنيرة من جميع المشاركين. انظر جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والكواشف المستخدمة في هذا البروتوكول.
1. جمع عينات الدم
- قبل البدء ، تأكد من توفر الموافقة الخطية المستنيرة للمشاركين واتباع الإرشادات الأخلاقية بشكل صحيح.
- اجمع الدم في أنابيب Li-Heparin واحفظه في درجة حرارة الغرفة حتى يصبح جاهزا للمعالجة للحفظ بالتبريد.
2. الحفظ بالتبريد للدم الكامل
ملاحظة: يتم إجراء جميع الخطوات حتى يتم حصاد الخلايا بشكل معقم في تدفق الهواء الصفحي المعقم.
- للحفاظ على 1 مل من الدم بالتبريد ، اصنع 1 مل من وسط التجميد عن طريق خلط 800 ميكرولتر من مصل عجل الجنين (FCS) و 200 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO).
ملاحظة: يتم تحضير وسط التجميد بحجم مساو لعينات الدم التي يجب تجميدها. - للحفظ بالتبريد للدم الكامل ، انقل عينة الدم من أنبوب الهيبارين إلى أنابيب طرد مركزي سعة 15 أو 50 مل
ملاحظة: تعتمد سعة الأنبوب على حجم الدم. - دوامة الدم بسرعة منخفضة مع إضافة مستمرة ولكن قطرة من حجم متساو من وسط التجمد.
- نقل 2 مل من مزيج تجميد الدم إلى كريوفيال (2 مل) حيث تحتوي كل حصة على 1 مل من عينة الدم الممزوجة ب 1 مل من خليط التجميد.
- تجميد تدريجي تدريجي
- انقل الكريوفيالات إلى صندوق تبريد يحتوي على الأيزوبروبانول وضعها في الفريزر (-80 درجة مئوية) طوال الليل.
- نقل cryovials إلى النيتروجين السائل للاستخدام على المدى الطويل.
3. ذوبان الدم المحفوظ بالتبريد
ملاحظة: للحد من الوقت الإجمالي لعملية الذوبان ، يجب التعامل مع 8 كريوفيال كحد أقصى (2 مل لكل منهما) في المرة الواحدة.
- اعداد
- قم بتسخين 200 مل من المحلول الملحي المعقم المخزن بالفوسفات (PBS) إلى 37 درجة مئوية قبل إذابة الدم.
- إعداد حل عملي لوسط الاستزراع المطلوب في ظل ظروف معقمة. تأكد من أن الوسط لكل مزرعة يحتوي على 1.6 مل من الوسط الكامل: وسائط معهد روزويل بارك التذكاري (RPMI) مكملة بالبنسلين / الستربتومايسين (0.5٪) ، 0.2 مل من FCS ، 20 ميكرولتر من بيروفات الصوديوم ، و 2 ميكرولتر من β-mercaptoethanol.
ملاحظة: نظرا لأنه يمكن فقدان عدد كبير من خلايا الدم أثناء الذوبان ، يتم استزراع الدم المذاب في آبار صغيرة مثل 24 صفيحة بئر بحجم إجمالي 2 مل. يتم استخدام لوحة واحدة متعددة الآبار لكل جرعة. - لكل بئر مزرعة ، أشر إلى رمز المتبرع و A / B على الغطاء جنبا إلى جنب مع التاريخ والجرعة ، كما هو مقترح أدناه (الشكل 1).
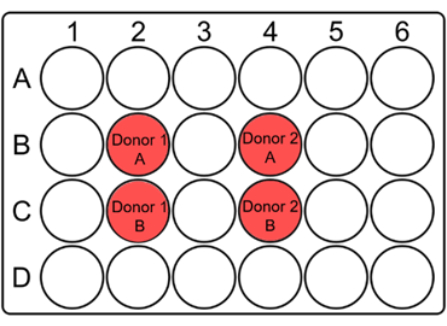
الشكل 1: التخطيط المقترح للوحة 24 بئرا لزراعة الدم الكامل لفحص النواة الدقيقة. ضع علامة على الآبار وأشر إلى رموز المانحين في الأماكن المناسبة على الغطاء. لكل عينة مريض ، يجب أن تكون الآبار المكررة مجاورة لبعضها البعض. لاحظ أنه تخطيط موحي لميزاء 10 × 10 ويمكن تغييره وفقا لحجم ميزاء أو عينات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- خطوات ذوبان وزراعة الدم الكامل
- قم بتسخين حمام الماء إلى 37 درجة مئوية.
- أخرج المبردات المطلوبة من النيتروجين السائل (يعتمد العدد على المتطلبات مثل عدد الجرعات).
ملاحظة: يحتوي المبرد الواحد على 1 مل من الدم و 1 مل من وسط التجمد. لذلك ، يمكن إنشاء ثقافتين بالدم من cryovial واحد. - قم بإذابة الجليد جزئيا في حمام الماء الدافئ (حتى لا تزال تظهر بلورات الثلج الصغيرة).
- أخرج القوارير من الحمام المائي ونظف الجزء الخارجي من القوارير بورق مناديل معقمة.
- في غطاء تدفق الهواء الصفحي المعقم ، افتح القوارير ببطء شديد لمنع فقاعات الهواء المتكونة داخل الأنابيب من الانسكاب.
- أعد تعليق محتويات كل قارورة وانقلها بشكل فردي إلى أنبوب طرد مركزي مخروطي سعة 15 مل (1 أنبوب لكل قارورة).
- إلى الأنابيب المعنية ، أضف قطرة قطرة 1 مل من برنامج تلفزيوني دافئ (37 درجة مئوية) أثناء تدوير الأنبوب برفق. أعد التعليق باستخدام ماصة P1000.
- للتخفيف والغسيل المنتظم ، أضف 7 مل من PBS المسخن مسبقا (37 درجة مئوية) وأعد التعليق باستخدام ماصة P1000.
- جهاز طرد مركزي الدم لمدة 8 دقائق عند 180 × جم (مع ضبط عند التسارع 1 ، الفرامل 1) في درجة حرارة الغرفة.
- خلال خطوة الانتظار هذه ، املأ الآبار الفارغة (بخلاف تلك التي سيتم فيها زراعة الخلايا) ب 500 ميكرولتر من برنامج تلفزيوني.
- ضع ألواح البئر مرة أخرى في الحاضنة للتسخين.
- بمجرد اكتمال الطرد المركزي ، قم بإزالة المادة الطافية بعناية ، تاركا وراءها حوالي 1 مل لتجنب إزعاج حبيبات الخلية.
- أعد تعليق الحبيبات في المادة الطافية المتبقية باستخدام ماصة P1000.
- أضف 8 مل من برنامج تلفزيوني دافئ (37 درجة مئوية) إلى الأنابيب المعنية أثناء تدوير الأنابيب برفق. بعد ذلك ، أعد التعليق باستخدام ماصة P1000.
- جهاز طرد مركزي الدم المعلق لمدة 8 دقائق عند 180 × جم (مع ضبط عند التسارع 9 ، الفرامل 9).
- خلال خطوة الانتظار هذه ، قم بنقل 200 ميكرولتر من وسط الاستزراع إلى كل بئر من الآبار المحددة.
- احتفظ بالألواح مرة أخرى في الحاضنة لتبقى عند 37 درجة مئوية.
- بعد الطرد المركزي ، قم بإزالة المادة الطافية بحركة مستمرة (لتجنب إزعاج حبيبات الخلية السائبة) ، ولكن اترك وراءك حوالي 80 ميكرولتر من المادة الطافية.
- إلى الحبيبات ، أضف 280 ميكرولتر من FCS (درجة حرارة الغرفة) وأعد التعليق (إلى حجم إجمالي 360 ميكرولتر).
- نقل 180 ميكرولتر من معلق الخلية إلى كل بئر وإعادة تعليقه (= 0.5 مل من "الدم" / الثقافة). يبلغ الحجم الإجمالي في كل بئر الآن 380 ميكرولتر ، مما ينتج عنه طبقة متوسطة 2 مم.
- احتضان الألواح في حاضنة CO2 عند 37 درجة مئوية لمدة 10 دقائق على الأقل قبل التشعيع.
4. مقايسة G0 MN
- أخرج الألواح من الحاضنة وقم بتشعيع ثقافة الخلية بالجرعات المطلوبة مثل الأشعة السينية 0.5 و 1 و 2 Gy (220 كيلو فولت ، 13 مللي أمبير ، 0.15 مم نحاس) في درجة حرارة الغرفة. استخدم العينات المشععة الوهمية كعناصر تحكم لتحديد عوائد MN التلقائية.
- بعد التشعيع مباشرة ، أضف 1.62 مل من وسط الاستزراع (37 درجة مئوية) إلى كل بئر.
- لتحفيز انقسام الخلايا في الخلايا اللمفاوية التائية ، أضف 40 ميكرولتر من Phytohemagglutinin (PHA) إلى كل بئر وأعد تعليقه جيدا.
- ضع هذه الألواح مرة أخرى في الحاضنة (5٪ CO2 ، 37 درجة مئوية).
ملاحظة: سيكون هذا هو وقت بدء الفحص. - منع التحفيز الخلوي بعد 23 ساعة من التحفيز عن طريق إضافة 8 ميكرولتر من السيتوكلاسين B (6 ميكروغرام / مل) لكل بئر وإعادة التعليق بشكل صحيح.
- حصاد مزارع الخلايا 70 ساعة بعد وقت التحفيز / الثقافة. أعد تعليق الخلايا ونقلها إلى أنبوب سعة 15 مل. شطف كل بئر مع 2 مل من برنامج تلفزيوني وإضافة هذا البرنامج الرسولي إلى أنبوب 15 مل المعني.
- أجهزة الطرد المركزي الأنابيب لمدة 8 دقائق في 180 × غرام ، في درجة حرارة الغرفة.
- تخلص من المادة الطافية ولكن اترك حوالي 500 ميكرولتر فوق الحبيبات.
- دوامة الحبيبات (بأقصى سرعة) وأثناء الدوامة ، أضف ببطء قطرة قطرة 2 مل من كلوريد البوتاسيوم البارد (KCl ، 4 °C).
- أجهزة الطرد المركزي على الفور الخلايا في 180 × غرام لمدة 8 دقائق.
- تخلص من المادة الطافية ، تاركا حوالي 500 ميكرولتر من المادة الطافية.
- دوامة الحبيبات (بأقصى سرعة) وأثناء الدوامة ، أضف ببطء قطرة قطرة 2 مل من المثبت البارد 1 (محلول الميثانول / حمض الخليك / رينجر بنسبة 4: 1: 5).
- اترك أنابيب العينة طوال الليل عند 4 درجات مئوية (الحد الأدنى 12 ساعة والحد الأقصى 96 ساعة).
- أجهزة الطرد المركزي لمدة 8 دقائق في 180 × غرام.
- تخلص من المادة الطافية.
- دوامة الحبيبات (بأقصى سرعة) وأثناء الدوامة ، أضف ببطء قطرة 2 مل من المثبت البارد 2 (الميثانول / حمض الخليك بنسبة 4: 1).
- أجهزة الطرد المركزي لمدة 8 دقائق في 180 × غرام.
- تخلص من المادة الطافية.
- دوامة الحبيبات (بأقصى سرعة) ثم أضفها ببطء (قطرة) ، بينما الدوامة ، 2 مل من المثبت البارد 2 إلى الحبيبات.
- اترك أنابيب العينة عند 4 درجات مئوية (الحد الأدنى 12 ساعة والحد الأقصى 96 ساعة).
- نظف الشرائح باستخدام الأيزوبروبانول وقم بتسميتها بشكل صحيح.
ملاحظة: استخدم الملصقات المطبوعة لوضع الملصقات حيث يمكن مسح حبر العلامة بسهولة أثناء المعالجة. - أجهزة الطرد المركزي أنابيب العينة لمدة 8 دقائق في 180 × غرام.
- نقل المادة الطافية إلى أنبوب آخر لتركيز الخلايا وفقا لحجم الحبيبات.
- دوامة بيليه.
- إسقاط 40 ميكرولتر من الخلايا الثابتة على شريحة جافة ونظيفة.
- دع الشرائح تجف في درجة حرارة الغرفة. تخزين الشرائح في مربع أو وصمة عار على الفور للمراقبة.
5. تلطيخ البرتقال أكريدين (AO)
- اغمر الشرائح في بقعة AO لمدة 1 دقيقة ، متبوعا بغسل سريع في الماء المقطر ، ثم ضع الشرائح في محلول الفوسفات (درجة الحموضة 6.8) لمدة 1 دقيقة.
- أخرج الشرائح من المحلول العازل وباستخدام ورق مناديل نظيف ، وجفف الجزء الخلفي من الشرائح ، وضع الشرائح على ورق مناديل نظيف.
- قم بإسقاط 20 ميكرولتر من المخزن المؤقت للفوسفات أعلى الشريحة وقم بتغطيته برفق بغطاء نظيف ، وتجنب فقاعات الهواء.
- ختم هذه الشرائح مع الاسمنت السيليكون.
ملاحظة: نظرا لأن AO حساس للضوء ويتلاشى بمرور الوقت ، للحصول على تباين لطيف ومضان ، يوصى بتسجيل الشرائح في غضون 5 أيام من تلطيخها. قم دائما بتخزين الشرائح في غرفة باردة (4 درجات مئوية) ، عندما لا يتم فحصها.
6. تسجيل الشرائح الملطخة
- ضع شريحتك تحت المجهر الفلوري وافحص 1000 خلية ثنائية النواة (BNs). عد يدويا MNs ، والتي تعد واحدة من المؤشرات الحيوية الستة للسمية. للقيام بذلك ، اطلب من اثنين من الهدافين المستقلين فحص 500 خلية BN / شريحة تحت نفس التكبير.
ملاحظة: فيما يلي بعض النقاط البارزة لمعايير التسجيل ، على النحو الموصى به من قبل Fenech لتسجيل الشرائح الملطخة9- حدد خلية BN من خلال البحث عن خلايا مستديرة بشكل جيد مع سيتوبلازم سليم ، مع نواتين متميزتين جيدا من نفس الحجم تقريبا والشكل المنتظم ونمط التلطيخ. تأكد من أن السيتوبلازم في خلية BN يمكن تمييزه عن السيتوبلازم في الخلية المجاورة.
- سجل MN ، مع ملاحظة أنه مطابق شكليا للنواة الرئيسية ولكنه أصغر منها ؛ حتى أكبر MN لا يمكن أن يكون أكثر من 1/3 من قطر النوى الرئيسية. سجل MN فقط إذا لم يلمس النوى الرئيسية أو على الأقل يمكن تمييز الحدود النووية الدقيقة عن حدود النوى الرئيسية.
النتائج
للتحقق من قابلية استنساخ البروتوكول ، أجرينا اختبار MN على عينات دم محفوظة بالتبريد ل 30 متطوعا سليما تتراوح أعمارهم بين 17 و 65 عاما. متوسط عمر المجموعة هو 35 سنة. تراوح وقت الحفظ بالتبريد من 1 أسبوع إلى 154 أسبوعا. بعد تعريض مزرعة خلايا الدم بأكملها لجرعات إشعاعية مختلفة (0.5 و 1 و 2 غراي) ، تم فحص إنتاج النوى الدقيقة في خلايا 1000 BN تحت المجهر. تشير الخلايا ثنائية النواة المستديرة بشكل جيد (كما هو موضح في الشكل 2) إلى استرجاع ناجح للخلايا السليمة القابلة للحياة من عينات الدم الكاملة المحفوظة بالتبريد. وتجدر الإشارة إلى أن الاستجابة الإشعاعية للخلايا الليمفاوية ظلت مستقرة بعد التخزين طويل الأجل في درجات حرارة منخفضة للغاية (النيتروجين السائل). وتتماشى هذه الملاحظة مع الاستجابة المتوقعة من عينات الدم الجديدة.
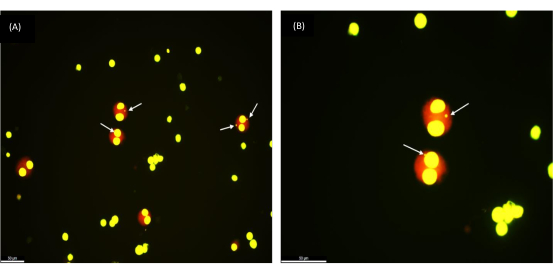
الشكل 2: النوى الدقيقة كما لوحظ في الخلايا ثنائية النواة المسترجعة من عينة دم كاملة مجمدة تم حفظها بالتبريد قبل عام واحد. (أ) التكبير 200x، (ب) التكبير 400x؛ الأسهم التي تشير إلى MNs. شريط المقياس = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
مع زيادة جرعات الإشعاع (0.5 و 1 و 2 غراي) ، لوحظت زيادة خطية تربيعية في إنتاجية النواة الدقيقة (الجدول 1 والشكل 3). تمثل غلة MN في عينات التحكم المشععة الوهمية (0 Gy) غلة MN الخلفية التي هي أساسا نتيجة للكروموسومات المتأخرة.
| الجرعة (غراي) | 0 | 0.5 | 1 | 2 |
| متوسط | 18 | 107 | 247 | 601 |
| إس دي | 10.8 | 23.9 | 53.3 | 101.1 |
| السيرة الذاتية (٪) | 59.9 | 22.3 | 21.6 | 16.8 |
| نطاق | 5-41 | 62-140 | 139-324 | 395-755 |
الجدول 1: نطاق ومعامل التباين جنبا إلى جنب مع متوسط غلة MN ، كما لوحظ في عينات الدم الكاملة المحفوظة بالتبريد ل 30 متبرعا صحيا ، مما يدل على التباين بين الأفراد. الاختصارات: CV = معامل الاختلاف ؛ SD = الانحراف المعياري.
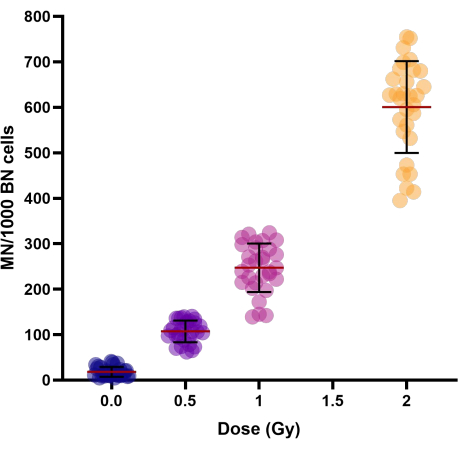
الشكل 3: غلة النوى الدقيقة كما لوحظ في عينات الدم الكاملة الضابطة والمحفوظة بالتبريد المشععة ل 30 متبرعا. تراوحت فترات الحفظ بالتبريد من 1 أسبوع إلى 154 أسبوعا. يظهر الرسم البياني للرسم المبعثر القيم الفردية. تمثل الخطوط في المجموعات متوسط ± SD للمجموعة. الاختصارات: MN = micronuclei; BN = ثنائي النواة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
للتحقيق في التباين بين الأفراد في عائد MN للأشخاص ، تم حساب معامل الاختلاف (CV) (انظر الجدول 1). بالنسبة ل MN الناجم عن الإشعاع ، تم الحصول على CV < 25٪ لجميع الجرعات (0.5 و 1 و 2 Gy) ، مما يشير إلى قابلية جيدة لاستنساخ البروتوكول المعدل.
Discussion
البروتوكول المعدل لتطبيق مقايسة CBMN هو وسيلة سهلة ومريحة نسبيا لتخزين عينات الدم بكميات كبيرة. يحدد الإجراء كل التفاصيل الدقيقة ولكن المهمة التي يجب الاهتمام بها أثناء الحفظ بالتبريد وفحص CBMN. تستخدم بروتوكولات المختبر الأخرى عادة 10٪ DMSO في خليط التجميد ، بينما يحتوي خليط التجميد لدينا على 20٪ DMSO جنبا إلى جنب مع 80٪ FCS7. نظرا لأن خليط التجميد هذا يضاف بأحجام متساوية إلى عينة الدم الكاملة ، فإن التركيز النهائي هو أيضا 10٪ DMSO. لتحسين معدل بقاء الخلية وتحفيز انقسام الخلايا ، نضيف 1٪ بيروفات الصوديوم و 0.1٪ بيتا ميركابتوإيثانول إلى وسط الاستزراع الكامل (cRPMI). هذا يتوافق مع بروتوكول زراعة الخلايا الذي وضعته مجموعتنا البحثية 6,8.
على الرغم من أن مشكلة تكتل الخلايا أثناء الذوبان لا يمكن حلها بالكامل في هذا البروتوكول ، إلا أن فصل الخلايا كان أفضل من البروتوكولات التقليدية الأخرى. بدلا من الإضافة المتسقة والمفاجئة لوسائط الاستزراع لاستعادة الخلايا بعد الذوبان ، حصلنا على نتائج أفضل عند إضافة PBS المسخن مسبقا (37 درجة مئوية) بالتنقيط أثناء خطوات الغسيل. يساعد هذا التحسن في تقليل الإجهاد الخلوي ويقلل من التكتل مع استعادة عالية مثبتة للخلايا. علاوة على ذلك ، لا يمكن ملاحظة أي اختلاف واضح في صلاحية الخلية عند استخدام PBS عبر RPMI. تم التحقق من صحة المجموعة من أن طول فترة الحفظ بالتبريد (حتى 1 سنة) لن يؤثر على غلة MN ، سواء في العينات المشععة وغير المشععة 6,8. تشير الدراسات إلى أنه يمكن تحقيق قابلية جيدة للخلايا وتكاثر PBMCs من خلال التجميد التدريجي عند درجات حرارة منخفضة (النيتروجين السائل) ، تليها الإضافة التدريجية للوسط المسخن مسبقا أثناء إذابة10,11. أظهر الباحثون أن المجموعات الفرعية للخلايا اللمفاوية التائية في الدم الكامل المذاب قابلة للمقارنة مع تلك التي لوحظت في PBMCsالمذابة 12. علاوة على ذلك ، ثبت أن الأنواع الفرعية للخلايا المستردة من عينات الدم الكاملة المحفوظة بالتبريد تشبه تلك التي لوحظت في عينات الدم الكاملة الطازجة13,14.
إذا قمنا بفحص النتائج الإرشادية التي تم الحصول عليها في التقرير ، فإننا نرى أن الزيادة التربيعية الخطية مع الجرعة (الشكل 3) تتفق مع تقارير الأدبيات الأخرى حول النوى الدقيقة التي يسببها نقل الطاقة الخطي (LET)15,16. التباين في غلة MN التي لوحظت في عينات الدم الكاملة المحفوظة بالتبريد (الجدول 1) في نطاق مع التباين المبلغ عنه لمزارع الدم الكامل الطازجة8،17،18. تم التحقق من صحة البروتوكول الموصوف بالتفصيل هنا على دم كامل طازج ومحفوظ بالتبريد ل 20 متطوعا سليما8. كان مؤشر الانقسام النووي (NDI) ، وهو معلمة مهمة لتكاثر الخلايا لوحظ في هذا التقرير8 ، متفقا مع المؤشر المقترح للدم الكامل الطازج19,20. مجتمعة ، يوفر هذا البروتوكول الأمثل للحفظ بالتبريد للدم الكامل ومقايسة النواة الدقيقة المعدلة إنتاجية أفضل للخلايا ، وبالتالي ، يوصى بتكييف هذا البروتوكول لتقييم الحساسية الإشعاعية. نظرا لأن قابلية استنساخ البروتوكول قد تم التحقق منها بالفعل8 ، يقترح أن يكون قابلا للتطبيق في الدراسات واسعة النطاق ومتعددة المراكز.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
يود المؤلفون أن يشكروا L. Pieters و T. Thiron و G. De Smet على دعمهم الفني. نحن ممتنون لجميع المتطوعين الذين تبرعوا بالدم للدراسة. تم دعم العمل ماليا من قبل مؤسسة الأبحاث - فلاندرز (FWO) بموجب منحة (T000118N).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tubes | Greiner | 188271 | |
| 24-well cell suspension plate | VWR | 734-2779 | |
| 96% alcohol | ChemLab | CL00.1807.2500 | |
| Acetic acid | Merck life science | 8,18,75,52,500 | |
| Acridine orange | Merck life science | 235474-5g | |
| CaCl2 | Merck life science | C5670-100g | |
| cover slips | VWR | 631-1365 | 22 x 50 |
| Cryobox (Mr.Frosty) | Nalgene, Sigma Aldrich | ||
| Cryovials 2ml | Novolab | A04573 | |
| Cytochalsin B | Merck life science | C6762-10 | 10 mg |
| Dimethyl sulphoxide (DMSO) | Merck life science | D4540-500ml | |
| Fetal calf serum (FCS) | Thermo Fischer scientific | 10270-106 | |
| Fixative 1 | Methanol/acetic acid/ringer in a ratio of 4:1:5 | ||
| Fixative 2 | Methanol/acetic acid in a ratio of 4:1 | ||
| GURR buffer | Thermo Fischer scientific | 10582013 | phosphate buffer (pH 6.8) |
| KCl | Merck life science | 1,04,93,60,250 | 75 mM |
| KH2PO4 | Merck life science | 1,04,87,30,250 | |
| Li-heparin tubes | BD Life sciences | 367526-LH170 I.U. | BD Vacutainer |
| Methanol | fisher scinetific | M/4000/17 | |
| Na2HPO2 | Merck life science | 10,65,80,500 | |
| NaCl | Merck life science | S7653-1kg | |
| Object slides | VWR | MENZAA00000112E04 | |
| Penicillin/Streptomycin | Thermo Fischer scientific | 15140-122 | 10,000 U/mL + 10,000 µg/mL |
| Phytohemagglutinin (PHA-M) | Thermo Fischer scientific | 10576-015 | |
| Ringer solution | contains NaCl, KCl, CaCl2 dissolved in distilled water | ||
| RPMI-1640 | Thermo Fischer scientific | 52400041 | |
| Silicon rubber adhesive sealent | collall | CF-100 | |
| Sodium pyruvate | Thermo Fischer scientific | 11360039 | |
| Sterile warm PBS (37 °C) | contains NaCl, Na2HPO2, KH2PO4 dissolved in distilled water | ||
| β-mercaptoethanol | Thermo Fischer scientific | 31350-010 |
References
- Grade, M., Difilippantonio, M. J., Camps, J. Patterns of chromosomal aberrations in solid tumors. Recent Results in Cancer Research. 200, 115-142 (2015).
- Jiao, Y., Cao, F., Liu, H. Radiation-induced cell death and its mechanisms. Health Physics. 123 (5), 376-386 (2022).
- Roederer, M., et al. The genetic architecture of the human immune system: a bioresource for autoimmunity and disease pathogenesis. Cell. 161 (2), 387-403 (2015).
- Bankoglu, E. E., et al. Effect of cryopreservation on DNA damage and DNA repair activity in human blood samples in the comet assay. Archives of Toxicology. 95, 1831-1841 (2021).
- Zijno, A., Saini, F., Crebelli, R. Suitability of cryopreserved isolated lymphocytes for the analysis of micronuclei with the cytokinesis-block method. Mutagenesis. 22, 311-315 (2007).
- Sioen, S., Cloet, K., Vral, A., Baeyens, A. The cytokinesis-block micronucleus assay on human isolated fresh and cryopreserved peripheral blood mononuclear cells. Journal of Personalized Medicine. 10 (3), 125 (2020).
- Cheng, L., Wang, L. E., Spitz, M. R., Wei, Q. Cryopreserving whole blood for functional assays using viable lymphocytes in molecular epidemiology studies. Cancer Letters. 166 (2), 155-163 (2001).
- Beyls, E., Baeyens, A., Vral, A. The cytokinesis-block micronucleus assay for cryopreserved whole blood. International Journal of Radiation Biology. 97 (9), 1252-1260 (2021).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2 (5), 1084-1104 (2007).
- Ramachandran, H., et al. Optimal thawing of cryopreserved peripheral blood mononuclear cells for use in high-throughput human immune monitoring studies. Cells. 1 (3), 313-324 (2012).
- Hønge, B. L., Petersen, M. S., Olesen, R., Møller, B. K., Erikstrup, C. Optimizing recovery of frozen human peripheral blood mononuclear cells for flow cytometry. PLoS One. 12 (11), e0187440-e0187517 (2017).
- Alam, I., Goldeck, D., Larbi, A., Pawelec, G. Flow cytometric lymphocyte subset analysis using material from frozen whole blood. Journal of Immunoassay and Immunochemistry. 33 (2), 128-139 (2012).
- Langenskiöld, C., Mellgren, K., Abrahamsson, J., Bemark, M. Determination of blood cell subtype concentrations from frozen whole blood samples using TruCount beads. Cytometry Part B: Clinical Cytometry. 94B, 660-666 (2018).
- Braudeau, C., et al. An easy and reliable whole blood freezing method for flow cytometry immuno-phenotyping and functional analyses. Cytometry Part B: Clinical Cytometry. 100 (6), 652-665 (2021).
- Thierens, H., Vral, A., De Ridder, L. Biological dosimetry using the micronucleus assay for lymphocytes: interindividual differences in dose response. Health Physics. 61 (5), 623-630 (1991).
- Vral, A., Fenech, M., Thierens, H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure. Mutagenesis. 26 (1), 11-17 (2011).
- Vral, A., Thierens, H., Baeyens, A., De Ridder, L. The micronucleus and G2-phase assays for human blood lymphocytes as biomarkers of individual sensitivity to ionizing radiation: limitations imposed by intraindividual variability. Radiation Research. 157 (4), 472-477 (2002).
- Pajic, J., et al. Inter-individual variability in the response of human peripheral blood lymphocytes to ionizing radiation: comparison of the dicentric and micronucleus assays. Radiation and Environmental Biophysics. 54, 317-325 (2015).
- Fenech, M., et al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes: results of an international slide-scoring exercise by the HUMN project. Mutation Research. 534 (1-2), 45-64 (2003).
- Miszczyk, J., Rawojć, K. Effects of culturing technique on human peripheral blood lymphocytes response to proton and X-ray radiation. International Journal of Radiation Biology. 96 (4), 424-433 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved