Method Article
Dondurularak Saklanmış Tam Kan Üzerinde Mikronükleus Testi
Bu Makalede
Özet
Burada, dondurularak saklanmış tam kan örneklerinde sitokinez-blok mikronükleus testi için optimize edilmiş bir protokol sunuyoruz. Mikronükleus analizi için tam kanın bu optimize edilmiş dondurularak saklanması yöntemi, büyük ölçekli örnekleme ve çok merkezli çalışmalar için güvenilir bir tekniktir ve kanla ilgili diğer testler için de kullanılabilir.
Özet
İn vitro sitokinez-blok mikronükleus (CBMN) testi, radyobiyoloji araştırmalarında, biyolojik dozimetride, genotoksisite çalışmalarında ve in vitro radyosensitivite testlerinde yaygın olarak kullanılan bir tekniktir. Bu sitogenetik yöntem, hücre bölünmesi sırasında geciken kromozomal fragmanlardan kaynaklanan iki çekirdekli hücrelerde mikronükleusların saptanmasına dayanır. Taze tam kan örnekleri, CBMN testi için en çok tercih edilen örnek türüdür. Bununla birlikte, taze kan örnekleriyle çalışmanın dezavantajları, kan alımından hemen sonra işlem yapılmasını ve fazladan kan örneklemesi olmadan gerçekleştirilebilecek sınırlı sayıda tekrarlanan analizi içerir.
Taze kan örneklerine duyulan ihtiyaç lojistik olarak zor olabileceğinden, dondurularak saklanmış tam kan örneklerinde CBMN testi, özellikle büyük ölçekli hasta çalışmalarında büyük avantaj sağlayacaktır. Bu makale, tam kan örneklerini dondurmak ve bu donmuş kan örnekleri üzerinde CBMN testini gerçekleştirmek için bir protokolü açıklamaktadır. Sağlıklı gönüllülerden alınan kan örnekleri farklı zaman noktalarında donduruldu ve çözüldü ve daha sonra modifiye edilmiş bir mikronükleus tahlil protokolüne tabi tutuldu. Sonuçlar, bu optimize edilmiş prosedürün donmuş kan örnekleri üzerinde CBMN testinin performansına izin verdiğini göstermektedir. Açıklanan kriyoprezervasyon protokolü, diğer sitogenetik testler ve proliferatif lenfositler gerektiren çeşitli fonksiyonel testler için de çok yararlı olabilir.
Giriş
İyonlaştırıcı radyasyonun (IR) keşfinden bu yana, canlılar üzerindeki olumsuz etkileri nedeniyle araştırmacılar arasında tartışma konusu olmuştur. Zararlı etki genellikle çift sarmallı kırılmalar (DSB'ler) gibi DNA hasarı ile kendini gösterir ve bu DSB'lerin onarılamaması, kanserin önemli ayırt edici özellikleri olan kromozomal anormalliklere ve mutasyonlara yol açar 1,2. Bu tür kromozomal anormallikler, sitokinez-blok mikronükleus (CBMN) testi gibi sitojenik deneylerle incelenebilir. Mikronükleuslar, yavru çekirdeklere dahil edilemeyen ve dolayısıyla mitoz sırasında geride kalan gecikmeli kromozomal parçalardır.
CBMN, in vivo veya in vitro iyonlaştırıcı radyasyona maruz kalan bireylerde kromozomal hasarı değerlendirmek için yaygın olarak kullanılan, güvenilir bir sitogenetik tekniktir. CBMN tahlilinde taze tam kan veya izole edilmiş periferik kan mononükleer hücreleri (PBMC'ler) kullanılabilir. PBMC'lerin izolasyonu ve işlenmesi zaman alıcı olabileceğinden ve hücrenin hayatta kalması ve büyümesi için destekleyici ortam görevi gören serum plazması kaybına eşlik ettiğinden, taze tam kan çoğunlukla tercih edilen biyolojik materyaldir. İyi bir çift çekirdekli hücre verimi elde etmek için, taze tam kan toplandıktan hemen sonra işlenmelidir. Bununla birlikte, acil işleme ihtiyacı, zaman kısıtlamaları sırasında lojistik olarak zorlayıcı olabilir. Ayrıca, çok sayıda numunenin uzun bir süre boyunca alınması veya işleme merkezlerinden uzak noktalarda toplanması gerektiğinde, taze kan örneklerinin saklanması sınırlayıcı bir faktör olabilir 3,4.
Ayrıca, aynı kişide/hastada tekrarlanan MN analizine izin vermek için kan örneklerinin dondurulması faydalı olacaktır. CBMN testinin daha sonra uygulanması için lenfositleri saklamanın bir yolu, izole edilmiş PBMC'lerindondurulmasıdır 5,6. Ancak bu teknik, PBMC'lerin dondurulabilmesi için birkaç işlem adımı gerektirir. Bu nedenle, tam kanın dondurularak saklanması, izole edilmiş PBMC'lerin dondurularak saklanmasına basit ve zaman açısından verimli bir alternatif olacaktır. Sitogenetik testler veya lenfositlerin çoğalmasını gerektiren testler için donmuş tam kanın kullanımı hakkında çok az bilgi mevcuttur. Sadece bir makale, metafaz analizi için dondurularak saklanmış tam kanın kullanıldığını bildirmektedir7.
Tam kanın dondurularak saklanması biyoizleme, biyodozimetri ve radyosensitivite değerlendirmesi alanında birçok avantaj sunacağından, grubumuz tam kan için CBMN testininuygulanmasına izin veren bir kriyoprezervasyon protokolünü optimize etti 8. Dondurularak saklanmış tam kan kültürlerinde bulunan lenfositlerin genomik bütünlüklerini ve proliferasyon kapasitelerini en az 1 yıl koruduklarını gösterdik. Bu yöntem yazısında, Beyls ve ark.8 tarafından optimize edilen kriyoprezervasyon prosedürü ve CBMN test protokolü ayrıntılı olarak açıklanmış ve 30 sağlıklı bireyden donmuş kan örnekleri için elde edilen bulgular raporlanmıştır. CBMN testi için, dondurularak saklanmış tam kan örneklerinin lenfositlerindeki MN yanıtını değerlendirmek için kan kültürleri in vitro 0.5, 1 ve 2 Gy dozlarında ışınlandı.
Protokol
Bu çalışma için, yaşları 17 ile 65 arasında değişen 30 sağlıklı donörden damar delinmesi yoluyla kan örnekleri toplandı. 20 bağışçıdan elde edilen MN verileri, Beyls ve ark.8 Kan örneklerinin toplanması, Belçika'daki Ghent Üniversite Hastanesi Etik Kurulu'nun (kayıt numarası: 2019/1565) yönergelerine uygundur. Tüm katılımcılardan yazılı bilgilendirilmiş onam alındı. Bu protokolde kullanılan tüm malzemeler ve reaktiflerle ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Kan örneklerinin toplanması
- Başlamadan önce, katılımcıların yazılı bilgilendirilmiş onamının mevcut olduğundan ve etik yönergelere uygun şekilde uyulduğundan emin olun.
- Kanı Li-Heparin tüplerine toplayın ve kriyoprezervasyon için işlenmeye hazır olana kadar oda sıcaklığında saklayın.
2. Tam kanın dondurularak saklanması
NOT: Hücre toplamaya kadar olan tüm adımlar steril laminer hava akışında aseptik olarak gerçekleştirilir.
- 1 mL kanı dondurarak saklamak için, 800 μL Fetal Buzağı Serumu (FCS) ve 200 μL dimetil sülfoksiti (DMSO) karıştırarak 1 mL dondurma ortamı yapın.
NOT: Dondurma ortamı, dondurulması gereken kan örneklerine eşit hacimde hazırlanır. - Tam kanın dondurularak saklanması için, kan örneğini heparinize tüpten 15 veya 50 mL'lik santrifüj tüplerine aktarın
NOT: Tüpün kapasitesi kanın hacmine bağlıdır. - Kanı, eşit hacimde donma ortamının sürekli ancak damla damla eklenmesiyle düşük hızda vorteksleyin.
- 2 mL kan donma karışımını, her bir alikotun 1 mL dondurma karışımı ile karıştırılmış 1 mL kan örneğine sahip olduğu kriyoviyallere (2 mL) aktarın.
- Kademeli kademeli dondurma
- Kriyovialleri izopropanol içeren bir kriyobox'a aktarın ve gece boyunca bir dondurucuya (-80 °C) koyun.
- Kriyoviyalleri uzun süreli kullanım için sıvı nitrojene aktarın.
3. Dondurularak saklanmış kanın çözülmesi
NOT: Çözdürme işleminin toplam süresini sınırlamak için, bir seferde maksimum 8 kriyovion (her biri 2 mL) kullanılmalıdır.
- Hazırlık
- Kanı çözmeden önce 200 mL steril Fosfat tamponlu Salin'i (PBS) 37 °C'ye ısıtın.
- Steril koşullar altında gerekli kültür ortamının çalışma solüsyonunu hazırlayın. Kültür başına ortamın 1.6 mL tam ortam içerdiğinden emin olun: penisilin / streptomisin (% 0.5), 0.2 mL FCS, 20 μL sodyum piruvat ve 2 μL β-merkaptoetanol ile desteklenmiş Rosewell Park Memorial Enstitüsü (RPMI) ortamı.
NOT: Çözdürme sırasında önemli sayıda kan hücresi kaybolabileceğinden, çözülen kan, toplam hacmi 2 mL olan 24 oyuklu plakalar gibi küçük kuyucuklarda kültürlenir. Doz başına bir çok kuyulu plaka kullanılır. - Her kültür kuyusu için, aşağıda önerildiği gibi donör kodunu ve A/B'yi tarih ve dozla birlikte kapakta belirtin (Şekil 1).
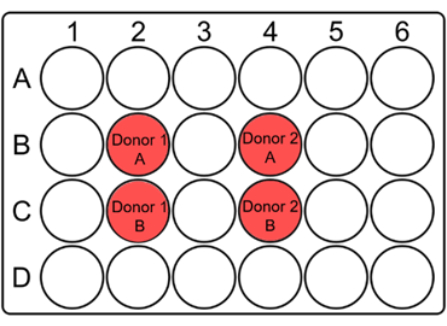
Şekil 1: Mikronükleus testi için tam kanı kültürlemek için 24 oyuklu bir plakanın önerilen düzeni. Kuyucukları işaretleyin ve donör kodlarını kapakta uygun yerlerde belirtin. Her hasta numunesi için, çift kuyucuklar birbirine bitişik olmalıdır. 10 x 10 kolimatör için düşündürücü bir düzen olduğunu ve kolimatörün veya numunelerin boyutuna göre değiştirilebileceğini unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Tam kanın çözülmesi ve kültürlenmesi için adımlar
- Su banyosunu 37 °C'ye ısıtın.
- Gerekli kriyoviyalleri sıvı nitrojenden çıkarın (sayı, doz sayısı gibi gereksinimlere bağlıdır).
NOT: Bir kriyoviyal 1 mL kan ve 1 mL donma ortamı içerir. Bu nedenle, bir kriyoviyalden alınan kanla iki kültür kurulabilir. - Kriyoviyalleri ılık su banyosunda kısmen çözün (küçük buz kristalleri hala görülene kadar).
- Şişeleri su banyosundan çıkarın ve şişelerin dışını steril kağıt mendille temizleyin.
- Steril bir laminer hava akımı başlığında, tüplerin içinde oluşan hava kabarcıklarının dökülmesini önlemek için şişeleri çok yavaş açın.
- Her bir şişenin içeriğini yeniden süspanse edin ve bunları ayrı ayrı 15 mL'lik bir konik santrifüj tüpüne (şişe başına 1 tüp) aktarın.
- İlgili tüplere, tüpü hafifçe döndürürken damla damla 1 mL ılık (37 °C) PBS ekleyin. Bir P1000 pipeti ile tekrar süspanse edin.
- Seyreltme ve homojen yıkama için, damla damla 7 mL önceden ısıtılmış PBS (37 °C) ekleyin ve bir P1000 pipeti ile yeniden süspanse edin.
- Kanı oda sıcaklığında 180 × g'da ( hızlanma 1, fren 1'de) 8 dakika santrifüj edin.
- Bu bekleme adımı sırasında, boş kuyucukları (hücrelerin kültürleneceği yer dışında) 500 μL PBS ile doldurun.
- Ön ısıtmak için kuyu plakalarını inkübatöre geri yerleştirin.
- Santrifüjleme tamamlandıktan sonra, hücre peletini bozmamak için yaklaşık 1 mL geride bırakarak süpernatanı dikkatlice çıkarın.
- Kalan süpernatanttaki peleti bir P1000 pipeti ile yeniden süspanse edin.
- Tüpleri hafifçe döndürürken ilgili tüplere damla damla 8 mL ılık PBS (37 °C) ekleyin. Daha sonra bir P1000 pipeti ile tekrar süspanse edin.
- Yeniden süspanse edilen kanı 8 dakika boyunca 180 × g'da santrifüjleyin ( hızlanma 9, fren 9'da ayarlanarak).
- Bu bekleme adımı sırasında, işaretli kuyucukların her birine 200 μL kültür ortamı aktarın.
- Plakaları 37 °C'de kalacak şekilde inkübatörde saklayın.
- Santrifüjlemeden sonra, süpernatanı sürekli bir hareketle çıkarın (gevşek hücre peletini rahatsız etmemek için), ancak yaklaşık 80 μL süpernatanı geride bırakın.
- Pelet'e 280 μL FCS (oda sıcaklığı) ekleyin ve yeniden süspanse edin (toplam 360 μL hacme).
- Her bir kuyucuğa 180 μL hücre süspansiyonu aktarın ve yeniden süspanse edin (= 0.5 mL "kan"/kültür). Her bir kuyucudaki toplam hacim artık 380 μL'dir ve bu da 2 mm'lik bir orta tabaka ile sonuçlanır.
- Plakaları ışınlamadan önce en az 10 dakika boyunca 37 ° C'de bir CO2 inkübatörde inkübe edin.
4. G0 MN testi
- Plakaları inkübatörden çıkarın ve hücre kültürünü oda sıcaklığında 0.5, 1 ve 2 Gy X-ışınları (220 kV, 13 mA, 0.15 mm Cu) gibi gerekli dozlarla ışınlayın. Spontan MN verimlerini belirlemek için sahte ışınlanmış numuneleri kontrol olarak kullanın.
- Işınlamadan hemen sonra, her bir oyuğa 1.62 mL kültür ortamı (37 °C) ekleyin.
- T-lenfositlerde hücre bölünmesini uyarmak için, her bir oyuğa 40 μL Fitohemaglutinin (PHA) ekleyin ve iyice yeniden süspanse edin.
- Bu plakaları inkübatöre geri yerleştirin (%5CO2, 37 °C).
NOT: Bu, tahlilin başlangıç zamanı olacaktır. - Oyuk başına 8 μL sitokalasin B (6 μg / mL) ekleyerek stimülasyondan 23 saat sonra sitokinezi bloke edin ve uygun şekilde yeniden süspanse edin.
- Hücre kültürlerini stimülasyon/kültür süresinden 70 saat sonra hasat edin. Hücreleri yeniden askıya alın ve 15 mL'lik bir tüpe aktarın. Her bir kuyuyu 2 mL PBS ile durulayın ve bu PBS'yi ilgili 15 mL tüpe ekleyin.
- Tüpleri oda sıcaklığında 180 × g'da 8 dakika santrifüjleyin.
- Süpernatanı atın, ancak peletin üzerinde yaklaşık 500 μL bırakın.
- Peletleri vorteksleyin (tam hızda) ve girdap yaparken yavaşça damla damla 2 mL soğuk potasyum klorür (KCl, 4 °C) ekleyin.
- Hücreleri hemen 180 × g'da 8 dakika santrifüjleyin.
- Süpernatanı atın, yaklaşık 500 μL süpernatan bırakın.
- Peletleri vorteksleyin (tam hızda) ve girdap yaparken yavaşça damla damla 2 mL soğuk fiksatif 1 (4:1:5 oranında Metanol/Asetik asit/Ringer çözeltisi) ekleyin.
- Numune tüplerini gece boyunca 4 °C'de bırakın (minimum 12 saat ve maksimum 96 saat).
- 180 × g'da 8 dakika santrifüjleyin.
- Süpernatanı atın.
- Peletleri vorteksleyin (tam hızda) ve vorteksleme sırasında yavaşça damla damla 2 mL soğuk fiksatif 2 (4:1 oranında metanol/asetik asit) ekleyin.
- 180 × g'da 8 dakika santrifüjleyin.
- Süpernatanı atın.
- Peletleri vorteksleyin (tam hızda) ve ardından yavaşça (damla damla) girdap yaparken pelete 2 mL soğuk fiksatif 2 ekleyin.
- Numune tüplerini 4 °C'de bırakın (minimum 12 saat ve maksimum 96 saat).
- Slaytları izopropanol ile temizleyin ve uygun şekilde etiketleyin.
NOT: İşleme sırasında keçeli kalem mürekkebi kolayca silindiğinden, etiketlemek için basılı çıkartmalar kullanın. - Numune tüplerini 180 × g'da 8 dakika santrifüjleyin.
- Hücreleri peletin boyutuna göre konsantre etmek için süpernatanı başka bir tüpe aktarın.
- Peleti girdaplayın.
- Sabit hücrelerin 40 μL'sini kuru ve temiz bir slayt üzerine bırakın.
- Slaytları oda sıcaklığında kurumaya bırakın. Slaytları bir kutuda saklayın veya gözlem için hemen boyayın.
5. Akridin portakal (AO) boyama
- Slaytları 1 dakika AO boyasına batırın, ardından damıtılmış suda hızlı bir şekilde yıkayın ve ardından slaytları 1 dakika fosfat tamponuna (pH 6.8) yerleştirin.
- Slaytları tampon solüsyonundan ve temiz kağıt mendille çıkarın, slaytların arkasını kurutun ve slaytları temiz bir kağıt mendil üzerine koyun.
- Sürgünün üzerine 20 μL fosfat tamponu bırakın ve hava kabarcıklarını önleyerek temiz bir lamel ile nazikçe örtün.
- Bu slaytları silikon çimento ile kapatın.
NOT: AO ışığa duyarlı olduğundan ve zamanla solduğundan, güzel bir kontrast ve floresan için, slaytların boyandıktan sonraki 5 gün içinde puanlanması önerilir. Slaytları muayene edilmediği zaman daima soğuk bir odada (4 °C) saklayın.
6. Lekeli slaytların puanlanması
- Slaytınızı bir floresan mikroskobu altına yerleştirin ve 1.000 çift çekirdekli hücreyi (BN) inceleyin. Toksisitenin altı biyobelirtecinden biri olan MN'leri manuel olarak sayın. Bunu yapmak için, iki bağımsız puanlayıcının aynı büyütme altında 500 BN hücresini / slaytı incelemesini sağlayın.
NOT: Aşağıda, Fenech tarafından lekeli slaytları puanlamak için önerilen puanlama kriterlerinin bazı önemli noktalarıverilmiştir 9- Yaklaşık olarak aynı boyutta, düzenli şekle ve boyama desenine sahip iki iyi ayırt edilmiş çekirdeğe sahip, bozulmamış sitoplazmaya sahip güzel yuvarlak hücreler arayarak bir BN hücresi seçin. BN hücresinin sitoplazmasının, bitişik hücrenin sitoplazmasından ayırt edilebilir olduğundan emin olun.
- Morfolojik olarak ana çekirdeklerle aynı ancak ondan daha küçük olduğuna dikkat ederek bir MN puanlayın; en büyük MN bile ana çekirdeğin çapının 1/3'ünden fazla olamaz. Bir MN'yi yalnızca ana çekirdeğe dokunmuyorsa veya en azından mikronükleer sınır ana çekirdeğin sınırından ayırt edilebiliyorsa puanlayın.
Sonuçlar
Protokolün tekrarlanabilirliğini doğrulamak için, 17 ila 65 yaşları arasındaki 30 sağlıklı gönüllünün dondurularak saklanmış kan örnekleri üzerinde MN testini gerçekleştirdik. Grubun yaş ortalaması 35'tir. Kriyoprezervasyon süresi 1 hafta ile 154 hafta arasında değişmekteydi. Tam kan hücresi kültürü farklı radyasyon dozlarına (0.5, 1 ve 2 Gy) maruz bırakıldıktan sonra, 1.000 BN hücresindeki mikronükleus verimi mikroskop altında incelendi. Güzel yuvarlatılmış iki çekirdekli hücreler ( Şekil 2'de görülebileceği gibi), dondurularak saklanmış tam kan örneklerinden sağlıklı canlı hücrelerin başarılı bir şekilde alındığını gösterir. Lenfositlerin radyasyon tepkisi, ultra düşük sıcaklıklarda (sıvı nitrojen) uzun süreli depolamadan sonra stabil kalmıştır. Bu gözlem, taze kan örneklerinden beklenen yanıtla uyumludur.
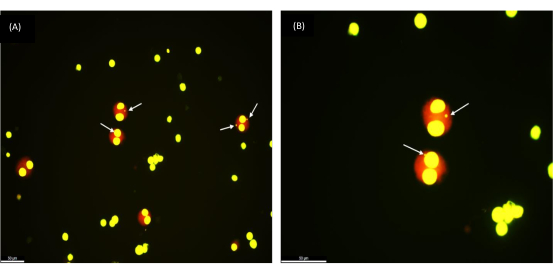
Şekil 2: 1 yıl önce dondurularak saklanmış donmuş tam kan örneğinden alınan iki çekirdekli hücrelerde gözlemlenen mikronükleuslar. (a) büyütme 200x, (b) büyütme 400x; MN'leri gösteren oklar. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Artan radyasyon dozları (0.5, 1 ve 2 Gy) ile mikronükleus veriminde doğrusal-ikinci dereceden bir artış gözlenmiştir (Tablo 1 ve Şekil 3). Sahte ışınlanmış kontrol numunelerindeki (0 Gy) MN verimleri, esas olarak gecikmeli kromozomların sonucu olan arka plan MN verimlerini temsil eder.
| Doz (Gy) | 0 | 0.5 | 1 | 2 |
| Ortalama | 18 | 107 | 247 | 601 |
| SD | 10.8 | 23.9 | 53.3 | 101.1 |
| Özgeçmiş (%) | 59.9 | 22.3 | 21.6 | 16.8 |
| Aralık | 5-41 | 62-140 | 139-324 | 395-755 |
Tablo 1: Bireyler arası değişkenliğin göstergesi olan 30 sağlıklı donörün dondurularak saklanmış tam kan örneklerinde gözlemlendiği gibi, ortalama MN verimi ile birlikte varyasyon aralığı ve katsayısı. Kısaltmalar: CV = varyasyon katsayısı; SD = standart sapma.
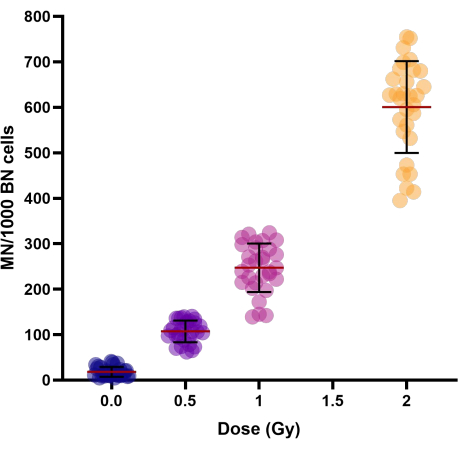
Şekil 3: 30 donörün kontrol ve ışınlanmış dondurularak saklanmış tam kan örneklerinde gözlemlendiği gibi mikronükleus verimleri. Kriyoprezervasyon süreleri 1 hafta ile 154 hafta arasında değişmekteydi. Dağılım grafiği tek tek değerleri gösterir. Kümelerdeki çizgiler, grubun Ortalama ± SD'sini temsil eder. Kısaltmalar: MN = mikronükleus; BN = ikili. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kişilerin MN verimindeki bireyler arası varyasyonu araştırmak için, varyasyon katsayısı (CV) hesaplanmıştır (bakınız Tablo 1). Radyasyona bağlı MN için, tüm dozlar (0.5, 1 ve 2 Gy) için% 25'
Tartışmalar
CBMN testinin uygulanması için değiştirilmiş protokol, kan örneklerini toplu olarak saklamanın nispeten kolay ve kullanışlı bir yoludur. Prosedür, kriyoprezervasyon ve CBMN testi sırasında dikkat edilmesi gereken tüm küçük ama önemli ayrıntıları özetlemektedir. Diğer laboratuvar protokolleri normalde dondurma karışımında %10 DMSO kullanırken, dondurma karışımımız %80 FCS7 ile birlikte %20 DMSO içerir. Bu dondurma karışımı tam kan örneğine eşit hacimlerde eklendiğinden, nihai konsantrasyon da %10 DMSO'dur. Hücre sağkalım oranını artırmak ve hücre bölünmesini uyarmak için, tam kültür ortamına (cRPMI) %1 sodyum piruvat ve %0.1 beta-merkaptoetanol ekliyoruz. Bu, araştırma grubumuz 6,8 tarafından oluşturulan hücre kültürü protokolüne uygundur.
Bu protokolde çözdürme sırasında hücre kümelenmesi sorunu tam olarak çözülemese de, hücre ayrışması diğer konvansiyonel protokollere göre daha iyiydi. Çözdürme işleminden sonra hücreleri geri kazanmak için tutarlı, ani kültür ortamı ilavesi yerine, yıkama adımları sırasında önceden ısıtılmış PBS (37 °C) damla damla eklendiğinde daha iyi sonuçlar elde ettik. Bu gelişme, hücresel stresi azaltmaya yardımcı olur ve kanıtlanmış yüksek hücre iyileşmesi ile kümelenmeyi en aza indirir. Ayrıca, PBS RPMI üzerinden kullanıldığında hücre canlılığında net bir fark gözlenemedi. Kriyoprezervasyon süresinin uzunluğunun (1 yıla kadar) hem ışınlanmış hem de ışınlanmamış numunelerdeMN verimini etkilemeyeceği grup tarafından doğrulanmıştır 6,8. Çalışmalar, iyi hücre canlılığının ve PBMC'lerin çoğalmasının, düşük sıcaklıklarda (sıvı nitrojen) kademeli dondurma ve ardından çözülürken önceden ısıtılmış ortamın kademeli olarak eklenmesiyle elde edilebileceğini düşündürmektedir10,11. Araştırmacılar, çözülmüş tam kandaki T-lenfositlerin alt popülasyonlarının, çözülmüş PBMC'lerde gözlemlenenlerle karşılaştırılabilirolduğunu göstermiştir 12. Ayrıca, dondurularak saklanmış tam kan örneklerinden elde edilen hücre alt tiplerinin, taze tam kan örneklerinde gözlemlenenlere benzer olduğu kanıtlanmıştır13,14.
Raporda elde edilen gösterge niteliğindeki sonuçları incelersek, dozla doğrusal ikinci dereceden artışın (Şekil 3) Doğrusal enerji transferi (LET) ile indüklenen mikronükleus15,16 hakkındaki diğer literatür raporlarıyla uyumlu olduğunu görürüz. Dondurularak saklanmış tam kan örneklerinde (Tablo 1) gözlenen MN verimlerindeki değişkenlik, taze tam kan kültürleri için bildirilenlearalıktadır 8,17,18. Burada ayrıntılı olarak açıklanan protokol, 20 sağlıklı gönüllünün taze ve dondurularak saklanmış tam kanı üzerinde doğrulanmıştır8. Bu rapordagözlenen hücre proliferasyonunun önemli bir parametresi olan nükleer bölünme indeksi (NDI) 8, taze tam kan için önerilenle uyumluydu 19,20. Birlikte ele alındığında, tam kanın dondurularak saklanması ve modifiye edilmiş mikronükleus testinin bu optimize edilmiş protokolü daha iyi bir hücre verimi sağlar ve bu nedenle, radyosensitivite değerlendirmeleri için bu protokolün uyarlanması önerilir. Protokolün tekrarlanabilirliği zaten doğrulanmışolduğundan8, büyük ölçekli ve çok merkezli çalışmalarda uygulanabilirliği olması önerilmektedir.
Açıklamalar
Yazarların beyan edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar teknik destekleri için L. Pieters, T. Thiron ve G. De Smet'e teşekkür eder. Çalışma için kan bağışında bulunan tüm gönüllülere müteşekkiriz. Çalışma, Grant (T000118N) kapsamında Research Foundation-Flanders (FWO) tarafından mali olarak desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tubes | Greiner | 188271 | |
| 24-well cell suspension plate | VWR | 734-2779 | |
| 96% alcohol | ChemLab | CL00.1807.2500 | |
| Acetic acid | Merck life science | 8,18,75,52,500 | |
| Acridine orange | Merck life science | 235474-5g | |
| CaCl2 | Merck life science | C5670-100g | |
| cover slips | VWR | 631-1365 | 22 x 50 |
| Cryobox (Mr.Frosty) | Nalgene, Sigma Aldrich | ||
| Cryovials 2ml | Novolab | A04573 | |
| Cytochalsin B | Merck life science | C6762-10 | 10 mg |
| Dimethyl sulphoxide (DMSO) | Merck life science | D4540-500ml | |
| Fetal calf serum (FCS) | Thermo Fischer scientific | 10270-106 | |
| Fixative 1 | Methanol/acetic acid/ringer in a ratio of 4:1:5 | ||
| Fixative 2 | Methanol/acetic acid in a ratio of 4:1 | ||
| GURR buffer | Thermo Fischer scientific | 10582013 | phosphate buffer (pH 6.8) |
| KCl | Merck life science | 1,04,93,60,250 | 75 mM |
| KH2PO4 | Merck life science | 1,04,87,30,250 | |
| Li-heparin tubes | BD Life sciences | 367526-LH170 I.U. | BD Vacutainer |
| Methanol | fisher scinetific | M/4000/17 | |
| Na2HPO2 | Merck life science | 10,65,80,500 | |
| NaCl | Merck life science | S7653-1kg | |
| Object slides | VWR | MENZAA00000112E04 | |
| Penicillin/Streptomycin | Thermo Fischer scientific | 15140-122 | 10,000 U/mL + 10,000 µg/mL |
| Phytohemagglutinin (PHA-M) | Thermo Fischer scientific | 10576-015 | |
| Ringer solution | contains NaCl, KCl, CaCl2 dissolved in distilled water | ||
| RPMI-1640 | Thermo Fischer scientific | 52400041 | |
| Silicon rubber adhesive sealent | collall | CF-100 | |
| Sodium pyruvate | Thermo Fischer scientific | 11360039 | |
| Sterile warm PBS (37 °C) | contains NaCl, Na2HPO2, KH2PO4 dissolved in distilled water | ||
| β-mercaptoethanol | Thermo Fischer scientific | 31350-010 |
Referanslar
- Grade, M., Difilippantonio, M. J., Camps, J. Patterns of chromosomal aberrations in solid tumors. Recent Results in Cancer Research. 200, 115-142 (2015).
- Jiao, Y., Cao, F., Liu, H. Radiation-induced cell death and its mechanisms. Health Physics. 123 (5), 376-386 (2022).
- Roederer, M., et al. The genetic architecture of the human immune system: a bioresource for autoimmunity and disease pathogenesis. Cell. 161 (2), 387-403 (2015).
- Bankoglu, E. E., et al. Effect of cryopreservation on DNA damage and DNA repair activity in human blood samples in the comet assay. Archives of Toxicology. 95, 1831-1841 (2021).
- Zijno, A., Saini, F., Crebelli, R. Suitability of cryopreserved isolated lymphocytes for the analysis of micronuclei with the cytokinesis-block method. Mutagenesis. 22, 311-315 (2007).
- Sioen, S., Cloet, K., Vral, A., Baeyens, A. The cytokinesis-block micronucleus assay on human isolated fresh and cryopreserved peripheral blood mononuclear cells. Journal of Personalized Medicine. 10 (3), 125 (2020).
- Cheng, L., Wang, L. E., Spitz, M. R., Wei, Q. Cryopreserving whole blood for functional assays using viable lymphocytes in molecular epidemiology studies. Cancer Letters. 166 (2), 155-163 (2001).
- Beyls, E., Baeyens, A., Vral, A. The cytokinesis-block micronucleus assay for cryopreserved whole blood. International Journal of Radiation Biology. 97 (9), 1252-1260 (2021).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2 (5), 1084-1104 (2007).
- Ramachandran, H., et al. Optimal thawing of cryopreserved peripheral blood mononuclear cells for use in high-throughput human immune monitoring studies. Cells. 1 (3), 313-324 (2012).
- Hønge, B. L., Petersen, M. S., Olesen, R., Møller, B. K., Erikstrup, C. Optimizing recovery of frozen human peripheral blood mononuclear cells for flow cytometry. PLoS One. 12 (11), e0187440-e0187517 (2017).
- Alam, I., Goldeck, D., Larbi, A., Pawelec, G. Flow cytometric lymphocyte subset analysis using material from frozen whole blood. Journal of Immunoassay and Immunochemistry. 33 (2), 128-139 (2012).
- Langenskiöld, C., Mellgren, K., Abrahamsson, J., Bemark, M. Determination of blood cell subtype concentrations from frozen whole blood samples using TruCount beads. Cytometry Part B: Clinical Cytometry. 94B, 660-666 (2018).
- Braudeau, C., et al. An easy and reliable whole blood freezing method for flow cytometry immuno-phenotyping and functional analyses. Cytometry Part B: Clinical Cytometry. 100 (6), 652-665 (2021).
- Thierens, H., Vral, A., De Ridder, L. Biological dosimetry using the micronucleus assay for lymphocytes: interindividual differences in dose response. Health Physics. 61 (5), 623-630 (1991).
- Vral, A., Fenech, M., Thierens, H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure. Mutagenesis. 26 (1), 11-17 (2011).
- Vral, A., Thierens, H., Baeyens, A., De Ridder, L. The micronucleus and G2-phase assays for human blood lymphocytes as biomarkers of individual sensitivity to ionizing radiation: limitations imposed by intraindividual variability. Radiation Research. 157 (4), 472-477 (2002).
- Pajic, J., et al. Inter-individual variability in the response of human peripheral blood lymphocytes to ionizing radiation: comparison of the dicentric and micronucleus assays. Radiation and Environmental Biophysics. 54, 317-325 (2015).
- Fenech, M., et al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes: results of an international slide-scoring exercise by the HUMN project. Mutation Research. 534 (1-2), 45-64 (2003).
- Miszczyk, J., Rawojć, K. Effects of culturing technique on human peripheral blood lymphocytes response to proton and X-ray radiation. International Journal of Radiation Biology. 96 (4), 424-433 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır