Method Article
Il test del micronucleo su sangue intero crioconservato
In questo articolo
Riepilogo
Qui presentiamo un protocollo ottimizzato per il test del micronucleo del blocco della citochinesi su campioni di sangue intero crioconservato. Questo metodo ottimizzato di crioconservazione del sangue intero per l'analisi del micronucleo è una tecnica affidabile per il campionamento su larga scala e gli studi multicentrici e può essere utilizzato anche per altri test correlati al sangue.
Abstract
Il test in vitro del micronucleo a blocco di citochinesi (CBMN) è una tecnica ampiamente utilizzata nella ricerca in radiobiologia, nella dosimetria biologica, negli studi di genotossicità e nei test di radiosensibilità in vitro . Questo metodo citogenetico si basa sull'individuazione di micronuclei in cellule binucleate derivanti da frammenti cromosomici in ritardo durante la divisione cellulare. I campioni di sangue intero fresco sono il tipo di campione preferito per il test CBMN. Tuttavia, gli svantaggi di lavorare con campioni di sangue fresco includono l'elaborazione immediata dopo la raccolta del sangue e il numero limitato di analisi ripetute che possono essere eseguite senza ulteriori prelievi di sangue.
Poiché la necessità di campioni di sangue fresco può essere logisticamente impegnativa, il test CBMN su campioni di sangue intero crioconservati sarebbe di grande vantaggio, soprattutto negli studi su pazienti su larga scala. Questo documento descrive un protocollo per congelare campioni di sangue intero ed eseguire il test CBMN su questi campioni di sangue congelato. I campioni di sangue di volontari sani sono stati congelati e scongelati in diversi momenti e poi sottoposti a un protocollo di analisi del micronucleo modificato. I risultati dimostrano che questa procedura ottimizzata consente l'esecuzione del test CBMN su campioni di sangue congelato. Il protocollo di crioconservazione descritto può essere molto utile anche per altri saggi citogenetici e per una varietà di saggi funzionali che richiedono linfociti proliferanti.
Introduzione
Fin dalla sua scoperta, l'uso delle radiazioni ionizzanti (IR) è stato oggetto di dibattito tra i ricercatori a causa dei suoi effetti negativi sugli esseri viventi. L'effetto dannoso si manifesta solitamente con danni al DNA come le rotture a doppio filamento (DSB) e la mancata riparazione di questi DSB porta ad aberrazioni cromosomiche e mutazioni, che sono importanti segni distintivi del cancro 1,2. Tali aberrazioni cromosomiche possono essere esaminate mediante saggi citogenici come il test del micronucleo a blocchi di citochinesi (CBMN). I micronuclei sono frammenti cromosomici ritardati che non possono essere incorporati nei nuclei figli e, quindi, vengono lasciati durante la mitosi.
La CBMN è una tecnica citogenetica affidabile e comunemente usata per valutare il danno cromosomico in individui esposti a radiazioni ionizzanti in vivo o in vitro. Nel test CBMN possono essere utilizzati sangue intero fresco o cellule mononucleate isolate del sangue periferico (PBMC). Il sangue intero fresco è per lo più il materiale biologico di scelta poiché l'isolamento e l'elaborazione delle PBMC possono richiedere molto tempo ed è accompagnata da una perdita di plasma sierico che funge da mezzo di supporto per la sopravvivenza e la crescita cellulare. Per ottenere una buona resa cellulare binucleata, il sangue intero fresco deve essere trattato immediatamente dopo la raccolta. Tuttavia, la necessità di un'elaborazione immediata può essere logisticamente impegnativa a causa dei vincoli di tempo. Inoltre, quando si suppone che molti campioni vengano acquisiti per un periodo prolungato o raccolti in punti lontani dai centri di elaborazione, la conservazione di campioni di sangue fresco può essere un fattore limitante 3,4.
Inoltre, per consentire l'analisi MN ripetuta nello stesso individuo/paziente, sarebbe utile il congelamento dei campioni di sangue. Un modo per conservare i linfociti per una successiva applicazione del test CBMN è il congelamento delle PBMC isolate 5,6. Questa tecnica, tuttavia, richiede diverse fasi di elaborazione prima che le PBMC possano essere congelate. Pertanto, la crioconservazione del sangue intero rappresenterebbe un'alternativa semplice ed efficiente in termini di tempo alla crioconservazione di PBMC isolate. Sono disponibili poche informazioni sull'uso del sangue intero congelato per i saggi citogenetici o per i saggi che richiedono la proliferazione dei linfociti. Solo un articolo riporta l'uso di sangue intero crioconservato per l'analisi della metafase7.
Poiché la crioconservazione del sangue intero offrirebbe molti vantaggi nel campo del biomonitoraggio, della biodosimetria e della valutazione della radiosensibilità, il nostro gruppo ha ottimizzato un protocollo di crioconservazione per il sangue intero che consente l'applicazione del test CBMN8. Abbiamo dimostrato che i linfociti presenti nelle colture di sangue intero crioconservate mantengono la loro integrità genomica e la capacità di proliferazione per almeno 1 anno. In questo documento sui metodi, descriviamo in dettaglio la procedura di crioconservazione e il protocollo del saggio CBMN, che è stato ottimizzato da Beyls et al.8, e riportiamo i risultati ottenuti per campioni di sangue congelati di 30 individui sani. Per il test CBMN, le emocolture sono state irradiate in vitro con dosi di 0,5, 1 e 2 Gy per valutare la risposta MN nei linfociti di campioni di sangue intero crioconservato.
Protocollo
Per questo studio, sono stati raccolti campioni di sangue mediante venipuntura da 30 donatori sani di età compresa tra 17 e 65 anni. I dati MN di 20 donatori sono stati riutilizzati dall'articolo di Beyls et al.8 La raccolta dei campioni di sangue è conforme alle linee guida del Comitato etico dell'ospedale universitario di Gand (numero di registrazione: 2019/1565), Belgio. È stato ottenuto il consenso informato scritto da parte di tutti i partecipanti. Vedere la Tabella dei materiali per i dettagli relativi a tutti i materiali e i reagenti utilizzati in questo protocollo.
1. Raccolta di campioni di sangue
- Prima di iniziare, assicurati che sia disponibile il consenso informato scritto dei partecipanti e che le linee guida etiche siano seguite correttamente.
- Raccogliere il sangue in provette di Li-eparina e conservarlo a temperatura ambiente fino al momento della lavorazione per la crioconservazione.
2. Crioconservazione del sangue intero
NOTA: Tutte le fasi fino alla raccolta delle cellule vengono eseguite in modo asettico in flusso d'aria laminare sterile.
- Per crioconservare 1 mL di sangue, preparare 1 mL di terreno di congelamento mescolando 800 μL di siero fetale di vitello (FCS) e 200 μL di dimetilsolfossido (DMSO).
NOTA: Il terreno di congelamento viene preparato in un volume pari ai campioni di sangue che devono essere congelati. - Per la crioconservazione del sangue intero, trasferire il campione di sangue dalla provetta eparinizzata alle provette da centrifuga da 15 o 50 mL
NOTA: La capacità della provetta dipende dal volume del sangue. - Vorticare il sangue a bassa velocità con l'aggiunta continua ma goccia a goccia di un uguale volume di mezzo di congelamento.
- Trasferire 2 mL di miscela per congelamento del sangue in crioviali (2 mL) dove ogni aliquota contiene 1 mL di campione di sangue miscelato con 1 mL di miscela congelante.
- Congelamento graduale graduale
- Trasferire i crioviali in una criobox contenente isopropanolo e metterli in congelatore (-80 °C) per una notte.
- Trasferire i crioviali in azoto liquido per un uso a lungo termine.
3. Scongelamento del sangue crioconservato
NOTA: Per limitare il tempo totale del processo di scongelamento, è necessario gestire un massimo di 8 crioviali (2 mL ciascuno) alla volta.
- Preparazione
- Preriscaldare 200 mL di soluzione salina sterile tamponata con fosfato (PBS) a 37 °C prima di scongelare il sangue.
- Preparare una soluzione di lavoro del terreno di coltura richiesto in condizioni sterili. Assicurarsi che il terreno per coltura includa 1,6 mL di terreno completo: terreno di coltura Rosewell Park Memorial Institute (RPMI) integrato con penicillina/streptomicina (0,5%), 0,2 mL di FCS, 20 μL di piruvato di sodio e 2 μL di β-mercaptoetanolo.
NOTA: Poiché un numero significativo di cellule del sangue può essere perso durante lo scongelamento, il sangue scongelato viene coltivato in piccoli pozzetti come piastre da 24 pozzetti con un volume totale di 2 ml. Viene utilizzata una piastra a più pozzetti per dose. - Per ogni pozzetto di coltura, indicare il codice del donatore e A/B sul coperchio insieme alla data e alla dose, come suggerito di seguito (Figura 1).
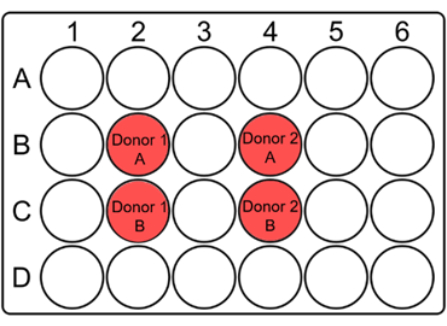
Figura 1: Layout suggerito di una piastra a 24 pozzetti per la coltura di sangue intero per il test del micronucleo. Contrassegnare i pozzetti e indicare i codici donatori nei punti appropriati del coperchio. Per ogni campione del paziente, i pozzetti duplicati devono essere adiacenti l'uno all'altro. Si noti che si tratta di un layout suggestivo per un collimatore 10 x 10 e può essere modificato in base alle dimensioni del collimatore o dei campioni. Fare clic qui per visualizzare una versione più grande di questa figura.
- Passaggi per lo scongelamento e la coltura del sangue intero
- Riscaldare il bagnomaria a 37 °C.
- Estrarre i crioviali necessari dall'azoto liquido (il numero dipende dai requisiti, come il numero di dosi).
NOTA: Un crioviale contiene 1 mL di sangue e 1 mL di terreno di congelamento. Pertanto, è possibile impostare due colture con sangue proveniente da un crioviale. - Scongelare parzialmente i crioviali a bagnomaria (fino a quando non sono ancora visibili piccoli cristalli di ghiaccio).
- Estrarre i flaconcini dal bagnomaria e pulire l'esterno dei flaconcini con carta velina sterile.
- In una cappa sterile a flusso d'aria laminare, aprire i flaconcini molto lentamente per evitare che le bolle d'aria formatesi all'interno delle provette fuoriescano fuori.
- Risospendere il contenuto di ciascun flaconcino e trasferirlo singolarmente in una provetta da centrifuga conica da 15 mL (1 provetta per flaconcino).
- Alle rispettive provette, aggiungere goccia a goccia 1 mL di PBS caldo (37 °C) mentre si agita delicatamente la provetta. Risospendere con una pipetta P1000.
- Per la diluizione e il lavaggio uniforme, aggiungere goccia a goccia 7 mL di PBS preriscaldato (37 °C) e risospendere con una pipetta P1000.
- Centrifugare il sangue per 8 minuti a 180 × g (con impostazione all'accelerazione 1, freno 1) a temperatura ambiente.
- Durante questa fase di attesa, riempire i pozzetti vuoti (diversi da quello in cui verranno coltivate le cellule) con 500 μL di PBS.
- Riposizionare le piastre a pozzetti nell'incubatrice per preriscaldarle.
- Una volta completata la centrifugazione, rimuovere con cautela il surnatante, lasciando circa 1 mL per evitare di disturbare il pellet cellulare.
- Risospendere il pellet nel surnatante rimanente con una pipetta P1000.
- Aggiungere goccia a goccia 8 mL di PBS caldo (37 °C) nelle rispettive provette agitando delicatamente le provette. Successivamente, risospendere con una pipetta P1000.
- Centrifugare il sangue risospeso per 8 min a 180 × g (con impostazione ad accelerazione 9, freno 9).
- Durante questa fase di attesa, trasferire 200 μL di terreno di coltura in ciascuno dei pozzetti contrassegnati.
- Tenere le piastre nell'incubatrice per rimanere a 37 °C.
- Dopo la centrifugazione, rimuovere il surnatante con un movimento continuo (per evitare di disturbare il pellet di cellule sciolte), ma lasciare circa 80 μL del surnatante.
- Al pellet aggiungere 280 μL di FCS (temperatura ambiente) e risospendere (per un volume totale di 360 μL).
- Trasferire 180 μL della sospensione cellulare in ciascun pozzetto e risospendere (= 0,5 mL di "sangue"/coltura). Il volume totale in ogni pozzetto è ora di 380 μL, con conseguente strato medio di 2 mm.
- Incubare le piastre in un incubatore a CO2 a 37 °C per almeno 10 minuti prima dell'irradiazione.
4. Saggio G0 MN
- Estrarre le piastre dall'incubatore e irradiare la coltura cellulare con le dosi richieste come raggi X da 0,5, 1 e 2 Gy (220 kV, 13 mA, 0,15 mm Cu) a temperatura ambiente. Utilizzare campioni irradiati fittizi come controlli per identificare le rese spontanee di MN.
- Subito dopo l'irradiazione, aggiungere 1,62 mL di terreno di coltura (37 °C) in ciascun pozzetto.
- Per stimolare la divisione cellulare nei linfociti T, aggiungere 40 μL di fitoemoagglutinina (PHA) a ciascun pozzetto e risospendere accuratamente.
- Rimettere queste piastre nell'incubatrice (5% CO2, 37 °C).
NOTA: Questa sarà l'ora di inizio del test. - Bloccare la citochinesi 23 ore dopo la stimolazione aggiungendo 8 μL di citocalasina B (6 μg/mL) per pozzetto e risospendere correttamente.
- Prelevare le colture cellulari 70 ore dopo la stimolazione/coltura. Risospendere e trasferire le cellule in una provetta da 15 ml. Sciacquare ogni pozzetto con 2 mL di PBS e aggiungere questo PBS alla rispettiva provetta da 15 mL.
- Centrifugare le provette per 8 minuti a 180 × g, a temperatura ambiente.
- Scartare il surnatante ma lasciare circa 500 μL sul pellet.
- Agitare il pellet (alla massima velocità) e durante il vortice, aggiungere lentamente 2 mL di cloruro di potassio freddo (KCl, 4 °C).
- Centrifugare immediatamente le cellule a 180 × g per 8 min.
- Scartare il surnatante, lasciando circa 500 μL di surnatante.
- Agitare il pellet (alla massima velocità) e durante il vortice, aggiungere lentamente 2 mL di fissativo a freddo 1 (soluzione di metanolo/acido acetico/Ringer in un rapporto di 4:1:5).
- Lasciare le provette per una notte a 4 °C (minimo 12 ore e massimo 96 ore).
- Centrifugare per 8 minuti a 180 × g.
- Scartare il surnatante.
- Vorticare il pellet (alla massima velocità) e durante il vortice, aggiungere lentamente goccia a goccia 2 mL di fissativo freddo 2 (metanolo/acido acetico in un rapporto di 4:1).
- Centrifugare per 8 min a 180 × g.
- Scartare il surnatante.
- Agitare il pellet (alla massima velocità) e poi aggiungere lentamente (goccia a goccia), mentre si vortex, 2 mL di fissativo freddo 2 al pellet.
- Lasciare le provette a 4 °C (minimo 12 h e massimo 96 h).
- Pulire i vetrini con isopropanolo ed etichettarli correttamente.
NOTA: Utilizzare adesivi stampati per etichettare poiché l'inchiostro del pennarello viene facilmente rimosso durante l'elaborazione. - Centrifugare le provette per 8 minuti a 180 × g.
- Trasferire il surnatante in un'altra provetta per concentrare le cellule in base alle dimensioni del pellet.
- Vorticare il pellet.
- Far cadere 40 μL delle celle fisse su un vetrino asciutto e pulito.
- Lasciare asciugare i vetrini a temperatura ambiente. Conservare immediatamente i vetrini in una scatola o in una macchia per l'osservazione.
5. Colorazione arancione acridina (AO)
- Immergere i vetrini in una colorante AO per 1 minuto, seguito da un rapido lavaggio in acqua distillata, quindi posizionare i vetrini in tampone fosfato (pH 6,8) per 1 minuto.
- Estrarre i vetrini dalla soluzione tampone e con carta velina pulita, asciugare il retro dei vetrini e mettere i vetrini su una carta velina pulita.
- Far cadere 20 μL di tampone fosfato sulla parte superiore del vetrino e coprirlo delicatamente con un vetrino coprioggetti pulito, evitando la formazione di bolle d'aria.
- Sigillare questi vetrini con cemento siliconico.
NOTA: Poiché l'AO è sensibile alla luce e sbiadisce nel tempo, per un buon contrasto e fluorescenza, si consiglia di segnare i vetrini entro 5 giorni dalla colorazione. Conservare sempre i vetrini in una cella frigorifera (4 °C), quando non vengono esaminati.
6. Punteggio dei vetrini macchiati
- Posiziona il vetrino sotto un microscopio a fluorescenza ed esamina 1.000 cellule binucleate (BN). Contare manualmente i MN, che sono uno dei sei biomarcatori di tossicità. A tale scopo, due marcatori indipendenti esaminano 500 celle/vetrini da BN con lo stesso ingrandimento.
NOTA: Di seguito sono riportati alcuni punti salienti dei criteri di punteggio, come raccomandato da Fenech per assegnare un punteggio9 ai vetrini colorati- Selezionare una cellula BN cercando cellule ben arrotondate con citoplasma intatto, con due nuclei ben distinti di circa le stesse dimensioni, forma regolare e schema di colorazione. Assicurarsi che il citoplasma della cellula BN sia distinguibile dal citoplasma della cellula adiacente.
- Segnare un MN, notando che è morfologicamente identico ma più piccolo dei nuclei principali; anche il MN più grande non può essere più di 1/3 del diametro dei nuclei principali. Segnare un MN solo se non tocca i nuclei principali o almeno il confine micronucleare è distinguibile dal confine dei nuclei principali.
Risultati
Per validare la riproducibilità del protocollo, abbiamo eseguito il test MN su campioni di sangue crioconservati di 30 volontari sani di età compresa tra 17 e 65 anni. L'età media del gruppo è di 35 anni. Il tempo di crioconservazione variava da 1 settimana a 154 settimane. Dopo aver esposto la coltura di cellule intere del sangue a diverse dosi di radiazioni (0,5, 1 e 2 Gy), la resa dei micronuclei in 1.000 cellule BN è stata esaminata al microscopio. Le cellule binucleate ben arrotondate (come si può vedere nella Figura 2) indicano un recupero riuscito di cellule vitali sane da campioni di sangue intero crioconservati. Da notare che la risposta alle radiazioni dei linfociti è rimasta stabile dopo la conservazione a lungo termine a temperature ultra-basse (azoto liquido). Questa osservazione è in linea con la risposta attesa da campioni di sangue fresco.
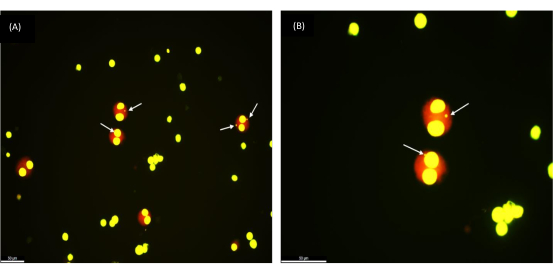
Figura 2: Micronuclei osservati in cellule binucleate recuperate da un campione di sangue intero congelato che è stato crioconservato 1 anno fa. (A) Ingrandimento 200x, (B) Ingrandimento 400x; Frecce che puntano verso i MN. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Con l'aumento delle dosi di radiazioni (0,5, 1 e 2 Gy), è stato osservato un aumento lineare-quadratico della resa del micronucleo (Tabella 1 e Figura 3). Le rese di MN nei campioni di controllo irradiati fittizi (0 Gy) rappresentano le rese di MN di fondo che sono principalmente il risultato di cromosomi ritardati.
| Dose (Gy) | 0 | 0.5 | 1 | 2 |
| Nella media | 18 | 107 | 247 | 601 |
| SD | 10.8 | 23.9 | 53.3 | 101.1 |
| CV (%) | 59.9 | 22.3 | 21.6 | 16.8 |
| Gamma | 5-41 | 62-140 | 139-324 | 395-755 |
Tabella 1: Intervallo e coefficiente di variazione insieme alla resa media di MN, come osservato in campioni di sangue intero crioconservati di 30 donatori sani, indicativi di variabilità interindividuale. Abbreviazioni: CV = coefficiente di variazione; SD = deviazione standard.
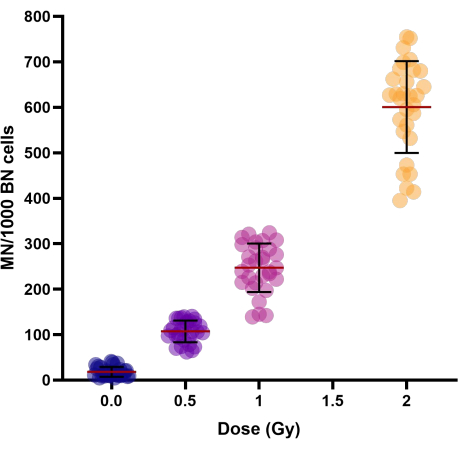
Figura 3: Resa dei micronuclei osservata in campioni di sangue intero crioconservati di controllo e irradiati di 30 donatori. I periodi di crioconservazione variavano da 1 settimana a 154 settimane. Il grafico del grafico a dispersione mostra i singoli valori. Le linee nei cluster rappresentano la media ± la deviazione standard del gruppo. Abbreviazioni: MN = micronuclei; BN = binucleato. Fare clic qui per visualizzare una versione più grande di questa figura.
Per studiare la variazione interindividuale del rendimento MN delle persone, è stato calcolato il coefficiente di variazione (CV) (vedi Tabella 1). Per la MN indotta da radiazioni, è stato ottenuto un CV < 25% per tutte le dosi (0,5, 1 e 2 Gy), il che indica una buona riproducibilità del protocollo modificato.
Discussione
Il protocollo modificato per l'applicazione del test CBMN è un modo relativamente semplice e conveniente per conservare campioni di sangue in massa. La procedura delinea tutti i dettagli minuti ma importanti che devono essere curati durante la crioconservazione e il test CBMN. Altri protocolli di laboratorio utilizzano normalmente il 10% di DMSO nella miscela di congelamento, mentre la nostra miscela di congelamento contiene il 20% di DMSO insieme all'80% di FCS7. Poiché questa miscela di congelamento viene aggiunta in volumi uguali al campione di sangue intero, anche la concentrazione finale è del 10% di DMSO. Per migliorare il tasso di sopravvivenza cellulare e stimolare la divisione cellulare, aggiungiamo l'1% di piruvato di sodio e lo 0,1% di beta-mercaptoetanolo al terreno di coltura completo (cRPMI). Questo è in accordo con il protocollo di coltura cellulare stabilito dal nostro gruppo di ricerca 6,8.
Sebbene il problema dell'aggregazione cellulare durante lo scongelamento non potesse essere risolto completamente in questo protocollo, la segregazione cellulare era migliore rispetto agli altri protocolli convenzionali. Invece di un'aggiunta costante e brusca di terreni di coltura per recuperare le cellule dopo lo scongelamento, abbiamo ottenuto risultati migliori quando il PBS preriscaldato (37 °C) è stato aggiunto goccia a goccia durante le fasi di lavaggio. Questo miglioramento aiuta a ridurre lo stress cellulare e riduce al minimo l'aggregazione con un comprovato elevato recupero di cellule. Inoltre, non è stata osservata alcuna chiara differenza nella vitalità cellulare quando il PBS è stato utilizzato su RPMI. È stato convalidato dal gruppo che la durata del periodo di crioconservazione (fino a 1 anno) non influirà sulle rese di MN, sia nei campioni irradiati che in quelli non irradiati 6,8. Gli studi suggeriscono che una buona vitalità cellulare e la proliferazione delle PBMC possono essere ottenute con un congelamento graduale a basse temperature (azoto liquido), seguito da un'aggiunta graduale di terreno preriscaldato durante lo scongelamento10,11. I ricercatori hanno dimostrato che le sottopopolazioni di linfociti T nel sangue intero scongelato sono paragonabili a quelle osservate nelle PBMCscongelate 12. Inoltre, è dimostrato che i sottotipi di cellule recuperati da campioni di sangue intero crioconservati sono simili a quelli osservati in campioni di sangue intero fresco13,14.
Se esaminiamo i risultati indicativi ottenuti nel rapporto, vediamo che l'aumento quadratico lineare con la dose (Figura 3) è in accordo con altri rapporti della letteratura sui micronuclei indotti dal trasferimento di energia lineare (LET)15,16. La variabilità delle rese di MN osservata nei campioni di sangue intero crioconservato (Tabella 1) è in linea con quella riportata per le colture di sangue intero fresco 8,17,18. Il protocollo qui descritto in dettaglio è stato validato su sangue intero fresco e crioconservato di 20 volontari sani8. L'indice di divisione nucleare (NDI), che è un parametro importante della proliferazione cellulare osservato in tale relazione8, era in accordo con quello suggerito per il sangue intero fresco19,20. Nel complesso, questo protocollo ottimizzato di crioconservazione del sangue intero e il test del micronucleo modificato forniscono una migliore resa cellulare e, pertanto, l'adattamento di questo protocollo è raccomandato per le valutazioni della radiosensibilità. Poiché la riproducibilità del protocollo è già stata validata8, si suggerisce di averne l'applicabilità in studi su larga scala e multicentrici.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Gli autori desiderano ringraziare L. Pieters, T. Thiron e G. De Smet per il loro supporto tecnico. Siamo grati a tutti i volontari che hanno donato il sangue per lo studio. Il lavoro è stato sostenuto finanziariamente dalla Research Foundation- Flanders (FWO) nell'ambito di Grant (T000118N).
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tubes | Greiner | 188271 | |
| 24-well cell suspension plate | VWR | 734-2779 | |
| 96% alcohol | ChemLab | CL00.1807.2500 | |
| Acetic acid | Merck life science | 8,18,75,52,500 | |
| Acridine orange | Merck life science | 235474-5g | |
| CaCl2 | Merck life science | C5670-100g | |
| cover slips | VWR | 631-1365 | 22 x 50 |
| Cryobox (Mr.Frosty) | Nalgene, Sigma Aldrich | ||
| Cryovials 2ml | Novolab | A04573 | |
| Cytochalsin B | Merck life science | C6762-10 | 10 mg |
| Dimethyl sulphoxide (DMSO) | Merck life science | D4540-500ml | |
| Fetal calf serum (FCS) | Thermo Fischer scientific | 10270-106 | |
| Fixative 1 | Methanol/acetic acid/ringer in a ratio of 4:1:5 | ||
| Fixative 2 | Methanol/acetic acid in a ratio of 4:1 | ||
| GURR buffer | Thermo Fischer scientific | 10582013 | phosphate buffer (pH 6.8) |
| KCl | Merck life science | 1,04,93,60,250 | 75 mM |
| KH2PO4 | Merck life science | 1,04,87,30,250 | |
| Li-heparin tubes | BD Life sciences | 367526-LH170 I.U. | BD Vacutainer |
| Methanol | fisher scinetific | M/4000/17 | |
| Na2HPO2 | Merck life science | 10,65,80,500 | |
| NaCl | Merck life science | S7653-1kg | |
| Object slides | VWR | MENZAA00000112E04 | |
| Penicillin/Streptomycin | Thermo Fischer scientific | 15140-122 | 10,000 U/mL + 10,000 µg/mL |
| Phytohemagglutinin (PHA-M) | Thermo Fischer scientific | 10576-015 | |
| Ringer solution | contains NaCl, KCl, CaCl2 dissolved in distilled water | ||
| RPMI-1640 | Thermo Fischer scientific | 52400041 | |
| Silicon rubber adhesive sealent | collall | CF-100 | |
| Sodium pyruvate | Thermo Fischer scientific | 11360039 | |
| Sterile warm PBS (37 °C) | contains NaCl, Na2HPO2, KH2PO4 dissolved in distilled water | ||
| β-mercaptoethanol | Thermo Fischer scientific | 31350-010 |
Riferimenti
- Grade, M., Difilippantonio, M. J., Camps, J. Patterns of chromosomal aberrations in solid tumors. Recent Results in Cancer Research. 200, 115-142 (2015).
- Jiao, Y., Cao, F., Liu, H. Radiation-induced cell death and its mechanisms. Health Physics. 123 (5), 376-386 (2022).
- Roederer, M., et al. The genetic architecture of the human immune system: a bioresource for autoimmunity and disease pathogenesis. Cell. 161 (2), 387-403 (2015).
- Bankoglu, E. E., et al. Effect of cryopreservation on DNA damage and DNA repair activity in human blood samples in the comet assay. Archives of Toxicology. 95, 1831-1841 (2021).
- Zijno, A., Saini, F., Crebelli, R. Suitability of cryopreserved isolated lymphocytes for the analysis of micronuclei with the cytokinesis-block method. Mutagenesis. 22, 311-315 (2007).
- Sioen, S., Cloet, K., Vral, A., Baeyens, A. The cytokinesis-block micronucleus assay on human isolated fresh and cryopreserved peripheral blood mononuclear cells. Journal of Personalized Medicine. 10 (3), 125 (2020).
- Cheng, L., Wang, L. E., Spitz, M. R., Wei, Q. Cryopreserving whole blood for functional assays using viable lymphocytes in molecular epidemiology studies. Cancer Letters. 166 (2), 155-163 (2001).
- Beyls, E., Baeyens, A., Vral, A. The cytokinesis-block micronucleus assay for cryopreserved whole blood. International Journal of Radiation Biology. 97 (9), 1252-1260 (2021).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2 (5), 1084-1104 (2007).
- Ramachandran, H., et al. Optimal thawing of cryopreserved peripheral blood mononuclear cells for use in high-throughput human immune monitoring studies. Cells. 1 (3), 313-324 (2012).
- Hønge, B. L., Petersen, M. S., Olesen, R., Møller, B. K., Erikstrup, C. Optimizing recovery of frozen human peripheral blood mononuclear cells for flow cytometry. PLoS One. 12 (11), e0187440-e0187517 (2017).
- Alam, I., Goldeck, D., Larbi, A., Pawelec, G. Flow cytometric lymphocyte subset analysis using material from frozen whole blood. Journal of Immunoassay and Immunochemistry. 33 (2), 128-139 (2012).
- Langenskiöld, C., Mellgren, K., Abrahamsson, J., Bemark, M. Determination of blood cell subtype concentrations from frozen whole blood samples using TruCount beads. Cytometry Part B: Clinical Cytometry. 94B, 660-666 (2018).
- Braudeau, C., et al. An easy and reliable whole blood freezing method for flow cytometry immuno-phenotyping and functional analyses. Cytometry Part B: Clinical Cytometry. 100 (6), 652-665 (2021).
- Thierens, H., Vral, A., De Ridder, L. Biological dosimetry using the micronucleus assay for lymphocytes: interindividual differences in dose response. Health Physics. 61 (5), 623-630 (1991).
- Vral, A., Fenech, M., Thierens, H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure. Mutagenesis. 26 (1), 11-17 (2011).
- Vral, A., Thierens, H., Baeyens, A., De Ridder, L. The micronucleus and G2-phase assays for human blood lymphocytes as biomarkers of individual sensitivity to ionizing radiation: limitations imposed by intraindividual variability. Radiation Research. 157 (4), 472-477 (2002).
- Pajic, J., et al. Inter-individual variability in the response of human peripheral blood lymphocytes to ionizing radiation: comparison of the dicentric and micronucleus assays. Radiation and Environmental Biophysics. 54, 317-325 (2015).
- Fenech, M., et al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes: results of an international slide-scoring exercise by the HUMN project. Mutation Research. 534 (1-2), 45-64 (2003).
- Miszczyk, J., Rawojć, K. Effects of culturing technique on human peripheral blood lymphocytes response to proton and X-ray radiation. International Journal of Radiation Biology. 96 (4), 424-433 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon