Method Article
قياس تنفس الميتوكوندريا في ألياف العضلات الهيكلية للإنسان والفأر عن طريق قياس التنفس عالي الدقة
In This Article
Summary
نصف هنا طريقة شاملة لقياس الفسفرة التأكسدية للميتوكوندريا في ألياف العضلات الهيكلية النفاذية الطازجة من عضلة الإنسان أو الفأر. تسمح هذه الطريقة بالقياس الكمي في الوقت الفعلي لتنفس الميتوكوندريا وتقييم تفضيل الوقود والمرونة الأيضية مع الحفاظ على شبكات الميتوكوندريا الحالية وسلامة الغشاء.
Abstract
وظيفة الميتوكوندريا، وهي حجر الزاوية في إنتاج الطاقة الخلوية، أمر بالغ الأهمية للحفاظ على التوازن الأيضي. يرتبط اختلاله الوظيفي في العضلات الهيكلية بالاضطرابات الأيضية السائدة (مثل مرض السكري والسمنة) ، وضمور العضلات ، وساركوبينيا. في حين أن هناك العديد من التقنيات لتقييم محتوى الميتوكوندريا والتشكل ، فإن الطريقة المميزة لتقييم وظيفة الميتوكوندريا هي قياس الفسفرة المؤكسدة للميتوكوندريا (OXPHOS) عن طريق قياس التنفس. يوفر القياس الكمي للميتوكوندريا OXPHOS نظرة ثاقبة لكفاءة إنتاج الطاقة المؤكسدة للميتوكوندريا والطاقة الحيوية الخلوية. يوفر مقياس التنفس عالي الدقة قياسات حساسة للغاية وقوية ل OXPHOS الميتوكوندريا في ألياف العضلات المتداخلة عن طريق قياس التغيرات في الوقت الفعلي في معدل استهلاك الأكسجين في الميتوكوندريا. إن استخدام ألياف العضلات المتداخلة ، على عكس الميتوكوندريا المعزولة ، يحافظ على شبكات الميتوكوندريا ، ويحافظ على سلامة غشاء الميتوكوندريا ، ويسمح في النهاية بإجراء قياسات أكثر صلة من الناحية الفسيولوجية. يسمح هذا النظام أيضا بقياس تفضيل الوقود والمرونة الأيضية - الجوانب الديناميكية لاستقلاب طاقة العضلات. هنا ، نقدم دليلا شاملا لقياسات OXPHOS للميتوكوندريا في ألياف العضلات الهيكلية للإنسان والفأر باستخدام مقياس تنفس عالي الدقة. تتكون مجموعات العضلات الهيكلية من أنواع مختلفة من الألياف تختلف في تفضيل وقود الميتوكوندريا والطاقة الحيوية. باستخدام مقياس تنفس عالي الدقة ، نصف طرقا لتقييم كل من ركائز تحلل السكر الهوائية والأحماض الدهنية لتقييم تفضيل الوقود والمرونة الأيضية بطريقة تعتمد على نوع الألياف. البروتوكول متعدد الاستخدامات وقابل للتطبيق على كل من ألياف العضلات البشرية والقوارض. الهدف هو تعزيز قابلية استنساخ ودقة تقييمات وظيفة الميتوكوندريا ، مما سيحسن فهمنا للعضية المهمة لصحة العضلات.
Introduction
الميتوكوندريا هي حجر الزاوية في إنتاج الطاقة الخلوية ، مما يجعلها لا غنى عنها للحفاظ على التوازن الخلوي والعضوي الأمثل. هذه العضيات مزدوجة الغشاء مسئولة بشكل أساسي عن الفسفرة التأكسدية. تعمل هذه العملية على تحويل العناصر الغذائية بكفاءة ، مثل السكريات والأحماض الدهنية ، إلى أدينوسين ثلاثي الفوسفات (ATP) ، العملة الخلوية للطاقة. بالإضافة إلى دورها في استقلاب الطاقة ، تعد الميتوكوندريا أيضا منظمات رئيسية للعمليات الخلوية المختلفة ، بما في ذلك موت الخلايا المبرمج ، وتوازن الكالسيوم ، وأنواع الأكسجين التفاعلية (ROS) 1,2. بسبب دورها المحوري في الحفاظ على التوازن الخلوي والعضوي ، غالبا ما يكون للاضطرابات في وظيفة الميتوكوندريا آثار ضارة على صحة الأنسجة والكائنات الحية. في العضلات الهيكلية ، يرتبط خلل الميتوكوندريا بالعديد من الحالات المرضية ، بما في ذلك الاضطرابات الأيضية (مثل السمنة والسكري وأمراض القلب والأوعية الدموية) ، ساركوبينيا ، وضمور العضلات3،4،5،6،7،8.
يمكن أن يظهر الخلل الوظيفي للميتوكوندريا في المقام الأول على أنه محتوى ميتوكوندريا متغير ، وعدد ، ومورفولوجيا ، بالإضافة إلى اضطراب التمثيل الغذائي. وبالتالي ، فإن تحقيق فهم شامل لخلل الميتوكوندريا يتطلب نهجا تكامليا وشاملا. تتضمن دراسات التوصيف الأولية فحص مستويات التعبير لمجمعات بروتين السلسلة التنفسية كقراءة لمحتوى الميتوكوندريا ، وتحديد كمية الحمض النووي للميتوكوندريا وعلامات التكوين الحيوي كمقياس للتكوين الحيوي للميتوكوندريا ، والتصوير المجهري الإلكتروني المتطور لتقييم مورفولوجيا الميتوكوندريا9،10. تشمل التقييمات الإضافية لوظيفة الميتوكوندريا تقييم إنتاج ROS الخلوي و ATP وإمكانات غشاء الميتوكوندريا9.
نظرا لأن الميتوكوندريا ضرورية لإنتاج الطاقة الخلوية والتوازن ، فإن السمة المميزة لتقييم وظيفة الميتوكوندريا هي قياس الفسفرة التأكسدية للميتوكوندريا (OXPHOS). يسمح قياس التنفس عالي الدقة للألياف العضلية النفاذية بقياس التغيرات في الوقت الفعلي في معدل استهلاك الأكسجين في الميتوكوندريا كقراءة للتغيرات الديناميكية في نشاط السلسلة التنفسية للميتوكوندريا OXPHOS9،11،12. يسمح تطبيق المعدلات والمثبطات الكيميائية الانتقائية للمرء بقياس نشاط المجمعات التنفسية المختلفة بشكل مباشر ومتسلسل. على الرغم من أنه يمكن استخدام الميتوكوندريا المعزولة في قياس التنفس ، إلا أن استخدام ألياف عضلية جديدة ونفاذة يحافظ على شبكات الميتوكوندريا الداخلية وسلامة الغشاء - مما يسمح بإجراء قياسات أكثر صلة من الناحية الفسيولوجية. بالإضافة إلى ذلك، نظرا لأن أنواع الألياف العضلية المختلفة لها تفضيلات مختلفة للركيزة ومعدلات التنفس، فإن هذا النظام يسمح للمرء بقياس التغيرات في تفضيل الوقود والمرونة الأيضية بناء على نوعالألياف 13.
هنا ، نصف بروتوكولا شاملا لقياسات OXPHOS للميتوكوندريا باستخدام ألياف العضلات الهيكلية البشرية أو الفأر في نظام قياس التنفس عالي الدقة. تتضمن طرقا لقياس تنفس الأكسجين الميتوكوندريا في الألياف المؤكسدة أو المحللة للسكر باستخدام إما البيروفات أو بالميتويل كارنيتين كركيزة. يسمح هذا البروتوكول باستخدام ركائز الوقود الأخرى لمعالجة أسئلة التمثيل الغذائي المحددة المتعلقة بالعيوب في استخدام الركيزة وتفضيل الوقود.
Protocol
تمت الموافقة على جميع إجراءات الماوس من قبل اللجنة المؤسسية لرعاية واستخدام بجامعة واشنطن. يمكن استخدام الفئران من أي جنس وعمر ووزن لهذه التجارب وستعتمد على طبيعة السؤال التجريبي الذي يسعى المرء إلى معالجته. الفئران المستخدمة هنا هي الفئران البالغة (12-16 أسبوعا) ، ذكور الفئران من النوع البري C57BL / 6. تمت الموافقة على جميع الإجراءات البشرية من قبل مجلس المراجعة المؤسسية بجامعة واشنطن. وافق المشاركون في الدراسة على استخدام البيانات ، وبيانات الموضوع البشري التمثيلية المدرجة في هذا البروتوكول مأخوذة من دراسة منشورة14. البيانات هنا مأخوذة من الإناث غير المصابات بالسكري بعد انقطاع الطمث (55-75 سنة). وترد في الجدول 1 تفاصيل إعداد الكواشف اللازمة للمقايسة. يتم سرد المعلومات المتعلقة بالكواشف والأدوات والآلات المحددة المستخدمة في الفحص في جدول المواد. يتم تقديم نظرة عامة تخطيطية للبروتوكول في الشكل 1.
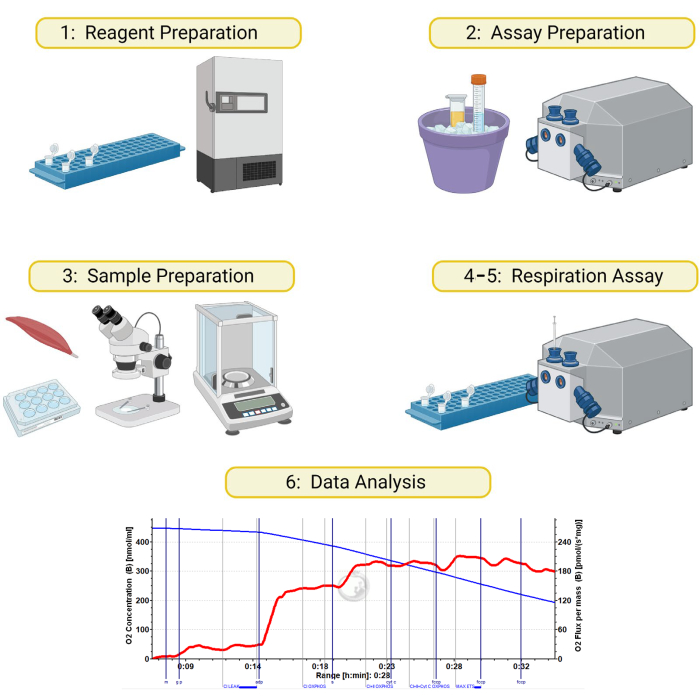
الشكل 1: رسم تخطيطي لقياس التنفس عالي الدقة على عينات العضلات الهيكلية النفاذية. تنقسم الطريقة المفصلة في هذه المخطوطة إلى 6 أقسام: 1) تحضير مخازن التنفس والكواشف ، 2) تحضير الأدوات والكاشف في يوم الفحص ، 3) تحضير عينات العضلات ونفاذيتها ، 4) تحضير العينة والأداة ، 5) تشغيل فحص التنفس ، و 6) تحليل البيانات. تم إنشاؤها باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد الفحص ومعايرة الأدوات
- في يوم الفحص ، قم بإزالة العدد المطلوب من القسمة لكل مركب تنفس (بليبستاتين ، بالميتويل كارنيتين ، الغلوتامات ، مالات ، ADP ، سكسينات ، سيتوكروم C ، FCCP) وذوبان الجليد. ذوبان قوارير BIOPS و MiR05 على الجليد.
- تحضير محاليل الصابونين والبيروفات كما هو موضح في الجدول 1. قم بإعداد حل عملي ل MiR05 كما في الجدول 1. تحضير 5 مل من محلول العمل من MiR05 لكل أداة (2 غرفة). توسيع النطاق حسب الحاجة.
- قم بتشغيل نظام قياس التنفس عالي الدقة ونظام التفريغ. قم بإزالة السدادات ، وقم بإزالة محلول تخزين الإيثانول بنسبة 70٪ عن طريق الفراغ ، وأعد ملء الغرفة بدرجة جزيئية عالية النقاء H2O. قم بإزالة H2O عن طريق الفراغ وإعادة التعبئة. كرر لما مجموعه 3 غسلات. بعد الغسيل النهائي ، أضف 2 مل من MiR05 (بدون الكرياتين أو الجليبيستاتين) إلى كل غرفة.
- افتح برنامج قياس التنفس. بعد بدء تشغيل البرنامج ، سيتم فتح مربع منبثق لإعدادات الجهاز. اضبط سرعة تحريك الغرفة على 750 دورة في الدقيقة ، ودرجة الحرارة على 37 درجة مئوية ، والفاصل الزمني لتسجيل البيانات على 2 ثانية. اضبط الكسب على 1 وجهد الاستقطاب على 800 مللي فولت لأجهزة استشعار الأكسجين. انقر فوق الاتصال ب Oxygraph لإنشاء اتصال مع الأداة.
- بعد إنشاء الاتصال، سيتم فتح مربع حوار لتسمية الملف التجريبي وحفظه. احفظ الملف بالتاريخ الحالي والمعايرة. بعد حفظ الملف ، سيظهر مربع حوار منبثق للتفاصيل التجريبية. ليست هناك حاجة إلى معلومات لتشغيل المعايرة ، ويمكن إغلاق الصندوق.
- سجل تركيز الأكسجين لمدة 30 دقيقة على الأقل للسماح للغرف بالإحماء وتسجيل إشارات معايرة الهواء. يمكن القيام بذلك أثناء تحضير ألياف العضلات ، كما هو مفصل في الخطوة 2 أدناه.
- في نهاية فترة المعايرة، حدد منطقة معايرة عبر المنطقة التي يكون فيها تركيز الأكسجين (الخط الأزرق) مستقرا. للقيام بذلك ، اضغط باستمرار على مفتاح Shift وزر الماوس الأيسر واسحب عبر منطقة على المخطط الزمني.
- افتح نافذة المعايرة بالانتقال إلى معايرة Oxygraph > O2. لمعايرة الهواء، حدد العلامة التي تم إنشاؤها في الخطوة 1.8. انقر فوق معايرة ونسخ إلى الحافظة.
- كرر الخطوات 1.6-1.8 للغرفة المتبقية. قم بإجراء معايرة الهواء يوميا. أوقف تسجيل معايرة الهواء واحفظ الملف عن طريق قطع الاتصال بالجهاز. بعد أن تصبح العينات جاهزة ، انتقل إلى الخطوة 3 لإجراء الفحص.
2. حصاد ونفاذية ألياف العضلات والهيكل العظمي
- عزل أنسجة الفأر
- لكل عينة ليتم تحليلها ، املأ بئرا واحدا من طبق استزراع 12 بئرا ب 1 مل من BIOPS. ضع الطبق على الثلج ليبرد.
- بعد القتل الرحيم للفأر عن طريق استنشاق ثاني أكسيد الكربون متبوعا بخلع عنق الرحم ، احصد العضلات الهيكلية ذات الأهمية ، مع التأكد من إزالة جميع الأنسجة الضامة والدهون (الشكل 2 أ). ضع العضلات في أحد الآبار التي تحتوي على BIOPS. ضعه على الثلج حتى تحضير الألياف.
ملاحظة: يمكن فحص أي عضلة هيكلية باستخدام هذا البروتوكول - يعتمد نوع العضلات الذي تم فحصه على السؤال التجريبي الذي يسعى المرء إلى معالجته. في حالة العضلات الهيكلية ذات أنواع الألياف المختلطة ، مثل gastrocnemius ، من الممكن فصل الأنسجة إلى أقسام بيضاء وحمراء لقياس النشل السريع في الغالب (المقاطع البيضاء) والألياف البطيئة في الغالب (المقاطع الحمراء) (الشكل 2 ب).
- عزل الأنسجة البشرية
- جمع الأنسجة باتباع البروتوكول السريري14. شطف الأنسجة بسرعة مع برنامج تلفزيوني بارد ومعقم ووضعه في أنبوب مخروطي يحتوي على 2 مل من محلول BIOPS. احتفظ بالمناديل على الثلج حتى تحضير الألياف.
- إعداد الألياف
- سيتم النفاذية في لوحة زراعة الأنسجة المكونة من 6 آبار. أضف 2 مل من محلول BIOPS إلى مجموعة واحدة من الآبار و 2 مل من MiR05 إلى مجموعة أخرى من الآبار. ستكون هناك حاجة إلى مجموعة واحدة من الآبار لكل عينة يتم فحصها.
- قم بتعبئة صينية بالثلج وضع طبق بتري الزجاجي رأسا على عقب. تأكد دائما من إبقاء العضلات على الجليد.
- انقل عينات العضلات المحصودة إلى منصة طبق بتري المبردة باستخدام الملقط. باستخدام ملقطين رفيعي الرأس ومجهر تشريح مع مصدر ضوء ، قم بتنظيف الأنسجة برفق عن طريق إزالة أي أوتار ولفافة وأنسجة دهنية متصلة بالعضلات.
- بعد إزالة جميع الأنسجة غير العضلية الدخيلة ، اسحب ألياف العضلات برفق باستخدام الملقط ذي الرؤوس الدقيقة حتى تصبح حزم صغيرة من الألياف الشفافة يتراوح طولها من 0.75 إلى 1.0 مم (الشكل 2C-D). بعد فصل الألياف ، استخدم الملقط لنقل حزم الألياف إلى بئر على لوحة 6 آبار تحتوي على محلول BIOPS على الجليد.
- أضف 20 ميكرولتر من محلول سابونين 5 مجم / مل إلى كل بئر BIOPS واحتضن الطبق على الثلج أثناء التأرجح برفق في غرفة باردة لمدة 20 دقيقة.
- بعد علاج الصابونين ، انقل ألياف العضلات إلى البئر التي تحتوي على MiR05 لشطفها قبل الفحص. احتضن على الجليد بينما تهتز بلطف في غرفة باردة لمدة 15 دقيقة.
- بعد اكتمال حضانة الألياف في MiR05 ، اجمع الألياف بالملقط الحاد وامسح ألياف العضلات برفق على مسح المهمة. قم بلف أنبوب طرد مركزي بلاستيكي دقيق سعة 1.5 مل على توازن دقيق وضع 2-3 مجم من الألياف في الأنبوب. سجل وزن الألياف النهائي على جانب كل أنبوب. ضع الأنبوب على الثلج. كرر مع عينات أخرى. انتقل فورا إلى الخطوة 3.
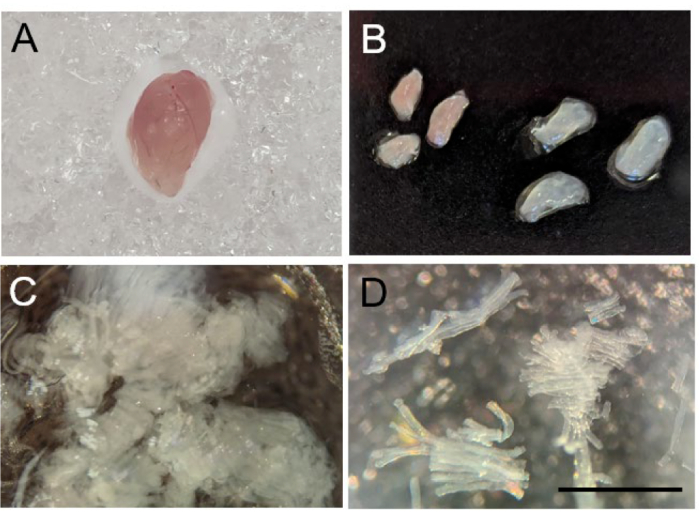
الشكل 2: فصل الألياف العضلية الهيكلية للفأر. (أ) التشكل الإجمالي لساق الفأر بعد الحصاد. ب: تشريح الساق إلى قسمين أحمر (يسار) وأبيض (يمين). ج: ألياف عضلية منفصلة ميكانيكيا. د: صورة بمعدل 10 أضعاف للألياف العضلية المنفصلة بنجاح. شريط المقياس 1 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد عينات العضلات في مقياس التنفس
- قم بتفريغ MiR05 المستخدم لمعايرة الأجهزة كما هو مفصل في الخطوة 1 أعلاه وأضف 2.1 مل من محلول MiR05 العامل إلى كل غرفة.
- ابدأ ملفا جديدا للتجربة باستخدام إعدادات الأداة نفسها كما هو مفصل في الخطوة 1.5. فوق. قم بتعيين اسم الملف وحفظ الإعدادات.
- بعد تعيين اسم الملف ، سيكون مربع حوار الشاشة التالية للحصول على تفاصيل تجريبية محددة. أدخل معلومات العينة ووزن كل عينة مضافة إلى كل غرفة. أغلق مربع الحوار.
- بمجرد الدخول إلى الملف التجريبي الجديد ، اضبط المعايرة عن طريق فتح نافذة معايرة O2. انقر فوق نسخ من ملف وحدد الملف المحفوظ من الخطوة 1.9. فوق. انقر فوق الزر معايرة ونسخ إلى الحافظة . كرر العملية للغرفة المتبقية.
- باستخدام ملقط رفيع ، انقل حزم الألياف العضلية بعناية إلى محلول التنفس للغرفة المناسبة. كرر للغرفة المتبقية.
- ضع السدادات على الحجرة وأغلق الحجرة بحذر عن طريق دفع السدادات في منتصف الطريق إلى الأسفل. بمجرد أن تتفاعل الحلقات على السدادات مع جدار الحجرة وتكون هناك مقاومة ، استخدم حركة التواء أثناء الضغط لأسفل للإغلاق. عندما تكون الغرفة مغلقة في منتصف الطريق ، يمكن ملاحظة فقاعة هواء صغيرة في الجزء العلوي من الغرفة.
ملاحظة: تخضع الألياف النفاذية لقيود انتشار الأكسجين في ظل ظروف الجهاز التنفسي العادية. للتحايل على هذا القيد ، يتم إجراء الفحص تحت تركيزات الأكسجين المرتفعة11. - املأ حقنة بلاستيكية سعة 10 مل بالأكسجين النقي من خزان الأكسجين. ضع الإبرة الطويلة غير الحادة المرفقة مع الأداة على المحقنة. ضع الإبرة في الحجرة الأولى وقم بتوصيل حوالي 1 مل من الأكسجين ببطء إلى الغرفة.
- مراقبة تركيز الأكسجين في الغرفة في برنامج قياس التنفس. عندما يصل تركيز الأكسجين في الغرفة إلى 350-400 نانومول / مل ، قم بلف السدادة برفق أثناء الضغط لأسفل لإغلاق الحجرة بالكامل. انظر إلى الغرفة وتأكد من عدم وجود فقاعات هواء. في حالة وجود فقاعة هواء ، أعد فتح الغرفة بعناية وسرعة ، وأضف 100 ميكرولتر من محلول MiR05 الإضافي العامل ، وأغلق الغرفة بسرعة مرة أخرى. كرر مع الغرف المتبقية.
- يجب الحفاظ على تركيزات الأكسجين فوق 250 نانومول / مل أثناء الفحص. أضف أكسجينا إضافيا حسب الحاجة عن طريق فتح الحجرة جزئيا ، وإضافة المزيد من الأكسجين من المحقنة إلى فقاعة الهواء ، وإغلاق الحجرة بعناية مرة أخرى.
- تطبيع بيانات تدفق الأكسجين إلى كتلة الأنسجة المستخدمة في التجربة. لضبط الرسوم البيانية ، قم بتغيير التخطيط ليعكس O2 Flux (pmol O2 / (s x mg)). من قائمة التخطيط، حدد تخطيط 06 - تدفق محدد لكل وحدة عينة. سيتم الآن تقديم البيانات بشكل طبيعي لكمية الأنسجة في كل غرفة.
4. قياس التنفس عالية الدقة
- عندما يستقر تركيز الأكسجين (الخط الأزرق) وتدفق O2 (الخط الأحمر) بعد إضافة الأكسجين ، ابدأ بروتوكول التنفس. يمكن اعتبار الأكسجين مستقرا عندما يكون الخط الأزرق مسطحا أو يتناقص ببطء. يجب أن يكون تدفق O2 مسطحا وضمن 5 مساء O2 / s x mg.
- أضف جميع الكواشف باستخدام المحاقن الزجاجية. من المهم عدم استخدام نفس المحقنة للركائز والمثبطات وأجهزة فك التوصيل. لديك حقنة منفصلة لكل منهما. بعد إضافة كل مركب ، سجل تدفق الأكسجين لمدة 1-2 دقيقة بعد استقرار معدل التنفس قبل إضافة الكاشف التالي.
- قياس التنفس
- باستخدام حقنة زجاجية سعة 10 ميكرولتر ، أضف 2.5 ميكرولتر من 0.8 متر مالات إلى كل غرفة. اضغط على F4 لتحديد المخطط الزمني وتسمية العلامة ب M. سجل تدفق O2 المستقر لمدة 1-2 دقيقة.
- أضف الكواشف الخاصة بالمغذيات كما هو موضح أدناه.
- تحلل السكر الهوائي: باستخدام حقنة زجاجية 10 ميكرولتر ، أضف 10 ميكرولتر من الغلوتامات 2 متر و 5 ميكرولتر من البيروفات 2 متر إلى كل غرفة. اضغط على F4 لتحديد الجدول الزمني وتسمية العلامة ب G P. سجل تدفق O2 المستقر لمدة 1-2 دقيقة.
- الأحماض الدهنية: باستخدام حقنة زجاجية سعة 10 ميكرولتر ، أضف 10 ميكرولتر من الغلوتامات 2 متر و 10 ميكرولتر من 10 مللي متر بالميتويل كارنيتين إلى كل غرفة. اضغط على F4 لتحديد المخطط الزمني وتسمية العلامة باستخدام G PC. سجل تدفق O2 مستقر لمدة 1-2 دقيقة.
- باستخدام حقنة زجاجية سعة 25 ميكرولتر ، أضف 20 ميكرولتر من 0.5 متر (مع MgCl2) ADP إلى كل غرفة. اضغط على F4 لوضع علامة على المخطط الزمني وتسمية العلامة ب ADP. سجل تدفق O2 مستقر لمدة 1-2 دقيقة.
- باستخدام حقنة زجاجية سعة 25 ميكرولتر ، أضف 20 ميكرولتر من سكسينات 1 متر إلى كل غرفة. اضغط على F4 لتحديد المخطط الزمني وتسمية العلامة ب S. سجل تدفق O2 مستقر لمدة 1-2 دقيقة.
- باستخدام حقنة زجاجية سعة 10 ميكرولتر ، أضف 5 ميكرولتر من 4 مللي متر سيتوكروم سي إلى كل غرفة. اضغط على F4 لتحديد المخطط الزمني وتسمية العلامة ب Cyt C. سجل تدفق O2 المستقر لمدة 1-2 دقيقة.
- قم بالمعايرة في ثلاث بلعات سعة 1 ميكرولتر من 1 mM FCCP باستخدام حقنة زجاجية 10 ميكرولتر. هناك تأثير خلط بشكل عام عند إضافة FCCP ينتج عنه انخفاض قصير في مستويات تدفق O2 . انتظر حتى يزداد تدفق O2 ويستقر قبل المتابعة إلى الخطوة التالية. اضغط على F4 بعد كل إضافة لوضع علامة على المخطط الزمني وعلامة التسمية باستخدام FCCP. سجل تدفق O2 مستقر لمدة 1 دقيقة بعد كل إضافة.
- عند اكتمال اختبار التنفس ، قم بإزالة السدادات برفق عن طريق الالتواء والسحب لأعلى. شطف الغرف 3x مع H2O عالية النقاء من زجاجة بخ ، تليها 3x مع 70 ٪ من الإيثانول من زجاجة بخ. بعد شطف الإيثانول النهائي ، املأ الغرف بنسبة 70٪ من الإيثانول للتخزين.
- اضبط السدادات في الغرف حتى تشعر بالمقاومة. لا تغلق السدادات على طول الطريق. ضع أغطية فوق السدادات ، واحفظ ملف الفحص وافصل الجهاز عن برنامج قياس التنفس. قم بإيقاف تشغيل الأداة.
5. تحليل البيانات
- افتح ملف التحليل في برنامج قياس التنفس. استخراج البيانات من مناطق تدفق الأكسجين المستقرة التي تم الحصول عليها بعد حقن مركبات التنفس.
- لتحديد مناطق الاهتمام ، اضغط مع الاستمرار على مفتاح Shift ، وانقر فوق زر الماوس الأيسر ، واسحب المربع عبر منطقة معدل التدفق O2 المستقرة لمراحل الفحص المفصلة أدناه.
- مراحل الفحص14،15،16،17،18،19،20
- حدد الجدول الزمني بعد إضافة مالات / الغلوتامات / البيروفات (بروتوكول تحلل السكر الهوائي) أو مالات / الغلوتامات / بالميتويل كارنيتين (بروتوكول الأحماض الدهنية). يمثل هذا المعدل معدل التنفس في الحالة 2 المعقدة (LEAK(n)).
- ضع علامة على المخطط الزمني بعد إضافة ADP. يمثل هذا المعدل معدل التنفس في الحالة 3 المعقدة (CI OXPHOS).
- ضع علامة على الجدول الزمني بعد إضافة السكسينات. يمثل هذا المعدل معدل التنفس المعقد I + II الحالة 3 (CI + II OXPHOS).
- ضع علامة على المخطط الزمني بعد إضافة السيتوكروم C. يمثل هذا المعدل معدل التنفس المركب I + II + Cytochrome State 3 (CI + II + Cyt C OXPHOS).
- ضع علامة على المخطط الزمني لمعايرة FCCP بأعلى معدل تدفق O2 . يمثل هذا المعدل الحد الأقصى لمعدل التنفس (MAX ETS).
- استرجع قيم البيانات للمناطق المحددة على المخطط الزمني عن طريق تحديد وضع علامة > إحصائيات. انسخ معدل تدفق O2 (pmol O2 / (s x mg)) للغرفة المحددة إلى جدول بيانات.
- كرر وضع العلامات واستخراج البيانات للغرف الإضافية.
- احسب نسبة التحكم في الجهاز التنفسي (RCR) بقسمة الحالة 3 للمجمع I + II (بعد إضافة السكسينات) على الحالة المعقدة I 2 (قبل إضافة ADP).
النتائج
يوضح الشكل 3 والشكل 4 مخططات الأكسجين لبروتوكولات قياس التنفس بالسكر والأحماض الدهنية الهوائية ، على التوالي ، لألياف عضلات الساق الحمراء والبيضاء المحضرة بشكل صحيح. كما تظهر نتائج كمية تمثيلية كمية. يوضح الشكل 5 مخططا للأكسجين لقياس التنفس التحلل للسكر الهوائي في عينات خزعة العضلات البشرية التي تم تحضيرها بشكل صحيح. كما يتم عرض النتائج الكمية التمثيلية. لاحظ أنه في الشكل 3 والشكل 4 والشكل 5، لا تؤدي إضافة السيتوكروم C بعد إضافة ADP إلى التأثير على تدفق الأكسجين، مما يشير إلى أن غشاء الميتوكوندريا الخارجي للعينة سليم. يوضح الشكل 6 مخطط أكسجين لقياس التنفس التحلل للسكر الهوائي حيث تؤدي إضافة السيتوكروم C بعد ADP إلى ارتفاع (زيادة بنسبة 40٪) في تدفق الأكسجين ، مما يشير إلى تلف غشاء الميتوكوندريا الخارجي وبالتالي لا ينبغي استخدام العينة لقياس التنفس - يمكن أن تكون الأسباب المحتملة لهذه النتيجة هي التعامل غير المناسب أو تجميد / ذوبان الأنسجة ، إطالة نفاذية الأنسجة ، وعدم استخدام الأنسجة المعزولة حديثا.
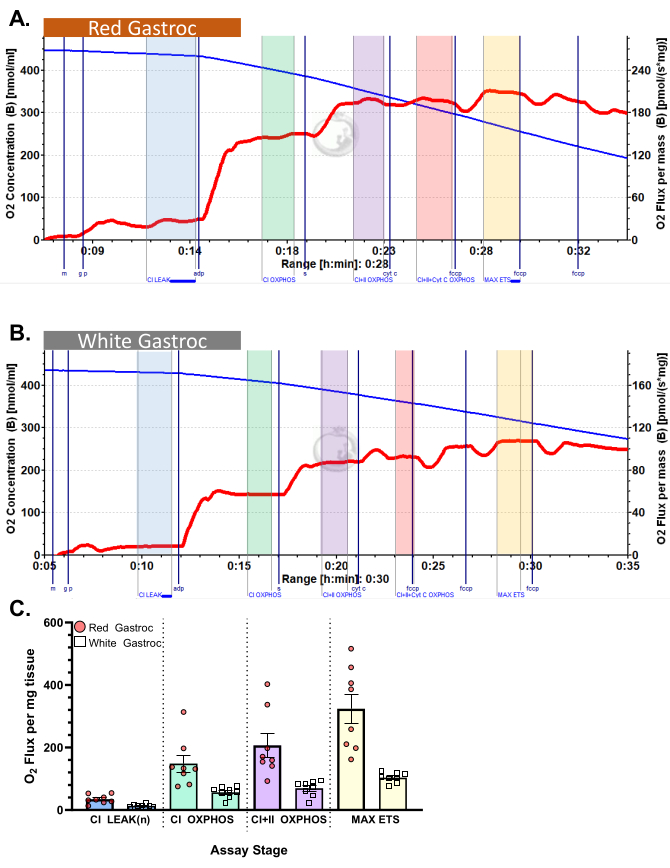
الشكل 3: استهلاك الأكسجين في الماوس. أظهرت النتائج استهلاك الأكسجين في (A) أحمر و (B) أبيض gastrocnemius باستخدام بروتوكول البيروفات. حالة التدفق 2 بعد إضافة مالات ، الغلوتامات ، والبيروفات (الظل الأزرق ، CI LEAK). لوحظ تحفيز كبير لاستهلاك O2 بعد إعطاء ADP (الظل الأخضر ، CI OXPHOS) ، مع دفع التنفس أكثر بعد إضافة السكسينات (الظل الأرجواني ، CI + II OXPHOS). لم يحدث السيتوكروم C أي زيادة كبيرة (<15٪) ، مما يشير إلى أن غشاء الميتوكوندريا الخارجي سليم (الظل البرتقالي ، CI + II + Cyt C OXPHOS). الميتوكوندريا غير مقترنة بعد إضافة FCCP (الظل الأصفر ، MAX ETS). يمثل الخط الأزرق تركيز الأكسجين في غرفة مغلقة. يمثل الخط الأحمر معدل استهلاك الأكسجين (O2 تدفق). المركبات المضافة: مالات (م) ، غلوتامات (جم) ، بيروفات (ع) ، أدينوسين ثنائي الفوسفات (ADP) ، سيتوكروم سي (سيت ج) ، كربونيل سيانيد ف ثلاثي فلورو روميثوكسي فينيل هيدرازون (FCCP). (ج) يعكس التمثيل البياني بالأعمدة النتائج التمثيلية (ن = 8). يتم تمثيل البيانات على أنها ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
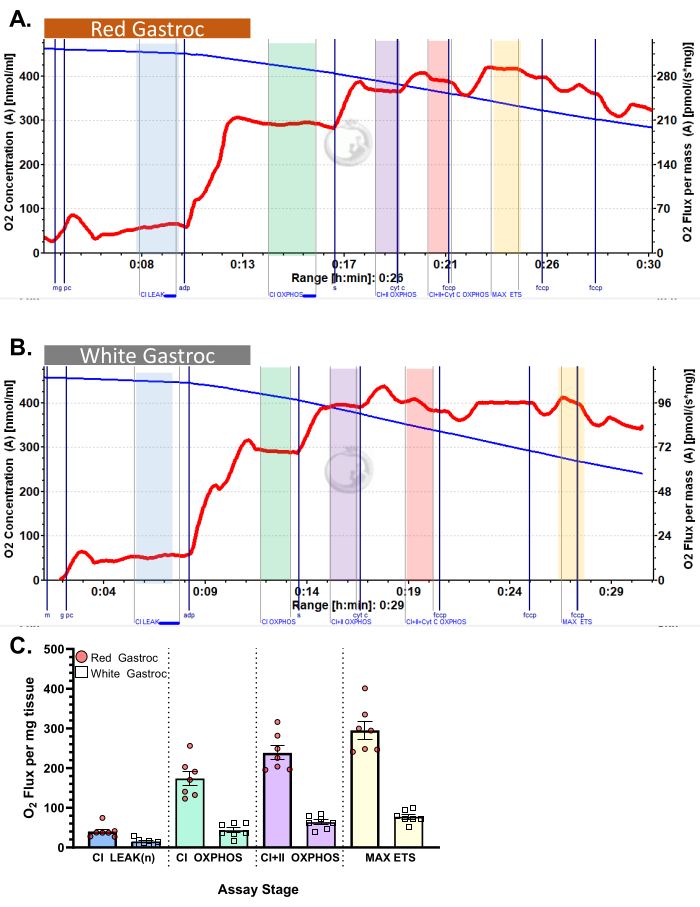
الشكل 4: استهلاك الأكسجين في الماوس. أظهرت النتائج استهلاك الأكسجين في (A) أحمر و (B) أبيض gastrocnemius باستخدام بروتوكول بالميتويل كارنيتين. حالة التدفق 2 بعد إضافة مالات ، الغلوتامات ، وبالميتويل كارنيتين (الظل الأزرق ، CI LEAK). لوحظ تحفيز كبير لاستهلاك O2 بعد إعطاء ADP (الظل الأخضر ، CI OXPHOS) ، مع دفع التنفس أكثر بعد إضافة السكسينات (الظل الأرجواني ، CI + II OXPHOS). لم يحدث السيتوكروم C أي زيادة كبيرة (<15٪) ، مما يشير إلى أن غشاء الميتوكوندريا الخارجي سليم (الظل البرتقالي ، CI + II + Cyt C OXPHOS). الميتوكوندريا غير مقترنة بعد إضافة FCCP (الظل الأصفر ، MAX ETS). يمثل الخط الأزرق تركيز الأكسجين في غرفة مغلقة. يمثل الخط الأحمر معدل استهلاك الأكسجين (O2 تدفق). المركبات المضافة: مالات (م) ، غلوتامات (جم) ، بالميتويل كارنيتين (كمبيوتر) ، أدينوسين ثنائي الفوسفات (ADP) ، سيتوكروم ج (سيت ج) ، كاربونيل سيانيد-p-ثلاثي فلورو روميثوكسي فينيل هيدرازون (FCCP). (ج) يعكس التمثيل البياني بالأعمدة النتائج التمثيلية (ن = 7). يتم تمثيل البيانات على أنها ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
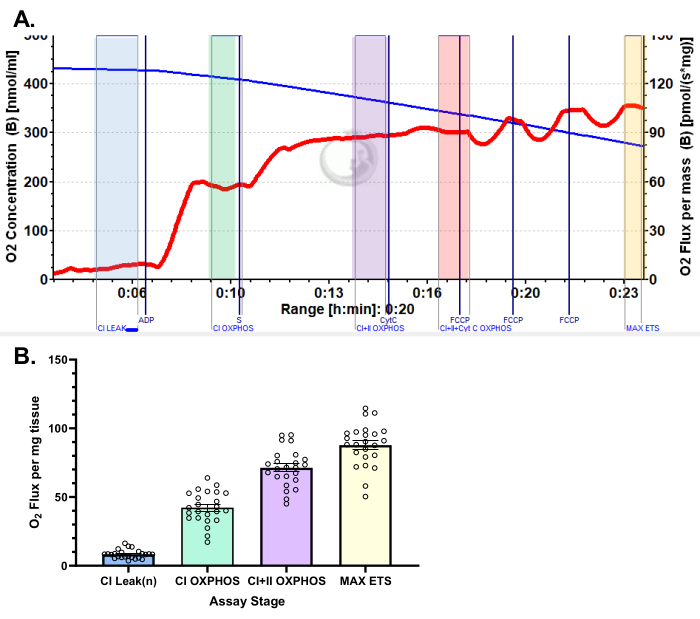
الشكل 5: النتائج التمثيلية لاستهلاك الأكسجين في الأوعية الدموية الجانبية البشرية باستخدام بروتوكول البيروفات. (أ) حالة التدفق 2 بعد إضافة المالات والغلوتامات والبيروفات (الظل الأزرق ، CI LEAK). لوحظ تحفيز كبير لاستهلاك O2 بعد إعطاء ADP (الظل الأخضر ، CI OXPHOS) ، مع دفع التنفس أكثر بعد إضافة السكسينات (الظل الأرجواني ، CI + II OXPHOS). لم يحدث السيتوكروم C أي زيادة كبيرة (<15٪) ، مما يشير إلى أن غشاء الميتوكوندريا الخارجي سليم (الظل البرتقالي ، CI + II + Cyt C OXPHOS). الميتوكوندريا غير مقترنة بعد إضافة FCCP (الظل الأصفر ، MAX ETS). يمثل الخط الأزرق تركيز الأكسجين في غرفة مغلقة. يمثل الخط الأحمر معدل استهلاك الأكسجين (O2 تدفق). المركبات المضافة: مالات (م) ، غلوتامات (جم) ، بيروفات (ع) ، أدينوسين ثنائي الفوسفات (ADP) ، سيتوكروم سي (سيت ج) ، كربونيل سيانيد ف ثلاثي فلورو روميثوكسي فينيل هيدرازون (FCCP). (ب) يعكس الرسم البياني بالأعمدة النتائج التمثيلية التي تم الحصول عليها من خزعات الأوعية الدموية الجانبية (ن = 24). يتم تمثيل البيانات على أنها ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
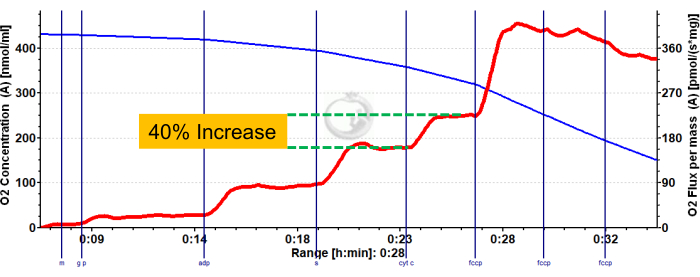
الشكل 6: نتيجة تمثيلية توضح سلامة غشاء الميتوكوندريا الخارجي المخترق في الساق الأحمر للفأر. حالة التدفق 2 بعد إضافة مالات ، الغلوتامات ، والبيروفات (الظل الأزرق ، CI LEAK). لوحظ تحفيز كبير لاستهلاك O2 بعد إعطاء ADP (الظل الأخضر ، CI OXPHOS) ، مع دفع التنفس أكثر بعد إضافة السكسينات (الظل الأرجواني ، CI + II OXPHOS). تسبب السيتوكروم C في زيادة كبيرة في استهلاك O2 (>15٪) ، مما يشير إلى تلف غشاء الميتوكوندريا الخارجي. يمثل الخط الأزرق تركيز الأكسجين في غرفة مغلقة. يمثل الخط الأحمر معدل استهلاك الأكسجين (O2 تدفق). المركبات المضافة: مالات (م) ، غلوتامات (جم) ، بيروفات (ع) ، أدينوسين ثنائي الفوسفات (ADP) ، سيتوكروم سي (سيت ج) ، كربونيل سيانيد ف ثلاثي فلورو روميثوكسي فينيل هيدرازون (FCCP). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: تحضير الكاشف لمركبات التنفس ومحاليل التنفس. يتم تقديم تفاصيل لإعداد الكواشف اللازمة للفحص ، بما في ذلك تركيزات المخزون النهائي وكيفية تحضيرها وتخزينها. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
يوفر هذا البروتوكول بروتوكول قالب شامل ومباشر لتقييم وظيفة الميتوكوندريا في ألياف العضلات الهيكلية المتداخلة لكل من عينات الإنسان والفئران. هناك العديد من المزايا لاستخدام الألياف النفاذية بدلا من الميتوكوندريا المعزولة. إحدى المزايا الرئيسية هي أن استخدام الألياف النفاذية يتطلب كميات صغيرة (2-5 ملغ) من الأنسجة ، مما يجعل هذه الطريقة مناسبة لكل من عينات خزعة العضلات البشرية وعضلات الفأر. ميزة أخرى على الميتوكوندريا المعزولة هي أن البنية الخلوية تظل سليمة ، مما يضمن الحفاظ على التفاعلات الهيكلية والوظيفية بين الميتوكوندريا والمكونات الخلوية12،21،22،23.
يوفر استخدام البيروفات والمالات والغلوتامات في بروتوكول تحلل السكر الهوائي تقييما شاملا واسع الطيف لإمداد NADH للمجمع I24،25،26،27،28. في حين أن هذا النهج الشامل يوفر تقييما لنشاط Complex I في ظل ظروف التمثيل الغذائي الشاملة وذات الصلة من الناحية الفسيولوجية ، فإن استخدام البيروفات مالات أو الغلوتامات مالات قد يكون نهجا تجريبيا أكثر ملاءمة. على سبيل المثال ، قد يؤدي استخدام الغلوتامات مالات إلى إثارة الاختلافات في وظيفة الميتوكوندريا المتعلقة بهدم الأحماض الأمينية29. نحن نشجع الباحثين على التفكير بعناية في النهج المناسب لاستخدامه في نموذج بحثهم المحدد.
بينما يركز هذا البروتوكول على استخدام الركائز لتقييم نشاط الميتوكوندريا ، قد يكون استخدام مثبطات محددة ضروريا لتحقيق الأهداف التجريبية. على سبيل المثال ، يمكن استخدام الروتينون لتثبيط المركب I12،21،30 ، oligomycin المستخدم لتثبيط المركب V (ATP Synthase)12,21 ومضاد الميسين A لمنع المركب III12,21 لتقييم التنفس غير الميتوكوندريا. يمكن بسهولة تكييف البروتوكول المقدم أعلاه ليشمل استخدام مثبطات محددة. من الجدير بالذكر أن أحد التحذيرات المتعلقة باستخدام المثبطات هو أن هذه المركبات لزجة وتتطلب تنظيفا مكثفا لإزالتها من حجرة الجهاز. نجد أن استخدام محلول 10٪ BSA لمدة 60 دقيقة يكفي لإزالة مثبطات البقايا.
يشير تنفس التسرب إلى معدل استهلاك الأكسجين المستقل عن تخليق ATP. يمثل هذا المعدل تدفق البروتونات مرة أخرى إلى مصفوفة الميتوكوندريا من عبر غشاء الميتوكوندريا الداخلي. هناك ثلاث طرق مقبولة لتقييم استهلاك الأكسجين بشكل مستقل عن تخليق ATP (LEAK). الأول ، LEAK (n) ، يقيس معدل استهلاك الأكسجين في وجود ركائز ولكن دون إضافة الأدينيل (ADP أو ATP)31،32،33. تمثل حالة التسرب هذه التسرب الجوهري لغشاء الميتوكوندريا. الطريقة الثانية ، LEAK (t) ، تقاس في وجود ATP34 والثالثة ، LEAK (o) ، تقاس في وجود مثبط ATP-synthase oligomycin35،36،37. يستخدم هذا البروتوكول LEAK (n) لهذا التقييم ، ولكن اعتمادا على الأهداف والنماذج التجريبية ، قد تكون الطرق الأخرى لقياس تدفق الأكسجين LEAK مناسبة.
لهذا الفحص ، يتم استكمال MiR05 بكل من الكرياتين (3 مجم / مل) وبليبستاتين (10 ميكرومتر). يتم تسهيل نقل الميتوكوندريا ADP بواسطة الكرياتين كيناز (CK) ، ويضاف الكرياتين إلى محلول التنفس لتشبع نشاط CK38,39. يمكن أن تنقبض الألياف العضلية تلقائيا وتكون حساسة أيضا للانقباض الناجم عن ADP. لتقييم النشاط التنفسي للميتوكوندريا دون تأثير الانكماش ، تمت إضافة بليبيستاتين لمنع نشاط تقلص الألياف38. بالإضافة إلى ذلك ، تشير الدراسات التي أجريت على العضلات البشرية إلى أن القدرة التنفسية قد تتأثر بطريقة الخزعة (الخزعة المجهرية مقابل إبرة بيرجستروم) وأن هذا الاختلاف قد يكون بسبب الاختلافات في طول الألياف التي تم الحصول عليها40,41. قد تكون الألياف الأقصر أكثر عرضة للتلف أثناء التحضير ، ويساعد استخدام البليبستاتين في الحفاظ على الوظيفة. قد تكون هناك ظروف معينة لا يتناسب فيها استرخاء الألياف مع أهداف البحث ، وفي هذه الحالة ، يمكن استبعاد البليبستاتين من محلول MiR05.
نفاذية ألياف العضلات والهيكل العظمي مع الصابونين يولد المسام في غشاء البلازما يسمح للركائز والمثبطات بدخول الخلية بحرية. يحتوي الصابونين على تقارب عال للكوليسترول ، وهو غني وفير في أغشية البلازما الخلوية ، في حين أن أغشية الميتوكوندريا فقيرة بالكوليسترول42,43. من المتوقع أن يحافظ علاج الصابونين المستخدم لإعداد الألياف في هذا البروتوكول على سلامة غشاء الميتوكوندريا. قد يحدث تلف في الميتوكوندريا أيضا بسبب قوى القص الناتجة عن الفصل الميكانيكي للأنسجة إلى ألياف. نقترح أن يتم فصل الأنسجة إلى حزم الألياف بسرعة وبأقل قدر من المناولة. لتقييم الضرر المحتمل للميتوكوندريا، قمنا بتضمين معايرة السيتوكروم C في بروتوكول التنفس. لا يمكن أن يمر السيتوكروم C عبر غشاء الميتوكوندريا الخارجي السليم12 ، وبالتالي ، فإن أي زيادة في تدفق O2 بعد إضافة السيتوكروم C تشير إلى حدوث تلف في غشاء الميتوكوندريا الخارجي أثناء عملية تحضير العينة. في إحدى دراساتنا الحديثة ، وجدنا أن تدفق O2 زاد بنسبة 8٪ 15 بعد إضافة السيتوكروم C ، مما يؤكد أن استخدام الصابونين المقترح في هذا البروتوكول لا يؤدي إلى تلف الميتوكوندريا. نقترح استبعاد أي عينة تظهر زيادة أكبر من 15٪ في تدفق O2 بعد إضافة السيتوكروم C من التحليل44. يتم تضمين هذه الخطوة بشكل صارم كإجراء لمراقبة الجودة وليس كتقييم لنشاط المعقد الرابع.
في حين أن قياس التنفس عالي الدقة يتفوق في توفير قياسات حساسة للغاية وموثوقة لاستهلاك الأكسجين ، فإن أحد القيود الملحوظة للأجهزة هو أنه يمكن قياس عينتين فقط في وقت واحد لكل أداة. وهذا يتطلب دراسة متأنية عند تصميم الدراسات التي تشمل مجموعات مع عينات متعددة. في حين أنه قد يكون هناك إغراء لإجراء قياسات على مجموعات عينات مختلفة على مدار اليوم ، فإننا ننصح الباحثين بشدة بالنظر في تأثير إيقاع الساعة البيولوجية على التمثيل الغذائي. كشفت الأبحاث التي أجريت على كل من العضلات الهيكلية البشرية والقوارض عن تأثير الساعة البيولوجية على وظيفة الميتوكوندريا45,46. وبالتالي ، نوصي بإجراء قياسات على مدار عدة أيام في نفس الوقت من اليوم لحساب هذه التقلبات اليومية.
أخيرا ، لضمان قياسات قياس التنفس القوية والقابلة للتكرار ، يجب أن يتلقى مقياس التنفس التنظيف والصيانة والمعايرة بانتظام. يجب إجراء معايرة الهواء ، كما هو مفصل في البروتوكول ، يوميا. ننصح المستخدمين أيضا بإجراء معايرة شهرية كاملة (هواء وصفر) لأجهزة استشعار الأكسجين البولاروغرافي. يجب على المستخدمين الرجوع إلى وثائق الشركة المصنعة وموقعها على الويب للحصول على مزيد من المعلومات حول طريقة المعايرة هذه وللحصول على إرشادات حول الصيانة الروتينية للأجهزة.
يظل قياس التنفس عالي الدقة هو المعيار الذهبي لقياس تنفس الميتوكوندريا. تسهل الطريقة المفصلة في هذا البروتوكول التقييم القوي لقدرة الميتوكوندريا في كل من القوارض والعضلات الهيكلية البشرية. تم تطبيق هذا البروتوكول على الدراسات التي تقيم وظيفة الميتوكوندريا المرتبطة بنماذج الفئران الوراثية 15,16 ، في سياق مرض الكلى المزمن19 ، بعد تناول المكملات الغذائية14,20 والتمرين17,18.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم الأبحاث الواردة في هذا المنشور من قبل مركز أبحاث السمنة للتغذية ، ومنحة المعاهد الوطنية للصحة P30 DK056341 ، ومنحة المعاهد الوطنية للصحة K01 HL145326.
Materials
| Name | Company | Catalog Number | Comments |
| 10 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-125 | For respiration assay titration |
| 25 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-133 | For respiration assay titration |
| ADP | Merck | 117105 | Respirometry Assay |
| Black Glass Dissection Dish | Scintica | DD-90-S-BLK | For sample preparation |
| Blebbistatin | Sigma | B0560 | Working MiR05 Solution |
| BSA, fatty acid free | Sigma | A6003 | MiR05 Solution |
| Calcium Carbonate | Sigma | C4830 | BIOPS Solution |
| Creatine | Sigma | 27900 | Working MiR05 Solution |
| Cytochrome C | Sigma | C7752 | Respirometry Assay |
| DatLab | Oroboros Instruments | N/A | Respirometry Software |
| Dithiothreitol (DTT) | Sigma | D0632 | BIOPS Solution |
| D-Sucrose | Sigma | 84097 | MiR05 Solution |
| EGTA | Sigma | E4378 | BIOPS & MiR05 Solution |
| FCCP | Sigma | C2920 | Respirometry Assay |
| Glutamate | Sigma | G1626 | Respirometry Assay |
| HEPES | Sigma | H7523 | MiR05 Solution |
| Imidazole | Sigma | 56750 | BIOPS Solution |
| KH2PO4 | Sigma | P5379 | MiR05 Solution |
| Lactobionic acid | Sigma | 153516 | MiR05 Solution |
| Malate | Sigma | M1000 | Respirometry Assay |
| MES hydrate | Sigma | M8250 | BIOPS Solution |
| MgCl2 - 6 H2O | Sigma | M2670 | BIOPS & MiR05 Solution |
| Oroboros Oxygraph-2K (O2K) System | Oroboros Instruments | 10203-03 | High resolution respirometer |
| Palmitoyl-Carnitine | Sigma | P4509 | Respirometry Assay |
| Potassium Hydroxide | Sigma | P1767 | BIOPS Solution |
| Precision Tweezers | Fisher | 17-467-168 | For sample preparation |
| Saponin | Sigma | S2149 | For Fiber Permeabilization |
| Sodium ATP | Sigma | A2383 | BIOPS Solution |
| Sodium Phosphocreatine | Sigma | P7936 | BIOPS Solution |
| Sodium Pyruvate | Sigma | P2256 | Respirometry Assay |
| Succinate | Sigma | S2378 | Respirometry Assay |
| Taurine | Sigma | T0625 | BIOPS & MiR05 Solution |
References
- Rizzuto, R., De Stefani, D., Raffaello, A., Mammucari, C. Mitochondria as sensors and regulators of calcium signalling. Nat Rev Mol Cell Biol. 13 (9), 566-578 (2012).
- Ruegsegger, G. N., Creo, A. L., Cortes, T. M., Dasari, S., Nair, K. S. Altered mitochondrial function in insulin-deficient and insulin-resistant states. J Clin Invest. 128 (9), 3671-3681 (2018).
- Simoneau, J. A., Kelley, D. E. Altered glycolytic and oxidative capacities of skeletal muscle contribute to insulin resistance in NIDDM. J Appl Physiol. 83 (1), 166-171 (1997).
- Ryan, T. E., et al. Extensive skeletal muscle cell mitochondriopathy distinguishes critical limb ischemia patients from claudicants. JCI Insight. 3 (21), 123235(2018).
- Sullivan, M. J., Green, H. J., Cobb, F. R. Skeletal muscle biochemistry and histology in ambulatory patients with long-term heart failure. Circulation. 81 (2), 518-527 (1990).
- Giebelstein, J., et al. The proteomic signature of insulin-resistant human skeletal muscle reveals increased glycolytic and decreased mitochondrial enzymes. Diabetologia. 55 (4), 1114-1127 (2012).
- Tezze, C., et al. Age-associated loss of OPA1 in muscle impacts muscle mass, metabolic homeostasis, systemic inflammation, and epithelial senescence. Cell Metab. 25 (6), 1374-1389 (2017).
- Hughes, M. C., et al. Early myopathy in Duchenne muscular dystrophy is associated with elevated mitochondrial H(2) O(2) emission during impaired oxidative phosphorylation. J Cachexia Sarcopenia Muscle. 10 (2), 643-661 (2019).
- Yin, Y., Shen, H. Common methods in mitochondrial research (Review). Int J Mol Med. 50 (4), 5182(2022).
- Vue, Z., et al. 3D reconstruction of murine mitochondria reveals changes in structure during aging linked to the MICOS complex. Aging Cell. 22 (12), e14009(2023).
- Doerrier, C., et al. High-resolution fluoRespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods Mol Biol. 1782, 31-70 (2018).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Picard, M., Hepple, R. T., Burelle, Y. Mitochondrial functional specialization in glycolytic and oxidative muscle fibers: tailoring the organelle for optimal function. Am J Physiol Cell Physiol. 302 (4), C629-C641 (2012).
- Yoshino, M., et al. Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women. Science. 372 (6547), 1224-1229 (2021).
- Mousa, M. G., et al. Site-1 protease inhibits mitochondrial respiration by controlling the TGF-beta target gene Mss51. Cell Rep. 42 (4), 112336(2023).
- Moon, S. H., et al. Genetic deletion of skeletal muscle iPLA(2)gamma results in mitochondrial dysfunction, muscle atrophy and alterations in whole-body energy metabolism. iScience. 26 (6), 106895(2023).
- Bittel, A. J., et al. A single bout of premeal resistance exercise improves postprandial glucose metabolism in obese men with prediabetes. Med Sci Sports Exerc. 53 (4), 694-703 (2021).
- Bittel, A. J., et al. A single bout of resistance exercise improves postprandial lipid metabolism in overweight/obese men with prediabetes. Diabetologia. 63 (3), 611-623 (2020).
- Bittel, D. C., Bittel, A. J., Varadhachary, A. S., Pietka, T., Sinacore, D. R. Deficits in the skeletal muscle transcriptome and mitochondrial coupling in progressive diabetes-induced CKD relate to functional decline. Diabetes. 70 (5), 1130-1144 (2021).
- Mills, K. F., et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice. Cell Metab. 24 (6), 795-806 (2016).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985(2017).
- Lemieux, H., Semsroth, S., Antretter, H., Hofer, D., Gnaiger, E. Mitochondrial respiratory control and early defects of oxidative phosphorylation in the failing human heart. Int J Biochem Cell Biol. 43 (12), 1729-1738 (2011).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int J Biochem Cell Biol. 41 (10), 1837-1845 (2009).
- Appelman, B., et al. Muscle abnormalities worsen after post-exertional malaise in long COVID. Nat Commun. 15 (1), 17(2024).
- O'Rourke, A. R., et al. Impaired muscle relaxation and mitochondrial fission associated with genetic ablation of cytoplasmic actin isoforms. FEBS J. 285 (3), 481-500 (2018).
- Inigo, M. R., et al. Estrogen receptor-alpha in female skeletal muscle is not required for regulation of muscle insulin sensitivity and mitochondrial regulation. Mol Metab. 34, 1-15 (2020).
- Musci, R. V., et al. Phytochemical compound PB125 attenuates skeletal muscle mitochondrial dysfunction and impaired proteostasis in a model of musculoskeletal decline. J Physiol. 601 (11), 2189-2216 (2023).
- Englund, D. A., et al. p21 induces a senescence program and skeletal muscle dysfunction. Mol Metab. 67, 101652(2023).
- Zhang, K., et al. Mitochondrial supercomplex assembly regulates metabolic features and glutamine dependency in mammalian cells. Theranostics. 13 (10), 3165-3187 (2023).
- Davis, M. S., Barrett, M. R. High-resolution fluoro-respirometry of equine skeletal muscle. J Vis Exp. (192), e65075(2023).
- Schytz, C. T., et al. Skeletal muscle mitochondria demonstrate similar respiration per cristae surface area independent of training status and sex in healthy humans. J Physiol. 602 (1), 129-151 (2024).
- Hingst, J. R., et al. Inducible deletion of skeletal muscle AMPKalpha reveals that AMPK is required for nucleotide balance but dispensable for muscle glucose uptake and fat oxidation during exercise. Mol Metab. 40, 101028(2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Gnaiger, E., Mendez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc Natl Acad Sci U S A. 97 (20), 11080-11085 (2000).
- Basse, A. L., et al. Nampt controls skeletal muscle development by maintaining Ca(2+) homeostasis and mitochondrial integrity. Mol Metab. 53, 101271(2021).
- Flensted-Jensen, M., et al. Combined changes in temperature and pH mimicking exercise result in decreased efficiency in muscle mitochondria. J Appl Physiol. 136 (1985), 79-88 (2024).
- Porter, C., et al. Mitochondrial respiratory capacity and coupling control decline with age in human skeletal muscle. Am J Physiol Endocrinol Metab. 309 (3), E224-E232 (2015).
- Perry, C. G., et al. Inhibiting myosin-ATPase reveals a dynamic range of mitochondrial respiratory control in skeletal muscle. Biochem J. 437 (2), 215-222 (2011).
- Veksler, V. I., et al. Muscle creatine kinase-deficient mice. II. Cardiac and skeletal muscles exhibit tissue-specific adaptation of the mitochondrial function. J Biol Chem. 270 (34), 19921-19929 (1995).
- Isner-Horobeti, M. E., et al. Microbiopsies versus Bergstrom needle for skeletal muscle sampling: impact on maximal mitochondrial respiration rate. Eur J Appl Physiol. 114 (5), 885-889 (2014).
- Hughes, M. C., et al. Mitochondrial bioenergetics and fiber type assessments in microbiopsy vs. Bergstrom percutaneous sampling of human skeletal muscle. Front Physiol. 18 (6), 360(2015).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat Protoc. 3 (6), 965-976 (2008).
- Elustondo, P., Martin, L. A., Karten, B. Mitochondrial cholesterol import. Biochim Biophys Acta Mol Cell Biol Lipids. 1862 (1), 90-101 (2017).
- Ramos, P. M., Li, C., Elzo, M. A., Wohlgemuth, S. E., Scheffler, T. L. Mitochondrial oxygen consumption in early postmortem permeabilized skeletal muscle fibers is influenced by cattle breed. J Anim Sci. 98 (3), 044(2020).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab. 5 (8), 635-645 (2016).
- de Goede, P., et al. Time-restricted feeding during the inactive phase abolishes the daily rhythm in mitochondrial respiration in rat skeletal muscle. FASEB J. 36 (2), e22133(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved