Method Article
通过高分辨率呼吸测定法测量人和小鼠骨骼肌纤维中的线粒体呼吸
摘要
在这里,我们描述了一种测量来自人或小鼠肌肉的新鲜透化骨骼肌纤维中线粒体氧化磷酸化的综合方法。该方法允许实时量化线粒体呼吸并评估燃料偏好和代谢灵活性,同时保留现有的线粒体网络和膜完整性。
摘要
线粒体功能是细胞能量产生的基石,对于维持代谢稳态至关重要。其骨骼肌功能障碍与普遍的代谢紊乱(例如糖尿病和肥胖)、肌营养不良和肌肉减少症有关。虽然有许多技术可以评估线粒体含量和形态,但评估线粒体功能的标志性方法是通过呼吸测定法测量线粒体氧化磷酸化 (OXPHOS)。线粒体 OXPHOS 的定量有助于深入了解线粒体氧化能产生和细胞生物能量学的效率。高分辨率呼吸计通过测量线粒体耗氧率的实时变化,对透化肌肉纤维中的线粒体 OXPHOS 进行高灵敏度、稳健的测量。与分离的线粒体相反,使用透化的肌纤维可以保留线粒体网络,保持线粒体膜的完整性,并最终允许进行更生理相关的测量。该系统还允许测量燃料偏好和代谢灵活性 - 肌肉能量代谢的动态方面。在这里,我们提供了使用高分辨率呼吸计测量人和小鼠骨骼肌纤维中线粒体 OXPHOS 的综合指南。骨骼肌群由不同的纤维类型组成,这些纤维类型的线粒体燃料偏好和生物能量学各不相同。使用高分辨率呼吸计,我们描述了评估有氧糖酵解和脂肪酸底物的方法,以纤维类型依赖性方式评估燃料偏好和代谢灵活性。该方案用途广泛,适用于人和啮齿动物的肌肉纤维。目标是提高线粒体功能评估的可重复性和准确性,这将提高我们对对肌肉健康很重要的细胞器的理解。
引言
线粒体是细胞能量产生的基石,使其成为维持最佳细胞和生物体内平衡不可或缺的。这些双膜细胞器主要负责氧化磷酸化。这个过程有效地将糖和脂肪酸等营养物质转化为三磷酸腺苷 (ATP),这是能量的细胞货币。除了在能量代谢中的作用外,线粒体还是各种细胞过程的关键调节因子,包括细胞凋亡、钙稳态和活性氧 (ROS)1,2。由于它们在维持细胞和生物体稳态中起着关键作用,因此线粒体功能的破坏通常会对组织和生物体健康产生不利影响。在骨骼肌中,线粒体功能障碍与多种疾病状态有关,包括代谢紊乱(例如肥胖、糖尿病和心血管疾病)、肌肉减少症和肌营养不良症 3,4,5,6,7,8。
线粒体功能障碍主要表现为线粒体内容、数量和形态改变,以及新陈代谢中断。因此,全面了解线粒体功能障碍需要一种综合和整体的方法。初步表征研究包括检查呼吸链蛋白复合物的表达水平作为线粒体含量的读数,量化线粒体 DNA 和生物发生标志物作为线粒体生物发生的量度,以及复杂的电子显微镜成像以评估线粒体形态 9,10。线粒体功能的其他评估包括评估细胞 ROS 和 ATP 的产生以及线粒体膜电位9。
由于线粒体对于细胞能量产生和体内平衡至关重要,因此评估线粒体功能的标志是测量线粒体氧化磷酸化 (OXPHOS)。透化肌纤维的高分辨率呼吸测定法可以测量线粒体耗氧率的实时变化,作为线粒体 OXPHOS 呼吸链活性动态变化的读数 9,11,12。选择性化学调节剂和抑制剂的应用允许人们直接和连续地测量不同呼吸复合物的活性。尽管分离的线粒体可用于呼吸测定,但使用新鲜的、透化的肌纤维可以保持内源性线粒体网络和膜完整性 - 从而允许进行更具生理相关性的测量。此外,由于不同的肌肉纤维类型具有不同的底物偏好和呼吸速率,因此该系统允许人们根据纤维类型13 测量燃料偏好和代谢灵活性的变化。
在这里,我们描述了在高分辨率呼吸计系统中使用人或小鼠骨骼肌纤维进行线粒体 OXPHOS 测量的综合方案。包括使用丙酮酸或棕榈酰肉碱作为底物定量氧化或糖酵解纤维中线粒体氧呼吸的方法。该协议允许使用其他燃料底物来解决与底物利用和燃料偏好缺陷有关的特定代谢问题。
研究方案
所有小鼠程序均已获得华盛顿大学机构动物护理和使用委员会的批准。任何性别、年龄和体重的小鼠都可以用于这些实验,并且将取决于人们试图解决的实验问题的性质。这里使用的小鼠是成年(12-16 周龄)、雄性野生型 C57BL/6 小鼠。所有人工程序均已获得华盛顿大学机构审查委员会的批准。研究对象同意数据使用,本协议中包含的代表性人类受试者数据来自已发表的研究14。此处的数据来自非糖尿病绝经后 (55-75 岁) 女性。制备测定所需试剂的详细信息见 表 1。材料 表中列出了有关检测中使用的特定试剂、工具和机器的信息。该协议的示意图概述如图 1 所示。
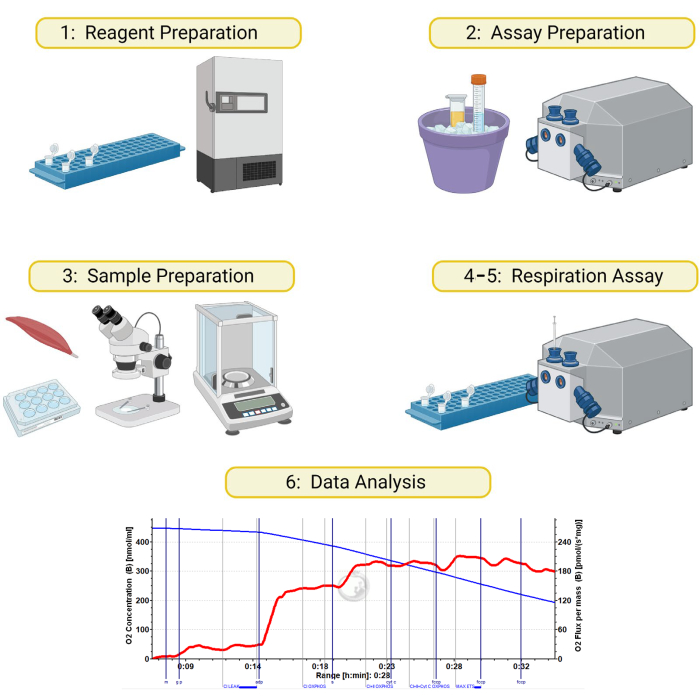
图 1:透化骨骼肌样本的高分辨率呼吸测定示意图。 本手稿中详述的方法分为 6 个部分:1) 呼吸缓冲液和试剂的制备,2) 测定当天的仪器和试剂制备,3) 肌肉样品的制备和透化,4) 制备样品和仪器,5) 运行呼吸测定,以及 6) 数据分析。使用 BioRender.com 创建 请单击此处查看此图的较大版本。
1. 分析准备和仪器校准
- 在测定当天,除去所需数量的每种呼吸化合物(blebbistatin、棕榈酰肉碱、谷氨酸、苹果酸盐、ADP、琥珀酸盐、细胞色素 C、FCCP)的等分试样,并在冰上解冻。在冰上解冻 BIOPS 和 MiR05 小瓶。
- 如 表 1 所示制备皂苷和丙酮酸溶液。如 表 1 所示,准备 MiR05 的工作溶液。每台仪器(2 个腔室)准备 5 mL 的 MiR05 工作溶液。根据需要扩展。
- 打开高分辨率呼吸测定系统和真空系统。去除塞子,真空除去 70% 乙醇储存溶液,用超纯分子级 H2O 重新填充腔室。通过真空去除 H2O 并重新填充。重复总共 3 次洗涤。最后一次洗涤后,向每个腔室中加入 2 mL 的 MiR05(不含肌酸或 blebbistatin)。
- 打开呼吸测量软件。软件启动后,将打开一个弹出框进行仪器设置。将腔室搅拌速度设置为 750 rpm,温度设置为 37 °C,数据记录间隔为 2 秒。将氧传感器的增益设置为 1,将极化电压设置为 800 mV。单击 Connect to Oxygraph 以建立与仪器的通信。
- 建立通信后,将打开一个对话框来命名并保存实验文件。使用当前日期和校准保存文件。保存文件后,将出现一个弹出对话框,其中包含实验详细信息。校准运行不需要任何信息,可以关闭该框。
- 记录氧气浓度至少 30 分钟,以使腔室预热并记录空气校准信号。这可以在准备肌肉纤维时完成,如下面的步骤 2 中所述。
- 在校准期结束时,在氧浓度(蓝线)稳定的区域上标记一个校准区域。为此,请按住 Shift 键和 鼠标左 键,然后在时间轴上的区域上拖动。
- 转到 Oxygraph > O2 校准打开校准窗口。对于 Air Calibration(空气校准),选择在步骤 1.8 中生成的标记。点击 校准并复制到剪贴板.
- 对剩余的腔室重复步骤 1.6-1.8。每天执行空气校准。停止空气校准记录并通过断开与仪器的连接来保存文件。样品准备好后,继续执行步骤 3 进行检测。
2. 骨骼肌纤维的收获和透化
- 小鼠组织分离
- 对于每个要分析的样品,用 1 mL 的 BIOPS 填充 12 孔培养皿的一个孔。将盘子放在冰上冷却。
- 通过吸入二氧化碳对小鼠实施安乐死后,然后进行颈椎脱位,收获感兴趣的骨骼肌,确保去除所有结缔组织和脂肪(图 2A)。将肌肉放入含有 BIOPS 的孔之一中。放在冰上直到纤维准备好。
注意:任何骨骼肌都可以使用此协议进行检查 - 检查的肌肉类型将取决于人们寻求解决的实验问题。对于具有混合纤维类型的骨骼肌,例如腓肠肌,可以将组织分为白色和红色部分,以测量主要是快速抽搐(白色部分)和主要是慢抽搐(红色部分)纤维(图 2B)。
- 人体组织分离
- 按照临床方案收集组织14.用冷的无菌 PBS 快速冲洗组织,并将其放入含有 2 mL BIOPS 溶液的锥形管中。将组织放在冰上,直到纤维制备。
- 纤维制备
- 透化将在 6 孔组织培养板中进行。向一组孔中加入 2 mL BIOPS 溶液,向另一组孔中加入 2 mL MiR05。每个被检测的样品都需要一组孔。
- 用冰块装满托盘,然后将玻璃培养皿倒置在冰上。确保始终将肌肉保持在冰上。
- 使用镊子将收集的肌肉样品转移到冷藏的培养皿平台中。使用两个细尖镊子和一个带光源的解剖显微镜,通过去除附着在肌肉上的任何肌腱、筋膜和脂肪组织来轻轻清洁组织。
- 去除所有外来的非肌肉组织后,用细尖镊子轻轻地将肌肉纤维拉开,直到它们成为长度为 0.75 - 1.0 毫米的半透明纤维小束(图 2C-D)。分离纤维后,使用镊子将纤维束转移到含有冰上 BIOPS 溶液的 6 孔板上的孔中。
- 向每个 BIOPS 孔中加入 20 μL 5 mg/mL 皂苷溶液,并在冰上孵育板,同时在冷藏室中轻轻摇动 20 分钟。
- 皂苷处理后,将肌肉纤维转移到含有 MiR05 的孔中,以便在测定前冲洗。在冰上孵育,同时在寒冷的房间里轻轻摇动 15 分钟。
- 在 MiR05 中完成纤维孵育后,用锋利的镊子收集纤维,并在任务擦拭上轻轻吸干肌肉纤维。将 1.5 mL 塑料微量离心管去皮,以精细天平放置,并在管中加入 2-3 mg 纤维。记录每个管侧面的最终纤维重量。将试管放在冰上。对其他样品重复。立即执行步骤 3。
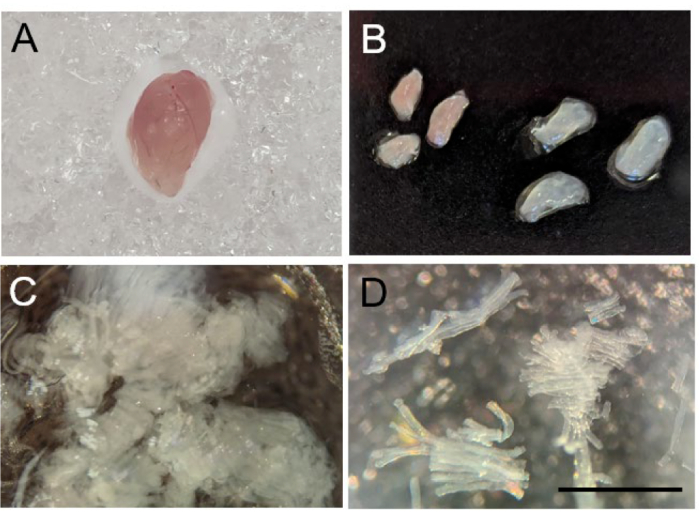
图 2:小鼠骨骼肌纤维的分离。 (A) 收获后小鼠腓肠肌的大体形态。(B) 将腓肠肌解剖成红色(左)和白色(右)段。(C) 机械分离的肌肉纤维。(D) 成功分离肌肉纤维的 10 倍图像。比例尺为 1 毫米。 请单击此处查看此图的较大版本。
3. 在呼吸计中制备肌肉样本
- 如上述步骤 1 中所述,抽真空出用于仪器校准的 MiR05,并向每个腔室中加入 2.1 mL 的工作 MiR05 溶液。
- 使用步骤 1.5 中详述的相同仪器设置为实验启动新文件。以上。设置文件名并保存设置。
- 设置文件名后,下一个屏幕对话框将用于特定的实验详细信息。输入样品信息和添加到每个腔室的每个样品的重量。关闭对话框。
- 进入新的实验文件后,通过打开 O2 Calibration 窗口来设置校准。单击 Copy from file 并选择从步骤 1.9 保存的文件。以上。点击 校准并复制到剪贴板 按钮。对其余腔室重复该过程。
- 使用细镊子,小心地将肌肉纤维束转移到适当腔室的呼吸溶液中。对剩余的腔室重复此操作。
- 将塞子放在腔室上,小心地将瓶塞推到底部一半左右,使腔室半封闭。一旦塞子上的 O 形圈与腔室壁啮合并产生阻力,在向下推以关闭时使用扭转动作。当腔室半关闭时,可以在腔室顶部观察到一个小气泡。
注意:透化纤维在正常呼吸条件下会受到氧扩散限制。为了规避这一限制,该测定是在高氧浓度下进行的11。 - 用氧气罐中的纯氧填充 10 mL 塑料注射器。将仪器随附的长而钝的针头放在注射器上。将针头放入第一个腔室中,然后缓慢地将大约 1 mL 的氧气输送到腔室中。
- 在呼吸测量软件中监测腔室氧浓度。当腔室氧浓度达到 350-400 nmol/mL 时,轻轻扭动塞子,同时向下推以完全关闭腔室。查看腔室并确保没有气泡残留。如果存在气泡,请小心快速地重新打开腔室,添加 100 μL 额外的工作 MiR05 溶液,然后再次快速关闭腔室。对其余腔室重复。
- 在检测过程中,氧浓度应保持在 250 nmol/mL 以上。根据需要添加额外的氧气,方法是部分打开腔室,将注射器中的更多氧气添加到气泡中,然后再次小心地关闭腔室。
- 将氧通量数据归一化为用于实验的组织质量。要调整图形,请更改布局以反映 O2 通量 (pmol O2 / (s x mg))。从布局菜单中,选择 06 - Specific Flux per Unit Sample 布局。现在将按照每个腔室中的组织量标准化数据呈现数据。
4. 高分辨率呼吸测量
- 当氧(蓝线)浓度和 O2 通量(红线)在加氧后稳定时,开始呼吸方案。当蓝线平坦或缓慢减少时,可以认为氧气是稳定的。O2 通量也应该是平坦的,并且在 5 pmol O2 / s x mg 范围内。
- 使用玻璃注射器添加所有试剂。重要的是,不要对底物、抑制剂和解偶联剂使用相同的注射器。每个注射器都有一个单独的注射器。添加每种化合物后,在呼吸速率稳定后记录氧通量 1-2 分钟,然后再添加下一个试剂。
- 呼吸测量
- 使用 10 μL 玻璃注射器,向每个腔室中加入 2.5 μL 0.8 M 苹果酸盐。按 F4 标记时间线并用 M 标记标记。记录稳定的 O2 通量 1-2 分钟。
- 如下所述添加营养特异性试剂。
- 需氧糖酵解剂:使用 10 μL 玻璃注射器,向每个腔室中加入 10 μL 2 M 谷氨酸和 5 μL 2 M 丙酮酸。按 F4 标记时间线并用 GP 标记标记。将稳定的 O2 通量记录 1-2 分钟。
- 脂肪酸:使用 10 μL 玻璃注射器,向每个腔室中加入 10 μL 2 M 谷氨酸和 10 μL 10 mM 棕榈酰肉碱。按 F4 标记时间线并使用 G PC 标记标记。记录稳定的 O2 通量 1-2 分钟。
- 使用 25 μL 玻璃注射器,向每个腔室中加入 20 μL 0.5 M(含 MgCl2)ADP。按 F4 标记时间轴并使用 ADP 标记标记。记录稳定的 O2 通量 1-2 分钟。
- 使用 25 μL 玻璃注射器,向每个腔室中加入 20 μL 1 M 琥珀酸盐。按 F4 标记时间线并用 S 标记标记。记录稳定的 O2 通量 1-2 分钟。
- 使用 10 μL 玻璃注射器,向每个腔室中加入 5 μL 4 mM 细胞色素 C。按 F4 标记时间线并用 Cyt C 标记标记。记录稳定的 O2 通量 1-2 分钟。
- 使用 10 μL 玻璃注射器分 3 次 1 μL 1 mM FCCP 推注进行滴定。添加 FCCP 时,通常存在混合效应,导致 O2 通量水平短暂降低。等待 O2 通量增加并稳定下来,然后再进行下一步。每次添加后按 F4 键,以使用 FCCP 标记时间轴和标签标记。每次添加后 1 分钟内记录稳定的 O2 通量。
- 呼吸测定完成后,通过向上扭转和拉动轻轻去除塞子。用喷瓶中的超纯 H2O 冲洗腔室 3 次,然后用喷瓶中的 70% 乙醇冲洗腔室 3 次。最后一次乙醇冲洗后,用 70% 乙醇填充腔室进行储存。
- 将塞子放在腔室中,直到您感到阻力。不要完全关闭塞子。将盖子盖在塞子上,保存检测文件并断开仪器与 Respirometry 软件的连接。关闭仪器。
5. 数据分析
- 在 Respirometry 软件中打开分析文件。从注射呼吸化合物后获得的稳定氧通量区域提取数据。
- 要标记感兴趣的区域,请按住 Shift 键,单击 鼠标左 键,然后将框拖动到稳定的 O2 通量速率区域,用于下面详述的分析阶段。
- 检测阶段14、15、16、17、18、19、20
- 标记添加苹果酸/谷氨酸/丙酮酸(需氧糖酵解方案)或苹果酸/谷氨酸/棕榈酰肉碱(脂肪酸方案)后的时间线。该速率表示复合物 I 状态 2 呼吸 (LEAK(n)) 速率。
- 在添加 ADP 后标记时间线。该速率表示复合物 I 状态 3 呼吸 (CI OXPHOS) 速率。
- 标记添加琥珀酸盐后的时间线。该速率表示复合物 I+II 状态 3 呼吸 (CI+II OXPHOS) 速率。
- 添加细胞色素 C 后标记时间线。该速率代表复合物 I+II+细胞色素状态 3 呼吸 (CI+II+Cyt C OXPHOS) 速率。
- 用最高的 O2 通量速率标记 FCCP 滴定的时间表。该心率表示最大呼吸频率 (MAX ETS)。
- 通过选择 Mark > Statistics (标记统计信息) 检索时间轴上标记区域的数据值。将标记腔室的 O2 通量率 (pmol O2/(s x mg)) 复制到电子表格中。
- 对额外的腔室重复标记和数据提取。
- 通过将复合物 I+II 状态 3(添加琥珀酸盐后)除以复合物 I 状态 2(添加 ADP 之前)来计算呼吸控制比 (RCR)。
结果
图 3 和 图 4 分别显示了有氧糖酵解和脂肪酸呼吸测定方案的氧图,用于正确制备的小鼠红色和白色腓肠肌纤维。还显示了代表性的量化结果以供参考。 图 5 显示了正确制备的人体肌肉活检样品中需氧糖酵解呼吸测定法的氧合图。还显示了具有代表性的定量结果。请注意,对于 图 3、 图 4 和 图 5,添加 ADP 后添加细胞色素 C 不会对氧通量产生影响,表明样品的线粒体外膜完整。 图 6 显示了有氧糖酵解呼吸测定法的氧图,其中 ADP 后添加细胞色素 C 导致氧通量激增(增加 40%),表明线粒体外膜已损坏,因此样品不应用于呼吸测定 - 导致此结果的潜在原因可能是组织处理不当或冻结/解冻, 延长组织的透化时间,不使用新鲜分离的组织。
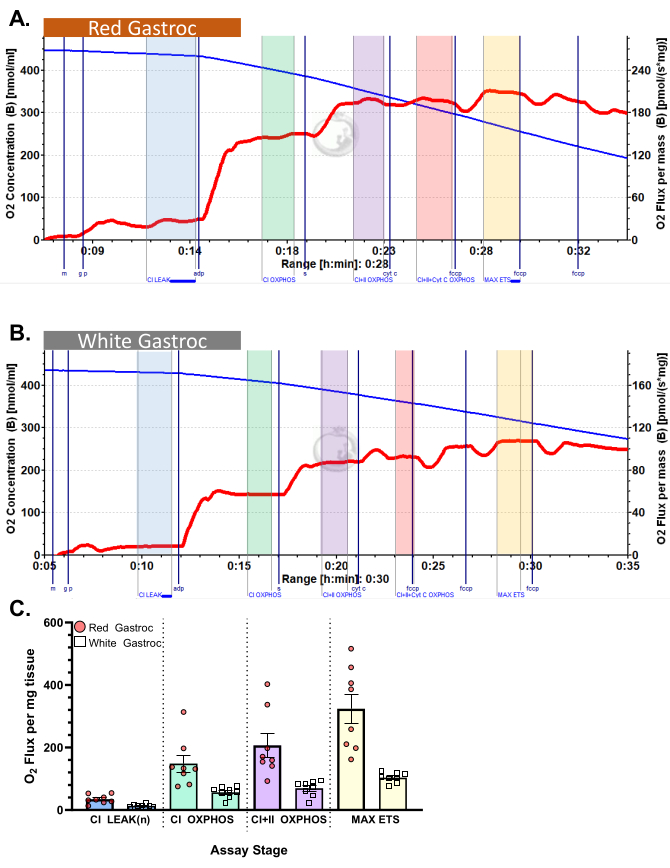
图 3:小鼠的耗氧量。 结果显示使用丙酮酸方案的 (A) 红色和 (B) 白色腓肠肌的耗氧量。添加苹果酸、谷氨酸和丙酮酸后的状态 2 通量(蓝色阴影,CI LEAK)。ADP 给药后观察到 O2 消耗的显着刺激 (绿色阴影,CI OXPHOS),添加琥珀酸盐后呼吸进一步驱动 (紫色阴影,CI+II OXPHOS)。细胞色素 C 诱导的细胞色素 C 没有显著增加 (<15%),表明线粒体外膜完整 (橙色阴影,CI+II+Cyt C OXPHOS)。线粒体在添加 FCCP (黄色阴影,MAX ETS) 后解偶联。蓝线表示密闭腔室中的氧气浓度。红线表示耗氧率(O2 通量)。添加的化合物:苹果酸 (m)、谷氨酸 (g)、丙酮酸 (p)、二磷酸腺苷 (ADP)、细胞色素 C (cyt c)、羰基氰化物-对三氟甲氧基苯腙 (FCCP)。 (C) 条形图反映了代表性结果 (n=8)。数据以 ± SEM 表示。 请单击此处查看此图的较大版本。
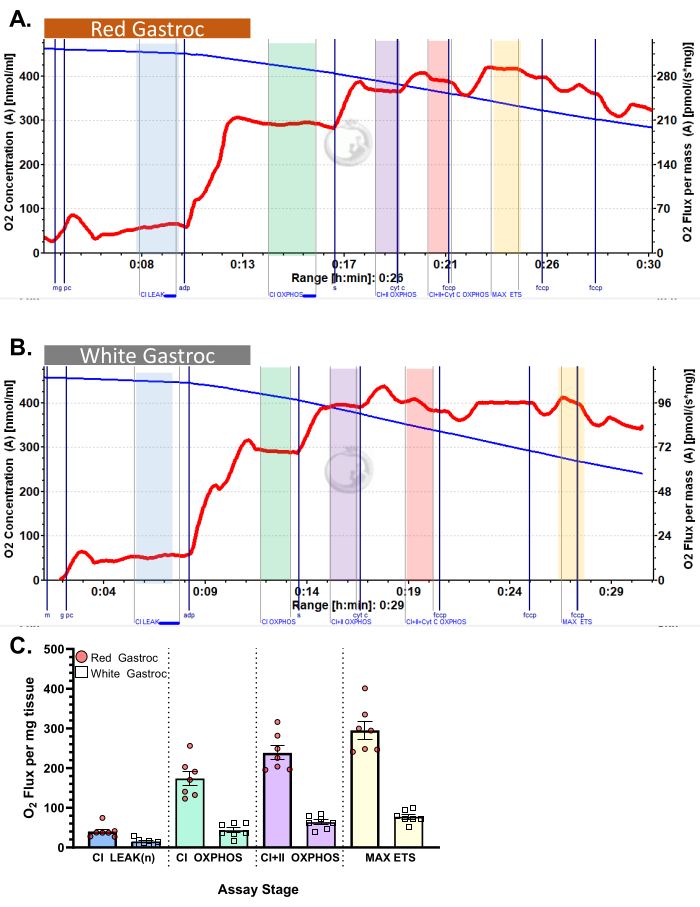
图 4:小鼠的耗氧量。 结果显示使用棕榈酰肉碱方案的 (A) 红色和 (B) 白色腓肠肌的耗氧量。添加苹果酸、谷氨酸和棕榈酰肉碱(蓝色阴影,CI LEAK)后的状态 2 通量。ADP 给药后观察到 O2 消耗的显着刺激 (绿色阴影,CI OXPHOS),添加琥珀酸盐后呼吸进一步驱动 (紫色阴影,CI+II OXPHOS)。细胞色素 C 诱导的细胞色素 C 没有显著增加 (<15%),表明线粒体外膜完整 (橙色阴影,CI+II+Cyt C OXPHOS)。线粒体在添加 FCCP (黄色阴影,MAX ETS) 后解偶联。蓝线表示密闭腔室中的氧气浓度。红线表示耗氧率(O2 通量)。添加的化合物:苹果酸 (m)、谷氨酸 (g)、棕榈酰肉碱 (pc)、二磷酸腺苷 (ADP)、细胞色素 C (cyt c)、羰基氰化物-对三氟甲氧基苯腙 (FCCP)。 (C) 条形图反映了代表性结果 (n=7)。数据以 ± SEM 表示。 请单击此处查看此图的较大版本。
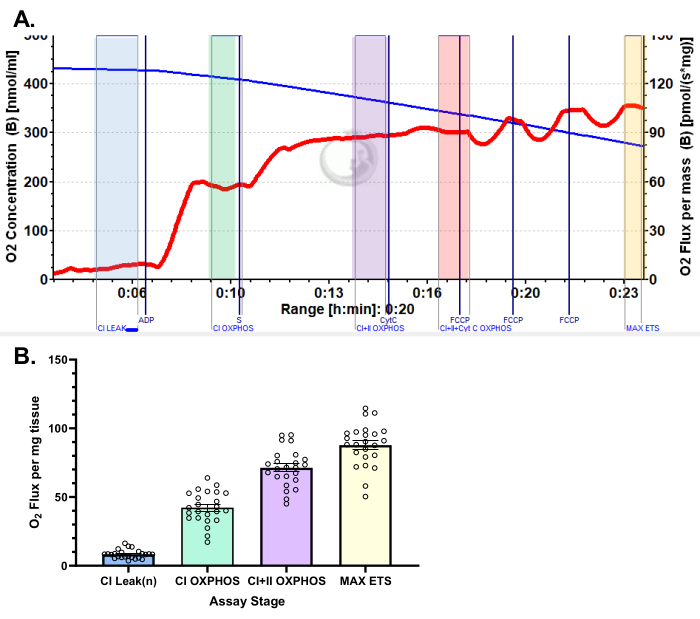
图 5:使用丙酮酸方案的人股外侧肌耗氧量的代表性结果。 (A) 添加苹果酸、谷氨酸和丙酮酸后的状态 2 通量(蓝色阴影,CI 泄漏)。ADP 给药后观察到 O2 消耗的显着刺激 (绿色阴影,CI OXPHOS),添加琥珀酸盐后呼吸进一步驱动 (紫色阴影,CI+II OXPHOS)。细胞色素 C 诱导的细胞色素 C 没有显著增加 (<15%),表明线粒体外膜完整 (橙色阴影,CI+II+Cyt C OXPHOS)。线粒体在添加 FCCP (黄色阴影,MAX ETS) 后解偶联。蓝线表示密闭腔室中的氧气浓度。红线表示耗氧率(O2 通量)。添加的化合物:苹果酸 (m)、谷氨酸 (g)、丙酮酸 (p)、二磷酸腺苷 (ADP)、细胞色素 C (cyt c)、羰基氰化物-对三氟甲氧基苯腙 (FCCP)。(B) 条形图反映了从股外侧肌活检中获得的代表性结果 (n = 24)。数据以 ± SEM 表示。 请单击此处查看此图的较大版本。
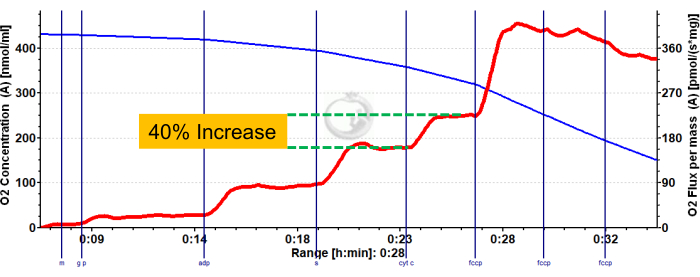
图 6:代表性结果表明小鼠红腓肠肌线粒体外膜完整性受损。 添加苹果酸、谷氨酸和丙酮酸后的状态 2 通量(蓝色阴影,CI LEAK)。ADP 给药后观察到 O2 消耗的显着刺激 (绿色阴影,CI OXPHOS),添加琥珀酸盐后呼吸进一步驱动 (紫色阴影,CI+II OXPHOS)。细胞色素 C 诱导 O2 消耗显着增加 (>15%),表明线粒体外膜受损。蓝线表示密闭腔室中的氧气浓度。红线表示耗氧率(O2 通量)。添加的化合物:苹果酸 (m)、谷氨酸 (g)、丙酮酸 (p)、二磷酸腺苷 (ADP)、细胞色素 C (cyt c)、羰基氰化物-对三氟甲氧基苯腙 (FCCP)。 请单击此处查看此图的较大版本。
表 1:呼吸化合物和呼吸溶液的试剂制备。 介绍了制备分析所需试剂的详细信息,包括最终储备液浓度以及如何制备和储存它们。 请点击此处下载此表格。
讨论
该方案提供了一个全面而直接的模板方案,用于评估人和小鼠样品的透化骨骼肌纤维中的线粒体功能。使用透化纤维而不是分离的线粒体有几个优点。一个关键优点是使用透化纤维需要少量 (2-5 mg) 组织,这使得该方法适用于人体肌肉活检样本和小鼠肌肉。与分离的线粒体相比,另一个优势是细胞结构保持完整,确保保留线粒体和细胞成分之间的结构和功能相互作用 12,21,22,23。
在我们的好氧糖酵解方案中使用丙酮酸、苹果酸和谷氨酸,对复合物 I24、25、26、27、28 的 NADH 供应进行了全面、广泛的评估。虽然这种综合方法提供了在整体和生理相关代谢条件下对复合物 I 活性的评估,但使用丙酮酸-苹果酸或谷氨酸-苹果酸可能是一种更合适的实验方法。例如,谷氨酸-苹果酸的使用可以梳理出与氨基酸分解代谢相关的线粒体功能的差异29。我们鼓励研究人员仔细考虑用于其特定研究模型的适当方法。
虽然该方案侧重于使用底物来评估线粒体活性,但可能需要使用特异性抑制剂来实现实验目标。例如,鱼藤酮可用于抑制复合物 I 12,21,30,寡霉素用于抑制复合物 V(ATP 合酶)12,21,抗霉素 A 用于阻断复合物 III12,21 以评估非线粒体呼吸。上面提供的方案可以很容易地适应包括特定抑制剂的使用。值得注意的是,关于抑制剂使用需要注意的一个问题是,这些化合物具有粘性,需要大量清洁才能从仪器腔室中取出。我们发现使用 10% BSA 溶液 60 分钟足以去除残留的抑制剂。
LEAK 呼吸是指与 ATP 合成无关的耗氧率。该速率表示质子从线粒体内膜流回线粒体基质。有三种公认的方法可以独立于 ATP 合成 (LEAK) 来评估耗氧量。第一个 LEAK(n) 测量在存在底物但不添加腺苷酸酯(ADP 或 ATP)的情况下的氧消耗率31,32,33。这种 LEAK 状态代表线粒体膜的内在渗漏。第二种方法 LEAK(t) 是在 ATP34 存在下测量的,第三种方法 LEAK(o) 是在 ATP 合酶抑制剂寡霉素 35,36,37 存在下测量的。该协议使用 LEAK(n) 进行此评估,但根据实验目标和模型,其他测量 LEAK 氧通量的方法可能是合适的。
对于该测定,MiR05 补充有肌酸 (3 mg/mL) 和 blebbistatin (10 μM)。肌酸激酶 (CK) 促进线粒体 ADP 转运,肌酸被添加到呼吸溶液中以使 CK 活性饱和38,39。肌肉纤维可以自发收缩,并且对 ADP 诱导的收缩也很敏感。为了在没有收缩影响的情况下评估线粒体呼吸活动,添加了 blebbistatin 以抑制纤维收缩活性38。此外,对人体肌肉的研究表明,呼吸能力可能受活检方法(显微活检与 Bergstrom 针)的影响,这种差异可能是由于获得的纤维长度的差异40,41。较短的纤维在制备过程中可能更容易受损,使用 blebbistatin 有助于保持功能。在某些情况下,纤维松弛不符合研究目标,在这种情况下,可以从 MiR05 溶液中排除 blebbistatin。
皂苷对骨骼肌纤维的透化在质膜中产生孔,使底物和抑制剂能够自由进入细胞。皂苷对胆固醇具有高亲和力,胆固醇在细胞质膜中含量丰富,而线粒体膜则缺乏胆固醇42,43。预计该方案中用于纤维制备的皂苷处理将保持线粒体膜的完整性。线粒体损伤也可能是由于组织机械分离成纤维而产生的剪切力而发生的。我们建议将组织分离成纤维束,并且只需最少的处理。为了评估潜在的线粒体损伤,我们在呼吸方案中加入了细胞色素 C 的滴定。细胞色素 C 不能穿过完整的线粒体外膜12,因此,添加细胞色素 C 后 O2 通量的任何增加都表明线粒体外膜损伤发生在样品制备过程中。在我们最近的一项研究中,我们发现添加细胞色素 C 后 O2 通量增加了 8%15,验证了该方案中建议的皂苷使用不会引起线粒体损伤。我们建议,在添加细胞色素 C 后,任何显示 O2 通量增加超过 15% 的样品都应从分析中排除44。该步骤严格作为质量控制措施,而不是作为复合物 IV 活性的评估。
虽然高分辨率呼吸测定法在提供高灵敏度和可靠的耗氧量测量方面表现出色,但该仪器的一个显著局限性是每台仪器只能同时测量两个样品。在设计涉及多个样本的队列的研究时,这需要仔细考虑。虽然可能会有全天对各种样本组进行测量的诱惑,但我们强烈建议研究人员考虑昼夜节律对新陈代谢的影响。对人类和啮齿动物骨骼肌的研究揭示了生物钟对线粒体功能的影响45,46。因此,我们建议在一天中的同一时间进行几天的测量,以考虑这些昼夜节律波动。
最后,为了确保呼吸计测量的可重复性和稳定性,呼吸计必须定期清洁、维护和校准。如实验方案中所述,应每天进行空气校准。我们建议用户每月对极谱法氧传感器进行完整的校准(空气和零度)。用户应参考制造商的文档和 web有关此校准方法的更多信息以及仪器日常维护的说明。
高分辨率呼吸测定法仍然是测量线粒体呼吸的金标准。该协议中详述的方法有助于对啮齿动物和人类骨骼肌中的线粒体能力进行稳健评估。该方案已应用于评估与遗传小鼠模型15,16 相关的线粒体功能的研究,在慢性肾病19 的情况下,膳食补充剂给药14,20 和运动17,18。
披露声明
作者没有什么可披露的。
致谢
本出版物中报告的研究得到了营养肥胖研究中心、NIH 赠款 P30 DK056341 和 NIH 赠款 K01 HL145326 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-125 | For respiration assay titration |
| 25 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-133 | For respiration assay titration |
| ADP | Merck | 117105 | Respirometry Assay |
| Black Glass Dissection Dish | Scintica | DD-90-S-BLK | For sample preparation |
| Blebbistatin | Sigma | B0560 | Working MiR05 Solution |
| BSA, fatty acid free | Sigma | A6003 | MiR05 Solution |
| Calcium Carbonate | Sigma | C4830 | BIOPS Solution |
| Creatine | Sigma | 27900 | Working MiR05 Solution |
| Cytochrome C | Sigma | C7752 | Respirometry Assay |
| DatLab | Oroboros Instruments | N/A | Respirometry Software |
| Dithiothreitol (DTT) | Sigma | D0632 | BIOPS Solution |
| D-Sucrose | Sigma | 84097 | MiR05 Solution |
| EGTA | Sigma | E4378 | BIOPS & MiR05 Solution |
| FCCP | Sigma | C2920 | Respirometry Assay |
| Glutamate | Sigma | G1626 | Respirometry Assay |
| HEPES | Sigma | H7523 | MiR05 Solution |
| Imidazole | Sigma | 56750 | BIOPS Solution |
| KH2PO4 | Sigma | P5379 | MiR05 Solution |
| Lactobionic acid | Sigma | 153516 | MiR05 Solution |
| Malate | Sigma | M1000 | Respirometry Assay |
| MES hydrate | Sigma | M8250 | BIOPS Solution |
| MgCl2 - 6 H2O | Sigma | M2670 | BIOPS & MiR05 Solution |
| Oroboros Oxygraph-2K (O2K) System | Oroboros Instruments | 10203-03 | High resolution respirometer |
| Palmitoyl-Carnitine | Sigma | P4509 | Respirometry Assay |
| Potassium Hydroxide | Sigma | P1767 | BIOPS Solution |
| Precision Tweezers | Fisher | 17-467-168 | For sample preparation |
| Saponin | Sigma | S2149 | For Fiber Permeabilization |
| Sodium ATP | Sigma | A2383 | BIOPS Solution |
| Sodium Phosphocreatine | Sigma | P7936 | BIOPS Solution |
| Sodium Pyruvate | Sigma | P2256 | Respirometry Assay |
| Succinate | Sigma | S2378 | Respirometry Assay |
| Taurine | Sigma | T0625 | BIOPS & MiR05 Solution |
参考文献
- Rizzuto, R., De Stefani, D., Raffaello, A., Mammucari, C. Mitochondria as sensors and regulators of calcium signalling. Nat Rev Mol Cell Biol. 13 (9), 566-578 (2012).
- Ruegsegger, G. N., Creo, A. L., Cortes, T. M., Dasari, S., Nair, K. S. Altered mitochondrial function in insulin-deficient and insulin-resistant states. J Clin Invest. 128 (9), 3671-3681 (2018).
- Simoneau, J. A., Kelley, D. E. Altered glycolytic and oxidative capacities of skeletal muscle contribute to insulin resistance in NIDDM. J Appl Physiol. 83 (1), 166-171 (1997).
- Ryan, T. E., et al. Extensive skeletal muscle cell mitochondriopathy distinguishes critical limb ischemia patients from claudicants. JCI Insight. 3 (21), 123235 (2018).
- Sullivan, M. J., Green, H. J., Cobb, F. R. Skeletal muscle biochemistry and histology in ambulatory patients with long-term heart failure. Circulation. 81 (2), 518-527 (1990).
- Giebelstein, J., et al. The proteomic signature of insulin-resistant human skeletal muscle reveals increased glycolytic and decreased mitochondrial enzymes. Diabetologia. 55 (4), 1114-1127 (2012).
- Tezze, C., et al. Age-associated loss of OPA1 in muscle impacts muscle mass, metabolic homeostasis, systemic inflammation, and epithelial senescence. Cell Metab. 25 (6), 1374-1389 (2017).
- Hughes, M. C., et al. Early myopathy in Duchenne muscular dystrophy is associated with elevated mitochondrial H(2) O(2) emission during impaired oxidative phosphorylation. J Cachexia Sarcopenia Muscle. 10 (2), 643-661 (2019).
- Yin, Y., Shen, H. Common methods in mitochondrial research (Review). Int J Mol Med. 50 (4), 5182 (2022).
- Vue, Z., et al. 3D reconstruction of murine mitochondria reveals changes in structure during aging linked to the MICOS complex. Aging Cell. 22 (12), e14009 (2023).
- Doerrier, C., et al. High-resolution fluoRespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods Mol Biol. 1782, 31-70 (2018).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Picard, M., Hepple, R. T., Burelle, Y. Mitochondrial functional specialization in glycolytic and oxidative muscle fibers: tailoring the organelle for optimal function. Am J Physiol Cell Physiol. 302 (4), C629-C641 (2012).
- Yoshino, M., et al. Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women. Science. 372 (6547), 1224-1229 (2021).
- Mousa, M. G., et al. Site-1 protease inhibits mitochondrial respiration by controlling the TGF-beta target gene Mss51. Cell Rep. 42 (4), 112336 (2023).
- Moon, S. H., et al. Genetic deletion of skeletal muscle iPLA(2)gamma results in mitochondrial dysfunction, muscle atrophy and alterations in whole-body energy metabolism. iScience. 26 (6), 106895 (2023).
- Bittel, A. J., et al. A single bout of premeal resistance exercise improves postprandial glucose metabolism in obese men with prediabetes. Med Sci Sports Exerc. 53 (4), 694-703 (2021).
- Bittel, A. J., et al. A single bout of resistance exercise improves postprandial lipid metabolism in overweight/obese men with prediabetes. Diabetologia. 63 (3), 611-623 (2020).
- Bittel, D. C., Bittel, A. J., Varadhachary, A. S., Pietka, T., Sinacore, D. R. Deficits in the skeletal muscle transcriptome and mitochondrial coupling in progressive diabetes-induced CKD relate to functional decline. Diabetes. 70 (5), 1130-1144 (2021).
- Mills, K. F., et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice. Cell Metab. 24 (6), 795-806 (2016).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Lemieux, H., Semsroth, S., Antretter, H., Hofer, D., Gnaiger, E. Mitochondrial respiratory control and early defects of oxidative phosphorylation in the failing human heart. Int J Biochem Cell Biol. 43 (12), 1729-1738 (2011).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int J Biochem Cell Biol. 41 (10), 1837-1845 (2009).
- Appelman, B., et al. Muscle abnormalities worsen after post-exertional malaise in long COVID. Nat Commun. 15 (1), 17 (2024).
- O'Rourke, A. R., et al. Impaired muscle relaxation and mitochondrial fission associated with genetic ablation of cytoplasmic actin isoforms. FEBS J. 285 (3), 481-500 (2018).
- Inigo, M. R., et al. Estrogen receptor-alpha in female skeletal muscle is not required for regulation of muscle insulin sensitivity and mitochondrial regulation. Mol Metab. 34, 1-15 (2020).
- Musci, R. V., et al. Phytochemical compound PB125 attenuates skeletal muscle mitochondrial dysfunction and impaired proteostasis in a model of musculoskeletal decline. J Physiol. 601 (11), 2189-2216 (2023).
- Englund, D. A., et al. p21 induces a senescence program and skeletal muscle dysfunction. Mol Metab. 67, 101652 (2023).
- Zhang, K., et al. Mitochondrial supercomplex assembly regulates metabolic features and glutamine dependency in mammalian cells. Theranostics. 13 (10), 3165-3187 (2023).
- Davis, M. S., Barrett, M. R. High-resolution fluoro-respirometry of equine skeletal muscle. J Vis Exp. (192), e65075 (2023).
- Schytz, C. T., et al. Skeletal muscle mitochondria demonstrate similar respiration per cristae surface area independent of training status and sex in healthy humans. J Physiol. 602 (1), 129-151 (2024).
- Hingst, J. R., et al. Inducible deletion of skeletal muscle AMPKalpha reveals that AMPK is required for nucleotide balance but dispensable for muscle glucose uptake and fat oxidation during exercise. Mol Metab. 40, 101028 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Gnaiger, E., Mendez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc Natl Acad Sci U S A. 97 (20), 11080-11085 (2000).
- Basse, A. L., et al. Nampt controls skeletal muscle development by maintaining Ca(2+) homeostasis and mitochondrial integrity. Mol Metab. 53, 101271 (2021).
- Flensted-Jensen, M., et al. Combined changes in temperature and pH mimicking exercise result in decreased efficiency in muscle mitochondria. J Appl Physiol. 136 (1985), 79-88 (2024).
- Porter, C., et al. Mitochondrial respiratory capacity and coupling control decline with age in human skeletal muscle. Am J Physiol Endocrinol Metab. 309 (3), E224-E232 (2015).
- Perry, C. G., et al. Inhibiting myosin-ATPase reveals a dynamic range of mitochondrial respiratory control in skeletal muscle. Biochem J. 437 (2), 215-222 (2011).
- Veksler, V. I., et al. Muscle creatine kinase-deficient mice. II. Cardiac and skeletal muscles exhibit tissue-specific adaptation of the mitochondrial function. J Biol Chem. 270 (34), 19921-19929 (1995).
- Isner-Horobeti, M. E., et al. Microbiopsies versus Bergstrom needle for skeletal muscle sampling: impact on maximal mitochondrial respiration rate. Eur J Appl Physiol. 114 (5), 885-889 (2014).
- Hughes, M. C., et al. Mitochondrial bioenergetics and fiber type assessments in microbiopsy vs. Bergstrom percutaneous sampling of human skeletal muscle. Front Physiol. 18 (6), 360 (2015).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat Protoc. 3 (6), 965-976 (2008).
- Elustondo, P., Martin, L. A., Karten, B. Mitochondrial cholesterol import. Biochim Biophys Acta Mol Cell Biol Lipids. 1862 (1), 90-101 (2017).
- Ramos, P. M., Li, C., Elzo, M. A., Wohlgemuth, S. E., Scheffler, T. L. Mitochondrial oxygen consumption in early postmortem permeabilized skeletal muscle fibers is influenced by cattle breed. J Anim Sci. 98 (3), 044 (2020).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab. 5 (8), 635-645 (2016).
- de Goede, P., et al. Time-restricted feeding during the inactive phase abolishes the daily rhythm in mitochondrial respiration in rat skeletal muscle. FASEB J. 36 (2), e22133 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。