Method Article
مجموعة هجينة ومقايسة أحادية الجزيء لتصوير حركة CMG المعاد تشكيلها بالكامل
In This Article
Summary
نقوم بالإبلاغ عن مجموعة هجينة ومقايسة أحادية الجزيء لتصوير وقياس حركة اللولب Cdc45 / Mcm2-7 / GINS (CMG) المسمى بالفلورسنت والمعاد تشكيله بالكامل على جزيئات الحمض النووي الخطية الموجودة في مكانها في فخ بصري.
Abstract
تحتوي حقيقيات النوى على لولب واحد متماثل يعرف باسم CMG ، والذي ينظم مركزيا ويقود replisome ، ويقود الطريق في مقدمة شوكات النسخ المتماثل. يعد الحصول على فهم ميكانيكي عميق لديناميكيات CMG أمرا بالغ الأهمية لتوضيح كيفية تحقيق الخلايا للمهمة الهائلة المتمثلة في تكرار الجينوم بالكامل بكفاءة ودقة مرة واحدة في كل دورة خلية. تقنيات الجزيء الواحد مناسبة بشكل فريد لتحديد ديناميكيات CMG نظرا لدقتها الزمنية والمكانية التي لا مثيل لها. ومع ذلك ، فقد اعتمدت دراسات الجزيء الواحد لحركة CMG حتى الآن على CMG المشكل مسبقا المنقى من الخلايا كمركب ، مما يحول دون دراسة الخطوات التي تؤدي إلى تنشيطه. هنا ، نصف مجموعة هجينة ومقايسة أحادية الجزيء سمحت بالتصوير على مستوى الجزيء الواحد لحركة CMG المسمى بالفلورسنت بعد إعادة تكوين تجميعها وتنشيطها بالكامل من 36 عديد ببتيد S. cerevisiae منقى مختلف. يعتمد هذا الفحص على الوظيفة المزدوجة لنهايات ركيزة الحمض النووي الخطية مع شقوقين متعامدين من التعلق ، ويمكن تكييفه لدراسة آليات معالجة الحمض النووي المعقدة المماثلة على مستوى الجزيء الواحد.
Introduction
يتم إجراء تكرار الحمض النووي في حقيقيات النوى بواسطة مركب بروتيني ديناميكي يعرف باسم replisome1. أحد المكونات الرئيسية لهذا المجمع هو اللولب المتماثل حقيقي النواة Cdc45 / Mcm2-7 / GINS (CMG) ، الذي يقود وينظم الرد مركزيا ، مما يؤدي إلى الطريق في مقدمة شوكات النسخ المتماثل 1,2. لذلك فإن الحصول على فهم كمي عميق لديناميات CMG أمر بالغ الأهمية لفهم ديناميكيات الرد. يمكن الحصول على مثل هذا الفهم من خلال تقنيات الجزيء الواحد ، والتي تناسب بشكل فريد دراسة المحركات الجزيئية ، مثل CMG ، نظرا لدقتها المكانية والزمانية التي لا مثيل لها ، ويمكن أن توفر لنا فهما كميا لا مثيل له لوظيفتها ، وعشوائية ، وديناميكياتها2،3،4،5،6،7،8،9.
في الجسم الحي ، يتم تحميل CMG وتنشيطه بطريقة منفصلة مؤقتا لضمان حدوث النسخ المتماثل مرة واحدة فقط لكل دورة خلية1،10،11. أولا ، في المرحلة G1 من دورة الخلية ، تقوم مجموعة من البروتينات المعروفة باسم عوامل التحميل بتحميل المكون الأول من CMG ، المركب السداسي Mcm2-7 ، على dsDNA12،13،14،15،16 في شكل سداسيمرات مزدوجة مع تكوين وجها لوجه15،17،18. في حالة الخميرة المحددة ، تحدث هذه العملية الأولية في تسلسلات DNA محددة تعرف باسم أصول النسخالمتماثل 1. على الرغم من أن Mcm2-7 هو النواة الحركية لطائرة اللولب المتماثلة ، إلا أنه في حد ذاته غير قادر على فك الحمض النووي19 بدون عاملي تنشيط اللولب Cdc45 و GINS ، اللذين يجب تجنيدهما في Mcm2-7 المحمل ليؤدي إلى CMGنشط بالكامل 11،19،20،21. تتم عملية تنشيط اللولب في المرحلة S من دورة الخلية وتبدأ بالفسفرة الانتقائية للسداسيات المزدوجة Mcm2-7 بواسطة كيناز DDK22،23،24 المنظم لدورة الخلية. تسهل أحداث الفسفرة هذه تجنيد Cdc45 و GINS إلى السداسيمرات المزدوجة Mcm2-710،22،23،24،25،26 بواسطة مجموعة ثانية من البروتينات تعرف باسم عوامل إطلاق10،11،26. يؤدي ارتباط Cdc45 و GINS إلى ظهور طائرتين شقيقتين من طائرات الهليكوبتر CMG ، والتي تحيط في البداية بكلا خيطي الحمض النووي للوالدين ولا تزال موجودة في تكوين وجها لوجه11,27. في خطوة التنشيط النهائية ، يحفز عامل الإطلاق Mcm10 البثق المعتمد على التحلل المائي ATP لشريط DNA واحد من كل شقيق CMG11. بعد قذف الشريط ، تتجاوز طائرات الهليكوبتر CMG الشقيقة وتنفصل عن بعضها البعض عن طريق الانتقال على طول ssDNA بطريقة تعتمد على التحلل المائي ATP11،20،21،28 ، وفك الحمض النووي عن طريق استبعاد الشريط29 غير الإزفاء بشكل معقم. تمت إعادة تشكيل هذه العملية برمتها بالكامل في المختبر من مجموعة صغيرة من 36 عديد ببتيدات S. cerevisiae المنقاة10,11.
على الرغم من التنظيم الرائع في الجسم الحي لتجميع CMG وتنشيطه الموصوف أعلاه ، فقد اعتمدت دراسات الحركة أحادية الجزيء المعاد تشكيلها في المختبر ل CMG2،30،31،32،33،34 حتى الآن على CMG المنشط مسبقا المنقى كمركب من الخلايا20,21، في عداد المفقودين جميع الخطوات قبل تفعيلها والطبيعة ثنائية الاتجاه لحركتها. كان نهج CMG المنشط مسبقا هو المعيار الذهبي في مجال الجزيء الواحد جزئيا بسبب التعقيد الكيميائي الحيوي لتفاعل تجميع CMG المعاد تشكيله بالكامل10,11. كان هذا التفاعل الكيميائي الحيوي يمثل تحديا للترجمة من المستوى الكيميائي الحيوي السائب إلى مستوى الجزيء الواحد لعدة أسباب. أولا ، لزيادة كفاءة التفاعل إلى أقصى حد ، فإن عوامل التحميل والإطلاق اللازمة لتجميع وتنشيط CMG مطلوبة بتركيزات في حدود 10-200 نانومتر10،11،27. تتوافق نطاقات التركيز هذه مع النهاية العليا لما يمكن أن تتحمله معظم تقنيات الجزيء الواحد ، خاصة عند استخدام المكونات ذات العلامات الفلورية35. أخيرا ، تطورت CMG لتبحر عبر آلاف أزواج القواعد في خلية36،37،38،39. لذلك ، لدراسة حركته على نطاق مكاني ذي صلة بيولوجيا ، يحتاج المرء إلى ركائز الحمض النووي الطويلة (عادة بأطوال بترتيب عشرات الكيلوقواعد)30،31،34،40،41،42. يشكل استخدام ركائز الحمض النووي الطويلة هذه تحديا إضافيا يتمثل في أنه كلما طالت ركيزة الحمض النووي ، زادت مواقع الارتباط غير المحددة المحتملة للبروتينات ومجاميع البروتين. في حالة CMG ، فإن النقطة الأخيرة مهمة بشكل خاص ، حيث أن العديد من عوامل التحميل والإطلاق المشاركة في تجميع وتنشيط CMG تحتوي على مناطق مضطربة جوهريا43 وهي عرضة للتجميع.
هنا ، نبلغ عن مجموعة هجينة ومقايسة أحادية الجزيء سمحت بمراقبة وقياس حركة CMG بعد إعادة تشكيل تجميعها وتنشيطها بالكامل من 36 عديد الببتيد S. cerevisiae المنقى28. يعتمد هذا الفحص على الوظيفة المزدوجة لكلا طرفي ركيزة الحمض النووي مع شقوقين متعامدين للتعلق: ديسثيوبيوتين وديجوكسيجينين2 (الشكل 1 أ). يستخدم الجزء الأول ، desthiobiotin ، لربط ركيزة الحمض النووي بشكل عكسي بالخرز المغناطيسي المطلي بالستربتافيدين44 (الشكل 1 ب). بعد ذلك ، يتم تجميع CMG المسمى بالفلورسنت وتنشيطه على الحمض النووي المرتبط بالخرز ، ويتم استخدام رف مغناطيسي لتنقية وغسل مجمعات الحمض النووي المرتبطة بالخرز المغناطيسي: CMG (الشكل 1C). عند القيام بذلك ، تتم إزالة البروتين الزائد الذي من شأنه أن يتجمع على ركيزة الحمض النووي ؛ يوفر هذا مجمعات DNA: CMG خالية من التجميع تقريبا. ثم يتم استخلاص المجمعات السليمة من الخرز المغناطيسي عن طريق إضافة فائض مولي من البيوتين الحر ، والذي يمكن أن يتفوق على تفاعل ديسثيوبيوتين - ستربتافيدين (الشكل 1 د). الحمض النووي الفردي: ثم يتم ربط مجمعات CMG بين حبتين من البوليسترين محاصرتين بصريا مغلفتين بجسم مضاد للديجوكسيجينين (مضاد للحفر) ؛ في هذه الخطوة ، يتم استخدام الجزء الثاني على الحمض النووي ، digoxigenin ، لأنه يمكن أن يرتبط بمضاد الحفر حتى في محلول عازل يحتوي على فائض من البيوتين الحر (الشكل 1E). بمجرد تثبيت مركب DNA: CMG في مكانه في المصيدة الضوئية ، يتم تصوير حركة CMG المسمى بالفلورسنت باستخدام ليزر مسح متحد البؤر (الشكل 1F). نتوقع أن هذا الاختبار يمكن تكييفه بسهولة للدراسة على مستوى الجزيء الواحد لتفاعلات الحمض النووي المعقدة المماثلة: البروتين.
Protocol
1. تخليق ركيزة الحمض النووي الخطية ذات الوظائف المزدوجة والارتباط بالخرز المغناطيسي
- الوظيفة المزدوجة لركيزة الحمض النووي مع شقوق ديسثيوبيوتين وديجوكسيجينين
- خطي 20 ميكروغرام من 23.6 كيلو بايت بلازميد pGL50-ARS1 (يحتوي على أصل ARS1 طبيعي للنسخ المتماثل ، مستنسخ في المنزل ومتاح عند الطلب) مع 200 وحدة من إنزيم التقييد AflII لمدة 16 ساعة عند 37 درجة مئوية في حجم نهائي قدره 200 ميكرولتر من 1x buffer (50 mM أسيتات البوتاسيوم ، 20 mM Tris-acetate ، 10 mM خلات المغنيسيوم ، 100 ميكروغرام / مل BSA ، درجة الحموضة 7.9).
ملاحظة: يمكن تقليل هذه الخطوة إلى 4 ساعات دون تقليل العائد ، إذا كان أكثر ملاءمة. - قم بتعطيل AflII عن طريق احتضان التفاعل عند 65 درجة مئوية لمدة 20 دقيقة. قم بتخفيف نتوءات TTAA ذات 4 نيوكليوتيد الناتجة عن طريق استكمال تفاعل الخطية 200 ميكرولتر ب 60 وحدة من بوليميراز Klenow Fragment (3 'إلى 5' exo-) ، 17 ميكرولتر من المخزن المؤقت 10x (500 mM NaCl ، 100 mM Tris-HCl ، 100 mM MgCl2 ، 10 mM DTT ، pH 7.9) ، 33 μM D-Desthiobiotin-7-dATP ، 33 μM Digoxigenin-11-dUTP ، 33 μM dCTP ، 33 μM dGTP ، والماء عالي النقاء إلى الحجم النهائي 370 ميكرومتر. احتضان التفاعل عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: في هذه الخطوة ، يخفف جزء Klenow من الأجزاء المتدلية في طرفي الحمض النووي الخطي من خلال دمج اثنين من D-Desthiobiotin-7-dATP واثنين من نيوكليوتيدات Digoxigenin-11-dUTP في كل طرف. - استكمل التفاعل ب 10 mM EDTA وقم بتعطيل جزء Klenow عن طريق احتضان التفاعل عند 75 درجة مئوية لمدة 20 دقيقة. ارفع حجم التفاعل إلى 400 ميكرولتر بماء فائق النقاء.
- خذ أربعة أعمدة تدور S-400 ، وقم بدوامها لمدة 30 ثانية على الأقل لإعادة تعليق الراتنج ، ثم قم بطردها لمدة 1 دقيقة عند 735 × جم لإزالة المخزن المؤقت للتخزين. انقل الأعمدة لتنظيف أنابيب سعة 1.5 مل.
- على الفور ، أضف 100 ميكرولتر من محلول الحمض النووي إلى كل عمود وطردها مركزيا لمدة 2 دقيقة عند 735 × جم. الحمض النووي الآن في التدفق ، وقد يتم التخلص من الأعمدة.
- قم بتجميع تدفق الأعمدة الأربعة معا ، وقم بقياس الحجم باستخدام ماصة وقياس تركيز الحمض النووي باستخدام مقياس الطيف الضوئي. سيستخدم هذا لحساب كمية الحمض النووي المرتبطة بالخرزات.
- خطي 20 ميكروغرام من 23.6 كيلو بايت بلازميد pGL50-ARS1 (يحتوي على أصل ARS1 طبيعي للنسخ المتماثل ، مستنسخ في المنزل ومتاح عند الطلب) مع 200 وحدة من إنزيم التقييد AflII لمدة 16 ساعة عند 37 درجة مئوية في حجم نهائي قدره 200 ميكرولتر من 1x buffer (50 mM أسيتات البوتاسيوم ، 20 mM Tris-acetate ، 10 mM خلات المغنيسيوم ، 100 ميكروغرام / مل BSA ، درجة الحموضة 7.9).
- ربط الحمض النووي الخطي الوظيفي المزدوج بالخرز المغناطيسي المغلف بالستربتافيدين
- حبات مغناطيسية مغلفة ب Vortex M-280 streptavidin لمدة 30 ثانية لإعادة تعليقها.
- انقل 4 ملغ من الخرزات المغناطيسية المغلفة بالستربتافيدين M-280 المعاد تعليقها إلى أنبوب نظيف سعة 1.5 مل. ضع الأنبوب في رف مغناطيسي ، وانتظر 1 دقيقة حتى يتم جمع الخرز ، وقم بإزالة المخزن المؤقت للتخزين.
- أضف 1 مل من 1x buffer A (5 mM Tris-HCl pH 7.5 و 0.5 mM EDTA و 1 M NaCl) إلى الخرز وأعد تعليقه عن طريق الدوامة لمدة 5 ثوان. احتضان الخرز في درجة حرارة الغرفة لمدة 5 دقائق.
ملاحظة: يجب تصفية جميع المخازن المؤقتة بشكل معقم. قم بعمل حجم كبير من 2x buffer A و 1x buffer B (انظر أدناه) و 1x buffer C (انظر أدناه) مسبقا لتوفير الوقت (موصى به). هذه المخازن المؤقتة هي تلك الموصى بها من قبل الشركة المصنعة للخرز المغناطيسي ويمكن تخزينها في - 20 درجة مئوية. - ضع الأنبوب في حامل مغناطيسي ، وانتظر 1 دقيقة حتى يتم جمع الخرز ، وقم بإزالة المخزن المؤقت A.
- أعد تعليق الخرزات في 400 ميكرولتر من 2x buffer A عن طريق السحب ، ثم أضف 400 ميكرولتر من محلول الحمض النووي الوظيفي (لاحظ أن هذا يخفف من المخزن المؤقت 2x A إلى تركيز نهائي قدره 1x ، وهو الأمثل لربط الحمض النووي بالخرزات). تخلط بلطف عن طريق الماصة.
- احتضان خليط الخرزة / الحمض النووي طوال الليل عند 4 درجات مئوية مع الدوران من طرف إلى طرف للسماح للحمض النووي الوظيفي بالارتباط بالخرزات.
- استخدم الحامل المغناطيسي لإزالة المادة الطافية (لا تتخلص منها قبل قياس حجمها باستخدام ماصة وتركيز الحمض النووي غير المنضم باستخدام مقياس الطيف الضوئي) واغسل الخرز 2x مع 500 ميكرولتر من المخزن المؤقت B (10 mM HEPES-KOH درجة الحموضة 7.6 ، 1 mM EDTA ، و 1 M KOAc) لإزالة الحمض النووي غير المرتبط على وجه التحديد. اغسل الخرزات 2x ب 500 ميكرولتر من المخزن المؤقت C (10 mM HEPES-KOH pH 7.6 و 1 mM EDTA) ، وهو المخزن المؤقت للتخزين الموصى به من قبل الشركة المصنعة.
- احسب إجمالي كمية الحمض النووي (DNA) المرتبطة بالحبيبات المغناطيسية بمقارنة إجمالي كمية الحمض النووي (DNA) المضافة إلى الحبيبات بكمية الحمض النووي (DNA) المتبقية في المادة الطافية. يجب أن يكون العائد في حدود 2.3-2.9 ملغ من الحمض النووي (~ 150-190 fmol) لكل ملغ من الخرز المغناطيسي. إذا تم الحصول على عوائد أقل ، فتحقق من أن أعمدة S400 ليست جافة قبل استخدامها. راقب باستمرار سلامة الحمض النووي عن طريق الرحلان الكهربائي الهلامي لضمان عدم تدهور ركيزة الحمض النووي البلازميد الأولية.
- أعد تعليق الخرزات في 300 ميكرولتر من المخزن المؤقت C وتخزينها عند 4 درجات مئوية. لمنع النك ، قم بعمل 4 حصص للاستخدام مرة واحدة من 1 ملغ من الخرز المغناطيسي ، ولا تخزن الحمض النووي لمدة تزيد عن أسبوعين.
2. مجموعة هجينة ومقايسة أحادية الجزيء لتصوير وقياس حركة CMG المعاد تشكيلها بالكامل باستخدام ملاقط بصرية مزدوجة الحزمة مترابطة ومجهر متحد البؤر
- تجميع المجموعة وتنشيط CMG المسمى بالفلورسنت على الحمض النووي المرتبط بالخرز المغناطيسي (الشكل 1 ج).
ملاحظة: تم تنفيذ تفاعلات تجميع وتنشيط CMG على مرحلتين: تحميل Mcm2-7 والفسفرة ، وتجميع وتنشيط CMG. ما لم ينص على خلاف ذلك ، تم إجراء جميع خطوات تبادل المخزن المؤقت بمساعدة رف مغناطيسي عن طريق السماح بجمع الخرز بواسطة المغناطيس لمدة 1 دقيقة ثم إزالة المادة الطافية. أجريت جميع عمليات الحضانة في كتلة حرارية يتم التحكم في درجة حرارتها مع غطاء لمنع التبييض الضوئي للبروتينات الفلورية. في حالة عدم توفر غطاء ، يجب تغطية الأنابيب بورق القصدير. تم إجراء التنقية ووضع العلامات الفلورية لجميع البروتينات المستخدمة في هذا البروتوكول كما هو موضح سابقا10,11,28.- Mcm2-7 التحميل والفسفرة
- خذ 1 ملغ من الخرزات المغناطيسية المغلفة بالستربتافيدين المرتبطة بالحمض النووي وقم بإزالة المخزن المؤقت للتخزين (المخزن المؤقت C).
- اغسل الخرزات ب 200 ميكرولتر من مخزن التحميل المؤقت (25 مللي متر HEPES-KOH درجة الحموضة 7.6 ، 100 مللي متر كلفن الغلوتامات ، 10 مللي مول MgOAc ، بديل NP40 0.02٪ ، 10٪ جلسرين ، 2 مللي متر DTT ، 100 ميكروغرام / مل BSA ، و 5 مللي متر ATP).
- قم بإزالة المخزن المؤقت للتحميل وأعد تعليق الخرزات في 75 ميكرولتر من المخزن المؤقت للتحميل. تخلط بلطف عن طريق الماصة.
- أضف ORC بتركيز نهائي قدره 37.5 نانومتر إلى الحمض النووي المرتبط بالخرز واحتضان التفاعل لمدة 5 دقائق عند 30 درجة مئوية مع تحريض 800 دورة في الدقيقة.
- أضف Cdc6 بتركيز نهائي قدره 50 نانومتر واحتضان التفاعل لمدة 5 دقائق عند 30 درجة مئوية مع تقليب 800 دورة في الدقيقة.
- أضف Mcm2-7 / Cdt1 (أو المسمى بالفلورسنت Mcm2-7JF646-Halo-Mcm3 / Cdt1) بتركيز نهائي يبلغ 100 نانومتر واحتضان التفاعل لمدة 20 دقيقة عند 30 درجة مئوية مع تحريض 800 دورة في الدقيقة.
- أضف DDK بتركيز نهائي قدره 100 نانومتر واحتضان التفاعل لمدة 30 دقيقة عند 30 درجة مئوية مع تحريض 800 دورة في الدقيقة.
- قم بإزالة المادة الطافية واغسل الحمض النووي المرتبط بالخرزة (والذي يحتوي الآن على سداسيمرات Mcm2-7 المفسفرة) مع 200 ميكرولتر من المخزن المؤقت للغسيل عالي الملح (HSW) (25 مللي متر HEPES-KOH درجة الحموضة 7.6 ، 300 مللي متر KCl ، 10 mM MgOAc ، بديل NP40 0.02٪ ، 10٪ جلسرين ، 1 مللي متر DTT ، و 400 ميكروغرام / مل BSA). امزجه عن طريق السحب ، مع التأكد من إعادة تعليق الخرزات بالكامل في المخزن المؤقت ، وعدم ظهور كتل.
- قم بإزالة المخزن المؤقت HSW واغسل الخرز مرة واحدة باستخدام 200 ميكرولتر من المخزن المؤقت CMG (25 mM HEPES-KOH pH 7.6 ، 250 mM K glutamate ، 10 mM MgOAc ، بديل 0.02٪ NP40 ، 10٪ جلسرين ، 1 mM DTT ، و 400 ميكروغرام / مل BSA).
- تجميع وتفعيل CMG المسمى بالفلورسنت
- قم بإزالة المخزن المؤقت CMG وأعد تعليق الحبيبات المرتبطة بالحمض النووي في 50 ميكرولتر من المخزن المؤقت CMG المكمل ب 5 mM ATP.
- أضف 50 نانومتر Dpb11 ، 200 نانومتر جينز ، 30 نانومتر بولز ، 20 نانومتر s-cdk ، 50 نانومتر Cdc45LD555 ، 30 نانومتر Sld3/7 ، 55 نانومتر Sld2 ، و 10 نانومتر Mcm10 إلى الحمض النووي المرتبط بالخرزة. في هذه الخطوة ، امزج جميع البروتينات في أنبوب واحد مباشرة قبل إضافتها إلى الحمض النووي وضعها على الجليد. أضف الحمض النووي المعاد تعليقه المرتبط بالخرز إلى مزيج البروتين. احتضان التفاعل لمدة 15 دقيقة عند 30 درجة مئوية مع تحريض 800 دورة في الدقيقة.
- اغسل الخرزات 3x ب 200 ميكرولتر من المخزن المؤقت HSW. اغسل الخرزات مرة واحدة باستخدام 200 ميكرولتر من المخزن المؤقت CMG.
- شطف الحمض النووي السليم: مجمعات CMG من الخرز المغناطيسي (الشكل 1 د)
- قم بإزالة المخزن المؤقت CMG و elute DNA: مجمعات CMG من الخرز المغناطيسي عن طريق تعليق الحبيبات المغناطيسية المرتبطة بالحمض النووي المحتوية على CMG في 200 ميكرولتر من المخزن المؤقت للشطف (CMG buffer مكمل ب 10 mM من البيوتين). احتضان في درجة حرارة الغرفة لمدة 1 ساعة مع تحريض 800 دورة في الدقيقة.
- ضع الأنبوب في رف مغناطيسي واترك الخرز يتجمع لمدة 5 دقائق. اجمع بعناية المادة الطافية (التي تحتوي الآن على مجمعات الحمض النووي الملتصقة: CMG) دون تعطيل الخرزات المستقرة ونقلها إلى أنبوب جديد.
- لضمان عدم بقاء أي خرز في المحلول (حيث يمكن أن تتداخل الخرزات المغناطيسية المتبقية في المحلول مع جزء الاصطياد البصري من الفحص) ، ضع المادة الطافية المجمعة مرة أخرى في رف مغناطيسي واترك أي حبات متبقية يتم جمعها لمدة 5 دقائق أخرى. جمع بعناية طاف ونقله إلى أنبوب جديد.
- أضف 1400 ميكرولتر من المخزن المؤقت CMG إلى 200 ميكرولتر من المادة الطافية. العينة جاهزة الآن للتصوير أحادي الجزيئ.
- Mcm2-7 التحميل والفسفرة
- تصوير أحادي الجزيء ل CMG المعاد تشكيله بالكامل باستخدام ملاقط بصرية مزدوجة الحزمة مترابطة وفحص مجهري متحد البؤر (الشكل 1 هاء-ز).
ملاحظة: يتم إجراء الجزء أحادي الجزيء من الفحص في إعداد تجاري يجمع بين ملاقط بصرية مزدوجة الحزمة مع الفحص المجهري متحد البؤر والموائع الدقيقة45,46 (الشكل 1 هاء-ز) ، ولكن يمكن أيضا إجراؤها في إعداد منزلي. تم تجهيز الإعداد التجاري المستخدم هنا بخلية تدفق الموائع الدقيقة مع خمسة مداخل (يشار إليها باسم القنوات 1-5 ، على التوالي) ومخرج واحد (الشكل 1 هاء). في الخطوات أدناه ، تكون جميع أسماء الأزرار و / أو اللوحات خاصة بالبرنامج الذي يتم توفيره مع هذا الإعداد التجاري.- استخدم المداخل الخمسة في الإعداد التجاري على النحو التالي: حقن القنوات 1-3 من اليسار واستخدامها لمحاصرة الخرز (القناة 1) ، وربط مجمع بروتين الحمض النووي (القناة 2) ، والتحقق من وجود CMG (القناة 3). استخدم القناتين 4 و 5 كخزانات بروتين ومواقع تبادل عازلة. قبل كل تجربة ، تخميل خلية تدفق الموائع الدقيقة لمدة 30 دقيقة على الأقل مع 1 ملغ / مل من ألبومين مصل الأبقار ، متبوعا بنسبة 0.5٪ Pluronic F-127 المذاب في ماء فائق النقاء.
- تأكد من أن محتوى كل قناة في كل تجربة كما هو موضح (الشكل 1E):
القناة 1: حبات البوليسترين المطلية بالديغوكسيجينين (قطر 2.06 ميكرومتر) مخففة 1:50 في PBS ؛
القناة 2: الحمض النووي: مجمعات CMG المستخلصة من الخرز المغناطيسي.
القناة 3: المخزن المؤقت للتصوير (المخزن المؤقت CMG المكمل ب 2 mM 1،3،5،7 سيكلوكتاتيترين ، 2 mM 4-nitrobenzylalchohol ، و 2 mM Trolox) ؛
القناتان 4 و 5: مخزن مؤقت للتصوير مكمل ب 25 نانومتر RPA ، 10 نانومتر Mcm10 ، وإما 5 مللي متر ATP ، 5 مللي متر ATPγS ، أو بدون نيوكليوتيد.
- تأكد من أن محتوى كل قناة في كل تجربة كما هو موضح (الشكل 1E):
- قبل التجربة ، اضبط طاقة ليزر الملائمة لتحقيق صلابة 0.3 pN / nm في كلا المصيدتين33,46 بالنقر فوق الزر "إعادة المعايرة" في لوحة Power Controls الخاصة بالبرنامج. اضبط حجم البكسل متحد البؤر على 50 × 50 نانومتر ، وحجم الصورة على 160 × 18 بكسل ، ووقت الإضاءة لكل بكسل على 0.2 مللي ثانية ، ومعدل الإطارات على 5 ثوان في لوحة Image Scan الخاصة بالبرنامج. اضبط التحكم في درجة الحرارة على 30 درجة مئوية في لوحة درجة الحرارة.
ملاحظة: بالإضافة إلى ذلك ، نوصي بتعيين أقصى سرعة للمرحلة (تستخدم للتنقل بين القنوات) إلى 0.2 مم / ثانية لتقليل تفكك CMG عن الحمض النووي بواسطة قوة السحب. - قم بتدفق جميع الحلول إلى خلية التدفق عند ضغط ثابت قدره 0.5 بار في منفذ الحقن (والذي يمكن إعداده في لوحة شريط الضغط الخاصة بالبرنامج). ثم قم بإيقاف تشغيل التدفق في القناتين 4 و 5. بعد تدفق جميع الحلول في البداية ، قلل الضغط إلى 0.2 بار.
- انقل ليزر الملائمة إلى القناة 1 حتى يتم التقاط حبة واحدة في كل مصيدة بصرية. انقل الخرز المحاصر إلى القناة 2 عن طريق تحريك عصا التحكم أثناء الضغط على الزناد. بعد ذلك ، قم بصيد مركب DNA: CMG عن طريق تحريك الخرزة اليمنى باتجاه الخرزة اليسرى وبعيدا عنها باستخدام عصا التحكم دون الضغط على الزناد ، حتى يتم احتجاز حبل الحمض النووي (وهو ما يعرف من خلال مراقبة منحنى تمديد القوة للحمض النوويالمحاصر 47 في لوحة FD Viewer للبرنامج).
- لربط الحمض النووي ، تأكد من إدخال طول الحمض النووي وقيمة درجة الحرارة الصحيحة في لوحة النموذج المرجعي ، والتي سترسم تلقائيا نموذج سلسلة نظرية قابلة للتوسيع تشبه الدودة لبناء الحمض النووي في لوحة FD Viewer. إذا تم القبض على جزيء DNA واحد بين الحبيبتين ، فيجب أن يتطابق سلوك تمديد القوة للحمض النووي بشكل وثيق مع نموذج السلسلة الشبيهة بالدودة القابلة للتوسيع. تأكد من أن هذا هو الحال من خلال مراقبة منحنى تمديد القوة التجريبي ، والذي سيرسمه البرنامج تلقائيا أعلى المنحنى النظري.
ملاحظة: يمكن أن تشير الانحرافات عن النموذج النظري إلى وجود جزيئات DNA متعددة مرتبطة بين الخرزات و / أو وجود مجاميع بروتينية مرتبطة بالحمض النووي وضغطه. لمنع تفكك البروتينات بوساطة القوة من الحمض النووي ، لا تتجاوز توتر 10 pN خلال هذا الاختبار الأولي.
- لربط الحمض النووي ، تأكد من إدخال طول الحمض النووي وقيمة درجة الحرارة الصحيحة في لوحة النموذج المرجعي ، والتي سترسم تلقائيا نموذج سلسلة نظرية قابلة للتوسيع تشبه الدودة لبناء الحمض النووي في لوحة FD Viewer. إذا تم القبض على جزيء DNA واحد بين الحبيبتين ، فيجب أن يتطابق سلوك تمديد القوة للحمض النووي بشكل وثيق مع نموذج السلسلة الشبيهة بالدودة القابلة للتوسيع. تأكد من أن هذا هو الحال من خلال مراقبة منحنى تمديد القوة التجريبي ، والذي سيرسمه البرنامج تلقائيا أعلى المنحنى النظري.
- انقل الخرزات إلى القناة 3 وأوقف التدفق على الفور في جميع القنوات. قم بإجراء مسح تجريبي أحادي الإطار في القناة 3 للتأكد من وجود CMG ، والإضاءة باستخدام ليزر 561 نانومتر بقوة 4 μW كما تم قياسه عند الهدف. اضبط قوى الليزر التصويرية في لوحة ليزر الإثارة. إذا كان موجودا ، فسيظهر CMG كبقع محدودة الحيود ثنائية الأبعاد كما هو موضح في الشكل 1G والشكل 2A.
- إذا لم يكن من الممكن اكتشاف الحمض النووي ، فتحقق من القناة 2 بحثا عن الفقاعات ، والتي يمكن أن تبطئ التدفق في القناة 2 (مقارنة بالقناتين 1 و 3). في حالة وجود فقاعات ، قم بزيادة الضغط في القناة من 2 إلى 1 بار لمحاولة طرد الفقاعات من خلالها.
- إذا كان CMG موجودا ، انقل حبل الحمض النووي إلى القناة 4 أو 5 للتصوير ؛ خلاف ذلك ، أعد تشغيل التدفق ، وتجاهل الخرزات ، وارجع إلى الخطوة 2.2.4.
- في القنوات 4 أو 5 ، اضبط المسافة بين الخرزات لتحقيق توتر أولي قدره 2 pN في حبل الحمض النووي. لهذا ، أدخل 2 pN في لوحة التحليل الطيفي للقوة وانقر على زر تمكين لبدء مشبك القوة. بمجرد أن يصل التوتر الأولي إلى 2 pN ، قم بتعطيل مشبك القوة قبل التصوير بالنقر فوق الزر تمكين في لوحة Force Spectroscopy.
- صورة CMGCdc45-LD555 كل 5 ثوان باستخدام ليزر 561 نانومتر بقوة 4 μW كما تم قياسه عند الهدف (الشكل 1F). لهذا ، انقر فوق الزر "بدء المسح" في لوحة مسح الصور. في مثل هذه الفحوصات ، سيظهر CMG كنقاط محدودة الحيود ثنائية الأبعاد ، مثل المثال في الشكل 1G.
- إذا لوحظ CMG ولكن لا يبدو أنه يتحرك قبل التبييض ، فاختبر جميع البروتينات المستخدمة في نشاط النيوكلياز ، لأن الشقوق الموجودة على الحمض النووي ستتسبب في انفصال CMG عن DNA41 ، مما يقلل بشدة من عمليته الظاهرة.
ملاحظة: يجب أن تعطي طاقة الليزر البالغة 4 μW نتائج متسقة في حالة استخدام المجهر التجاري المستخدم هنا. إذا كنت تستخدم إعداد بناء منزلي ، فإننا نوصي بتقدير طاقة الليزر المثلى تجريبيا. يجب أن تعطي طاقة الليزر المثلى إشارة كافية من الفلوروفور لتوطينها بالدقة المطلوبة ، وعمر فلوروفور قريب من النطاق الزمني المطلوب للتجربة.
ملاحظة: على الرغم من أن هذا المنشور يركز على المجموعة الهجينة ومقايسة الجزيء الواحد ، فقد نشرنا سابقا وصفا شاملا لتحليل البيانات التي تم إنشاؤها باستخدام هذا الفحص48.
- إذا لوحظ CMG ولكن لا يبدو أنه يتحرك قبل التبييض ، فاختبر جميع البروتينات المستخدمة في نشاط النيوكلياز ، لأن الشقوق الموجودة على الحمض النووي ستتسبب في انفصال CMG عن DNA41 ، مما يقلل بشدة من عمليته الظاهرة.
- استخدم المداخل الخمسة في الإعداد التجاري على النحو التالي: حقن القنوات 1-3 من اليسار واستخدامها لمحاصرة الخرز (القناة 1) ، وربط مجمع بروتين الحمض النووي (القناة 2) ، والتحقق من وجود CMG (القناة 3). استخدم القناتين 4 و 5 كخزانات بروتين ومواقع تبادل عازلة. قبل كل تجربة ، تخميل خلية تدفق الموائع الدقيقة لمدة 30 دقيقة على الأقل مع 1 ملغ / مل من ألبومين مصل الأبقار ، متبوعا بنسبة 0.5٪ Pluronic F-127 المذاب في ماء فائق النقاء.
النتائج
عند تنفيذه بشكل صحيح ، يجب أن ينتج البروتوكول الموصوف هنا مجمعات DNA: CMG خالية من المجموع تقريبا. يجب ألا يؤدي التفاعل الخالي من التجميع إلى انسداد أي من القنوات في خلية تدفق الموائع الدقيقة ، ويجب أن يكون من الممكن تمديد جزيئات الحمض النووي المحاصرة إلى امتداد من طرف إلى طرف في حدود 10٪ من طول كفافها دون كسر الحمض النووي. على العكس من ذلك ، إذا كان هناك تجمع في التفاعل ، فقد تصبح جزيئات الحمض النووي مضغوطة في بعض الأحيان بواسطة الركام ، وغالبا ما تسبب تكسر الحمض النووي إذا تمددت. طريقة جيدة للتعرف على مجاميع البروتين هي من خلال النظر في مسح 2D للحمض النووي. في تفاعل خال من التجميع، يظهر CMG كبقع منفصلة ومتماثلة محدودة الحيود تزدحم قليلا بالحمض النووي، مثل تلك الموجودة في عمليات المسح الموضحة في الشكل 2 أ. على العكس من ذلك ، فإن المجاميع أقل تميزا ، وأحيانا تكون النقط غير المتماثلة تزدحم بطول أكبر من الحمض النووي ، مثل تلك الموجودة في عمليات المسح الموضحة في الشكل 2 ب. علاوة على ذلك ، إذا تم تنفيذ الفحص بنجاح ، وتم تحقيق نقاء عال للبروتينات المنقاة ، فستظهر حركة طويلة المدى ل CMG في وجود ATP ، كما لوحظ في الكيموغراف الموضح في الشكل 2C.
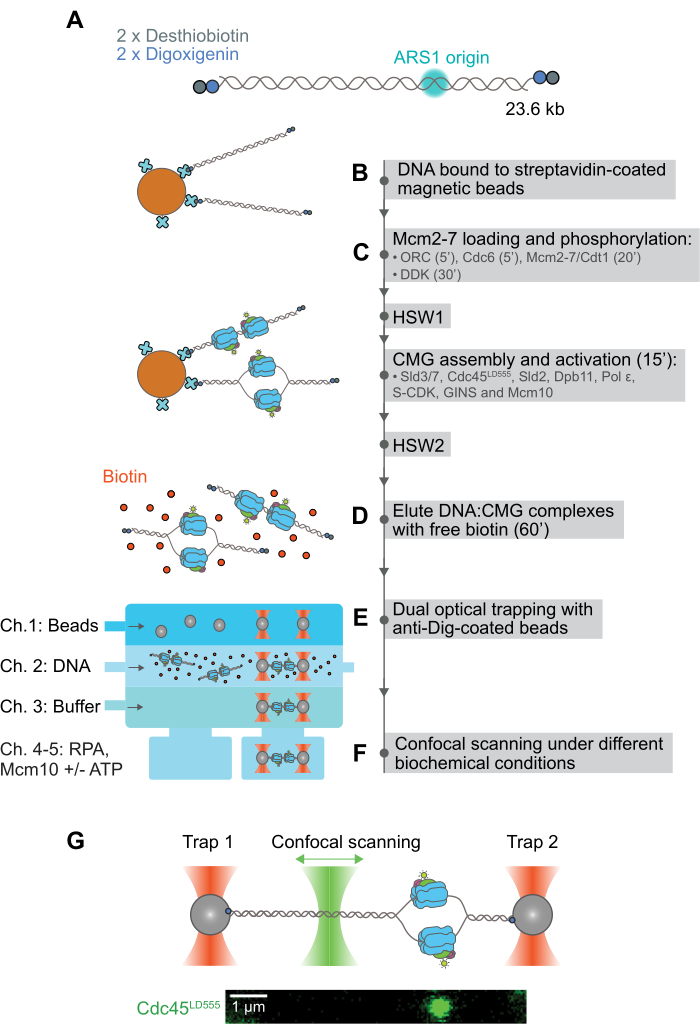
الشكل 1: وصف تصويري للمجموعة الهجينة ومقايسة الجزيء الواحد لتصوير وتحديد حركة CMG المعاد تكوينها بالكامل. (أ) الحمض النووي الخطي 23.6 kb الذي يحتوي على أصل ARS1 للتكرار يحدث بشكل طبيعي يعمل بشكل مضاعف في كلا الطرفين مع شقوق desthiobiotin و digoxigenin. (ب) يرتبط الحمض النووي (DNA) الذي يعمل بوظيفة مضاعفة بالحبيبات المغناطيسية المغلفة بالستربتافيدين من خلال شقوق ديسثيوبيوتين. (ج) يتم تجميع CMG وتنشيطه تدريجيا على الحمض النووي المرتبط بالخرز المغناطيسي مع تضمين خطوات غسيل مختلفة لإزالة البروتين الزائد غير المرتبط وركام البروتين. (د) الحمض النووي السليم: ثم يتم استخلاص معقدات CMG من الخرز المغناطيسي عن طريق إضافة فائض من البيوتين الحر ، والذي يتفوق على تفاعل ديسثيوبيوتين والستربتافيدين. (ه) الحمض النووي الفردي: ترتبط معقدات CMG بين حبتين من البوليسترين المغلفة بالديجوكسيجينين المحاصرة بصريا بمساعدة خلية تدفق الموائع الدقيقة. لاحظ أن تفاعل Dig-anti-Dig متعامد مع تفاعلات البيوتين وأفيدين ، لذلك لا يتأثر بوجود البيوتين الحر. (F) بمجرد تثبيتها في مكانها بواسطة الملقط البصري ، يتم نقل معقدات DNA: CMG إلى ظروف عازلة مختلفة ، حيث يتم بعد ذلك مسح مستوى الحمض النووي باستخدام ليزر مسح متحد البؤر لتصوير حركة CMG على طول الحمض النووي بمرور الوقت. (G) تظهر اللوحة العلوية رسما تخطيطيا لمركب DNA: CMG مثبت في مكانه بين حبتين من البوليسترين المحاصرتين بصريا مضادتين للحفر يتم مسحهما ضوئيا بواسطة ليزر مسح متحد البؤر. تظهر اللوحة السفلية مثالا على مسح 2D ل CMG مرتبطا بالحمض النووي الموجود في مكانه باستخدام مصيدة بصرية. الحمض النووي غير مسمى في هذه التجارب ، ولكن يمكن اعتباره خطا أفقيا يمر عبر منتصف الصورة. وقد عدل هذا الرقم من28. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
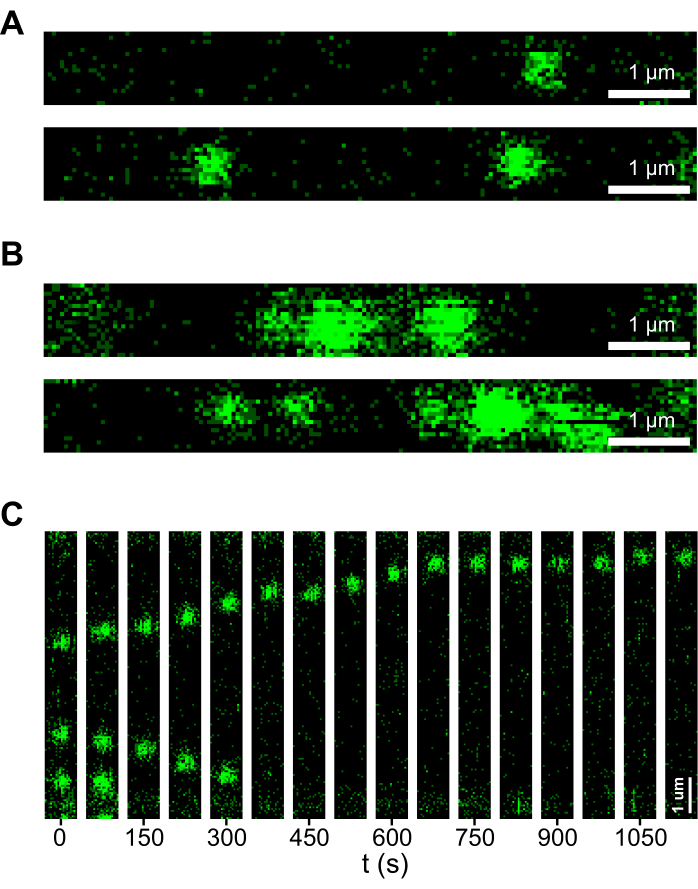
الشكل 2: أمثلة على بيانات من تجربة ناجحة وغير ناجحة. (أ) مثال المسح الضوئي 2D لحمض نووي يحتوي على CMG في عينة خالية من التجميع. في كلا المسحين ، يظهر CMG بقعا متناظرة ومنفصلة محدودة الحيود موزعة بشكل ضئيل على طول الحمض النووي. (ب) مثال المسح الضوئي 2D لحمض نووي يحتوي على CMG في عينة تحتوي على مجاميع. في كلا المسحين ، يشكل CMG نقاطا أقل تناسقا تزدحم بالحمض النووي. (ج) الكيموغراف يوضح موضع بقع حيود CMG المحدودة على الحمض النووي (DNA) بمرور الزمن في وجود الأدينوسين الثلاثي الفوسفات (ATP)، ويوضح الحركة بعيدة المدى لمعقدات CMG. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
خطوات حاسمة وفحوصات جودة الكاشف المهمة
يتم تسليط الضوء على الخطوات الحاسمة وفحوصات جودة الكواشف البيولوجية في الفحص هنا. أولا ، نقاء البروتينات المستخدمة مهم لأن تدهور الحمض النووي الناجم حتى عن ملوثات النيوكلياز الصغيرة في عينات البروتين سيؤثر سلبا على البيانات. وذلك لأن جزيئات الحمض النووي السليمة (أو المشقوقة جزئيا) فقط هي التي يمكن أن تكون محاصرة في الملقط البصري ثنائي الحزمة. والأهم من ذلك ، أن الشقوق الموجودة على الحمض النووي ستؤدي إلى فصل CMGعن 41 ، مما يعقد مراقبة حركة CMG بعيدة المدى. نوصي بشدة باختبار كل بروتين منقى لنشاط النيوكلياز ، بالإضافة إلى المراقبة المستمرة لسلامة ركيزة البلازميد الأولية لضمان تقليل النك إلى الحد الأدنى. الخطوة الثانية المهمة هي الإزالة الدقيقة للخرز المغناطيسي بعد شطف مجمعات DNA: CMG. يجب إجراء إزالة الطافات في هذه الخطوة ببطء حتى لا تزعج الخرز الذي تم جمعه. إذا تركت حبات مغناطيسية في العينة المنقولة إلى الملقط البصري ، فغالبا ما تصطدم بخرز البوليسترين المحبوس بصريا ، مما يتسبب في هروبها من المصيدة الضوئية وتعقيد عملية الحصول على البيانات. أخيرا ، يجب التعامل مع مجمعات DNA: CMG بعناية في الملقط البصري. تحقيقا لهذه الغاية ، نوصي بعدم زيادة توتر الحمض النووي فوق 10 pN ، لأن تطبيق القوة قد يفصل CMG عن الحمض النووي. علاوة على ذلك ، يجب أن يتم التنقل بين القنوات في خلية تدفق الموائع الدقيقة ببطء قدر الإمكان (~ 0.2 مم / ثانية) لمنع قوى السحب الناتجة من فصل CMG عن الحمض النووي.
تعديلات على الطريقة
هناك عدة خطوات للفحص يمكن تعديلها. على سبيل المثال ، أظهرنا أنه يمكن تقليل وقت الشطف من 60 دقيقة إلى 30 دقيقة دون التأثير بشكل كبير على عائد الشطف. بالإضافة إلى ذلك ، نوصي باستكمال المخزن المؤقت للشطف بتركيز منخفض (أقل من 1 مللي مول) من ATP أو ATPγS لمنع CMG من الانتشار خارج نهايات الحمض النووي وكذلك لتثبيت CMG28 بشكل عام. علاوة على ذلك ، على الرغم من أن التركيبات العازلة وتركيزات البروتين التي نبلغها هنا تستند إلى تلك المستخدمة في العمل الكيميائي الحيوي وأحادي الجزيء السابق11,18 ، فإن الفحص الذي نصفه متوافق تماما مع البروتوكولات الأخرى لتجميع CMG 26,27. لذلك ، فإن أي تقدم كيميائي حيوي تم الإبلاغ عنه لزيادة كفاءة تجميع CMG أو تنشيطه يمكن ويجب تنفيذه في الجزء الأكبر من الفحص لزيادة المحصول. أخيرا ، تؤدي زيادة الوقت بين الإطارات إلى زيادة الوقت الإجمالي الذي يمكن فيه تصوير CMG ، مما يسهل مراقبة حركة CMG بعيدة المدى قبل تبييض الفلوروفور.
حدود الطريقة
الطريقة الهجينة التي نصفها محدودة حيث يمكن للمرء فقط تصوير CMG بعد تنشيطه بكميات كبيرة. ستكون هناك حاجة إلى مزيد من العمل لمراقبة تنشيط CMG في الوقت الفعلي. هناك قيد مهم آخر وهو أنه بينما نتوقع تجميع CMG في أزواج17،26،27 ، فإن العدد الإجمالي لمجمعات CMG لكل حمض نووي نلاحظه هو في الغالبواحد 28 ، مما يشير إلى أن CMG ، أو على الأقل Cdc45 ينفصل عن الحمض النووي أثناء التعامل مع مجمعات الحمض النووي الحساسة: CMG. إن تقليل عدد خطوات المناولة قبل التصوير أحادي الجزيء ، بالإضافة إلى تطوير استراتيجيات تخميل أفضل للأنابيب البلاستيكية وزجاج خلية تدفق الموائع الدقيقة مهيأة لزيادة هذا العائد.
أهمية الطريقة
استخدمت دراسات الحركة أحادية الجزيء ل CMG حتى الآن CMG المنشط مسبقا المنقى كمركب من الخلايا. على الرغم من أنه أبسط نسبيا ، إلا أن نهج CMG الذي تم تنشيطه مسبقا محدود من حيث أنه يفتقد أيا من الخطوات التي تؤدي إلى تنشيط CMG ، بالإضافة إلى الطبيعة ثنائية الاتجاه ل CMG والحركة الاستجابية. من ناحية أخرى ، فإن إعادة التكوين الكامل لتجميع وتنشيط CMG لديه القدرة على دراسة أي خطوات ما قبل التنشيط ، وكذلك دراسة حركة CMG بطريقة ثنائية الاتجاه. ومع ذلك ، يصعب ترجمة هذا النهج من المستوى الكيميائي الحيوي السائب إلى مستوى الجزيء الواحد ، لأنه ينطوي على الكثير من عوامل وخطوات البروتين النقي. ساعد الفحص الذي نصفه هنا في التغلب على هذه التحديات من خلال السماح لنا بتصوير حركة CMG المعاد تشكيلها بالكامل على مستوى الجزيء الواحد ، مما يسمح لنا بالوصول إلى بعض ديناميكيات ما قبل التنشيط المفقودةسابقا 28. بالإضافة إلى ذلك ، على الرغم من أننا نرى في الغالب CMG واحدا لكل حمض نووي ، فقد تمكنا من ملاحظة عدة حالات لمركبين CMG يتحركان في اتجاهين متعاكسين ، ويمكننا حتى التقاط الفصل الأولي ل CMGs الشقيقة عن بعضهاالبعض 28 ، مما يوفر بعض الأفكار حول إنشاء النسخ المتماثل ثنائي الاتجاه.
ميزة أخرى لهذا الفحص مقارنة بحركة CMG السابقة تكمن في الطبيعة المزدوجة تماما لركيزة الحمض النووي التي نستخدمها (الشكل 1 أ). في أعمال CMG السابقة التي تم تنشيطها مسبقا ، كانت الطريقة الأكثر شيوعا لربط CMG بركيزة الحمض النووي هي من خلال رفرف ssDNA مقاس 3 بوصات. ينتج عن هذا بناء الحمض النووي الذي لا يمكن تقييده بسهولة من الناحية الالتوائية وبالتالي يحظر دراسة دور اللف الفائق في التقدم الاستجابي. وعلى العكس من ذلك، يمكن أن يكون للطريقة الجديدة التي نصفها هنا إمكانية التكيف لدراسة دور عزم الدوران في هذه العملية؛ لأن ركيزة الحمض النووي المستخدمة مزدوجة الشريط تماما.
تطبيقات أوسع للطريقة
سيمهد الفحص الهجين الموصوف الطريق نحو إعادة التكوين الكامل ل repplisome حقيقي النواة الكامل ، مما يسمح لنا وللآخرين بمراقبة وتحديد الديناميكيات المهمة التي تسمح للرد بالنجاح في جميع مهامه المختلفة. بغض النظر عن تكرار الحمض النووي ، يمثل الفحص الذي نبلغه تقدما مهما في ترجمة تفاعل كيميائي حيوي معقد من الكيمياء الحيوية السائبة إلى مستوى الجزيء الواحد. نتوقع أن هذا الاختبار يمكن تعديله بسهولة لدراسة تفاعلات الحمض النووي المعقدة المماثلة: البروتين المشاركة في آليات معالجة الحمض النووي المختلفة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يشكر المؤلفون آن إيرلي ولوسي دروري وماكس دوغلاس على توفير سلالات الخميرة للإفراط في التعبير عن البروتينات غير المسماة ، بالإضافة إلى أعضاء مختبر N.D. أنوج كومار وكاتينكا ليجثارت وجوليان جروس لمساعدتهم في تنقية عوامل التحميل و DDK. يشكر المؤلفون أيضا كالي مكلوسكي ، ودوريان ميكولاجزاك ، وجوزيف ييليس ، وجاكوب لويس ، وأليساندرو كوستا ، وحسن يارديمسي ، وتايكجيب ها على المناقشات العلمية المفيدة. تعترف D.R.M. بالتمويل المقدم من زمالة بوهرنجر إنجلهايم فوندز للدكتوراه. تقر N.D. بالتمويل من المنظمة الهولندية للبحث العلمي (NWO) من خلال منحة Top 714.017.002 ومن مجلس البحوث الأوروبي من خلال منحة متقدمة (REPLICHROMA ؛ رقم المنحة 789267).
Materials
| Name | Company | Catalog Number | Comments |
| AflII | NEB | R0520L | |
| Anti-digoxigenin coated polystyrene beads | Spheroteck | DIGP-20-2 | |
| ATP solution | Thermo Fisher | R0441 | |
| ATPγS | Roche | 11162306001 | |
| BSA | NEB | B9000S | |
| C-Trap | Lumicks | ||
| CutSmart Buffer | NEB | B6004S | Provided with AflII |
| dCTP | Promega | U122B | |
| D-Desthiobiotin-7-dATP | Jena Bioscience | NU-835-Desthiobio | |
| dGTP | Thermo Fisher | 10218014 | |
| Digoxigenin-11-dUTP | Jena Bioscience | NU-803-DIGXL | |
| Dynabeads M-280 Streptavidin magnetic beads | Invitrogen | 11205D | |
| Klenow Fragment (3'→5' exo-) | NEB | M0212L | |
| Microspin S-400 HR spin columns | GE Healthcare | GE27-5140-01 | |
| NEBuffer2 | NEB | B7002S | Provided with Klenow Fragment |
| Nonidet P 40 Substitute | Sigma | 74385 | |
| Pluronic F-127 | Sigma | P2443 |
References
- Bell, S. P., Labib, K. Chromosome duplication in Saccharomyces cerevisiae. Genetics. 203 (3), 1027-1067 (2016).
- Burnham, D. R., Kose, H. B., Hoyle, R. B., Yardimci, H. The mechanism of DNA unwinding by the eukaryotic replicative helicase. Nat Commun. 10 (1), 1-14 (2019).
- Ticau, S., Friedman, L. J., Ivica, N. A., Gelles, J., Bell, S. P. Single-molecule studies of origin licensing reveal mechanisms ensuring bidirectional helicase loading. Cell. 161 (3), 513-525 (2015).
- Ticau, S., et al. Mechanism and timing of Mcm2-7 ring closure during DNA replication origin licensing. Nat Str Mol Biol. 24 (3), 309-315 (2017).
- Gupta, S., Friedman, L. J., Gelles, J., Bell, S. P. A helicase- tethered ORC flip enables bidirectional helicase loading. eLife. 10, e74282 (2021).
- Lewis, J. S., et al. Single-molecule visualization of Saccharomyces cerevisiae leading-strand synthesis reveals dynamic interaction between MTC and the replisome. Proc Natl Acad Sci U S A. 114 (40), 10630-10635 (2017).
- Dulin, D., Berghuis, B. A., Depken, M., Dekker, N. H. Untangling reaction pathways through modern approaches to high-throughput single-molecule force-spectroscopy experiments. Curr Opinion Str Biol. 34, 116-122 (2015).
- Lewis, J. S., van Oijen, A. M., Spenkelink, L. M. Embracing heterogeneity: Challenging the paradigm of replisomes as deterministic machines. Chem Rev. 123 (23), 13419-13440 (2023).
- Abbondanzieri, E. A., Greenleaf, W. J., Shaevitz, J. W., Landick, R., Block, S. M. Direct observation of base-pair stepping by RNA polymerase. Nature. 438 (7067), 460-465 (2005).
- Yeeles, J. T. P., Deegan, T. D., Janska, A., Early, A., Diffley, J. F. X. Regulated eukaryotic DNA replication origin firing with purified proteins. Nature. 519 (7544), 431-435 (2015).
- Douglas, M. E., Ali, F. A., Costa, A., Diffley, J. F. X. The mechanism of eukaryotic CMG helicase activation. Nature. 555 (7695), 265-268 (2018).
- Remus, D., et al. Concerted loading of Mcm2-7 double hexamers around DNA during DNA replication origin licensing. Cell. 139 (4), 719-730 (2009).
- Frigola, J., Remus, D., Mehanna, A., Diffley, J. F. X. ATPase-dependent quality control of DNA replication origin licensing. Nature. 495 (7441), 339-343 (2013).
- Coster, G., Frigola, J., Beuron, F., Morris, E. P., Diffley, J. F. X. Origin licensing requires ATP binding and hydrolysis by the MCM replicative helicase. Mol Cell. 55 (5), 666-677 (2014).
- Coster, G., Diffley, J. F. X. Bidirectional eukaryotic DNA replication is established by quasi-symmetrical helicase loading. Science. 357 (6348), 314-318 (2017).
- Miller, T. C. R., Locke, J., Greiwe, J. F., Diffley, J. F. X., Costa, A. Mechanism of head-to-head MCM double-hexamer formation revealed by cryo-EM. Nature. 575 (7784), 704-710 (2019).
- Abid Ali, F., et al. Cryo-EM structure of a licensed DNA replication origin. Nat Commun. 8 (1), 1-10 (2017).
- Sánchez, H., et al. DNA replication origins retain mobile licensing proteins. Nat Commun. 12 (1), 1908 (2021).
- Ilves, I., Petojevic, T., Pesavento, J. J., Botchan, M. R. Activation of the MCM2-7 helicase by association with Cdc45 and GINS proteins. Mol Cell. 37 (2), 247-258 (2010).
- Moyer, S. E., Lewis, P. W., Botchan, M. R. Isolation of the Cdc45/Mcm2-7/GINS (CMG) complex, a candidate for the eukaryotic DNA replication fork helicase. Proc Natl Acad Sci U S A. 103 (27), 10236-10241 (2006).
- Langston, L. D., et al. CMG helicase and DNA polymerase ε form a functional 15-subunit holoenzyme for eukaryotic leading-strand DNA replication. Proc Natl Acad Sci U S A. 111 (43), 15390-15395 (2014).
- Sheu, Y. J., Stillman, B. Cdc7-Dbf4 phosphorylates MCM proteins via a docking site-mediated mechanism to promote S phase progression. Mol Cell. 24 (1), 101-113 (2006).
- Sheu, Y. J., Stillman, B. The Dbf4-Cdc7 kinase promotes S phase by alleviating an inhibitory activity in Mcm4. Nature. 463 (7277), 113-117 (2010).
- Randell, J. C. W., et al. Mec1 is one of multiple kinases that prime the Mcm2-7 helicase for phosphorylation by Cdc7. Mol Cell. 40 (3), 353-363 (2010).
- Greiwe, J. F., et al. Structural mechanism for the selective phosphorylation of DNA-loaded MCM double hexamers by the Dbf4-dependent kinase. Nat Str Mol Biol. 29 (1), 10-20 (2021).
- de Jesús-Kim, L., Friedman, L. J., Ramsoomair, C., Gelles, J., Bell, S. P. DDK regulates replication initiation by controlling the multiplicity of Cdc45-GINS binding to Mcm2-7. eLife. 10, 65471 (2021).
- Lewis, J. S., et al. Mechanism of replication origin melting nucleated by CMG helicase assembly. Nature. 606 (7916), 1007-1014 (2022).
- Ramírez Montero, D., et al. Nucleotide binding halts diffusion of the eukaryotic replicative helicase during activation. Nat Commun. 14 (1), 2082 (2023).
- Kose, H. B., Larsen, N. B., Duxin, J. P., Yardimci, H. Dynamics of the eukaryotic replicative helicase at lagging-strand protein barriers support the steric exclusion model. Cell Rep. 26 (8), 2113-2125 (2019).
- Lewis, J. S., et al. Single-molecule visualization of Saccharomyces cerevisiae leading-strand synthesis reveals dynamic interaction between MTC and the replisome. Proc Natl Acad Sci U S A. 114 (40), 10630-10635 (2017).
- Lewis, J. S., et al. Tunability of DNA polymerase stability during eukaryotic DNA replication. Mol Cell. 77, 1-9 (2020).
- Schauer, G. D., et al. Replisome bypass of a protein-based R-loop block by Pif1. Proc Natl Acad Sci U S A. 117 (48), 30354-30361 (2020).
- Wasserman, M. R., Schauer, G. D., O'Donnell, M. E., Liu, S. Replication fork activation is enabled by a single-stranded DNA gate in CMG helicase. Cell. 178 (3), 600-611 (2019).
- Kose, H. B., Xie, S., Cameron, G., Strycharska, M. S., Yardimci, H. Duplex DNA engagement and RPA oppositely regulate the DNA-unwinding rate of CMG helicase. Nat Commun. 11 (1), 1-15 (2020).
- White, D. S., Smith, M. A., Chanda, B., Goldsmith, R. H. Strategies for overcoming the single-molecule concentration barrier. ACS Meas Sci Au. 3 (4), 239-257 (2023).
- Liachko, I., et al. A comprehensive genome-wide map of autonomously replicating sequences in a naive genome. PLoS Genet. 6 (5), 22 (2010).
- Kapadia, N., et al. Processive activity of replicative DNA polymerases in the replisome of live eukaryotic cells. Mol Cell. 80 (1), 114-126 (2020).
- Claussin, C., Vazquez, J., Whitehouse, I. Single-molecule mapping of replisome progression. Mol Cell. 82 (7), 1372-1382 (2022).
- Polo Rivera, C., Deegan, T. D. Replicon-seq: seeing is believing. Trends Genet. 38 (10), 987-988 (2022).
- Sparks, J. L., et al. The CMG helicase bypasses DNA-protein cross-links to facilitate their repair. Cell. 176 (1-2), 167-181 (2019).
- Vrtis, K. B., et al. Single-strand DNA breaks cause replisome disassembly. Mol Cell. 81 (6), 1309-1318 (2021).
- Low, E., Chistol, G., Zaher, M. S., Kochenova, O. V., Walter, J. C. The DNA replication fork suppresses CMG unloading from chromatin before termination. Genes Dev. 34 (21), 1534-1545 (2020).
- Parker, M. W., et al. A new class of disordered elements controls DNA replication through initiator self-assembly. eLife. 8, 1-35 (2019).
- Hirsch, J. D., et al. Easily reversible desthiobiotin binding to streptavidin, avidin, and other biotin-binding proteins: Uses for protein labeling, detection, and isolation. Anal Biochem. 308 (2), 343-357 (2002).
- Candelli, A., Wuite, G. J. L., Peterman, E. J. G. Combining optical trapping, fluorescence microscopy and micro-fluidics for single molecule studies of DNA-protein interactions. Phys Chem Chem Phys. 13 (16), 7263-7272 (2011).
- Candelli, A., et al. Visualization and quantification of nascent RAD51 filament formation at single-monomer resolution. Proc Natl Acad Sci U S A. 111 (42), 15090-15095 (2014).
- Bustamante, C., Marko, J. F., Siggia, E. D., Smith, S. Entropic elasticity of lambda-phage DNA. Science. 265 (5178), 1599-1600 (1994).
- Liu, Z., et al. A biophysics toolbox for reliable data acquisition and processing in integrated force-confocal fluorescence microscopy. ACS Photonics. 11 (4), 1592-1603 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved