6.6 : 焓值
化学家通常使用称为焓( H )的属性来描述化学过程和物理过程的热力学。焓定义为系统内部能量( E )与其压力( P )和体积( V 的数学乘积之和>):
焓是一种状态函数。特定物质的焓值不能直接测量;只能确定化学或物理过程的焓变。对于在恒定压力(许多化学和物理变化的常见条件)下发生的过程,焓变(Δ H )为:
数学乘积 P Δ V 表示功( w ),即膨胀或压力-体积功。按照它们的定义,< V 和w的算术符号将始终相反:
代入该方程式和恒定压力下内能的定义(Δ E = q p + w )到焓变方程中得出:
其中 q p 是在恒定压力下的反应热。
因此,如果化学或物理过程是在恒定压力下进行的,而唯一的功是由膨胀或收缩引起的( PV 功),则热流( q < / em> p )和该过程的焓变(Δ H )相等。
运行本生灯时散发的热量等于发生的甲烷燃烧反应的焓变,因为它发生在基本恒定的大气压下。化学家通常在正常大气条件下,恒定外压和 q p =&Delta; H 的条件下进行实验,这使焓成为最方便的选择确定化学反应的热变化。
焓变的负值&lt; H &lt; 0表示放热反应(热量散发到周围环境);正值&lt; H &gt; 0表示吸热反应(从周围环境吸收的热量)。如果化学方程式的方向相反,则其 H 的算术符号会更改(在一个方向上吸热的过程在相反方向上放热)。
从概念上讲,Δ E (热量和功的度量)和Δ H (恒定压力下的热量的度量)都表示状态函数的变化对于系统。在体积变化的过程中,Δ V 小(冰融化),而Δ E 和Δ H 相同。但是,如果体积变化很大(水蒸发),则作为功率传递的能量将很大。因此,&lt; E 和&Delta; H 的值明显不同。
本文改编自 Openstax,化学2e,第5.3节:焓。 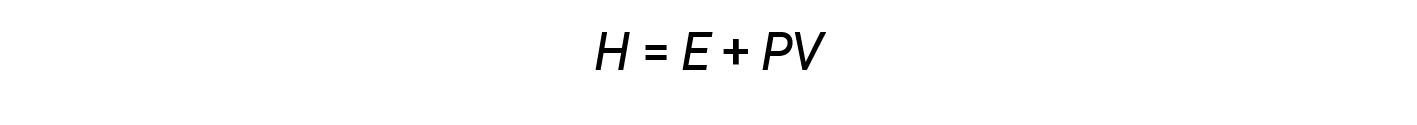
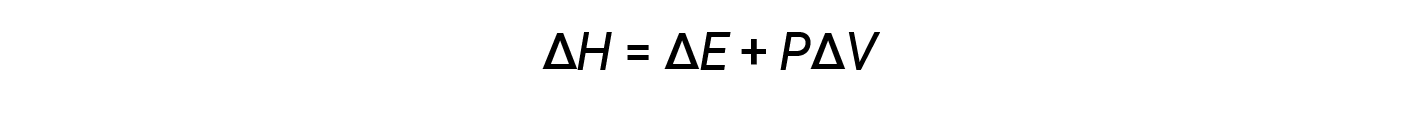
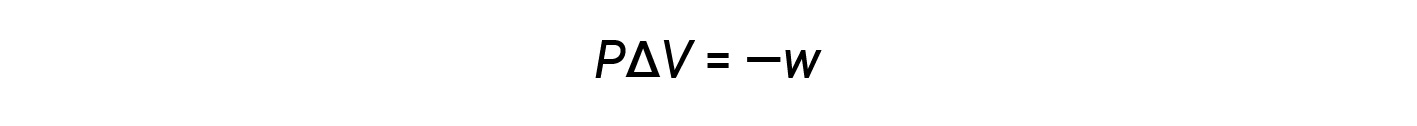
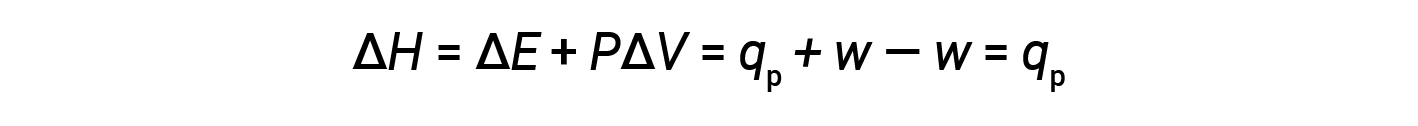
来自章节 6:

Now Playing
6.6 : 焓值
热化学
34.7K Views

6.1 : 能源基础
热化学
36.8K Views

6.2 : 热力学第一定律
热化学
31.4K Views

6.3 : 内能
热化学
28.7K Views

6.4 : 量化热量
热化学
53.8K Views

6.5 : 量化做功
热化学
19.0K Views

6.7 : 热化学方程
热化学
28.1K Views

6.8 : 恒压量热法
热化学
84.5K Views

6.9 : 定容量热法
热化学
26.8K Views

6.10 : 赫斯定律
热化学
44.3K Views

6.11 : 标准生成焓
热化学
40.9K Views

6.12 : 反应焓
热化学
31.4K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。