6.6 : Entalpia
Os químicos usam normalmente uma propriedade conhecida como entalpia (H) para descrever a termodinâmica de processos químicos e físicos. A entalpia é definida como a soma da energia interna de um sistema (E) e do produto matemático da sua pressão (P) e volume (V):
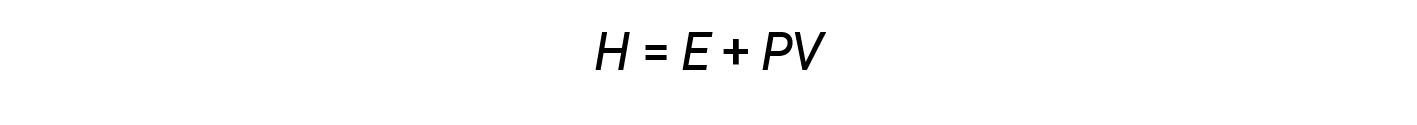
A entalpia é uma função de estado. Os valores de entalpia para substâncias específicas não podem ser medidos diretamente; só podem ser determinadas alterações de entalpia para processos químicos ou físicos. Para os processos que ocorrem a uma pressão constante (uma condição comum para muitas alterações químicas e físicas), a alteração da entalpia (ΔH) é:
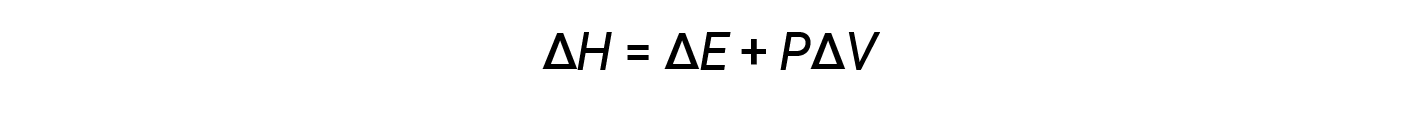
O produto matemático PΔV representa trabalho (w), nomeadamente trabalho de expansão ou de pressão-volume. Pelas suas definições, os sinais aritméticos de ΔV e w serão sempre opostos:
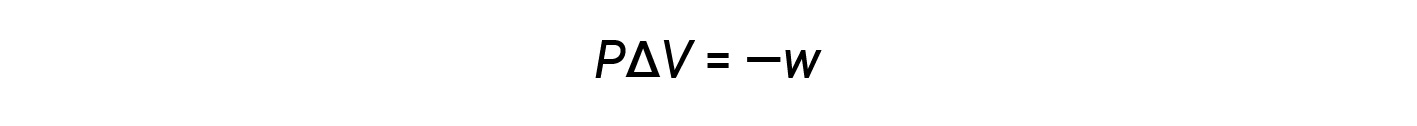
Substituindo esta equação e a definição de energia interna a uma pressão constante (ΔE = qp + w) na equação da alteração de entalpia obtemos:
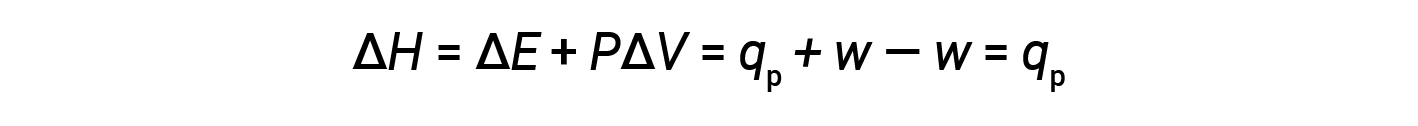
onde qp é o calor da reação sob condições de pressão constante.
Portanto, se um processo químico ou físico for realizado a uma pressão constante com o único trabalho feito por expansão ou contração (trabalho de P-V), então o fluxo de calor (qp) e a alteração de entalpia (ΔH) para o processo são iguais.
O calor fornecido ao operar um bico de Bunsen é igual à alteração de entalpia da reação de combustão do metano que ocorre uma vez que ocorre à pressão essencialmente constante da atmosfera. Os químicos geralmente realizam experiências em condições atmosféricas normais, a uma pressão externa constante com qp = ΔH, o que faz da entalpia a escolha mais conveniente para determinar as alterações de calor para reações químicas.
Um valor negativo de uma alteração da entalpia, ΔH < 0, indica uma reação exotérmica (calor fornecido às imediações); um valor positivo, ΔH > 0, indica uma reação endotérmica (calor absorvido das imediações). Se a direção de uma equação química for invertida, o sinal aritmético da sua ΔH é alterado (um processo que é endotérmico em uma direção é exotérmico na direção oposta).
Conceitualmente, ΔE (uma medida de calor e trabalho) e ΔH (uma medida de calor a uma pressão constante) representam alterações em função do estado do sistema. Em processos onde a alteração de volume, ΔV, é pequena (gelo a derreter), ΔE e ΔH são idênticos. No entanto, se a alteração de volume for significativa (evaporação da água), a quantidade de energia transferida como trabalho será significativa; assim, ΔE e ΔH têm valores significativamente diferentes.
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.3: Enthalpy.
Do Capítulo 6:

Now Playing
6.6 : Entalpia
Termoquímica
34.7K Visualizações

6.1 : Princípios Básicos de Energia
Termoquímica
37.0K Visualizações

6.2 : Primeira Lei da Termodinâmica
Termoquímica
31.5K Visualizações

6.3 : Energia Interna
Termoquímica
28.8K Visualizações

6.4 : Quantificação do Calor
Termoquímica
53.8K Visualizações

6.5 : Quantificação do Trabalho
Termoquímica
19.0K Visualizações

6.7 : Equações Termoquímicas
Termoquímica
28.2K Visualizações

6.8 : Calorimetria de Pressão Constante
Termoquímica
84.6K Visualizações

6.9 : Calorimetria de Volume Constante
Termoquímica
26.8K Visualizações

6.10 : Lei de Hess
Termoquímica
44.4K Visualizações

6.11 : Entalpia de Formação Padrão
Termoquímica
41.0K Visualizações

6.12 : Entalpias de Reações
Termoquímica
31.5K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados