6.10 : 赫斯定律
有两种方法可以确定化学变化所涉及的热量:通过实验进行测量,或者根据其他通过实验确定的焓变化进行计算。有些反应很难甚至不可能进行调查,以进行准确的实验测量。而且即使在不难进行或测量反应的情况下,也可以方便地确定反应中涉及的热量而无需进行实验。
这种类型的计算通常涉及使用赫斯定律(Hess's Law),该定律指出:如果一个过程可以写为几个逐步过程的总和,则总过程的焓变等于该过程的焓变总和。各个步骤。赫斯定律是有效的,因为焓是一种状态函数:焓的变化仅取决于化学过程的开始和结束位置,而不取决于化学过程从头到尾的过程。例如,碳与氧的反应形成二氧化碳的反应直接发生或通过两步过程发生。直接过程写为:
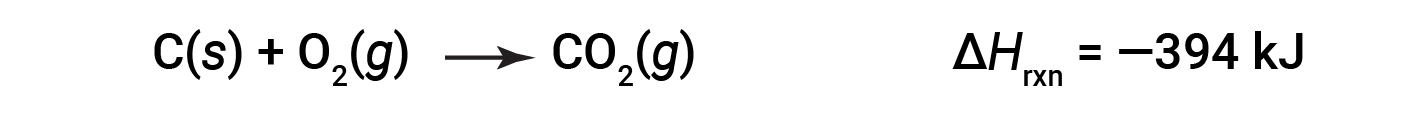
在两步过程中,首先形成一氧化碳:
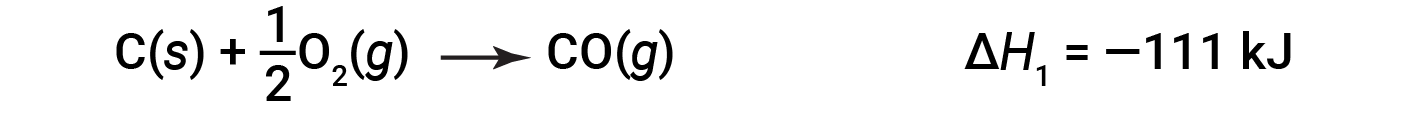
然后,一氧化碳进一步反应生成二氧化碳:
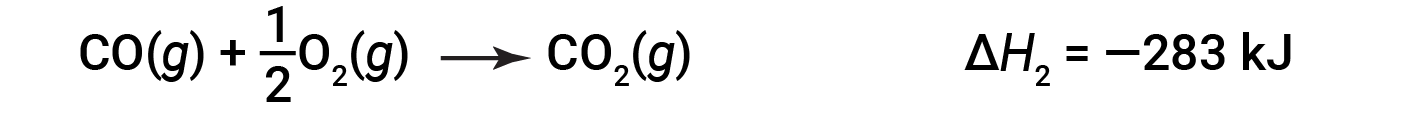
描述整个反应的方程式是这两个化学变化的总和:
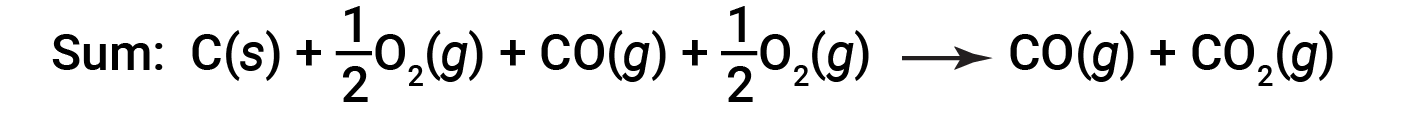
由于步骤2中消耗了步骤1中产生的一氧化碳,因此净变化为:

根据赫斯定律,反应的焓变将等于步骤的焓变之和。

Δ H 是相同的,而不管它是一步还是两步发生。对于化学和物理,这一发现(反应的总Δ H =整个反应的"步数"的Δ H 的总和)是正确的程序。
Δ H 的两个重要特征在使用赫斯定律解决问题时被证明是有用的。这是基于以下事实:Δ H 与反应物或产物的量成正比,并且以明确定义的方式改变反应(或热化学方程式)会改变Δ H 。
例如,形成1摩尔NO 2 ( g )的反应的焓变为+33.2 kJ:
当形成2摩尔NO 2 (两倍)时,Δ H 的大小是原来的两倍:
通常,如果将一个化学方程式相乘或相除,则焓变也应乘以或除以相同的数字。
一个方向上反应的 Δ H 大小相等,符号相反,相反方向上的符号ΔH。例如:
然后,对于逆反应,焓变也被逆转:
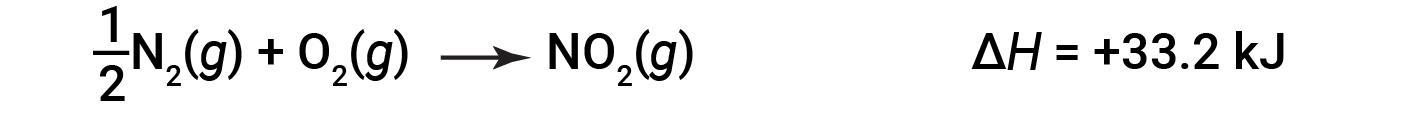
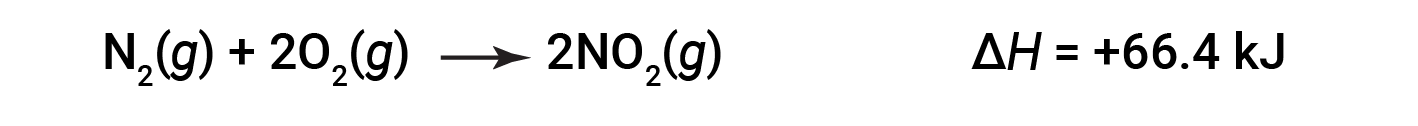
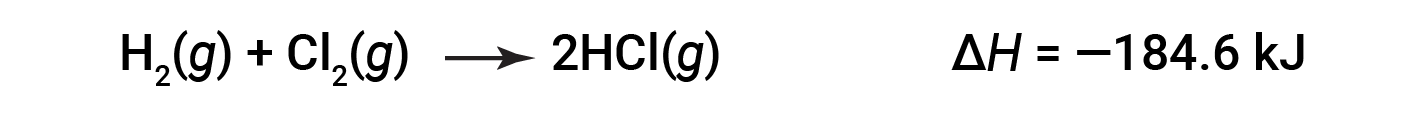
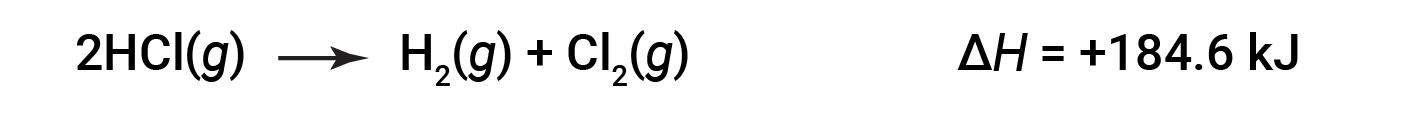
来自章节 6:

Now Playing
6.10 : 赫斯定律
热化学
44.4K Views

6.1 : 能源基础
热化学
37.0K Views

6.2 : 热力学第一定律
热化学
31.5K Views

6.3 : 内能
热化学
28.8K Views

6.4 : 量化热量
热化学
53.9K Views

6.5 : 量化做功
热化学
19.0K Views

6.6 : 焓值
热化学
34.8K Views

6.7 : 热化学方程
热化学
28.2K Views

6.8 : 恒压量热法
热化学
84.6K Views

6.9 : 定容量热法
热化学
26.9K Views

6.11 : 标准生成焓
热化学
41.0K Views

6.12 : 反应焓
热化学
31.5K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。