6.10 : Legge di Hess
Esistono due modi per determinare la quantità di calore coinvolta in un cambiamento chimico: misurarlo sperimentalmente o calcolarlo da altri cambiamenti di entalpia determinati sperimentalmente. Alcune reazioni sono difficili, se non impossibili, da indagare e da effettuare misurazioni accurate a titolo sperimentale. E anche quando una reazione non è difficile da eseguire o misurare, è conveniente essere in grado di determinare il calore coinvolto in una reazione senza dover eseguire un esperimento.
Questo tipo di calcolo di solito comporta l'uso della legge di Hess, che afferma: Se un processo può essere scritto come la somma di diversi processi stepwise, il cambiamento di entalpia del processo totale è uguale alla somma dei cambiamenti di entalpia dei vari passaggi. La legge di Hess è valida perché l'entalpia è una funzione di stato: i cambiamenti di entalpia dipendono solo da dove inizia e finisce un processo chimico, ma non dal percorso che ci vuole dall'inizio alla fine. Ad esempio, la reazione del carbonio con ossigeno per formare anidride carbonica avviene direttamente o con un processo in due fasi. Il processo diretto è scritto come:
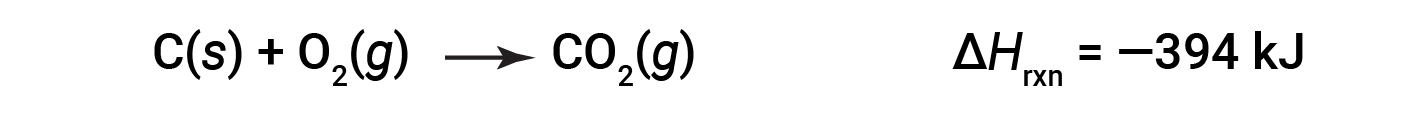
Nel processo in due fasi, si forma il primo monossido di carbonio:
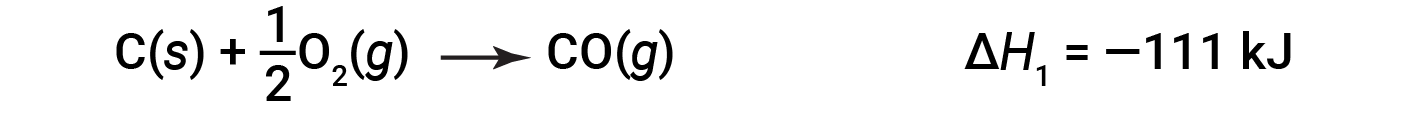
Quindi, il monossido di carbonio reagisce ulteriormente per formare anidride carbonica:
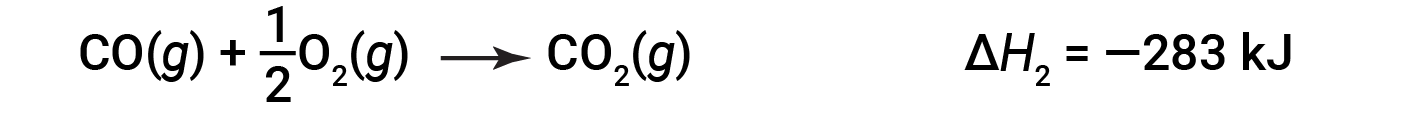
L'equazione che descrive la reazione complessiva è la somma di questi due cambiamenti chimici:
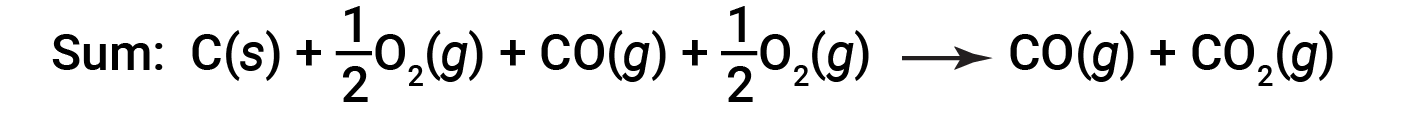
Poiché il CO prodotto nel passaggio 1 viene consumato nel passaggio 2, la variazione netta è:

Secondo la legge di Hess, il cambiamento di entalpia della reazione sarà uguale alla somma dei cambiamenti di entalpia dei passi.

ΔH della reazione complessiva è la stessa, indipendentemente dal fatto che si verifichi in uno o due step. Questo risultato (ΔH complessivo per la reazione = somma dei valori di ΔH per i "passi" di reazione nella reazione complessiva) è vero in generale per i processi chimici e fisici.
Ci sono due caratteristiche importanti di ΔH che si rivelano utili mentre si risolvono i problemi usando la legge di Hess. Questo si basa sul fatto che ΔH è direttamente proporzionale alle quantità di reagenti o prodotti, e cambiando la reazione (o l'equazione termochimica) in modi ben definiti cambia la ΔH di conseguenza.
Ad esempio, il cambiamento di entalpia per la reazione che forma 1 talpa di NO2 (g) è +33,2 kJ:
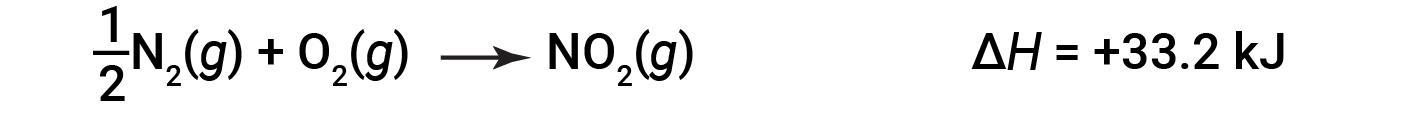
Quando si formano 2 talpe di NO2 (il doppio), la ΔH è due volte più grande:
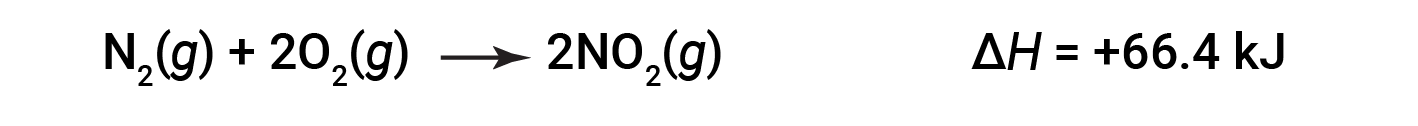
In generale, se si moltiplica o si divide un'equazione chimica, anche il cambiamento nell'entalpia dovrebbe essere moltiplicato o diviso per lo stesso numero.
ΔH per una reazione in una direzione è uguale in grandezza e opposto nel segno a ΔH per la reazione nella direzione inversa. Per esempio:
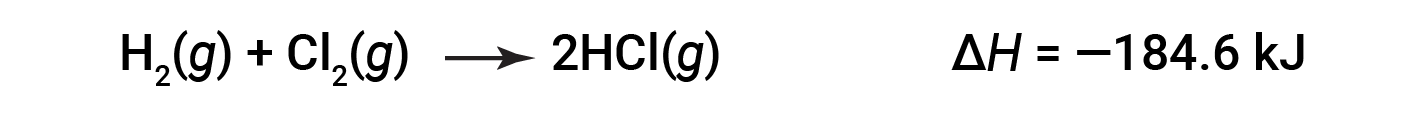
Quindi, per la reazione inversa, anche il cambiamento di entalpia è invertito:
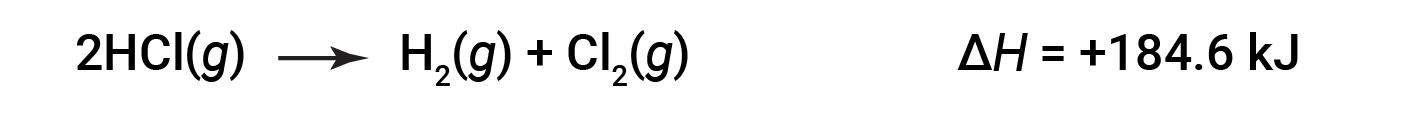
Questo testo è adattato da Openstax, Chimica 2e, Sezione 5.3: Entalpia.
Dal capitolo 6:

Now Playing
6.10 : Legge di Hess
Termochimica
44.5K Visualizzazioni

6.1 : Nozioni di base sull'energia
Termochimica
37.0K Visualizzazioni

6.2 : Prima legge della termodinamica
Termochimica
31.5K Visualizzazioni

6.3 : Energia interna
Termochimica
28.8K Visualizzazioni

6.4 : Quantificazione del calore
Termochimica
53.9K Visualizzazioni

6.5 : Quantificazione del lavoro
Termochimica
19.0K Visualizzazioni

6.6 : Entalpia
Termochimica
34.8K Visualizzazioni

6.7 : Equazioni termochimiche
Termochimica
28.2K Visualizzazioni

6.8 : Calorimetria a pressione costante
Termochimica
84.7K Visualizzazioni

6.9 : Calorimetria a volume costante
Termochimica
26.9K Visualizzazioni

6.11 : Entalpia standard di formazione
Termochimica
41.0K Visualizzazioni

6.12 : Entalpie di reazione
Termochimica
31.5K Visualizzazioni