16.12 : 错合离子的形成
一种路易斯 酸-碱 化学涉及形成一个错合离子 (或一个协调综合体) ,由一个中心原子 (通常是一个过渡金属阳离子) 组成,由被称为配体的离子或分子包围。 这些配体可以是中性分子 (如 H2O 或 NH3) ,也可以是离子 (如 CN− 或 OH−)。 通常,配体充当路易斯碱,向中心原子捐献一对电子。 这些类型的路易斯 酸-碱 反应是一个广泛的细分领域的示例,称为协调化学——这是本文件中另一章的主题。
一种或多种配体的金属离子形成协调复合物的反应的平衡常数称为形成常数 (Kf) (有时称为稳定性常数)。 例如,错合离子 [Cu(CN)2]− 由反应产生
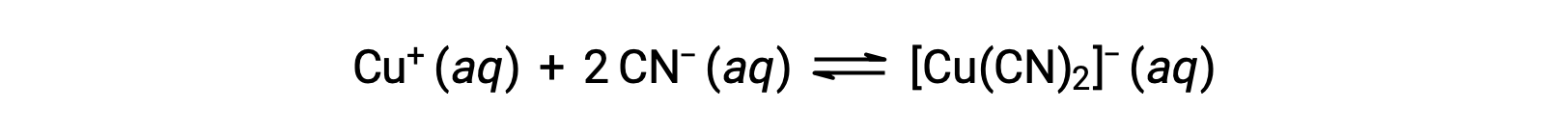
这种反应的形成常数是
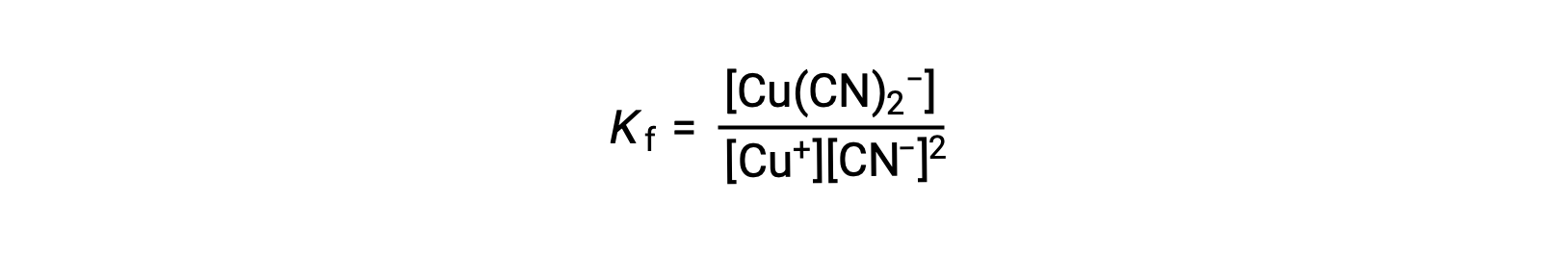
或者,可以考虑反向反应 (错合离子分解) ,在这种情况下,平衡常数为解离常数 (Kd)。 根据所述对等反应的平衡常数之间的关系,解离常数是形成常数的数学反函数 Kd = Kf−1。
作为错合离子形成溶解的一个例子,请考虑在氯化银和水的混合物中添加水氨时会发生什么情况。 氯化银在水中稍溶解,从而产生一个小浓度 Ag+ ([Ag+] = 1.3 × 10−5 M):
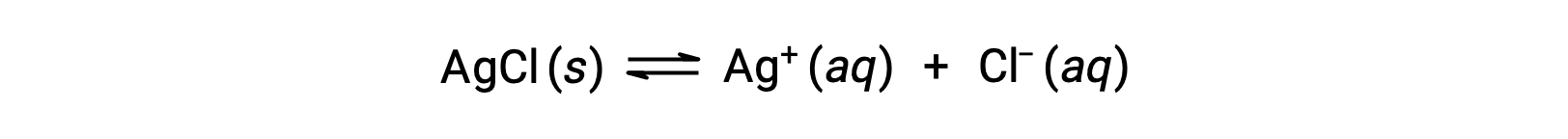
但是,如果水中存在 NH3,则错合离子 [Ag(NH3)2]+ 可以根据方程:
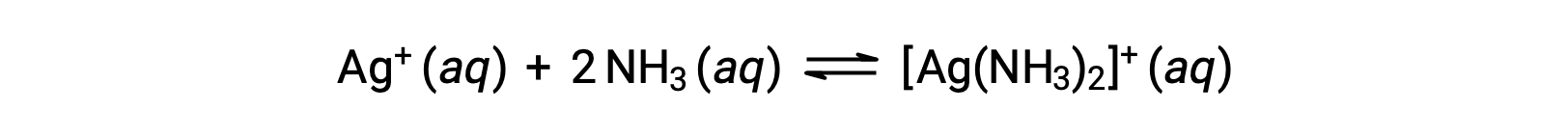
来自章节 16:

Now Playing
16.12 : 错合离子的形成
酸碱和溶解度平衡
23.0K Views

16.1 : 同离子效应
酸碱和溶解度平衡
40.8K Views

16.2 : 缓冲液
酸碱和溶解度平衡
163.2K Views

16.3 : 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
酸碱和溶解度平衡
67.9K Views

16.4 : 计算缓冲溶液中的 pH 值变化
酸碱和溶解度平衡
52.4K Views

16.5 : 缓冲液效力
酸碱和溶解度平衡
48.3K Views

16.6 : 滴定计算:强酸 - 强碱
酸碱和溶解度平衡
28.9K Views

16.7 : 滴定计算:弱酸 - 弱碱
酸碱和溶解度平衡
43.7K Views

16.8 : 指标
酸碱和溶解度平衡
47.7K Views

16.9 : 多质子酸的滴定
酸碱和溶解度平衡
95.6K Views

16.10 : 溶解度平衡
酸碱和溶解度平衡
51.8K Views

16.11 : 影响溶解度的因素
酸碱和溶解度平衡
32.9K Views

16.13 : 离子沉淀
酸碱和溶解度平衡
27.4K Views

16.14 : 定性分析
酸碱和溶解度平衡
20.0K Views

16.15 : 酸-碱 滴定曲线
酸碱和溶解度平衡
126.1K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。