需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
短杆菌肽为基础的荧光分析法,确定小分子的修改脂质双层属性的潜在
摘要
我们介绍一个快速荧光检测监控率作为衡量短杆菌肽通道活性的荧光猝灭。短杆菌肽通道,作为分子的力传感器监测双层跨越蛋白质检测中的脂质双层属性的变化。
摘要
用来调节生物功能的许多药物和其他小分子吸附在双层/溶液界面,从而改变脂质双层属性的双亲。这是很重要的,因为膜蛋白大力加上他们的主机双层的疏水相互作用。双层属性的变化,从而改变膜蛋白的功能,它提供了一种间接的方式为双亲调节蛋白质的功能,并为“脱靶”的药物作用的可能机制。之前我们已经开发出一种检测脂双层属性的变化,使用线性探头3,12短杆菌肽通道的电生理检测。短杆菌肽渠道transbilayer二聚体的两个非进行亚基组成的小型蛋白质。他们是敏感,在他们的膜环境,这使得他们在脂质双层属性的监测变化的强大探头双层跨越蛋白质检测变化。我们现在表现出的检测双层属性的变化,使用相同的渠道为探针的荧光分析法。该试剂盒是基于测量荧光猝灭的时间,当然,由于通过短杆菌肽通道进入一个淬灭的荧光装的大unilamellar水泡。我们使用荧光指示灯/淬灭对8 -萘胺-2,3,6 - trisulfonate(蚂蚁)/ TL +已成功地用于其他荧光猝灭测定 5,13 。 TL +渗透脂质双层慢慢8,但很容易通过开展短杆菌肽通道 1,14 。该方法可扩展性和适宜双层扰动,和潜在的“目标”,效果的小分子机理研究和高通量筛选。我们发现,使用这种方法的结果与前 12电结果吻合良好。
研究方案
1。生成蝼蚁充满脂质体
- 第1天,除去有机溶剂从血脂。
- 从冰箱中取出血脂和让它平衡至室温。
- 加入0.6毫升25毫克/毫升(1,2 dierucoyl - SN -甘油- 3 - phosphocholine)在氯仿溶液25 ml圆底烧瓶中的脂质。
- 不断旋转烧瓶,而干燥氮气保护下,直到所有的氯仿蒸发,薄薄的白色膜脂质大衣整个降低一半烧瓶。
- 干燥在真空状态下dessicator一夜之间。
- 第2天,准备将纳入到囊泡的荧光团的范例。
- 在NANO 3 100毫米,25毫米的蚂蚁,(娜盐)10毫米的HEPES补充水分。使用硝酸或氢氧化钠调节pH至7.0。每个蚁分子2的Na +,总共为150毫米的Na +]。添加1.671毫升的电解液,得到一个10毫米脂质的悬浮液。
- 封口膜和涡悬挂彻底。
- 防止光样品用铝箔,并让在室温下,年龄在一夜之间。
- 第3天,使unilamellar大泡和从外囊泡中删除所有的荧光。
- 超声为低功耗sonicator 1分钟。
- 冻融样本5-6次,每次5分钟,干冰和温暖(〜50 ° C)水中5分钟。
- 挤出的脂质悬挂使用阿凡提小型挤出机。设置一个0.1微米的聚碳酸酯过滤器和过滤器支持(见挤出机手册)的小型挤出机。挤出暂停来回21次暂停结束了相反的注射器。当多个批次的挤压,永远记住加载具有相同的注射器样本。多云初步脂质悬挂在挤出过程中,应该成为几乎半透明(它仍然是黄色由于蚁荧光基团)。如果挤压突然变得更容易,需要较少的压力将通过过滤器,过滤器可能已破裂,将需要更换。
- 删除运行一个使用重力协议的PD - 10脱盐柱挤压悬挂外部蚁。 20-30毫升钠缓冲平衡列(NANO 3 140毫米,10毫米的HEPES,pH值7.0,记得用硝酸或氢氧化钠调节pH)。挤压脂悬液加入1.5毫升的列,让它渗入。带来加入1毫升钠缓冲的总样本量2.5毫升。后缓冲区是完全纳入列,并没有泄漏出来,3毫升钠缓冲洗脱脂质体,并收集产生的样本。蚁充满LUV原液应包含有关血脂4-5毫米,并出现半透明的乳白色。保护样品的光带箔。
- 如果股票的解决方案是不立即使用,储存在13 ° C为最多7天。警告:不要冻结或冷却低于其液体晶相的转变温度(〜12 ° C),因为这会破坏囊泡的完整性,并会泄漏出来的荧光脂质的解决方案。
2。混合荧光解决方案
- 24小时前使用,稀释的脂质体和短杆菌肽孵育(13℃)。的短杆菌肽脂质囊泡的内层和外层膜之间的平衡是一个缓慢的过程,需要很长的潜伏期。
- 彻底涡蚂蚁LUV充满原液作为LUVs密度> 1克/毫升,因此将沉积物中的解决方案。
- 混合蝼蚁充满LUV钠缓冲库存为1:20。在一天的实验使用的所有脂质体混合在一起在一个烧瓶中,以提高样品的均匀性。
- 分离出的脂质体的3 / 4,并添加260 nm的短杆菌肽在DMSO预稀释(500微克/毫升)。
- 余下的1 / 4的相同体积的DMSO(不含短杆菌肽)添加在所有样本中不断保持溶剂浓度。
3。设立荧光仪器
- 我们使用温度控制应用光物理SX.20停流荧光光谱仪测量荧光猝灭率。
- 打开仪器提前一个小时,以便热身。的组件包括:计算机,电子控制单元,水浴(冷却器和加热器),灯电源和氮气罐。
- 设置使用临数据SX软件的拍摄条件。
- 设置1 / 1激发单色激发波长为352纳米,狭缝宽度光圈。
- 使用λ= 455 nm的高通滤波器,以记录排放。
- 使用“保持压力”的设置,使仪器保持在录制过程中的氮气压力,从而防止在几毫秒的压力振荡(和录音制品)。
- 设置“钛我“,以1秒和”点“到5000。
- 使用重复框和调整重复次数,我们通常使用9日和13重复,分别为缓冲区和淬灭运行。
- 水浴温度应设置为25 ° C,温度应在SX软件的监控。
- 设置驱动器的体积为120μL,这意味着仪器,每次运行一个示例,它混合了两个注射器60μL。有了这个工具的安装,120μL,卷给出了一个死区时间≈1.2毫秒。
- 蚂蚁脂质体的输出到8点左右,调整荧光检测的高电压(增益)。对于一个标准的实验混合物的增益应400-420五,有些药物是荧光灯,如他们能饱和的荧光信号。在这种情况下,增益/电压应下降。
- 始终加载到左边的注射器,并在合适的注射器缓冲/淬灭荧光样品。确保彻底涡含有脂质体装载前,所有样品,并意识到,随着时间的推移LUVs,将落户在注射器中。
4。做一个实验
- 准备一个蝼蚁加载LUVs与样本,无论是溶剂或化合物,并加载到一起要么钠缓冲或TL -淬灭(50毫米,94 毫米纳米 3 3 TlNO,在pH 7.0的10毫米的HEPES )分光光度计。
- 使用1.5 ml稀释蚂蚁LUV解决方案,或没有,准备在前一天的短杆菌肽。
- 添加所需浓度的化合物或溶剂的控制。保持溶剂浓度到最低限度,所有样品的不断。的浓度,将需要任何新的(未知)复合调整,以达到所需的剂量响应范围。孵育10分钟,在25 ° C黑暗环境中。
- 旋涡LUV样品,并加载到左边的注射器。装入正确的注射器钠缓冲或TL -淬灭。
- 彻底清除气泡来回推注射器从两个样本。
- 确保两个注射器加载之前关闭的阀门同样。不平等的加载会导致预混合的解决方案之前,他们到达录音室。
- 第一个样本,记录荧光钠缓冲,重复4次,高电压(增益)进行必要的调整,重复5次。
- 对于其余的样本,创纪录的9钠缓冲重复。
- TL -淬灭和创纪录的13重复更换钠缓冲。
- 用清水冲洗,并继续进行下一个样品。作为对照,我们使用样本:与短杆菌肽和溶剂都没有用溶剂,没有最大的化合物的浓度和短杆菌肽,短杆菌肽。
5。分析数据
- 分析计算机传输的结果。阅读所有的MATLAB数据分析。对于每个样本,在所有的缓冲区和淬灭重复读,不包括在每种情况下的第一个,因为这些含有混合文物。假设120μL的驱动器体积略小于四杆,以彻底清除以前停流管混合物。
- 所有样品的缓冲重复应该非常相似。如果有一个重大转变,在荧光信号,这取决于化合物的浓度,那么该化合物本身可能是荧光灯和它可能是必要的第一减去样品正常化之前,这个额外的荧光信号。
- 手动经过的痕迹,清除“坏”的重复:重复多exponentiality由于混合文物和/或气泡中含有尖峰或偏差。
- 规范化淬灭重复平均每个样品重复缓冲区的值。合并成一个可视化图形的所有样本的平均数。
- 没有短杆菌肽记录的痕迹都应该相似,表明几乎没有荧光猝灭;有可能是一个缓慢的荧光信号,由于缓慢通过囊泡双层8 铊泄漏+减少。如果没有短杆菌肽和没有修饰符的示例显示了显着的淬火,然后水疱恶化,不应该再继续使用。如果没有短杆菌肽,但与修饰的样品表现出显着的淬火,然后修饰扰乱到这样的程度,它使荧光基团或淬灭跨双层囊泡双层。
- 如果化合物改变脂质双分子层的属性,如短杆菌肽渠道检测,荧光的时间当然会明显改变。
- 对于每个样本,拉伸指数
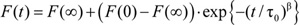 如4)是适合的第2-100毫秒归个人重复荧光猝灭曲线率
如4)是适合的第2-100毫秒归个人重复荧光猝灭曲线率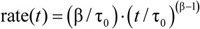 4在2毫秒计算。一个给定的样本,从所有的个人重复计算平均值和标准偏差。
4在2毫秒计算。一个给定的样本,从所有的个人重复计算平均值和标准偏差。 - 最后,确定正常化的时间最接近的对照样品,短杆菌肽和无修饰的淬火率的相对变化。
6。代表性的成果
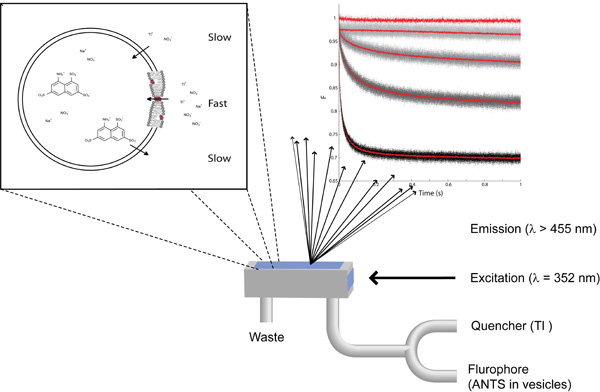
图1:要领的荧光猝灭为基础的检测,检测脂质双层属性的变化,左上:一个变焦单上用蚂蚁加在里面和在外面的NANO 3 加TlNO 3纳米脂质囊泡。右上:(形成从上到下)使用无猝灭剂蝼蚁充满水泡,与淬灭剂与淬灭剂和87,260和780 nm的短杆菌肽预掺杂,记录荧光信号。底部:停流混合室的示意图。
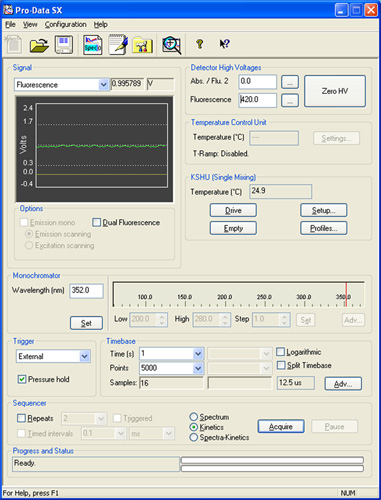
图2:临数据SX软件的演示实验装置的描述中引用的各种面板的屏幕截图。
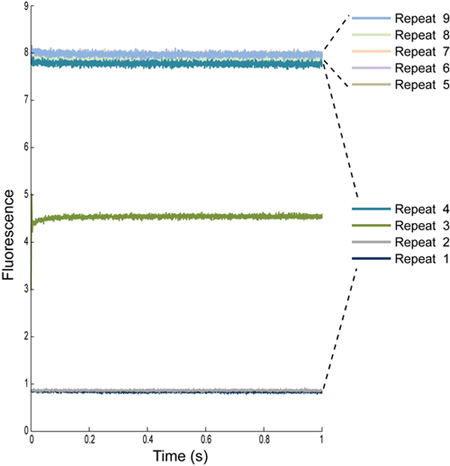
图3:多重复测定荧光信号从蚂蚁与钠缓冲加载LUVs第4个重复总是排除在外,因为它们包含混合文物。混合细胞样品注射器油管连接有一个定义的卷,因此最初的几个重复给我们读了什么是在以前的油管:重复1和2,结合一些水和样品重复3的水,大多样品重复4,为剩余的重复只是样品。
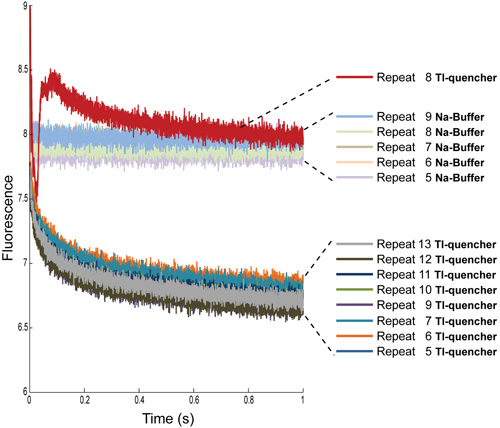
图4:多重复测定荧光信号从钠缓冲与TL -淬灭蚁装LUVs第4个重复已从两个条件。此外,TL -淬灭测量,重复8需要被删除,由于文物,最有可能的气泡。
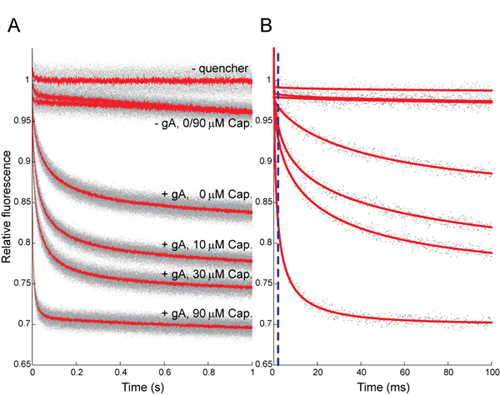
(一) 图5:辣椒素(CAP)对蚂蚁的荧光猝灭的时间当然归超过1秒的荧光信号,灰点表示所有重复的结果(N> 5%的条件);红色线条表示所有平均重复。 (二)第一个100毫秒,灰色点表示从单一重复的每个条件的结果;红色线条被拉长指数拟合(2 - 100毫秒),这些重复。点画蓝线表示的2毫秒大关,淬火率是确定的时间。在A和B的上部曲线显示结果没有铊+未来两年的痕迹显示在GA的情况下结果,与TL + ±章;低4跟踪显示与260 nm的GA和Tl +,其中结果数字表示,单位为μm[第]。为0,10,30和90微米的上限确定由一个拉伸指数率,淬火率分别为36 ± 6,69 ± 6,85 ± 8和247 ± 27(平均值± SD,N> 8)分别。
讨论
我们已经确定的双层修改药品和其他小双亲的潜力表现出快速的荧光为基础的检测。修改双层属性的化合物有可能间接的,非特异性的方式改变膜蛋白的功能,可能有助于“脱靶”的药物作用。该实验利用双层跨越蛋白质检测的12个双层属性的变化进行探测的短杆菌肽渠道的力量。使用基于荧光检测得到的结果与单通道12 GA实验结果吻合良好,表明该方法可用于筛选化合物库以及?...
披露声明
致谢
我们感谢许多刺激讨论迈克尔J.布鲁诺,拯救Rusinova和Jon T.袋。从美国国立卫生研究院,R01GM021342和阿塞拜疆恢复和重建补充R01GM021342 - 35S1,约西亚梅西,小基金会OSA的财政支持;三我的HII中巴方案;以及鸢尾属莱弗里特南伍德沃思医学科学家奖学金和美国国立卫生研究院的MSTP授予GM07739为RK。
材料
| Name | Company | Catalog Number | Comments |
| ANTS | Invitrogen | A-350 | |
| gramicidin | Sigma-Aldrich | G-5002 | |
| 1,2-dierucoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipid, Inc | 850398C | |
| Mini-Extruder kit | Avanti Polar Lipid, Inc | 610000 | |
| PD-10 Desalting column | Sigma-Aldrich | 54805 |
参考文献
- Andersen, O. S., Giebisch, G. H., Purcel, E. F. Ion transport through simple membranes. Renal Function. , (1978).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: An energetic perspective. Annu. Rev. Biophys. Biomol. Struct. 36, 107-130 (2007).
- Andersen, O. S., Koeppe, R. E., Roux, B., Chung, S. -. H., Andersen, O. S., Krishnamurthy, V. Gramicidin channels. Versatile tools. Biological Membrane Ion Channels: Dynamics, Structure, and Applications. , (2007).
- Berberan-Santos, M. N., Bodunov, E. N., Valeur, B. Mathematical functions for the analysis of luminescence decays with underlying distributions 1. Kohlrausch decay function (stretched exponential. Chem. Phys. 315, 171-182 (2005).
- Bruggemann, E. P., Kayalar, C. Determination of the molecularity of the colicin E1 channel by stopped-flow ion flux kinetics. Proc. Natl. Acad. Sci. USA. 83, 4273-4276 (1986).
- Bruno, M. J., Koeppe, R. E., Andersen, O. S. Docosahexaenoic acid alters bilayer elastic properties. Proc. Natl. Acad. Sci. USA. 104, 9638-9643 (2007).
- Buboltz, J. T., Feigenson, G. W. A novel strategy for the preparation of liposomes: rapid solvent exchange. Biochim. Biophys. Acta. 1417, 232-245 (1999).
- Gutknecht, J. Cadmium & thallous ion permeabilities through lipid bilayer membranes. Biochim. Biophys. Acta. 735, 185-188 (1983).
- Ingólfsson, H. I., Koeppe, R. E., Andersen, O. S. Curcumin is a modulator of bilayer material properties. Biochemistry. 46, 10384-10391 (2007).
- Keserü, G. M., Makara, G. M. The influence of lead discovery strategies on the properties of drug candidates. Nat. Rev. Drug Discov. 8, 203-212 (2009).
- Leeson, P. D., Springthorpe, B. The influence of drug-like concepts on decision-making in medicinal chemistry. Nat. Rev. Drug Discov. 6, 881-890 (2007).
- Lundb k, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S., S, O. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. J. R. Soc. Interface. 7, 373-395 (2010).
- Moore, H. P. &. a. m. p. ;. a. m. p., Raftery, M. A. Direct spectroscopic studies of cation translocation by Torpedo acetylcholine receptor on a time scale of physiological relevance. Proc. Natl. Acad. Sci. USA. 77, 4509-4513 (1980).
- Neher, E. Ionic specificity of the gramicidin channel and the thallous ion. Biochim. Biophys. Acta. 401, 540-544 (1975).
- O'Connell, A. M., Koeppe, R. E., Andersen, O. S. Kinetics of gramicidin channel formation in lipid bilayers: transmembrane monomer association. Science. 250, 1256-1259 (1990).
- Søgaard, R. GABAA receptor function is regulated by lipid bilayer elasticity. Biochemistry. 45, 13118-13129 (2006).
- Waring, M. J. Defining optimum lipophilicity and molecular weight ranges for drug candidates-Molecular weight dependent lower logD limits based on permeability. Bioorg. Med. Chem. Lett. 19, 2844-2851 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。