このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
グラミシジンベースの蛍光アッセイ、脂質二重層のプロパティの変更の可能性小分子を決定するための
要約
我々は、グラミシジンチャネル活性の尺度としての蛍光消光の速度を監視し、高速蛍光ベースのアッセイをご紹介。グラミシジンのチャンネルは、タンパク質にまたがる二重層により検知されたとして、脂質二重層の特性の変化を監視するための分子力変換器として使用されています。
要約
多くの薬と生物学的機能を調節するために使用される他の小さな分子は両親媒性脂質二重層/溶液界面のその吸着であり、それによって脂質二重層のプロパティを変更する。膜タンパク質がエネルギー的に疎水性相互作用によって、そのホストの二重層に結合されているため、これは重要です。二重層の特性の変化は、このように両親媒性物質は、タンパク質の機能と"オフターゲット"薬の効果の可能なメカニズムを変調するための間接的な方法を提供する、膜タンパク質の機能を変化させる。我々は以前のプローブ3,12のような線形グラミシジンのチャンネルを使用して、脂質二重層の特性の変化を検出するための電気生理学的ア ッセイを開発した。グラミシジンのチャンネルは2つの非導電性サブユニットのtransbilayer二量体化によって形成されるミニ蛋白質である。彼らはそれらのタンパク質にまたがる二重層により検知されたとして、脂質二重層の特性の変化を監視するための強力なプローブになる彼らの膜環境の変化に敏感です。我々は現在、プローブと同じチャンネルを使用して二重層の特性の変化を検出するための蛍光アッセイを示す。アッセイは、グラミシジンのチャンネルを通じて、クエンチャーのエントリに起因する蛍光体にロードされた大きな単ラメラ小胞からの蛍光消光の時間経過を測定することに基づいています。我々は、蛍光指示薬/消光剤ペア8 -アミノナフタレン-1,3,6 - trisulfonate(ANTS)/ TL +を正常他の蛍光消光アッセイ5,13で使用されている使用してください。 TL +はゆっくり8脂質二重層に浸透がグラミシジンのチャンネル1,14を実施を通じて容易に通過する。このメソッドは、両方の効果機序の研究と二重層-摂動のための小分子のハイスループットスクリーニング、および潜在的な"オフターゲット"のための拡張性と最適です。我々は、このメソッドを使用して結果が以前の電気生理学的結果12とよく一致していることがわかります。
プロトコル
1。 ANTS充填リポソームを生成する
- 1日目に、脂質から有機溶媒を除去。
- 冷凍庫から脂質を取り外して、常温に平衡させる。
- 25mLの丸底フラスコにクロロホルム溶液25 mg / mLの(1,2 - dierucoyl - sn -グリセロ-3 - ホスホコリン)脂質0.6 mLを加え。
- すべてのクロロホルムが蒸発し、脂質コートフラスコの全体の下半分の薄い白色フィルム完了するまで、窒素下で乾燥しながら継続的にフラスコを回転させる。
- 一晩真空下でデシケーター中で乾燥させます。
- 2日目、小胞に取り込まれる蛍光体でサンプルを準備。
- 100mMのNaNO 3を 、25mMのANTS(Na塩)、10mMのHEPESで再水和。 pHを7.0に調整してHNO 3またはNaOHを使用してください。各ANTSの分子が2のNa +を持って 、150mMの合計[Na +の ]。 10mMの脂質懸濁液を得るために電解液の1.671 mLを加え。
- 徹底的にパラフィルムと渦サスペンション。
- 箔で光から試料を保護し、室温で一晩、それは年齢ができます。
- 3日目に、大きな単ラメラ小胞を作り、小胞の外からすべての蛍光体を削除します。
- 低消費電力の超音波処理器で1分間超音波洗浄します。
- 凍結融解サンプルドライアイス上で5分、暖かい所で約5分で5〜6回、各時間(〜50 ° C)水。
- アバンティミニ押出機を用いて脂質懸濁液を押し出します。 0.1μmのポリカーボネートフィルターとフィルターをサポート(詳細については、押出機のマニュアルを参照してください)とミニ押出機を設定します。前後にサスペンションが反対側のシリンジに終わりますように、21回のサスペンションを押し出す。複数のバッチが押し出されるときは、常に同じシリンジでサンプルをロードすることを忘れないでください。押出中に曇った最初の脂質懸濁液は、(それはまだANTSの蛍光団のために黄色になる)とほぼ透明になるはず。押し出しが突然容易になり、少ない圧力がフィルタを通過移動するために必要な場合は、フィルターが破裂している可能性があり、交換する必要があります。
- 重力のプロトコルを使用してPD - 10脱塩カラムに押し出されたサスペンションを実行することにより、外部ANTSを削除します。ナトリウム緩衝液の20〜30 mLでカラムを平衡化(140mMのNaNO 3を 、10mMのHEPES、pH 7.0のpHを調整するHNO 3または水酸化ナトリウムを使用することを忘れないでください)。列に押し出し脂質懸濁液1.5 mLを加え、それが入って1 mLのナトリウム緩衝液を添加することにより2.5mLのためにサンプルの合計量を持参浸透しましょう。バッファが完全にカラムと何も組み込まれている後は、漏れ出しナトリウム緩衝液3mLでリポソームを溶出し、得られたサンプルを収集しています。満たされた結果として得られるANTSは、ストック溶液は4〜5 mMの脂質に関する含むと半透明の乳白色を表示するLUVは。アルミホイルで光からサンプルを保護する。
- ストック溶液は13で、すぐにストアを使用されていない場合で7日間の最大のためのC。警告:フリーズまたはその結晶相転移温度(〜12 ° C)、これは小胞の整合性を破壊すると蛍光物質が漏れないので液体の下に脂質溶液を冷却していない。
2。蛍光溶液を混合
- 24時間前、使用リポソームを希釈し(13℃時)グラミシジンでインキュベートする。脂質小胞"内側と外側の単分子膜との間のグラミシジンの平衡は、長いインキュベーションを必要とする、時間のかかるプロセスです。
- アリが充填徹底的に渦LUVsは密度> 1 g / mlのとソリューションにしたがって堆積物意志を持っているストック溶液をLUVは。
- ミックスANTS充填ナトリウム緩衝液中で株式の1:20にマブラヴ。サンプルの均一性を高めるために、単一のフラスコ中で一緒に実験の一日に使用するためのすべてのリポソームを混ぜる。
- リポソームの3 / 4を分離し、260nmのグラミシジンDMSOにあらかじめ希釈して(500μg/ mL)を加える。
- 残りの1 / 4に全てのサンプル中の溶媒濃度を一定に保つためにDMSOの同じ体積を(グラミシジンせずに)追加。
3。蛍光インストゥルメントの設定
- 我々は、蛍光消光の速度を測定する温度制御と応用光物性SX.20ストップトフロー分光を使用してください。
- ウォームアップを可能にするために前もって時間の時間で楽器をオンにします。コンポーネントは次のとおりです。コンピュータ、電子制御ユニット、水浴(クーラーとヒーターの両方)、ランプの電力供給と窒素のタンク。
- プロのデータSXのソフトウェアを使用して記録条件を設定します。
- 1 / 1〜励起用352 nmおよびスリット幅の開口部にモノクロの励起波長を設定します。
- 排出量を記録するためにλ= 455 nmのハイパスフィルタを使用してください。
- 録音時の窒素圧力を維持するために楽器を可能にするため、最初の数ミリ秒の間に圧力の振動(および録音のアーティファクト)を防止する"圧力ホールド"の設定を、使用してください。
- "Tiを設定する私は5000〜ポイント""1秒とする"。
- リピートボックスを使用するとリピートの数を調整するには、通常、我々はそれぞれ、バッファおよびクエンチャーの実行のために9および13のリピートを使用してください。
- 水槽温度を25に設定する必要があります° C、温度は、SXソフトウェアで監視する必要があります。
- たびに楽器が、サンプルを実行するには2つのシリンジの各々から60μLを混合することを意味し、120μLのドライブボリュームを設定します。この楽器のセットアップでは、120μLボリュームは≈1.2ミリ秒のデッドタイムを与える。
- 8の周囲にANTS -リポソームの出力のための蛍光検出器に高電圧(ゲイン)を調整します。標準的な実験的な混合のために利得が400から420にする必要がありますV.一部の薬は、蛍光は、蛍光信号を飽和させることができるようになっている。これらのケースでは、ゲイン/電圧を減少させるべきである。
- 常に右シリンジで左の注射器とバッファ/消光剤に蛍光サンプルをロードする。ロードする前に、リポソームを含む徹底的にボルテックスすべてのサンプルにすることを確認し、時間とLUVsは注射器で解決されることに注意してください。
4。実験を行っ
- ナトリウム緩衝液またはTL -クエンチャー(50mMのTlNO 3、94 mMのNaNO 3を 、pH7.0で10mMのHEPES)のいずれかと一緒にANTS -ロードされた溶媒や化合物のいずれかとLUVs、と分光へのロードのサンプルを準備します。
- 前日準備グラミシジンの有無にかかわらず、1.5 mLの希釈ANTS - Luvのソリューションを、使用してください。
- 所望の濃度の化合物またはコントロールの溶剤を追加。すべてのサンプル間の最小値と定数に溶剤濃度を維持する。濃度は、所望の投与量 - 応答の範囲を達成するために、新しい(未知の)化合物とを調整する必要があります。 25℃で10分間インキュベート° Cの暗所で。
- 渦は、左のシリンジにサンプルと負荷をLUVは。右のシリンジにナトリウムバッファーまたはTL -クエンチャーをロードします。
- 徹底的に前後にシリンジを押すことによって、両方のサンプルから気泡を取り除く。
- 両方の注射器がバルブを閉じる前に均等に負荷されていることを確認します。彼らはレコーディング室に到達する前に不平等な負荷がソリューションのプリミキシングになります。
- 非常に最初のサンプルの場合は、必要に応じて高電圧(ゲイン)を調整し、4回繰り返し、5回を繰り返し、ナトリウム緩衝液と蛍光を記録。
- 残りのサンプルは、Na -バッファとレコード9繰り返すため。
- タリウムクエンチャーとレコード13を繰り返すとナトリウム緩衝液を交換してください。
- 水ですすぎ、次のサンプルを続行します。溶剤持つグラミシジンと、最大化合物濃度と無グラミシジンとを、グラミシジンと溶剤の両方で:私たちがサンプルを使用しない制御として。
5。データの分析
- 分析のコンピュータに結果を転送する。分析するためのMATLABへのすべてのデータを読み込みます。各サンプルについて、それらが混合アーティファクトを含んでいるので、それぞれの場合の最初の4つを除く、すべてのバッファおよびクエンチャーの繰り返しで読み込む。 120μLのドライブボリュームを想定し、それは完全にストップトフローチューブから前の混合物をクリアするために4つのショット弱かかります。
- すべてのサンプルのバッファの繰り返しは非常に似ている必要があります。化合物の濃度に依存して蛍光シグナル、大きな変化が存在する場合、化合物自体は蛍光可能性があります、それは最初のサンプルを正規化する前に、この余分な蛍光信号を減算する必要があるかもしれません。
- 手動でトレースを通過すると、"悪い"繰り返し削除する:ミキシングアーティファクトおよび/または気泡によるマルチexponentialityからスパイクや逸脱を含む繰り返しを。
- 各サンプルのバッファーを繰り返すの平均開始値にクエンチャーが繰り返されを正規化する。可視化のための一つのグラフにすべてのサンプルの平均値を組み合わせる。
- ないグラミシジンで記録されたトレースはどれも似たり寄ったりだとほとんど蛍光消光を示すようにすべきですが、Tlの漏れを遅くする+小胞二重層〜8による蛍光シグナルの遅い低下する可能性があります。無グラミシジンと無修飾されたサンプルは、重要な消光を示している場合は、小胞は悪化しており、さらには使用しないでください。ないグラミシジンはあるが修飾子を持つ試料が大きな消光を示す場合は、修飾子は、それが蛍光団または消光剤が二重層を通過することができるような程度に小胞の脂質二重層を乱す。
- グラミシジンのチャンネルで検出されたとして、化合物は、脂質二重層のプロパティを変更した場合、蛍光の時間経過が明白に変更されます。
- 各サンプルについて、指数関数的に引き伸ばさ
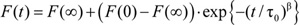 例えば、4)は、個々の繰り返しの正規化蛍光消光カーブの最初の200から100ミリ秒と速度に適合さ
例えば、4)は、個々の繰り返しの正規化蛍光消光カーブの最初の200から100ミリ秒と速度に適合さ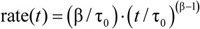 42ミリ秒で計算。平均値と標準偏差はすべての個々の繰り返しから、与えられたサンプルに対して計算されます。
42ミリ秒で計算。平均値と標準偏差はすべての個々の繰り返しから、与えられたサンプルに対して計算されます。 - 最後に、グラミシジンと無修飾されている時間に最も近いコントロールサンプルに正規化することによって急冷速度の相対的な変化を決定する。
6。代表的な結果
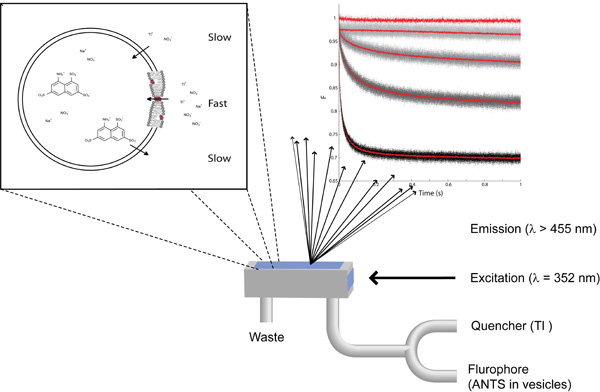
図1:蛍光クエンチベースのアッセイの必需品は、脂質二重層の特性の変化を検出するために左上:。ズームの内側と外側のNaNO 3を加えてTlNO 3のアリプラスNaNO 3を持つ単一の脂質小胞で。右上:クエンチャー、87、260と780nmのグラミシジンとプリドープで、消光剤と、クエンチャーなし(上から下フォーム)ANTS充填小胞を用いて記録された蛍光シグナル。ボトム:ストップトフロー混合室の模式図。
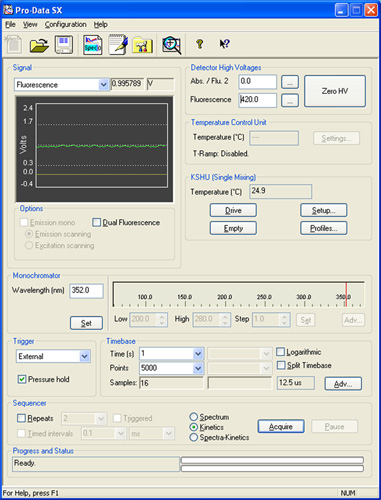
図2:実験装置の説明で参照されているさまざまなパネルを示すプロデータSXのソフトウェアからのスクリーンショット。
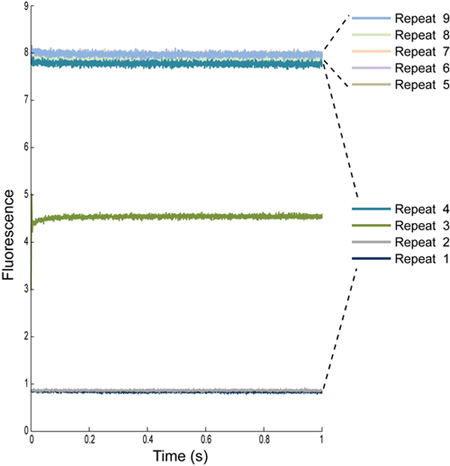
図3:彼らはミキシングアーティファクトを含むとしてのNa -バッファ付きANTS負荷LUVsからの蛍光信号の複数の繰り返し測定は、最初の4つの繰り返しは常に、除外されます。混合セルにサンプルの注射器を接続する配管には、定義されたボリュームを持っている、したがって、最初のいくつかの繰り返しは、私たちのチューブに以前にあったものの読書を与える:水を繰り返し1と2、繰り返し3の水とサンプルのいくつかの組合せに対してリピート4、残りの繰り返しのためだけのサンプルのほとんどがサンプル。
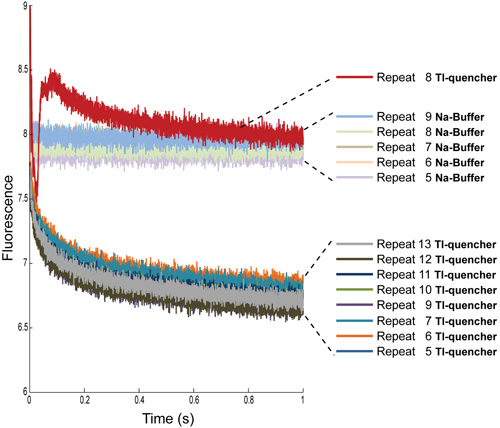
図4:。ANTS負荷のNa -バッファ付きおよびTl -クエンチャーとLUVsからの蛍光信号の複数の繰り返しの決定は、最初の4つの繰り返しは、両方の条件から削除されています。さらに、TL -消光測定のため、アーティファクト、ほとんど気泡により、削除する8ニーズを繰り返します。
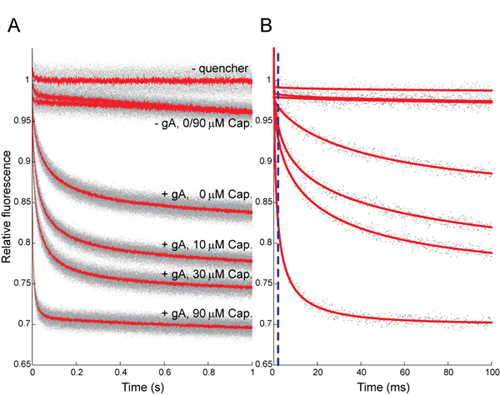
図5:ANTS蛍光消光の時間経過に対するカプサイシンの効果(キャップ)1秒以上()正規化された蛍光シグナルは、灰色のドットは、すべてのリピート(N> 5あたり状態)からの結果を表し、赤い線はすべての平均を表す繰り返す。 (B)最初の100 msのは、灰色のドットは、条件ごとに単一の繰り返しからの結果を表し、赤い線は指数関数フィット(2 - 100ミリ秒)に引き伸ばされて、それらの繰り返しにして。点描青い線が2ミリ秒のマーク、消光の速度が決定された時刻を示します。 AとBの両方でトップのトレースは、TLがない場合の結果を示しています+;次の2つのトレースは+ ±キャップTlのと、GAの不在の結果を示し、下位4トレースがどこに、260nmのGaとTlの+との結果を表示数字は、μMの[キャップ]を表します。として伸張指数関数の速度によって決定される0、10、30、90μMのキャップ、、のための消光の速度は36です± 6、69 ± 6、85 ± 8と247 ± 27(± SD、n個> 8を意味する) 、それぞれ。
ディスカッション
私たちは、麻薬や他の小さな両親媒性物質の二重層変更の可能性を決定するための高速な蛍光ベースのアッセイを実証している。二重層のプロパティを変更する化合物は、おそらく"オフターゲット"薬の効果に貢献し、間接的、非特異的に膜タンパク質の機能を変更する可能性があります。アッセイは、二重層貫通タンパク質によって感知される二層プロパティの変更12の...
開示事項
謝辞
我々は、多くの刺激的な議論のためにマイケルJ.ブルーノ、ラッダRusinovaとジョンT.サックに感謝。 NIH、R01GM021342とARRAサプリメントR01GM021342 - 35S1、及びOSAのジョサイアメイシー、ジュニア財団からの財政支援、トライ- I HII用CMBプログラム、およびアイリスL.とレヴェレットS.ウッドワース医学者フェローシップとNIH MSTP助成金RK用GM07739。
資料
| Name | Company | Catalog Number | Comments |
| ANTS | Invitrogen | A-350 | |
| gramicidin | Sigma-Aldrich | G-5002 | |
| 1,2-dierucoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipid, Inc | 850398C | |
| Mini-Extruder kit | Avanti Polar Lipid, Inc | 610000 | |
| PD-10 Desalting column | Sigma-Aldrich | 54805 |
参考文献
- Andersen, O. S., Giebisch, G. H., Purcel, E. F. Ion transport through simple membranes. Renal Function. , (1978).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: An energetic perspective. Annu. Rev. Biophys. Biomol. Struct. 36, 107-130 (2007).
- Andersen, O. S., Koeppe, R. E., Roux, B., Chung, S. -. H., Andersen, O. S., Krishnamurthy, V. Gramicidin channels. Versatile tools. Biological Membrane Ion Channels: Dynamics, Structure, and Applications. , (2007).
- Berberan-Santos, M. N., Bodunov, E. N., Valeur, B. Mathematical functions for the analysis of luminescence decays with underlying distributions 1. Kohlrausch decay function (stretched exponential. Chem. Phys. 315, 171-182 (2005).
- Bruggemann, E. P., Kayalar, C. Determination of the molecularity of the colicin E1 channel by stopped-flow ion flux kinetics. Proc. Natl. Acad. Sci. USA. 83, 4273-4276 (1986).
- Bruno, M. J., Koeppe, R. E., Andersen, O. S. Docosahexaenoic acid alters bilayer elastic properties. Proc. Natl. Acad. Sci. USA. 104, 9638-9643 (2007).
- Buboltz, J. T., Feigenson, G. W. A novel strategy for the preparation of liposomes: rapid solvent exchange. Biochim. Biophys. Acta. 1417, 232-245 (1999).
- Gutknecht, J. Cadmium & thallous ion permeabilities through lipid bilayer membranes. Biochim. Biophys. Acta. 735, 185-188 (1983).
- Ingólfsson, H. I., Koeppe, R. E., Andersen, O. S. Curcumin is a modulator of bilayer material properties. Biochemistry. 46, 10384-10391 (2007).
- Keserü, G. M., Makara, G. M. The influence of lead discovery strategies on the properties of drug candidates. Nat. Rev. Drug Discov. 8, 203-212 (2009).
- Leeson, P. D., Springthorpe, B. The influence of drug-like concepts on decision-making in medicinal chemistry. Nat. Rev. Drug Discov. 6, 881-890 (2007).
- Lundb k, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S., S, O. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. J. R. Soc. Interface. 7, 373-395 (2010).
- Moore, H. P. &. a. m. p. ;. a. m. p., Raftery, M. A. Direct spectroscopic studies of cation translocation by Torpedo acetylcholine receptor on a time scale of physiological relevance. Proc. Natl. Acad. Sci. USA. 77, 4509-4513 (1980).
- Neher, E. Ionic specificity of the gramicidin channel and the thallous ion. Biochim. Biophys. Acta. 401, 540-544 (1975).
- O'Connell, A. M., Koeppe, R. E., Andersen, O. S. Kinetics of gramicidin channel formation in lipid bilayers: transmembrane monomer association. Science. 250, 1256-1259 (1990).
- Søgaard, R. GABAA receptor function is regulated by lipid bilayer elasticity. Biochemistry. 45, 13118-13129 (2006).
- Waring, M. J. Defining optimum lipophilicity and molecular weight ranges for drug candidates-Molecular weight dependent lower logD limits based on permeability. Bioorg. Med. Chem. Lett. 19, 2844-2851 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved