需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
重组逆转录病毒的生产和B细胞的感染
摘要
一个有效率的制度中的一个基因的结构和功能分析体外脾B淋巴细胞的文化描述。这种方法需要利用一个辅助的自由,ecotrophic包装细胞系的重组逆转录病毒的生产。稳定,遗传兴趣在初级淋巴细胞基因的表达,是实现领导在接受类开关重组的B细胞表面抗体的生成。
摘要
在真核细胞基因的转基因表达是一个功能强大的反向遗传学方法,在其中一个感兴趣的基因是异源表达系统的控制下表达,以方便所产生的表型分析。这种方法可以用来在生物体中发现一个不正常的基因表达,表达了一个基因产物的突变形式,或过度表达的基因产物的显性负形式。它是造血系统的研究,转录调控是一个主要控制机制,在发展和分化的B 细胞在2-4审查,特别有用。
小鼠遗传学是研究人类基因和疾病的有力工具。一个小鼠和人类基因组的比较分析,揭示了共线性的保护,在超过90%的基因组5此外,在小鼠模型所使用的技术是适用于人类基因的研究,例如, 基因 干扰和等位基因更换6。然而,转基因小鼠的建立需要一个很大的金融和技术性质资源。有几个项目已经开始编译库(KOMP,EUCOMM,NorCOMM)敲除小鼠品系或突变引起的菌株(理研),这需要大规模的努力和合作 7的。因此,这是可取的,首先研究的一个发展的小鼠模型前,在原代细胞的细胞培养模型所需的基因表型。
逆转录病毒的DNA整合到宿主DNA中,最好内或附近转录单位或CpG岛,稳定和遗传利益打包基因的表达,同时避免转录沉默 8 9。然后下一个高效率的逆转录病毒启动子控制转录的基因,在转录和蛋白质的生产效率高。因此,逆转录病毒表达可用于难转染的细胞,细胞在有丝分裂过程中的一个活跃的状态。由于该病毒的结构基因内包装细胞系中,用于克隆感兴趣的基因的表达载体含有病毒没有结构基因,这既消除了病毒的回复的可能性,并增加了安全与病毒上清工作如没有传染性的病毒粒子产生的 10 。
在这里,我们提出了一个脾B细胞重组逆转录病毒的生产和后续感染的协议。隔离后,刺激培养的脾细胞与钍派生淋巴因子和抗CD40,诱导B细胞的增殖和分化 11爆裂。此协议是为年底发生在B细胞发育和分化,B细胞是从以下初始造血事件,但在抗原刺激诱导浆细胞分化的脾孤立的事件研究的理想。
研究方案
1。脾B淋巴细胞的分离和刺激
- 援助缺陷小鼠12岁之间的2-3个月收获的脾脏。脾隔离在无菌条件下进行,并暂时保存在冷磷酸盐缓冲液(PBS)中含有15%胎牛血清(FBS),机关。
- 脾,然后转移到无菌组织培养罩,和2.5%胎牛血清的PBS在5毫升匀浆。匀浆液转移到15毫升的猎鹰管。
- 1000RPM离心10分钟脾组织匀浆样品在4 ° C至颗粒细胞。
- 离心后弃上清。重悬细胞沉淀在10毫升红细胞(RBC)的裂解缓冲液在室温下7分钟,以避免红血细胞的污染。
- 离心机在1000 RPM为10分钟,倒出上清液样本,并重新悬浮在10毫升PBS含2.5%FBS细胞。
- 取出100μL分装和1:1000稀释使用标准hemacytometer使用台盼蓝排除任何死细胞计数细胞。大约有20-30万个细胞,可每脾。
- 1000RPM样品离心10分钟,倒出上清液。
- 0.5%BSA / PBS含2mm的EDTA浓度在10月7日每90μL细胞重悬沉淀。
- 加入抗CD43抗体包被的磁珠细胞特异性结合非B细胞。使用90μL,10%微升珠(10 7细胞)。拌匀,孵育4℃20分钟的彗星。
- 一旦细胞都被贴上了,加入2.5%FBS / PBS顶部管冲洗。在10分钟1000转离心样品。
- 倾倒上清液。在每毫升10 × 10 7细胞的浓度在0.1%的BSA / PBS重悬细胞。
- 装上一个磁选机的磁排序列。下面的位置,直接列一个锥形管,收集流过负载3ML 0.5%BSA / PBS总理和洗列。
- 一旦流经洗涤液,更换一个新的收集管。如果样品是小于1毫升样本量,调整至1 mL,用0.5%BSA / PBS / EDTA的负载列中的样本。负荷最大只有1毫升每列单元格,如果有必要使用多列。
- 允许细胞被动流经列和列下未结合的细胞收集在锥形管。洗净用3 mL 0.5%BSA / PBS,同时继续收集流列的4倍。
- 所有流量通过CD43负休息B细胞将丰富的收集。丢弃列。离心机流过,在10分钟1000转。
- 排出上清液,加入10毫升培养基(15%的FCS / +谷氨酰胺,PEN /链球菌,非必需氨基酸,50微米Β- ME公司)
- 计数在每毫升10 6细胞的细胞和文化。
- 为了刺激B细胞的生长和增殖,补充中期,终浓度20μg/ mL和1μg/ mL的重组IL - 4和抗CD40抗体,分别和细胞转移到培养瓶中。
- 文化过夜的细胞。计数细胞,并稀释至10 6细胞每毫升,加入适当的IL - 4和CD40 。
- 文化细胞病毒感染前72小时。
2。生产者细胞的转染
使用转染的既定协议,无论是使用阳离子脂质或磷酸钙。转染10厘米3板,每DNA的构造,使用100微克每盘的质粒DNA。我们经常使用磷酸钙转染法13,14,并注意与氯喹的补充时,病毒滴度高。
- 使用60%-70%汇合凤凰细胞作为生产细胞转染。在此汇合细胞计数,应每10厘米的板5万细胞。
- 转染前一小时,更换凤凰细胞生长的新鲜完整的媒体与媒体。
- 在无菌eppendorpf管,结合包装构造的DNA,250μL0.5M氯化钙2 100微克,并用无菌水调整最终体积为500μL
- 用1毫升吸管,大力500μL2X国家警察混合在15毫升的聚丙烯管这个解决方案
- 允许这种混合物在室温下休息8-10分钟。在这段时间内会形成沉淀。
- 添加下拉明智的细胞,而纷飞的介质均匀分布的混合物整个转染混合物。
- 细胞在37℃,12个小时。
- 转染后12小时,更换8毫升完整的B细胞生长介质中的细胞恢复到37℃培养箱。
3。刺激脾B细胞的感染
- 去除上清液凤凰细胞48小时后transfection和上清液通过0.2微米的过滤器,以消除任何细胞碎片。
- 混合3毫升病毒上清含3毫升预激活的B细胞(如步骤1)。为了加强病毒吸附到细胞,加入终浓度为每毫升16微克的聚凝胺。
- 细胞感染了90分钟在2500转离心30 ° C。
- 后立即旋转,为进一步48-72小时,在37 ° C,让细胞生长和增殖。
4。流式细胞仪分析
- 使用流式细胞仪分析细胞的表面表达B220和表面IgG1的。在细胞表面的IgG1的存在表明,类开关重组已经通过的援助基因的逆转录病毒互补抢救成功的结果发生。
5。代表性的成果
我们已经成功地救出蛋白因子活化诱导胞苷脱氨酶(AID),从援助缺陷(AID - / - )的不足,采用逆转录病毒转导的B淋巴细胞。简而言之,我们产生了鼠标援助(MAID)蛋白表达,转染与PMX - MAID - GFP 15-18凤凰细胞重组逆转录病毒。收获病毒感染进入细胞在体外类开关重组(CSR)的刺激条件下19援助缺陷小鼠的缺陷援助乙。感染的B细胞,然后分析了CSR公司的IgG1的文化后使用流式细胞仪分析72hrs。图2显示的IgG1的检测在B细胞的援助,但不是空的构造表面,说明CSR公司作为援助表达救援的结果发生。
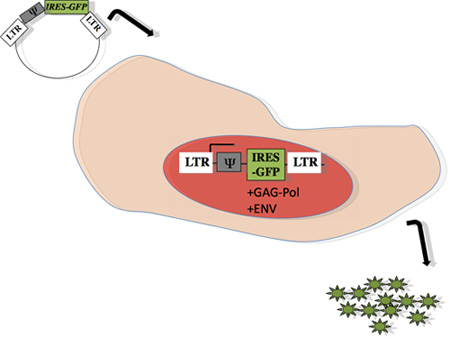
图1:计划内的生产者细胞的逆转录病毒包装:PMX - IRES - GFP基因的兴趣,Ψ代表,亚克隆入,如前面所述 15 。质粒转染到能够生产GAG - POL和包膜蛋白(凤凰,Orbigen),使用磷酸钙的方法13,14 ecotropic病毒包装细胞系。转染后48个小时,上清液中含有的病毒粒子感染收获到目标主乙从小鼠细胞。

图2:援助缺陷的B细胞,刺激抗CD40和IL - 4是一个包含PMX - MAID - GFP或单独表达GFP逆转录病毒的逆转录病毒感染。流式细胞仪分析,企业社会责任,IgG1的水平进行了评估。
讨论
这里描述和图1描绘的逆转录病毒转导的脾B细胞是一种遗传性的方法,是在B淋巴细胞的研究非常有用,因为许多lymphopoesis发展的事件是由转录调控1 ,2控制。 ,在B细胞的成熟,通过CD40L的触发,后期是诱导B细胞生长,进入细胞周期, 和增殖11,20所必需的。 如图2所示,B细胞可以在体外刺激抗CD40和IL - 4,经过这一阵扩散,逆转录病毒载体的功能在B细胞?...
披露声明
致谢
CK是由哥伦比亚大学的研究生课程。 UB是白血病和淋巴瘤协会的美国,从白血病研究基金会的收件人的新研究者奖的研究员,是由哥伦比亚大学新进教师启动经费支持。
材料
| Name | Company | Catalog Number | Comments |
| FCS | Atlanta Biologicals | S11550 | |
| RPMI | Invitrogen | 22400 | |
| PBS | Invitrogen | 20012 | |
| Red Blood Cell (RBC) lysis buffer | Sigma-Aldrich | R7757 | |
| CD43 beads | Miltenyi Biotec | ||
| B Cell Complete Media | Various | Various Components | RPMI, 15% FCS, 1% Non-Essential Amino Acids, 1% Sodium Pyruvate, 1% HEPES, 1% Pen-Strep, 50μM β-Mercapt–thanol |
| IL-4 | |||
| Anti-CD40 | BD Biosciences | 553787 | |
| polybrene | Sigma-Aldrich | 107689 | |
| Chloroquine diphosphate salt | Sigma-Aldrich | C6628 | Used at 100mM |
| Ph–nix Eco cells (Murine) | Orbigen | RVC-10002 | |
| PE-Cy5-α-mouse-CD45R (B220) | eBioscience | 15-0452-81 | |
| PE-α-mouse-IgG1 | BD Biosciences | A85-1 |
参考文献
- Bartholdy, B., Matthias, P. Transcriptional control of B cell development and function. Gene. 327, 1-23 (2004).
- Henderson, A., Calame, K. Transcriptional regulation during B cell development. Annu Rev Immunol. 16, 163-200 (1998).
- Graf, T. Differentiation plasticity of hematopoietic cells. Blood. 99, 3089-30101 (2002).
- Xiao, C., Rajewsky, K. MicroRNA control in the immune system: basic principles. Cell. 136, 26-36 (2009).
- Waterston, R. H. Initial sequencing and comparative analysis of the mouse genome. Nature. 420, 520-562 (2002).
- Griffiths, A. J. F., Miller, J. H., Suzuki, D. T., Lewontin, R. C., Gelbart, W. M. . Introduction to Genetic Analysis. , (2000).
- Gondo, Y. Next-generation gene targeting in the mouse for functional genomics. BMB Rep. 42, 315-3123 (2009).
- Plachy, J. Proviruses selected for high and stable expression of transduced genes accumulate in broadly transcribed genome areas. J Virol. 84, 4204-4211 (2010).
- Felice, B. Transcription factor binding sites are genetic determinants of retroviral integration in the human genome. PLoS One. 4, e4571-e4571 (2009).
- Karavanas, G. Cell targeting by murine retroviral vectors. Crit Rev Oncol Hematol. 28, 7-30 (1998).
- Noelle, R. J. A 39-kDa protein on activated helper T cells binds CD40 and transduces the signal for cognate activation of B cells. Proc Natl Acad Sci U S A. 89, 6550-6554 (1992).
- Muramatsu, M. Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 102, 553-563 (2000).
- Yelle, J., Dion, M., Hamelin, C. Efficient transfection of mammalian cells with viral DNA in optimal culture conditions. J Virol Methods. 7, 321-326 (1983).
- Chen, C., Okayama, H. High-efficiency transformation of mammalian cells by plasmid DNA. Mol Cell Biol. 7, 2745-2752 (1987).
- Fagarasan, S. In situ class switching and differentiation to IgA-producing cells in the gut lamina propria. Nature. 413, 639-6343 (2001).
- Basu, U. The AID antibody diversification enzyme is regulated by protein kinase A phosphorylation. Nature. 438, 508-5011 (2005).
- McBride, K. M. Regulation of class switch recombination and somatic mutation by AID phosphorylation. J Exp Med. 205, 2585-2594 (2008).
- Barreto, V. M. AID from bony fish catalyzes class switch recombination. J Exp Med. 202, 733-738 (2005).
- Delphin, S., Stavnezer, J. Regulation of antibody class switching to IgE: characterization of an IL-4-responsive region in the immunoglobulin heavy-chain germline epsilon promoter. Ann N Y Acad Sci. 764, 123-135 (1995).
- Castigli, E. CD40 expression and function in murine B cell ontogeny. Int Immunol. 8, 405-411 (1996).
- Ballantyne, J. Efficient recombination of a switch substrate retrovector in CD40- activated B lymphocytes: implications for the control of CH gene switch recombination. J Immunol. 161, 1336-1347 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。