Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Рекомбинантный Ретровирусные Производство и Заражение В-клетки
В этой статье
Резюме
Эффективной системы структуры и функции анализа гена в Исключая виво Культура селезенки В-лимфоцитов описана. Этот метод использует преимущества рекомбинантных ретровирусных производства помощник бесплатно, трофических клеточной линии упаковки. Стабильная, наследственные экспрессию гена интересов в рамках первичных лимфоцитов достигается, ведущие к генерации поверхностных антител на В-клетки проходят рекомбинации класса переключателя.
Аннотация
The transgenic expression of genes in eukaryotic cells is a powerful reverse genetic approach in which a gene of interest is expressed under the control of a heterologous expression system to facilitate the analysis of the resulting phenotype. This approach can be used to express a gene that is not normally found in the organism, to express a mutant form of a gene product, or to over-express a dominant-negative form of the gene product. It is particularly useful in the study of the hematopoetic system, where transcriptional regulation is a major control mechanism in the development and differentiation of B cells 1, reviewed in 2-4.
Mouse genetics is a powerful tool for the study of human genes and diseases. A comparative analysis of the mouse and human genome reveals conservation of synteny in over 90% of the genome 5. Also, much of the technology used in mouse models is applicable to the study of human genes, for example, gene disruptions and allelic replacement 6. However, the creation of a transgenic mouse requires a great deal of resources of both a financial and technical nature. Several projects have begun to compile libraries of knock out mouse strains (KOMP, EUCOMM, NorCOMM) or mutagenesis induced strains (RIKEN), which require large-scale efforts and collaboration 7. Therefore, it is desirable to first study the phenotype of a desired gene in a cell culture model of primary cells before progressing to a mouse model.
Retroviral DNA integrates into the host DNA, preferably within or near transcription units or CpG islands, resulting in stable and heritable expression of the packaged gene of interest while avoiding transcriptional silencing 8 9. The genes are then transcribed under the control of a high efficiency retroviral promoter, resulting in a high efficiency of transcription and protein production. Therefore, retroviral expression can be used with cells that are difficult to transfect, provided the cells are in an active state during mitosis. Because the structural genes of the virus are contained within the packaging cell line, the expression vectors used to clone the gene of interest contain no structural genes of the virus, which both eliminates the possibility of viral revertants and increases the safety of working with viral supernatants as no infectious virions are produced 10.
Here we present a protocol for recombinant retroviral production and subsequent infection of splenic B cells. After isolation, the cultured splenic cells are stimulated with Th derived lymphokines and anti-CD40, which induces a burst of B cell proliferation and differentiation 11. This protocol is ideal for the study of events occurring late in B cell development and differentiation, as B cells are isolated from the spleen following initial hematopoetic events but prior to antigenic stimulation to induce plasmacytic differentiation.
протокол
1. Селезенки В-лимфоцитов изоляции и стимуляции
- Урожай селезенки от AID-дефицитных мышей 12 от 2-3 месяцев. Изоляции селезенки осуществляется в стерильных условиях и органов временно храниться в холодном солевом фосфатном буфере (PBS), содержащей 15% эмбриональной телячьей сыворотки (FBS).
- Селезенка затем перевели в стерильную капот культуры тканей и гомогенизировали в 5 мл PBS дополнена 2,5% FBS. Передача гомогената на 15 мл трубки сокола.
- Центрифуга гомогенизированный образец ткани селезенки на 1000rpm в течение 10 минут при 4 ° С для осаждения клеток.
- Декантируйте супернатант после центрифугирования. Ресуспендируют осадок клеток в 10 мл клеток крови красный (РБК) лизис буфера при комнатной температуре в течение 7 минут, чтобы избежать загрязнения красных кровяных телец.
- Центрифуга образца при 1000 оборотов в минуту в течение 10 минут и сцедить надосадочную и ресуспендирования клеток в 10 мл PBS, содержащего 2,5% FBS.
- Удалить 100 мкл и считать клеток в разведении 1:1000 с использованием стандартного hemacytometer с трипановым синим, чтобы исключить любой мертвых клеток. Примерно 20-30 миллионов клеток могут быть получены в селезенке.
- Центрифуга образца при 1000rpm в течение 10 минут и сцедить супернатант.
- Ресуспендируют гранулы в 0,5% BSA / PBS содержащей 2 мМ ЭДТА в концентрации 10 7 клеток на 90 мкл.
- Добавить анти-CD43 антитела, покрытые магнитных шариков, чтобы клетки специфически связываются не-В-клеток. Используйте 10 мкл бисером на 90 мкл (10 7 клеток). Хорошо перемешать и инкубировать при температуре 4 ° С в течение 20 минут.
- Как только клетки были помечены, вымыть их, добавляя 2,5% FBS / PBS в верхней части трубки. Центрифуга образца при 1000 оборотов в минуту в течение 10 минут.
- Декантируйте супернатант. Ресуспендируют клеток в 0,1% BSA / PBS в концентрации 10х10 7 клеток на миллилитр.
- Гора магнитная сортировку колонок на магнитном сепараторе. Позиция конической трубе непосредственно под колонки для сбора проточные и нагрузки колонки с 3 мл 0,5% BSA / PBS, чтобы премьер и мыть.
- После мытья жидкость текла через, замените ее на новую трубку коллекции. Если в образце составляет менее 1 мл, отрегулируйте объем образца до 1 мл 0,5% BSA / PBS / ЭДТА и загрузить образец в колонку. Загружать только 1 мл максимум клеток на колонке и использовать несколько столбцов, если это необходимо.
- Разрешить клетки пассивно потока через колонку и собирают свободные клетки в конической трубе при колонке. Вымойте графе 4 раза с 3 мл 0,5% BSA / PBS, продолжая собирать проточные.
- Соберите все проточные, в котором CD43 отрицательные покоящихся клеток B будет обогащаться. Откажитесь от колонки. Центрифуга проточные при 1000 оборотов в минуту в течение 10 минут.
- Слейте надосадочную жидкость и добавляют 10 мл среды (15% FCS / + глютамин, Pen / Strep, Номера для Незаменимые аминокислоты, 50 мкМ Β-ME)
- Граф клеток и культуры на 10 6 клеток на мл.
- В целях стимулирования B клеточного роста и пролиферации, дополнения среде с рекомбинантным IL-4 и анти-CD40 антитела, такие, что окончательная концентрация 20 мкг / мл и 1 мкг / мл, соответственно, и передачи клеткам культуры колбу.
- Культура клетки на ночь. Граф клеток и разбавить до 10 6 клеток на миллилитр, добавив, IL-4 и CD40 в случае необходимости.
- Культуры клеток для 72 часов до вирусной инфекции.
2. Трансфекция Производитель Клетки
Используйте установленные протоколы для трансфекции с использованием либо катионными липидами или фосфата кальция. Трансфекции 10 см 3 в пластине построить ДНК, с использованием 100 мкг плазмидной ДНК на пластине. Мы обычно используют фосфат кальция трансфекции метод 13, 14 и отметить высокий титр вирусных когда дополнен хлорохину.
- Используйте 60% -70% сливной клетки Феникс в качестве продюсера ячейки, которые будут трансфекции. В это число клеток слияния должна быть не менее 5 миллионов клеток на 10 см тарелку.
- За час до трансфекции, заменить средства массовой информации со свежими полной информации для роста клеток Феникс.
- В стерильную пробирку eppendorpf, объединить 100 мкг упаковки построить ДНК, 250 мкл 0,5 М CaCl 2, а также настроить конечного объема до 500 мкл стерильной водой
- Использование 1 мл пипетки, энергично перемешать это решение с 500 мкл 2X ГНП в 15 мл трубки полипропилена
- Разрешить эту смесь, чтобы отдохнуть при комнатной температуре в течение 8-10 минут. За это время осадок будет форма.
- Добавить трансфекции смесь по каплям к клеткам в то время как закрученной среды, чтобы равномерно распределить смесь во всем.
- Инкубируйте клетки при 37 ° С в течение 12 часов.
- 12 часов после трансфекции, замените среду с 8 мл полной среды рост клеток B и вернуть клетки 37 ° C инкубатора.
3. Заражение Вынужденное селезенки клетки B
- Удалить супернатант из клеток Феникс 48hr после transfection и передать супернатанта через 0,2 мкм фильтр для удаления любой ячейке мусора.
- Смешайте 3 мл вируссодержащих супернатанта с 3 мл предварительно активированный В-клеток (как в шаге 1). В целях повышения вирусной адсорбции клеток, добавить polybrene в конечной концентрации 16 мкг на мл.
- Infect клетки центрифугированием при 2500 оборотах в минуту в течение 90 минут при температуре 30 ° C.
- Сразу же после спина, инкубировать дальнейшего 48-72 часов при 37 ° C для обеспечения роста и пролиферации клеток.
4. Анализ проточной цитометрии
- Использование потока цитометр, анализировать клетки для поверхностного выражения B220 и поверхностных IgG1. Наличие IgG1 на поверхности клеток показывает, что рекомбинация класса переключатель произошло в результате успешного спасения через ретровирусных дополняемости ПОМОЩИ гена.
5. Представитель Результаты
Мы успешно спасли дефицита Активация белка фактор индуцированного дезаминазы цитидин (AID) от AID-дефицитных (AID-/ -) В-лимфоциты использовании ретровирусной трансдукции. Одним словом, мы получили рекомбинантные ретровирусы выражения мыши AID (горничная) белка путем трансфекции клеток с Phoenix PMX-рабыни GFP 15-18. Собрано вирусы были инфицированы в AID B-дефицитных клеток, полученных от AID-дефицитных мышей в бывшей естественных класса переключатель рекомбинации (КСО) стимуляции условиях 19. Инфицированных клеток затем были проанализированы в области КСО для IgG1 после 72 часа в культуре с использованием анализа проточной цитометрии. На рисунке 2 показан обнаружения IgG1 на поверхности В-клеток с AID, но не пустой строить, указывая, что КСО произошло в результате ПОМОЩИ спасательных выражения.
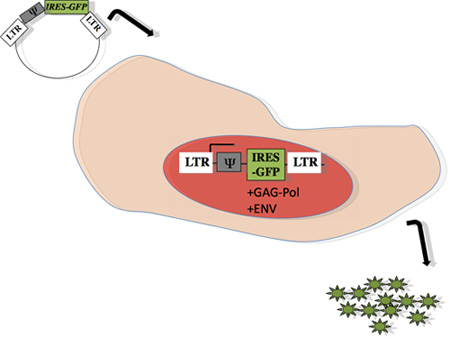
Рисунок 1: Схема ретровирусных упаковке в течение производитель клеток: Гена интерес, в лице Ψ, субклонировали PMX-IRES-GFP, как описано выше 15. Плазмиду трансфицировали в ecotropic вирусных клеточной линии упаковки, способных производить кляп-пол и конверт белка (Феникс, Orbigen), используя метод фосфата кальция 13, 14. Сорок восемь часов после трансфекции, супернатант, содержащий вирусные частицы были собраны для инфекции в целевой первичных клеток, полученных от мышей.

Рисунок 2: ПОМОЩЬ В дефицитных клеток, стимулированных анти-CD40 и ИЛ-4 были инфицированы ретровирусом содержащие PMX-рабыни GFP или ретровируса выражения GFP в одиночку. Уровень корпоративной социальной ответственности в IgG1 оценивалась с помощью анализа FACS.
Обсуждение
Ретровирусные трансдукции клеток селезенки, как описано здесь и как изображено на рисунке 1, генетический подход, который полезен при изучении В-лимфоцитов, поскольку многие из развития событий в lymphopoesis контролируются регуляции транскрипции 1, 2. В более поздних...
Раскрытие информации
Благодарности
СК при поддержке Колумбийского университета Высшей программы. UB является членом лейкемии и лимфомы общества Америки, получателем Новая премия следователя от лейкемии исследовательского фонда и при поддержке Колумбийского университета в Нью факультет стартовый капитал.
Материалы
| Name | Company | Catalog Number | Comments |
| FCS | Atlanta Biologicals | S11550 | |
| RPMI | Invitrogen | 22400 | |
| PBS | Invitrogen | 20012 | |
| Red Blood Cell (RBC) lysis buffer | Sigma-Aldrich | R7757 | |
| CD43 beads | Miltenyi Biotec | ||
| B Cell Complete Media | Various | Various Components | RPMI, 15% FCS, 1% Non-Essential Amino Acids, 1% Sodium Pyruvate, 1% HEPES, 1% Pen-Strep, 50μM β-Mercapt–thanol |
| IL-4 | |||
| Anti-CD40 | BD Biosciences | 553787 | |
| polybrene | Sigma-Aldrich | 107689 | |
| Chloroquine diphosphate salt | Sigma-Aldrich | C6628 | Used at 100mM |
| Ph–nix Eco cells (Murine) | Orbigen | RVC-10002 | |
| PE-Cy5-α-mouse-CD45R (B220) | eBioscience | 15-0452-81 | |
| PE-α-mouse-IgG1 | BD Biosciences | A85-1 |
Ссылки
- Bartholdy, B., Matthias, P. Transcriptional control of B cell development and function. Gene. 327, 1-23 (2004).
- Henderson, A., Calame, K. Transcriptional regulation during B cell development. Annu Rev Immunol. 16, 163-200 (1998).
- Graf, T. Differentiation plasticity of hematopoietic cells. Blood. 99, 3089-30101 (2002).
- Xiao, C., Rajewsky, K. MicroRNA control in the immune system: basic principles. Cell. 136, 26-36 (2009).
- Waterston, R. H. Initial sequencing and comparative analysis of the mouse genome. Nature. 420, 520-562 (2002).
- Griffiths, A. J. F., Miller, J. H., Suzuki, D. T., Lewontin, R. C., Gelbart, W. M. . Introduction to Genetic Analysis. , (2000).
- Gondo, Y. Next-generation gene targeting in the mouse for functional genomics. BMB Rep. 42, 315-3123 (2009).
- Plachy, J. Proviruses selected for high and stable expression of transduced genes accumulate in broadly transcribed genome areas. J Virol. 84, 4204-4211 (2010).
- Felice, B. Transcription factor binding sites are genetic determinants of retroviral integration in the human genome. PLoS One. 4, e4571-e4571 (2009).
- Karavanas, G. Cell targeting by murine retroviral vectors. Crit Rev Oncol Hematol. 28, 7-30 (1998).
- Noelle, R. J. A 39-kDa protein on activated helper T cells binds CD40 and transduces the signal for cognate activation of B cells. Proc Natl Acad Sci U S A. 89, 6550-6554 (1992).
- Muramatsu, M. Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 102, 553-563 (2000).
- Yelle, J., Dion, M., Hamelin, C. Efficient transfection of mammalian cells with viral DNA in optimal culture conditions. J Virol Methods. 7, 321-326 (1983).
- Chen, C., Okayama, H. High-efficiency transformation of mammalian cells by plasmid DNA. Mol Cell Biol. 7, 2745-2752 (1987).
- Fagarasan, S. In situ class switching and differentiation to IgA-producing cells in the gut lamina propria. Nature. 413, 639-6343 (2001).
- Basu, U. The AID antibody diversification enzyme is regulated by protein kinase A phosphorylation. Nature. 438, 508-5011 (2005).
- McBride, K. M. Regulation of class switch recombination and somatic mutation by AID phosphorylation. J Exp Med. 205, 2585-2594 (2008).
- Barreto, V. M. AID from bony fish catalyzes class switch recombination. J Exp Med. 202, 733-738 (2005).
- Delphin, S., Stavnezer, J. Regulation of antibody class switching to IgE: characterization of an IL-4-responsive region in the immunoglobulin heavy-chain germline epsilon promoter. Ann N Y Acad Sci. 764, 123-135 (1995).
- Castigli, E. CD40 expression and function in murine B cell ontogeny. Int Immunol. 8, 405-411 (1996).
- Ballantyne, J. Efficient recombination of a switch substrate retrovector in CD40- activated B lymphocytes: implications for the control of CH gene switch recombination. J Immunol. 161, 1336-1347 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены