Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Rekombinanten retroviralen Produktion und Infektion von B-Zellen
In diesem Artikel
Zusammenfassung
Ein effizientes System der Struktur-und Funktionsanalyse eines Gens in einer Ex vivo Kultur der Milz B-Lymphozyten beschrieben. Diese Methode nutzt die Vorteile der rekombinanten retroviralen Produktion in ein Helfer frei, ecotrophic Verpackungs-Zelllinie. Stabile, vererbbare Expression eines Gens von Interesse innerhalb des primären Lymphozyten erreicht, was zu Generation Oberfläche Antikörper auf B-Zellen durchlaufen Klasse wechseln Rekombination.
Zusammenfassung
Die transgenen Expression von Genen in eukaryotischen Zellen ist ein leistungsfähiges reverse genetische Ansatz, bei dem ein Gen von Interesse unter der Kontrolle eines heterologen Expressionssystem exprimiert wird, um die Analyse der resultierenden Phänotyp zu erleichtern. Dieser Ansatz kann verwendet werden, um ein Gen, das normalerweise nicht in den Organismus gefunden auszudrücken, um eine mutierte Form des Gens Produkt zum Ausdruck bringen, oder zu überexprimieren eine dominant-negative Form des Genprodukts werden. Es ist besonders nützlich in der Studie des hämatopoetischen Systems, wo Transkriptionsregulation ist ein wichtiger Kontrollmechanismus in der Entwicklung und Differenzierung von B-Zellen 1, in 2-4 überprüft.
Mausgenetik ist ein leistungsfähiges Werkzeug für die Erforschung der menschlichen Gene und Krankheiten. Eine vergleichende Analyse der Maus und menschlichen Genoms offenbart Erhaltung der Syntenie in mehr als 90% des Genoms 5. Außerdem ist ein Großteil der Technologie in Maus-Modellen verwendet werden für das Studium der menschlichen Gene, zum Beispiel Gendisruptionen und allelische Austausch 6 . Allerdings erfordert die Schaffung einer transgenen Maus ein hohes Maß an Ressourcen sowohl eine finanzielle und technische Natur. Mehrere Projekte wurden begonnen, um Bibliotheken von Knock-out-Maus-Stämme (KOMP, EUCOMM, NorCOMM) oder Mutagenese induzierte Belastungen (RIKEN), die großen Anstrengungen und Zusammenarbeit 7 erfordern kompilieren. Daher ist es wünschenswert, erste Studie der Phänotyp eines gewünschten Gens in einer Zellkultur-Modell von primären Zellen vor fortschreitend bis zu einem Mausmodell.
Retrovirale DNA integriert in die Wirts-DNA, vorzugsweise innerhalb oder in der Nähe Transkription Einheiten oder CpG-Inseln, die sich in stabilen und vererbbar Ausdruck des verpackten Gen von Interesse unter Vermeidung transkriptionellen Silencing 8 9. Die Gene werden dann unter der Kontrolle von einem hohen Wirkungsgrad retroviralen Promotor transkribiert, was zu einer hohen Effizienz der Transkription und Protein-Produktion. Daher kann retroviralen Expressionsvektor mit Zellen, die schwer zu transfizieren sind, verwendet werden, sofern die Zellen in einen aktiven Zustand während der Mitose. Da die strukturellen Gene des Virus innerhalb der Verpackungs-Zelllinie enthalten sind, enthalten die Expressionsvektoren verwendet werden, um das Gen von Interesse Klon keine strukturellen Gene des Virus, das sowohl die Möglichkeit der viralen Revertanten beseitigt und erhöht die Sicherheit bei der Arbeit mit viralen Überständen da keine infektiösen Virionen sind 10 hergestellt.
Hier präsentieren wir ein Protokoll für die rekombinante retrovirale Produktion und nachfolgende Infektion von Milz-B-Zellen. Nach der Isolierung werden die kultivierten Milzzellen mit Th abgeleitet Lymphokine und anti-CD40, die einen Ausbruch von B-Zell-Proliferation und Differenzierung 11 induziert stimuliert. Dieses Protokoll ist ideal für die Untersuchung der Ereignisse am späten B-Zell-Entwicklung und Differenzierung, wie B-Zellen aus der Milz nach der ersten hämatopoetischen Ereignisse, sondern vor antigenen Stimulation plasmazelluläre Differenzierung induzieren isoliert sind.
Protokoll
1. Milz B-Lymphozyten-Isolierung und Stimulation
- Ernten Sie die Milz von AID-defizienten Mäusen 12 zwischen 2-3 Monate alt. Die Isolierung der Milz ist in sterilen Bedingungen durchgeführt und die Organe sind vorübergehend in kaltem Phosphatpuffer (PBS) mit 15% fötalem Rinderserum (FBS) gehalten.
- Die Milz wird dann auf eine sterile Gewebekultur Haube übertragen und homogenisiert in 5 ml PBS mit 2,5% FBS. Übertragen Sie die Homogenat in ein 15 ml Falcon-Röhrchen.
- Centrifuge der homogenisierten Milzgewebe Probe bei 1000rpm für 10 Minuten bei 4 ° C die Zellen zu pelletieren.
- Den Überstand nach Zentrifugation. Zellpellet in 10 ml roter Blutkörperchen (RBC) Lysepuffer bei Raumtemperatur für 7 Minuten, um eine Verunreinigung durch rote Blutkörperchen zu vermeiden.
- Centrifuge Probe bei 1000 rpm für 10 Minuten und Dekantieren des Überstandes und Resuspendieren der Zellen in 10 mL PBS mit 2,5% FBS.
- Nehmen Sie 100 ul Aliquot und zählen Sie die Zellen bei einer 1:1000 Verdünnung mit einem Standard-Hämazytometer mit Trypanblau keine toten Zellen auszuschließen. Etwa 2 bis 30 Zellen pro Milz gewonnen werden.
- Centrifuge Probe bei 1000rpm für 10 Minuten und Dekantieren des Überstandes.
- Das Pellet in 0,5% BSA / PBS mit 2mM EDTA in einer Konzentration von 10 7 Zellen pro 90 ul.
- Add anti-CD43 Antikörper beschichteten magnetischen Kügelchen in die Zellen spezifisch zu binden non-B-Zellen. Verwenden Sie 10 l Perlen pro 90 &mgr; l (10 7 Zellen). Gut mischen und inkubieren Sie bei 4 ° C für 20 Minuten.
- Sobald die Zellen markiert sind, waschen Sie sie durch Zugabe von 2,5% FBS / PBS auf der Tube oben. Centrifuge Probe bei 1000 rpm für 10 Minuten.
- Den Überstand. Resuspendieren der Zellen in 0,1% BSA / PBS in einer Konzentration von 10x10 7 Zellen pro ml.
- Montieren Sie einen magnetischen Sortierspalte auf einem Magnetabscheider. Position eine konische Röhre direkt unter der Spalte auf der Flow-through sammeln und laden Sie die Spalte mit 3 ml 0,5% BSA / PBS zu grundieren und zu waschen.
- Sobald die Waschflüssigkeit durchströmt hat, mit einer neuen Kollektion Rohr zu ersetzen. Wenn die Probe weniger als 1 mL, passen Probenvolumen 1 ml mit 0,5% BSA / PBS / EDTA und laden Sie die Probe in der Säule. Legen Sie immer nur 1 mL maximal Zellen pro Spalte und verwenden mehrere Spalten, wenn nötig.
- Lassen Sie die Zellen passiv durch die Säule fließen und sammeln Sie die ungebundenen Zellen in den konischen Rohr unter der Spalte. Die Säule wird 4 mal mit 3 ml 0,5% BSA / PBS während sie weiterhin die Durchströmung zu sammeln.
- Sammeln Sie alle flow-through in die CD43 negativen ruhende B-Zellen angereichert werden. Entsorgen Sie die Spalte. Centrifuge Flow-Through bei 1000 rpm für 10 Minuten.
- Lassen Sie den Überstand und 10 ml Medium (15% FCS / + Glutamin, Pen / Strep, Non-essentielle Aminosäuren, 50 uM Β-ME)
- Zählen Sie die Zellen und Kultur bei 10 6 Zellen pro ml.
- Um B-Zell-Wachstum und die Proliferation zu stimulieren, zu ergänzen, das Medium mit rekombinantem IL-4 und anti-CD40 Antikörper, so dass die Endkonzentrationen 20 pg / ml und 1 pg / mL sind jeweils, und übertragen Sie die Zellen auf eine Kulturflasche.
- Kultur der Zellen über Nacht. Zählen von Zellen und verdünnt auf 10 6 Zellen pro ml, Zugabe von IL-4 und CD40 als angemessen.
- Kultur-Zellen für 72 Stunden vor der Virusinfektion.
2. Die Transfektion von Zellen Producer
Verwenden Sie etablierte Protokolle für die Transfektion entweder kationische Lipide oder Calciumphosphat. Transfizieren 10cm 3 Platten pro DNA-Konstrukt, mit 100 pg Plasmid-DNA pro Platte. Wir verwenden routinemäßig Calciumphosphat-Transfektion Methode 13, 14 und beachten hohe Virustiter, wenn sie mit Chloroquin ergänzt.
- Verwenden Sie 60% -70% konfluent Phoenix-Zellen als Produzent Zellen transfiziert werden. An dieser Einmündung Zellzahl sollte 5 Millionen Zellen pro 10 cm Platte sein.
- Eine Stunde vor der Transfektion, ersetzen Sie die Medien mit frischen komplette Medien für Phoenix Zellwachstum.
- In einem sterilen eppendorpf Rohr verbinden 100 ug Verpackung Konstrukt-DNA, 250 ul 0,5 M CaCl 2, und auf das Endvolumen auf 500 ul mit sterilem Wasser
- Mit einer 1 ml Pipette kräftig mischen diese Lösung mit 500 ul 2X HNP in einem 15mL Polypropylenröhrchen
- Lassen Sie diese Mischung bei Raumtemperatur für 8-10 Minuten ruhen lassen. Während dieser Zeit ein Niederschlag bildet.
- Fügen Sie die Transfektion Mischung, um die Zellen tropfenweise während Verwirbelung des Mediums gleichmäßig zu verteilen das Gemisch im gesamten.
- Inkubieren Sie die Zellen bei 37 ° C für 12 Stunden.
- 12 Stunden nach der Transfektion, ersetzen Sie das Medium mit 8ml komplette B-Zell-Nährmedium und kehren die Zellen an die 37 ° C Inkubator.
3. Die Infektion von Stimulated Milz B-Zellen
- Entfernen von Phoenix-Zellen 48hr post-transfe Überstandktion und die überstehende durch einen 0,2-Mikrometer-Filter, um alle Zelltrümmer zu entfernen.
- Mix 3 ml Virus-haltige Überstand mit 3 ml pre-aktivierten B-Zellen (wie in Schritt 1). Um virale Adsorption an die Zellen zu erhöhen, fügen Polybren bei einer Endkonzentration von 16 ug pro mL.
- Infizieren die Zellen durch Zentrifugation bei 2500 rpm für 90 Minuten bei 30 ° C.
- Unmittelbar nach dem Spin, eine weitere 48-72 Stunden bei 37 ° C inkubieren, um für das Zellwachstum und die Proliferation zu ermöglichen.
4. Durchflusszytometrie
- Mit einem Durchflusszytometer, analysieren die Zellen für Oberflächen-Expression von B220 und Oberfläche IgG1. Die Anwesenheit von IgG1 an der Oberfläche der Zellen zeigt, dass Klasse-Schalter Rekombination wurde als Ergebnis einer erfolgreichen Rettung über den retroviralen Komplementierung der AID-Gen aufgetreten.
5. Repräsentative Ergebnisse
Wir haben erfolgreich den Mangel an dem Protein Faktor Activation Induced Cytidindeaminase (AID) von AID-Mangel (AID-/ -) gerettet B-Lymphozyten mittels retroviraler Transduktion. Kurz gesagt, erwirtschafteten wir rekombinante Retroviren exprimierende Maus AID (MAID)-Protein durch Transfektion Phoenix-Zellen mit PMX-MAID-GFP 15-18. Die geernteten Viren wurden in AID-defizienten B-Zellen aus AID-defizienten Mäusen in ex vivo-Klasse wechseln, Rekombination (CSR) Stimulationsbedingungen 19 erhaltenen infiziert. Die infizierten B-Zellen wurden dann für CSR zu IgG1 nach 72 Stunden in Kultur mittels Durchflusszytometrie analysiert. Abbildung 2 zeigt den Nachweis von IgG1 an der Oberfläche von B-Zellen mit AID, aber nicht die leeren konstruieren, was darauf hinweist, dass CSR hat als Folge der AID Ausdruck Rettung aufgetreten.
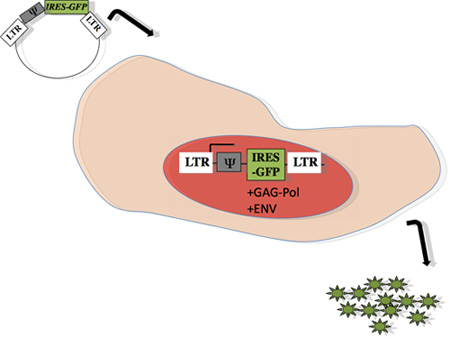
Abbildung 1: Schema des retroviralen Verpackung innerhalb Produzentenzellen: Gene von Interesse, durch Ψ vertreten, wurde in PMX-IRES-GFP subkloniert, wie zuvor 15 beschrieben. Das Plasmid wurde in eine ecotropen virale Verpackungs-Zelllinie in der Lage, gag-pol und Hüllprotein (Phoenix, Orbigen), mit Calciumphosphat-Methode 13, 14, transfiziert. Achtundvierzig Stunden nach der Transfektion wurde der Überstand mit viralen Partikeln für eine Infektion in primären Ziel B-Zellen aus Mäusen gewonnen geerntet.

Abbildung 2: AID defizienten B-Zellen mit anti-CD40 stimuliert und IL-4 wurden mit einem Retrovirus mit PMX-MAID-GFP oder ein Retrovirus, die GFP allein infiziert. Die Höhe der CSR zu IgG1 wurde durch FACS-Analyse ausgewertet.
Diskussion
Retrovirale Transduktion von Milz-B-Zellen, wie hier beschrieben und wie abgebildet in Abbildung 1 ist eine genetische Ansatz, die nützlich bei der Untersuchung der B-Lymphozyten ist, weil viele der Entwicklungs-Veranstaltungen in lymphopoesis durch Regulation der Transkription 1, 2 gesteuert werden. In den späteren Stadien der B-Zell-Reifung, Triggerung über CD40L ist essentiell für die Induktion der B-Zell-Wachstum, Eintritt in den Zellzyklus und Proliferation 11, 20. Wie in ...
Offenlegungen
Danksagungen
CK wird von der Columbia University Graduate-Programm unterstützt. UB ist Fellow der Leukemia and Lymphoma Society of America, die Empfänger von New Investigator Award der Leukämie Research Foundation und wird von der Columbia University New Faculty Anschubfinanzierung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| FCS | Atlanta Biologicals | S11550 | |
| RPMI | Invitrogen | 22400 | |
| PBS | Invitrogen | 20012 | |
| Red Blood Cell (RBC) lysis buffer | Sigma-Aldrich | R7757 | |
| CD43 beads | Miltenyi Biotec | ||
| B Cell Complete Media | Various | Various Components | RPMI, 15% FCS, 1% Non-Essential Amino Acids, 1% Sodium Pyruvate, 1% HEPES, 1% Pen-Strep, 50μM β-Mercapt–thanol |
| IL-4 | |||
| Anti-CD40 | BD Biosciences | 553787 | |
| polybrene | Sigma-Aldrich | 107689 | |
| Chloroquine diphosphate salt | Sigma-Aldrich | C6628 | Used at 100mM |
| Ph–nix Eco cells (Murine) | Orbigen | RVC-10002 | |
| PE-Cy5-α-mouse-CD45R (B220) | eBioscience | 15-0452-81 | |
| PE-α-mouse-IgG1 | BD Biosciences | A85-1 |
Referenzen
- Bartholdy, B., Matthias, P. Transcriptional control of B cell development and function. Gene. 327, 1-23 (2004).
- Henderson, A., Calame, K. Transcriptional regulation during B cell development. Annu Rev Immunol. 16, 163-200 (1998).
- Graf, T. Differentiation plasticity of hematopoietic cells. Blood. 99, 3089-30101 (2002).
- Xiao, C., Rajewsky, K. MicroRNA control in the immune system: basic principles. Cell. 136, 26-36 (2009).
- Waterston, R. H. Initial sequencing and comparative analysis of the mouse genome. Nature. 420, 520-562 (2002).
- Griffiths, A. J. F., Miller, J. H., Suzuki, D. T., Lewontin, R. C., Gelbart, W. M. . Introduction to Genetic Analysis. , (2000).
- Gondo, Y. Next-generation gene targeting in the mouse for functional genomics. BMB Rep. 42, 315-3123 (2009).
- Plachy, J. Proviruses selected for high and stable expression of transduced genes accumulate in broadly transcribed genome areas. J Virol. 84, 4204-4211 (2010).
- Felice, B. Transcription factor binding sites are genetic determinants of retroviral integration in the human genome. PLoS One. 4, e4571-e4571 (2009).
- Karavanas, G. Cell targeting by murine retroviral vectors. Crit Rev Oncol Hematol. 28, 7-30 (1998).
- Noelle, R. J. A 39-kDa protein on activated helper T cells binds CD40 and transduces the signal for cognate activation of B cells. Proc Natl Acad Sci U S A. 89, 6550-6554 (1992).
- Muramatsu, M. Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell. 102, 553-563 (2000).
- Yelle, J., Dion, M., Hamelin, C. Efficient transfection of mammalian cells with viral DNA in optimal culture conditions. J Virol Methods. 7, 321-326 (1983).
- Chen, C., Okayama, H. High-efficiency transformation of mammalian cells by plasmid DNA. Mol Cell Biol. 7, 2745-2752 (1987).
- Fagarasan, S. In situ class switching and differentiation to IgA-producing cells in the gut lamina propria. Nature. 413, 639-6343 (2001).
- Basu, U. The AID antibody diversification enzyme is regulated by protein kinase A phosphorylation. Nature. 438, 508-5011 (2005).
- McBride, K. M. Regulation of class switch recombination and somatic mutation by AID phosphorylation. J Exp Med. 205, 2585-2594 (2008).
- Barreto, V. M. AID from bony fish catalyzes class switch recombination. J Exp Med. 202, 733-738 (2005).
- Delphin, S., Stavnezer, J. Regulation of antibody class switching to IgE: characterization of an IL-4-responsive region in the immunoglobulin heavy-chain germline epsilon promoter. Ann N Y Acad Sci. 764, 123-135 (1995).
- Castigli, E. CD40 expression and function in murine B cell ontogeny. Int Immunol. 8, 405-411 (1996).
- Ballantyne, J. Efficient recombination of a switch substrate retrovector in CD40- activated B lymphocytes: implications for the control of CH gene switch recombination. J Immunol. 161, 1336-1347 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten