Method Article
与耳蜗内毛细胞传入树突:多泡发布监测功能区突触的突触后录音
摘要
全细胞膜片钳从听觉神经纤维在哺乳动物的耳蜗内毛细胞带状突触树突。
摘要
之间的内毛细胞(IHC)和听觉神经纤维传入突触提供一个electrophysiologically访问网站的记录 1-4单一的带状突触的突触后活动。感觉细胞带状突触释放的神经递质不断,这是调制在IHC膜电位的梯度变化的响应率。带状突触已被证明经营,多泡释放,可以释放多个水泡,同时唤起人们的兴奋性突触后电流(EPSCs)不同振幅1,4,6-11 。无论是突触前的色带,也不多泡释放的内在机制的作用,是目前很好的理解。
10-20听觉神经纤维,并与每一个结束,形成一个单一的带状突触的无髓单纤维接触的免疫组化免疫组化是支配。传入boutons联系综合家居照顾服务(直径约1微米)的小尺寸,使具有特殊时空分辨率进行录制。此外,该技术可以适应记录前和突触后细胞的同时,允许在突触传递函数进行研究,直接2。因此,这种方法提供了一个由神经传递的基本方面,可以研究的方法,从多泡释放的感觉细胞剪彩难以捉摸的功能。
研究方案
1。解决方案
- 解决方案,可提前做好准备。在4 ° C外解决方案,可存储长达一个月。内部解决方案等分可以储存冷冻(-20℃)。确定的解决方案,在室温下开始实验前。
- 剖析解决方案和细胞外记录解决方案(毫米):5.8氯化钾; 144氯化钠, 氯化镁 2 0.9; 1.3氯化钙0.7的NaH 2 PO 4 5.6葡萄糖; 10 HEPES; 1丙酮酸钠,pH值7.4(氢氧化钠),300 mOsm 。对于免疫组化的Ca 2 +电流隔离外的解决方案可以修改显示:5.8氯化钾; 114氯化钠,氯化镁2 0.9; 1.3氯化钙0.7 的NaH 2 PO 4 5.6葡萄糖; 10 HEPES 30茶氯离子,pH值7.4 (氢氧化钠); 300 mOsm。
- 1-2μM河豚毒素(TTX)可以添加到细胞外液块电压门控钠离子通道和隔离兴奋性突触后电流或电位(EPSCs或EPSPS)。
- 细胞内记录解决方案(毫米):20氯化钾; 110 K -磺酸; 5 MgCl 2的0.1氯化钙; 5 EGTA; 5 HEPES; 5 NA 2 ATP; 0.3 NA 2的GTP; 5 NA 2 phoshocreatine,pH值7.2(氢氧化钾) , 290 mOsm;或135氯化钾,氯化镁2 3.5 0.1 氯化钙 ; 5 EGTA; 5 HEPES; 4 NA 2 ATP; 0.2 NA 2的GTP; pH值7.2(KOH),290 mOsm。 IHC胞内溶液的Ca 2 +电流隔离:135 CsMeSO3 13茶氯; 氯化镁 2 3.5 2.5 NA 2 ATP; 1 EGTA,pH值7.2(CsOH); 290 mOsm 。这个解决方案会阻止一个大得多的K +电导数额巨大,目前剩下的留下的Ca 2 +。
2。为持有解剖组织
- 修改盖玻片使用期间举行录音准备到位,也可以提前做好准备。
- 应用Sylgard(道康宁,美联,MI)的下降对一个圆形的玻璃盖玻片(8-12毫米)边缘。将盖玻片(FST,项目没有26002-10)罚款昆虫针粗末。昆虫的脚紧紧地握住反对用钳玻璃和一个加热线圈设置sylgard附近举行。
3。制作电极
- 准备新鲜的电极上每一个实验的当天和储存在密封盒。十到二十的电极制造为每个准备。
- 选择电极的玻璃,我们用1毫米的高硼硅玻璃毛细管(1B100F - 4 WPI的,萨拉索塔,佛罗里达州)。
- 设计上一个多步骤的拉马拉电极的尖端直径约为2-3微米(〜6MΩ在上文所述的解决方案)的方案。我们使用一个萨特的P - 87多步的水平拉拔或一个Narishige垂直PC - 10拉马。
- 仔细大衣Sylgard电极柄接近尽可能的一角。这降低吸管电容和录音噪音降到最低。
- 消防波兰电极使用,如加热灯丝,从WPI的一个microforge。消防抛光电极应该有一个外尖端直径约1微米(在上文所述的解决方案10-15MΩ)。吸管壁的厚度大约是1 / 3微米。外径大小要修补传入布顿。
- 在实施同步录音的情况下:IHC吸管应构建以同样的方式(相同的玻璃,拉程序相同)的区别,火抛光应该留下一个较大的尖端直径〜3微米(6 - 8MΩ)。
4。设置实验
- 填写商会与重力美联储灌注系统外的解决方案和测试解决方案,含有药物或毒素的利益。
- 设置灌注,使浴体积约2毫升,不断灌注在一个速率为1.5 mL min - 1的顺序。
- 如果与局部灌注系统的实验过程中应用不同的解决方案,填补水库的解决方案。通过系统运行的解决方案,并确保没有气泡。
5。夹层和样品制备
- 所附的影片,说明了三个星期的老年大鼠(只Dawley,查尔斯河),这是较早期产后阶段的困难Corti器的夹层。记录从不同年龄大鼠的优点和缺点是审查讨论。
- 深刻异氟醚吸入麻醉大鼠。缺席时撤回反射和角膜反射严重抑郁,杀头。由约翰霍普金斯大学的动物护理和使用委员会已批准了这些程序。
- 删除从口鼻和皮肤的断头头。对开的头,并取出大脑暴露颞骨。
- 颞骨和地方清洁解剖菜含有标准细胞外液中删除。
- 删除颞骨骨封装,以揭露耳蜗。颞骨保持牢固的基地一双镊子。确定的圆形和椭圆形的窗户。定位耳蜗卵圆窗和螺旋式侧耳蜗朝上,使围绕耳蜗中删除多余的骨。
- 取出的骨封装耳蜗感觉上皮暴露,同时注意保护根尖线圈,将用于实验。使用第二对的罚款钳直接芯片关闭耳蜗的骨,开始与该地区比其他骨更透明。这里的骨较薄和容易消除。继续删除从根尖线圈周围的骨头。
- 使用微解剖剪刀穿过下方顶转的modiolus。然后断开从根尖耳蜗较低轮流转。
- 再次使用微解剖剪刀,如果有必要,以确保根尖又是完全切断。注意保护根尖线圈,它不应该拉或拉伸。用细镊子哄其余耳蜗根尖转。
- 取出根尖转两侧的骨休息。
- 小心取出血管纹,位于外毛细胞的区域(示意图1)组织的光亮带钢。请一定要避免删除的感觉毛细胞,它可以很容易脱落,血管纹沿。
- 用细镊子分离盖膜,有光泽,半透明膜,坐在上面的感觉毛细胞。
- 现在,修剪多余的组织和骨和扁平镊子准备。这是必要的,这样的组织可以放在下针均匀。
- 下放置的引脚连接到盖玻片(先前准备),照顾引脚的位置,离毛细胞的准备。
- 使用镊子盖玻片转移到录音室。确保人工耳蜗组织是完全下降而细胞外液转移盖玻片覆盖。按盖玻片下来到会议厅的玻璃底部牢固,以确保它在录制过程中不动。
- 立即着手与细胞外液灌注,以确保更好地生存的准备。
6。记录
- 找到准备通过显微镜目镜使用的10倍和40倍水浸泡DIC的目标。定位的准备记录电极可以使正交方法综合家居照顾服务的IHC侧壁。
- 如果准备卷曲,限制的综合家居照顾服务的基础地区的能见度,使用记录电极反推玻璃盖玻片的外缘下来的准备,照顾,以避免按综合家居照顾服务自己。
- *如果使用幼鼠,在这个阶段厚厚的一层以上的毛细胞,支持细胞,可以用清洁吸管(与尖端直径约10-20微米),以获得感官细胞1列,12中删除。
- 使用的监控,以评估是否是健康的组织。使用显微镜和NC70 Newvicon相机的4倍的放大倍率镜头,进一步放大图像和项目,面积约4800μm 的监视器上2。应拉长毛细胞具有完整的发束。当组织恶化,毛细胞膨胀并变得更加透明和颗粒感。
- 围绕基地的综合家居照顾服务本地化传入boutons。 Boutons是球形或椭圆形,直径约1微米,在一个闪亮的外观颜色的光。 boutons多数本地化细胞核水平以下。当组织,是不健康的boutons膨胀到正常大小约4倍,成为透明的,而不是有光泽,。
- 填写记录电极与细胞内的解决方案,适用于正压和使用的显微操纵电极的准备。
- 进行编制的免疫组化基地与电极水平的切口。按电极之间的一层薄薄的支持细胞和综合家居照顾服务,使用正压伪造通道在该地区的综合家居照顾服务的基础。这一步是为达到传入布顿和不支持紧密ensheath传入神经末梢的细胞,记录的“钥匙”。
- 小心地取出电极和一个充满新鲜的电极更换。
- 使用积极的压力,保持一个干净的电极尖端,通过访问孔机动电极膜的免疫组化。正压应协助在周围的支持细胞周围的综合家居照顾服务的移动。
- 电极周围相邻的支持细胞对传入布顿在所附的影片所示(移动,另一种方法是方法通过移动传入布顿长期的免疫组化膜电极尖端触碰,直至布顿)。确保电极尖端在前面的传入布顿(仍然是一个小的差距之间的布顿和电极由于正压移液器)。 Boutons提供超过支持细胞的抵抗力和免疫组化膜吸管的运动,它们可以“感觉”实验者。
- 移动吸管向上和向下推,以确保,布顿移动。这表明,枪头和布顿在同一Z平面。
- 对传入布顿按的电极,同时释放出积极的压力,适用于吸,形成GΩ的密封。形成一个传入布顿GΩ的密封是到毛细胞相似。印章形成可迅速出现或可能出现缓慢。
- 应用温柔的阵阵吸内的电极膜破裂,并进入全细胞记录配置。
- 如果细胞修补传入布顿,小库容瞬变将出现在广场密封形成过程中监测的测试脉冲(见图1)。我们估计电容传入的结束为0.4 - 1.8 PF( 见3,4) 。如果修补细胞是免疫组化,瞬态将取决于接入电阻的顺序上的3-5倍以上。
- 为了确认该单元格传入布顿,极化和去极化电压步骤运行的协议。传入纤维及综合家居照顾服务(经常打补丁误时,针对传入布顿)的电流电压关系(IVS)是个别的细胞类型的特征,如图2所示。
- 监视器的膜电位;传入纤维,它通常是-60至-65 mV的周围。
- 如果细胞是不是一个传入布顿,一个充满新鲜的电极取出电极,然后重复步骤8 - 13。每次尝试使用新的电极。
- 监控整个串联电阻施加电压的步骤,以确保密封不打烊的记录。如果串联电阻的增加,它可以帮助申请吸温和的脉冲或稍向后移动电极。串联电阻通常是大约30兆欧。分析突触活动时,我们放弃串联电阻大于50MΩ的录音。
- 现在,您可以记录突触活动(见图3)。无论是展品的传入纤维自发活动,或毛细胞需要去极化激活递质释放。应用具有较高的钾浓度(例如40毫米)的细胞外液的毛细胞去极化,往往激活或增加递质释放的速度。
- 对于同步录音的综合家居照顾服务和传入boutons 2,程序应以下列方式进行修改:继续通过步骤1至5。 IHC吸管填写与细胞内相应的解决方案对Ca 2 +电流隔离,并按照6。离开的IHC记录在“等待的立场”接近的IHC记录吸管。继续步骤6 - 14传入记录。当传入的吸管,在整个单元的配置,继续与IHC吸管。 Manoeuvre对相应的免疫组化的侧壁第二移液器,始终保持积极的压力。 IHC应显示侧壁压力缩进,它需要得到保证,支持细胞分离从。步骤12 - 13为免疫组化以及可用于。正如在14日的传入纤维相比,更大的电容瞬变的IHC录制的一个标志,除了特征IV关系。一旦建立了同步录音,应该允许一段时间(3 - 5分钟,根据串联电阻)为细胞内的解决方案,洗成的免疫组化。这将导致更大的Ca 2 +电流由于增加更大的K +电导块。
- 为了执行宽松的密封外录音,在第12步,而不是一个GΩ的密封,到传入布顿一个宽松的密封约30至50MΩ。这可以通过申请,同时释放正压少吸。传入布顿从P21的大鼠细胞外记录的一个例子,请参阅图5。
7。故障排除
- 如果密封可以形成,但细胞贴附过渡到全细胞记录无法实现,吸管内径可能过于狭窄。
- 如果无法形成严密密封,内吸液管直径可能太大,整个布顿可以吸进电极。
- 如果所有的突触事件是小而均匀,录音外传入。测试事件积极的膜电位逆转;细胞内记录EPSCs将扭转积极的潜力。
- 如果串联电阻是一贯的高修补传入终端时,尝试前试图打入整个单元的配置通过吸管向后移动。这有助于防止吸管堵塞和高访问性。
- 无所畏惧的移液器的正确位置。这是可能的电极移动,没有“松动”传入的印章,以减少高串联电阻或吸管堵塞。在建立同步录音,IHC通常是“推”对布顿。传入吸管的位置,可以予以更正。
8。代表性的成果
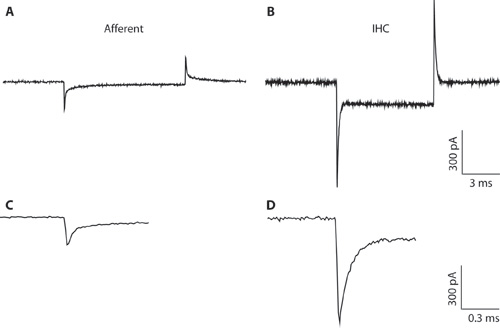
图1。 AB型 。记录传入纤维(A)和免疫组化(二)典型的瞬态极化从-94毫伏的控股电压电压命令到10毫伏。由于狭窄的吸管直径和高访问性,免疫组化录音(B)是不理想的全细胞免疫组化录音。记录显示,这里只说明从综合家居照顾服务和传入神经纤维之间的库容瞬变的区别。这有助于形成全细胞配置时的细胞类型之间的区别。从综合家居照顾服务的全细胞库容瞬变的幅度大于传入纤维的5倍。光盘。从A和B的瞬态显示在一个扩大的时间表。 C.传入的反应衰变可配合两个指数函数。电容传入的结局,估计从快的组成部分。
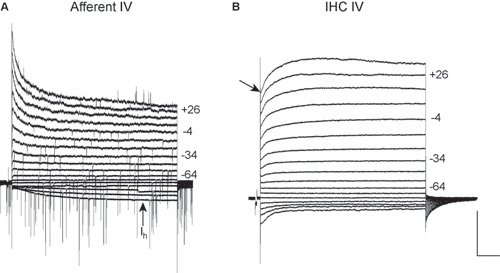
图2四传入布顿(A)和免疫组化(二)关系。从保持电位-84 MV从-124 mV时,以10 mV递增(额定电压)+ 36毫伏的电压步骤IV关系记录。电压显示一些痕迹的权利。这些录音进行了在室温下用5.8毫米外氯化钾。规模为:500 PA,200毫秒。
。IV关系,从出生后第19天的传入纤维。 EPSCs目前在大多数的电压步骤; EPSCs 6 mV的反向积极。此记录进行了在TTX的存在阻断电压门控Na +电流。请注意在极化电压(I H)慢慢激活的内向电流。此电流在综合家居照顾服务或支持细胞中不存在,并提供了一个很好的迹象,记录从细胞传入纤维(见3), B。四,从P19的免疫组化关系。由于狭窄的吸管直径和高访问性,记录不理想的表征IHC电流和电流小于预期。录音显示,在这里可以清晰地分辨出,企图传入纤维录音时,只展示综合家居照顾服务和传入纤维的IV关系。注意积极的潜力,其次是延迟整流钾电流13(箭头)的快速激活外向K +电流。

图3。突触电流传入纤维在40毫米的细胞外K +释放率增加IHC存在从一个在出生后第21天录得的典范。室温TTX,应用于块电压门控Na +电流。规模200 PA,5毫秒,请注意变量的大小和形状的EPSCs。对于EPSC特性的详细描述见 4,B 。 (:多相,O:#单相)标记的两个EPSCs规模的不断扩大显示:刻度100 PA,1毫秒。
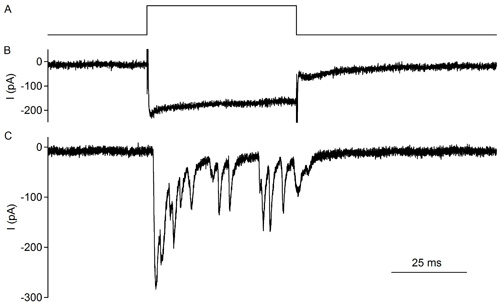
图4。尔蒂,产后10天(也见2)切除大鼠器官的免疫组化和联系传入布顿的同步录音。一个电压阶跃去极化的IHC引发神经递质的释放和激活传入布顿EPSCs 上跟踪:IHC去极化电压的协议。控股的潜力:-79 mV时,50毫秒-29毫伏的步骤中跟踪 :L -型钙 2 IHC 记录电流通常表现出小的失活和负电位激活下部曲线:反应传入纤维突触电流。 IHC去极化。请注意在50毫秒IHC去极化的突触的抑郁症。
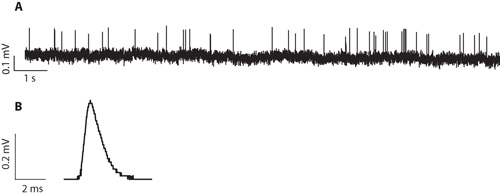
图5。 。传入布顿在产后21天的细胞外记录的典范。这是记录在室温下TURE,用5.8毫米的细胞外K + 。这个录音有一个典型的信号噪声比为记录在准备从3周龄大鼠,B。从P20的传入布顿记录外事件的平均波形。这是从10272事件的平均波形。
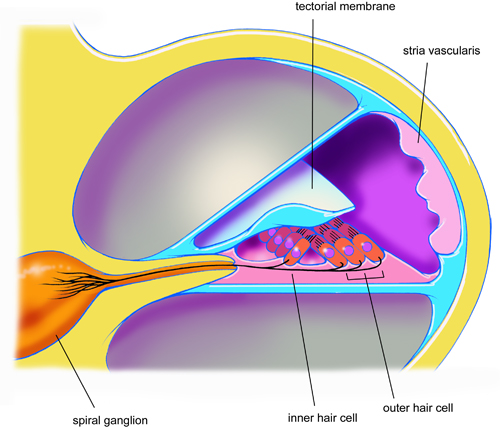
示意图1。穿越说明内层和外层的毛细胞,螺旋神经节,血管纹和盖膜之间的解剖关系的大鼠耳蜗转剖视图。
讨论
在此过程中的关键步骤是剥离。如果组织被拉长,或在夹层中损坏,传入神经纤维将无法生存。年轻的大鼠组织更多的弹性和宽容。我们发现,产后10至11天是最简单的解剖和实验的成功率较高。一个人工耳蜗成熟的重要程度发生出生后,开始听到来自12〜14日龄大鼠。因此,在年龄夹层是最容易的地方,突触可能无法完全成熟。
这里描述的大鼠解剖基本上是小鼠,主要的区别是更小的尺寸小鼠耳蜗相同。这种技术可以在小鼠15 transgenically修改审查带状突触的属性。这种技术的进一步修改包括:标签纤维 3到细胞内的解决方案中加入荧光染料;与突触前的内毛细胞和突触后传入布顿配对录音,让前和突触后细胞之间的传递函数 ,以确定2和宽松密封外录音传入boutons细胞的完整性,以避免损失。外记录的配置比整个单元的配置更容易实现和实验一般持续时间更长。
披露声明
致谢
这项工作是由耳聋研究基金会研究资助支持安永和NIDCD DC006476 EG和NIDCD DC005211听觉和平衡的中心,约翰霍普金斯大学。作品版权添菲尔普斯,美国约翰霍普金斯大学。
LG写了最初的手稿,安永和LG拍摄解剖和录音。所有的作者提供了典范人物,写的稿子做出了贡献。
材料
最重要的是在我们的电设置用于记录传入终端设备。
参考文献
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。