Method Article
蝸牛内有毛細胞に接触求心性樹状突起でのシナプス後録音:リボンシナプスでのモニタリングの多胞体のリリース
要約
哺乳類の蝸牛の内有毛細胞のリボンシナプスにおける聴覚神経線維の樹状突起からのホールセルパッチクランプ記録。
要約
内有毛細胞(IHC)と聴覚の神経線維の間の求心性シナプスでは、単一のリボンシナプス1-4のシナプス活動を記録するための電気生理学的にアクセス可能なサイトを提供しています。感覚細胞のリボンシナプスには、継続的にIHCの膜電位5の段階的変化に応答して変調される率を神経伝達物質を放出する。リボンシナプスは、複数の小胞が振幅1、4、6-11を変化させる興奮性シナプス後電流(EPSCs)を想起させる同時にリリースすることができる多胞体のリリースで動作することが示されている。シナプス前リボンの役割、また多胞体のリリースの根底にある機序は、現在よく理解されています。
IHCは、単一のリボンシナプスを形成するために終了する無髄単で10月20日聴覚の神経線維、およびすべての繊維の接触IHCによって神経支配されています。求心性boutons連絡IHCs(直径約1μm)の小さいサイズが行われる例外的な時間分解能での録音が可能になります。さらに、技術はシナプスでの伝達関数を直接2検討できるように、同時に両方の前とシナプス後細胞から記録するように適合させることができます。このメソッドは、したがって、多胞体のリリースからの感覚細胞のリボンのとらえどころのない機能に、神経伝達の基本的な側面を検討することができる手段を提供します。
プロトコル
1。ソリューション
- ソリューションは事前に準備することができます。細胞外溶液は最長1ヶ月間4℃で保存することができる。内部溶液のアリコート(-20℃)凍結保存することができます。ソリューションは、実験を開始する前に室温にしていることを確認してください。
- 解離液と細胞外記録液(MM):5.8 KClを、144のNaCl、0.9のMgCl 2、1.3 CaCl 2で 、0.7のNaH 2 PO 4、5.6グルコース、10 HEPES、1ナトリウムピルビン酸、pH7.4のナトリウム(NaOH)、300 mOsm。 IHCのCa 2 +電流の分離は、細胞外溶液は、示されたように変更することができます:5.8 KClを、114のNaCl、0.9のMgCl 2、1.3 CaCl 2で 、0.7のNaH 2 PO 4、5.6グルコース、10 HEPES、30 TEAのCl、pH7.4のナトリウム(NaOH )、300 mOsm。
- 1〜2μmのテトロドトキシン(TTX)は電圧依存性ナトリウムチャネルを遮断し、興奮性シナプス後電流または電位を(EPSCsまたはEPSPS)分離するために細胞外溶液に添加することができます。
- 細胞内記録液(MM):20のKCl、110 K -メタンスルホン酸、5のMgCl 2、0.1 CaCl 2を 、5 EGTA、5 HEPES、5のNa 2 ATP、0.3のNa 2 GTP、5のNa 2 phoshocreatine、pHは7.2(KOH)、 290 mOsm、または135のKCl、3.5 MgCl 2を 、0.1のCaCl 2、5 EGTA、5 HEPES、硫酸ナトリウム 、ATP、0.2のNa 2 GTP、pHは7.2(KOH)、290 mOsm。 IHCのCa 2の細胞内液+現在の分離:135 CsMeSO3、13 TEAのCl、3.5のMgCl 2、2.5のNa 2 ATP、1 EGTA、pHが7.2(CsOH)、290 mOsm。このソリューションは、Ca 2を残して 、はるかに大きいのK +コンダクタンスの有意な量をブロックしてしまいます+現在残っている。
2。ディテールに秘められた組織のためにホルダーを作る
- 録音中に場所の準備を保持するために使用される変更されたカバースリップは、事前に準備することができます。
- 円形のガラスのカバースリップ(8-12 mm)の端に向かってSylgard(ダウコーニング、ミッドランド、MI)のドロップを適用します。カバースリップ上に微細な昆虫のピン(FST、アイテムなし26002〜10)の厚さの端を置きます。ピンセットでガラスにしっかりと虫ピンを持ち、sylgardを設定するために、加熱コイルの近くに保持する。
3。電極を作る
- 各実験日および気密ボックス内のストアの新鮮な電極を準備する。それぞれの準備のための十から二十電極を作製。
- 電極のガラスを選択し、我々は1mmホウケイ酸ガラス毛細管(WPI、サラソタ、フロリダ州から1B100F - 4)を使用してください。
- 約2〜3ミクロン(前述のソリューションでMΩ〜6)の先端径と電極をプルするためにマルチステッププラー上のプログラムを設計します。我々は、サターP - 87マルチステップの水平プラーまたはナリシゲ垂直PC - 10プーラーを使用してください。
- 慎重にコートは、Sylgardと電極のシャンクは、できるだけ先端に近い。これは、ピペットの容量を最小限に抑える録音のノイズを減少させます。
- 火 - ポーランド語などのWPIからその利用可能なように加熱されたフィラメントをマイクロフォージを使用して電極。火災洗練された電極は、約1μm(前述のソリューションでMΩ10-15)の外側の先端径を持つ必要があります。ピペットの壁の厚さは約1 / 3程度です。外径は、パッチを適用する求心性神経繊維末端の大きさについて持っています。
- 同時録画を実装する場合には:IHCピペットは、火災の研磨が〜3μmの( - MΩ8 6)の大きい先端径を残す必要があることを区別して、同じ方法(同じガラス、同じ引っ張りプログラム)で構築されるべきである。
4。実験のセットアップ
- 興味のある薬物や毒素を含む細胞外液とテストソリューションを重力飼育の灌流システムに接続されているチャンバーを埋める。
- そのお風呂の容積が約2mLとなるように灌流を設定し、常に1.5 mLの分- 1のオーダーの速度で灌流。
- 別のソリューションがローカル灌流システムを実験中に適用する場合は、ソリューションと貯水池を埋める。システムを介してソリューションを実行しても気泡がないことを確認してください。
5。解剖とサンプル調製
- 付属のムービーは、以前の出生後の段階のそれよりも困難である3週齢のラット(スプラーグドーリー、チャールズリバー)、のためのコルチ器官の解剖を示しています。異なる年齢のラットからの録音の利点と欠点を議論で検討される。
- 深くイソフルラン吸入によりラットをanaesthetize。撤退の反射神経が存在しないと角膜反射がひどく押されたときに、首を切る。これらの手順は、ジョンズホプキンス大学の動物実験委員会によって承認されている。
- 首を切り落とした頭部から鼻と皮膚を取り除きます。頭を二分し、側頭骨を露出するために脳を取り除く。
- 標準細胞外溶液を含むクリーンな解剖皿に側頭骨と場所の両方を削除します。
- 削除蝸牛を露出するように骨は側頭骨をカプセル化する。ピンセットで基部にしっかりと側頭骨を保持する。円形と楕円形の窓を識別します。楕円形の窓と蝸牛の顔を上向きのスパイラル側とは蝸牛の周りに余分な骨を除去するように蝸牛を親しませる。
- 実験に使用される頂コイルを、保護するために注意しながら、感覚上皮を公開する蝸牛をカプセル化して骨を外します。骨の残りの部分よりも透明なエリアから始まる、蝸牛から直接骨をチップに微細な鉗子の2番目のペアを使用してください。ここで骨が薄くして削除する方が簡単です。心尖部コイルの周りから骨を除去続ける。
- 頂回転下蝸牛軸を切って進むためのマイクロ解剖ハサミを使用してください。その後、蝸牛の低い巻数から頂回転を外してください。
- 頂回転が完全に切断されることを保証するために、必要に応じて、再びミクロ解剖ハサミを使用してください。心尖部コイルを保護することに注意、それは引っ張られたり、伸縮してはいけません。蝸牛の残りの部分から頂回転を同軸に微細な鉗子を使用してください。
- 頂回転の両側から骨の残りの部分を削除します。
- 慎重に血管条、有毛細胞の領域(回路図1)の外側に位置する組織の光沢のあるストリップを取り外します。簡単に線条のvascularisとともに切り離さになることができる感覚有毛細胞を、削除しないように確認してください。
- 蓋膜、感覚有毛細胞の上に座っている光沢のある、半透明の膜を切り離すために微細な鉗子を使用してください。
- 今すぐ過剰な組織や骨をトリミングし、ピンセットで準備をフラット化。これは、組織がピンの下に均等に配置できるように、必要である。
- 離れて有毛細胞からピンの位置に注意しながら、カバースリップ(事前に準備)に接続されたピンの下準備を置きます。
- 録音室にカバースリップを転送するために鉗子を使用してください。蝸牛組織が完全にカバースリップを転送しながら、細胞外溶液の液滴で覆われていることを確認します。それが録音中に移動しないことを保証するためにチャンバーのガラスの底にしっかりとカバーを押し下げます。
- 調製直後のより良い生存を確保するため、細胞外溶液を灌流を開始。
6。録画
- 10倍と40倍の水浸DIC目標を用いて顕微鏡の接眼レンズを介しての準備を見つけます。記録電極は、IHCの側壁に直交IHCsに近づくことができるように準備を親しませる。
- 準備がIHCsの基底領域の可視性を制限し、オーバー丸まっている場合は、IHCs自分自身を押すように注意しながら、ガラスのカバースリップに対する準備の外縁を押し下げる方向に記録電極を使用してください。
- 幼若ラットを使用した場合*、この段階で有毛細胞上の細胞を支持するの厚い層は、感覚細胞1、12にアクセスするために洗浄ピペット(〜10月20日程度の先端の直径)で削除することができます。
- 組織が健全であるかどうかを評価するためのモニターを使用してください。顕微鏡とNC70 Newviconのカメラの間に4倍の倍率のレンズを使用すると、さらに画像やプロジェクトのモニター上に4800程度2の面積を拡大。有毛細胞は無傷の毛束を伸長することがあります。組織が落ちた場合は、有毛細胞が膨張し、より透明性と粗くなります。
- IHCsの基地周辺の求心性boutonsをローカライズする。 Boutonsは、直径が約1μmの球状または楕円体であり、光沢のある外観と色の光です。 boutonsの大部分は核のレベルの下にローカライズされています。組織が不健康boutonsではなく光沢よりも、約4倍、通常の大きさに膨張し、透明になっているとき。
- 細胞内液と記録電極を埋め、正圧を適用し、準備に操縦電極にマイクロマニピュレーターを使用してください。
- 電極とIHCのベースのレベルで準備中の切開を加えます。 IHCsの基部にある地域へのアクセスルートを偽造するために正圧を使用して、細胞とIHCsをサポートしているの薄い層の間に電極を押してください。このステップでは、求心性神経繊維末端に到達し、そのしっかりとensheath求心性終末の細胞を支持するから記録されないための"鍵"です。
- 慎重に電極を除去し、新鮮な埋め電極を交換してください。
- クリーンな電極の先端、作戦IHCの膜へのアクセスのスルーホール電極を維持するために正圧を使用した。正圧はIHCs周囲の支持細胞の周囲に移動を支援する必要があります。
- 添付の映画に示すように求心性神経繊維末端(に向かって隣接する支持細胞の周りに電極を移動する。代替アプローチは、移動することで求心性神経繊維末端に近づくことです。長いIHCの膜は、電極の先端まで)ブートンに触れる。電極の先端は(ブートンとピペットで正圧に起因する電極の間に小さなギャップがまだある)求心性神経繊維末端の前に直接であることを確認してください。 Boutonsは、支持細胞とIHCの膜よりもピペットの動きに対してより抵抗性を提供する;彼らは、実験者が"感じる"ことができます。
- 上下にピペッティングして移動し、その神経繊維末端の動きを確認するためにプッシュする。これにより、ピペットチップとブートンは同じZ -平面になっていることを示します。
- 求心性神経繊維末端に押し付け電極と、同時に正圧を解放し、GΩシールを形成するために吸引を適用する。求心性神経繊維末端上GΩシールの形成は、有毛細胞の上に似ています。シールの形成が急速であることも、徐々に発生する可能性があります。
- 電極内に破裂膜に吸引の穏やかなバーストを適用し、全細胞記録の設定を入力します。
- パッチを適用し、細胞が求心性神経繊維末端の場合は、小さな容量性の過渡電圧(図1を参照)シール形成時の監視テストの方形パルスに表示されます。 1.8 pFの(3を参照、4) -私達は0.4とする求心エンディングの容量を推定した。パッチを適用し、セルがIHCであれば、過渡は、アクセス抵抗に応じて3〜5倍も大きいの順序になります。
- 細胞が求心性神経繊維末端であることを確認するには、電圧のステップを過分極し、脱分極とプロトコルを実行する。求心性線維とIHCs(求心性神経繊維末端を目指す際に、しばしば誤ってパッチ適用)の電流電圧の関係は(IVS)個々の細胞種に特徴的であり、図2に示されています。
- 膜電位を監視し、求心性繊維のために、それは-60〜-65 mVの周りには通常です。
- 新鮮な埋め電極で13 - 細胞が求心性神経繊維末端ではない場合、電極と繰り返し手順8を削除します。それぞれの試行のための新しい電極を使用してください。
- シールがクロージングアップされていないことを保証するために電圧ステップを印加することにより、記録を通して直列抵抗を監視します。直列抵抗が増加した場合、それは吸引の穏やかなパルスを適用したり、後方にわずかに電極を移動するために役立ちます。直列抵抗は30MΩの周りに典型的です。シナプス活性を分析するとき、我々は50MΩ以上の直列抵抗と録音を破棄。
- これで(図3を参照)シナプス活動を記録することができます。どちらの求心性線維は自発的活性を示す、または有毛細胞は伝達物質の放出を活性化する脱分極である必要があります。高カリウムの濃度(例えば、40mMの)と細胞外溶液を適用すると、有毛細胞を脱分極し、多くの場合、伝達物質の放出の速度をアクティブ化または増加します。
- IHCsと求心性boutons 2の同時録画の場合は、手順は、次の方法で変更する必要があります:手順1〜5までを進めます。のCa 2に対応する細胞内液+現在の分離とIHCピペットを記入し、6に示すように従ってください。から記録されるIHCに近い"待機位置"のIHCの録音のためのピペットを残す。 14求心性録音のための - 手順6に進みます。求心性のピペットは、細胞全体の構成になっている場合IHCピペットを続行します。対応するIHCの側壁に向かってManoeuvre秒ピペット、常に正圧を維持する。 IHCは、圧力による側壁にインデントを表示する必要があります、それは支持細胞はそれから分離されることを確保する必要があります。ステップ12から13までは同様にIHCのために適用することができます。 14に示すように、求心性線維に比べて、大きな容量のトランジェントは、特徴的なIVの関係に加えて、IHCの録音の特徴です。 IHCに洗浄するために細胞内のソリューションのために - 同時録画が確立されると、しばらくの間は(5分、直列抵抗に応じて3)許可する必要があります。これははるかに大きいのK +コンダクタンスの増大ブロックによる大規模のCa 2 +電流になります。
- 実行するためにはむしろGΩのシールを作るよりも、ステップ12において、細胞外記録を緩いシール、求心性神経繊維末端にMΩ約30〜50の緩いシールを作る。これは、正圧を解放しながら少ない吸引を適用することによって達成することができます。 P21ラット求心性神経繊維末端から細胞外記録の例については、図5を参照してください。
7。トラブルシューティング
- シールを形成することができるが、セルに接続されたから全細胞記録への移行が達成できない場合は、ピペットの内径が狭すぎる可能性があります。
- 気密シールを形成することができない場合は、内側のピペット径が大きすぎると全体ブートンが電極に吸い取られる可能性があります。
- すべてのシナプスのイベントが小さく、均一である場合、録音は求心性に細胞外の可能性があります。正の膜電位でのイベントの逆転のためのテスト、細胞内に記録されたEPSCsは正の電位に反転します。
- パッチを適用する際求心端子直列抵抗が一貫して高い場合、細胞全体の構成に突破しようとする前に、後方にピペットを移動してみてください。これは、ピペットの目詰まりと高いアクセス抵抗を防ぐことができます。
- 大胆にピペットの正確な位置。求心性のシールを"失う"ことなく、高い直列抵抗またはピペットの目詰まりを減らすために電極を移動することが可能です。同時録音の確立時に、IHCは、通常ブートンに向かって"プッシュ"される。求心性ピペットの位置はそれに応じて修正することができます。
8。代表的な結果
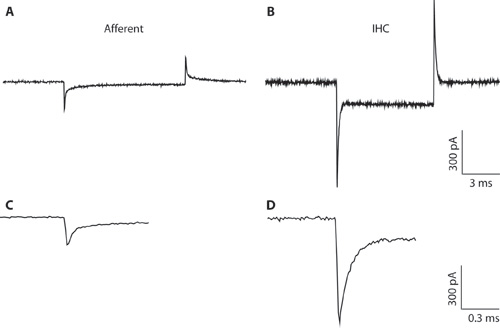
図1。 AB。典型的なトランジェントが-94 mVの保持電圧から電圧指令を過分極が10mVに対応して求心性線維(A)とIHC(B)から記録。細いピペットの直径と高アクセス抵抗、IHCの録音のために(B)全細胞IHCの録音のために最適とは言えません。録音はIHCsと求心性線維から容量性過渡の違いを説明するためにここに示されています。これは、全細胞構成を形成するときの細胞型を区別することができます。 IHCsから細胞全体の容量性の過渡現象は、5回の順に求心性線維からのものよりも振幅がより大きくなるからです。CD。拡張されたタイムスケールで示さ&Bからトランジェント。 C.求心性応答の減衰は2つの指数関数でフィットすることができます。求心エンディングの容量が速い成分から推定された。
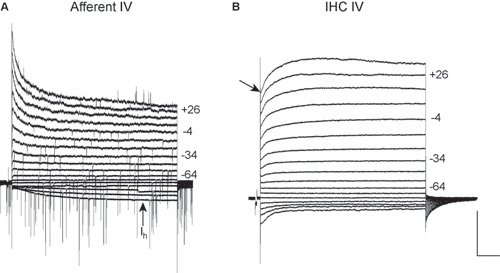
求心性神経繊維末端(A)とIHC(B)から図2。IVの関係。 IVの関係は、10 mV刻み(公称電圧)で-124 mVから+ 36 mVの電圧ステップで-84 mVの保持電位から記録されます。電圧は、いくつかのトレースの右側に表示されます。これらの録音は、室温で5.8 mMの細胞のKClを用いて行った。両方のスケール:500 pAの、200ミリ秒。
A。生後19日目での求心性線維からIVの関係は。 EPSCsは電圧ステップの大部分の間に存在する; EPSCsは+6 mVへの正逆。この録音は、電圧依存性Na +電流を遮断するTTXの存在下で実施された。過分極電圧(I h)で徐々に活性化内向き電流に注意してください。この電流はIHCsまたは支持細胞内に存在しないとから記録された細胞は求心性線維(3を参照)であること。B良い指標を提供する。 P19 IHCからIVの関係。細いピペットの直径と高アクセス抵抗のために、録音はIHC電流と電流が予想より小さいを特徴づけるために最適とは言えません。録音は、求心性繊維の記録が試みられたときに明確に、区別することができますIHCsと求心性線維のIVの関係を示すために、ここで示されています。遅延整流K +電流が13で続いて正の電位(矢印)で、高速活性化外向きK +電流に注意してください。

図3。IHCから放出の速度を高めるために40mMの細胞外のK +の存在下で生後21日目の求心性線維から記録プラーシナプス電流。 TTXと室温では、電圧依存性Na +電流を遮断するために適用される。。スケール200 PA、5ミリ秒は、EPSCsの変数のサイズと形状に注意してください。 EPSCの特性の詳細な説明については、4 Bを参照してください。拡張スケールで示した(相性::O、多面的な#):でマーク二つEPSCsスケール100 pAの、1ミリ秒。
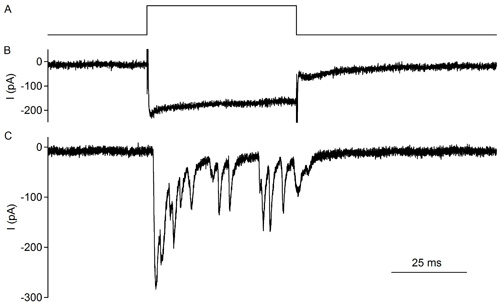
図4。IHCとコルチ器の切除したラットの臓器、生後10日目(また2参照)に接触する求心性神経繊維末端の同時記録。 IHCの脱分極電圧ステップは、神経伝達物質の放出を誘発し、求心性神経繊維末端にEPSCsを活性化する上トレース:。IHCの脱分極の電圧プロトコル。保持電位:-79 mVの、-29 mVの〜50 msのステップミドルトレース:L型Ca 2 IHCから記録+電流は、通常は少し不活性化を示し、負の電位で活性化するボトムトレース:応答の求心性線維のシナプス電流IHCの脱分極に。 50 msのIHCの脱分極時にシナプス抑制に注意してください。
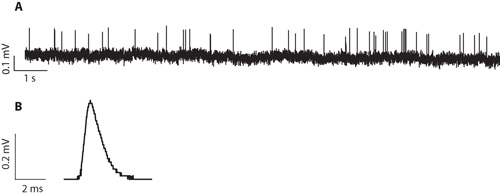
図5。 。生後21日目の求心性神経繊維末端からプラー細胞外記録。これは、室温で記録した5.8 mMの細胞外のK +と最高温度、。この録音は、3週齢のラットから調製における記録のため雑音比の代表的な信号を持っています。B。 P20求心性神経繊維末端から記録した細胞外のイベントの平均波形。これは、10272のイベントから平均的な波形です。
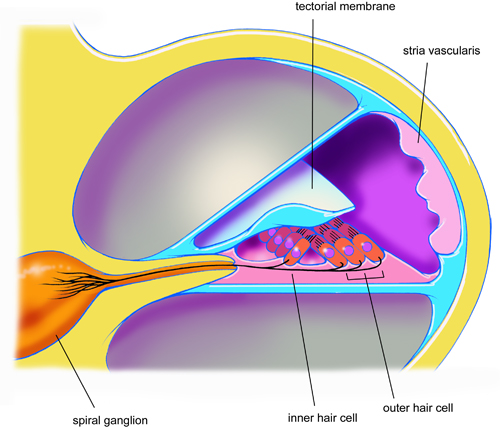
回路図は、1。内側と外側の有毛細胞、らせん神経節、血管条と蓋膜との間の解剖学的関係を示すラットの蝸牛の一巻きを通して断面をクロス。
ディスカッション
この手順の重要なステップは解剖です。組織が伸びたり解剖中に損傷している場合は、求心性繊維は生きていけないでしょう。若いラットの組織は、より弾力的と寛容です。私たちは、生後日数が10〜11は解剖するのが最も簡単であり、実験では高い成功率を持っていることがわかります。蝸牛成熟の相当程度は、生後12日目に約14から聞いて始めてラットで、出生後に発生します。したがって、解剖が最も簡単です歳の時に、シナプスは4完全に成熟できない場合があります。
解剖したラットのためここで説明するには、基本的にマウスの蝸牛の小さいサイズで、主な違いは、マウスでも同じです。この手法は、リボンシナプスの性質が遺伝子導入改変マウス15に確認することができます。この手法にさらに修正が含まれています:ラベルの繊維3に細胞内液に蛍光色素を加えること;、前シナプス内有毛細胞とシナプス後求心性神経繊維末端での録音をペアの前と後シナプス細胞間の伝達関数は2を決定することが可能とルーズ細胞の完全性の損失を避けるために、求心性boutonsで細胞外記録を封印。細胞外記録の設定は、全細胞の構成より達成しやすくなりますし、実験は、一般的に長持ちです。
開示事項
謝辞
この作品は、聴覚とバランスのためのセンター、ジョンズホプキンス大学にNIDCD DC005211でEGとするEYとNIDCD DC006476に聴覚障害研究財団研究助成金によってサポートされていました。アートワーク著作権ティムフェルプス、ジョンズホプキンス大学。
LGは、初期の原稿を書いた。EYとLGは、解剖やレコーディングを撮影した。すべての著者は模範の数字を提供し、原稿を書くことに貢献した。
資料
上記の求心端子からの録音に使用する私たちの電気生理学的な設定をしている機器です。
参考文献
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved