需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
收集可变浓度等温滴定量热数据集,以确定约束机制
摘要
ITC是一个功能强大的工具,为研究其主机的一个配体的结合。然而,在复杂的系统的几种模式可能适合同样的数据。这里介绍的方法,提供了一种手段来澄清合适的绑定模型和复杂的系统,提取相应的热力学参数。
摘要
等温滴定量热(ITC)是常用的确定与主机高分子配体的结合相关的热力学参数。 ITC主机/配体的相互作用研究一些较常见的光谱方法的优点。例如,两个组件交互时释放或吸收的热量是直接测量,不需要任何外源性的记者。因此,结合焓和协会常数(Ka)直接获得从国际贸易中心的数据,可用于计算熵的贡献。此外,等温线的形状是依赖于C值和所涉及的机理模型。 C -值被定义为C = N [P] TKA,[P] T是蛋白浓度,n是主机内配体结合位点的数目。在许多情况下,为一个给定的配体的多个结合位点非等效ITC允许每一个人的结合位点的热力学约束力参数的表征。然而,这需要使用正确的绑定模型。这种选择可能会产生问题,如果不同型号,可容纳相同的实验数据。我们曾表明,这个问题是可以规避在几个C -值进行实验。同时适合不同的模型在不同的C -值获得的多个等温线。正确的模式是未来整个变量- C数据集的拟合善良的基础上确定。这个过程是应用氨基糖甙类抗生素导致耐药酶氨基糖苷类的N - 6' -乙酰基转移酶- II(AAC(6')- II)。虽然我们的方法是适用于任何系统,更好地证明这一战略的必要性与高分子配体变构或协同系统,和不同的结合模式提供相同的数据基本上是相同的适合。据我们所知,有没有市售的这类系统。 AAC(6')- II,是一个同源二聚体,含有两个活性部位,呈现出两个亚基之间的协同。然而,在一个单一的C -价值得到国际贸易中心的数据,可以适合同样至少有两个不同型号的两集网站独立模型和两站点顺序(合作)模式。通过不同的C值,如上面所述,它是建立正确的绑定模型的AAC(6')- II是两个站点的顺序的绑定模型。在这里,我们描述的,必须在执行国际贸易中心实验时所采取的的,为了获得适合变量- C分析数据集的步骤。
研究方案
1。准备库存解决方案
- 净化大分子的兴趣。 (在这种情况下,氨基糖苷类的N - 6' -乙酰基- II(AAC6'二),是孤立的报道13。)
- 准备4公升的透析液。 (在这种情况下,我们使用25毫米4 - (2 - 羟乙基)- 1 - piperazineethanesulfonic酸(HEPES,MW 238.3克/摩尔),含有2毫米乙二胺四乙酸(EDTA,292.2兆瓦),在pH值7.5。)
- 透析的AAC(6')- II的样品在400微米(5毫升),用于必须在透析透析缓冲液(3 × 1.3升)的蛋白质。保持最后的透析液冲洗机和稀释样品。
- 最终的透析液,通过0.45微米的纤维滤纸过滤,并保存在4 ° C将被称为“运行缓冲”
- 通过0.2微米注射器的过滤器已运行缓冲液彻底冲洗过滤蛋白质溶液。测量使用标准的检测(布拉德福德,洛瑞等)或紫外吸收的蛋白质终浓度。商店的蛋白质,以最大限度地长期稳定。 (AAC(6')- II,这意味着存储在4 ° C的AAC(6')- II不保留冷冻和解冻后的活动)。
- 准备运行缓冲液溶解在4.0毫克200μL25毫米乙酰辅酶A的股票的解决方案(AcCoA,配体,809.57兆瓦)。冻结在-78 ° C,直到准备使用。
- 所有的蛋白质与配体样本必须来自同一只股票的解决方案,以最大限度地减少随机抽样样本浓度波动。一个横跨整个变量- C数据集的蛋白浓度修正系数调整分析 10 。
2。准备美国国际贸易委员会样本
- 酶液稀释到64 C值与终体积为2 mL。 (AAC(6')- II的情况下,这相当于到192微米。)
- 快速解冻,在冰水中的配体(AcCoA)原液。
- 准备一个AcCoA解决方案的0.5 mL的10倍以上的浓缩,然后在对蛋白质的结合位点的数量,在这种情况下,4毫米,420μL运行缓冲液80μLAcCoA原液稀释。转移到一个吸管灌浆管。快速返回AcCoA原液至-78 ° C。
- 德加的蛋白质和真空条件下的解决方案,在温度为1 5分钟℃以下所需的运行温度(19℃)。
3。设立注射器14
- 作为持有人在同一高度,直到预安装的注射器钳,通过注射器持有插入注射器。
- 第二注射器钳过的注射器,注射器支架的底部,直到它坚决反对按饲料。轻轻地拧紧钳提供0.050“球点六角驱动。
- 放入注射器吸液管人持有。
- 轻轻地滑入注射器吸液管注入。确保柱塞头孔的注射器直接送入。一旦完全插入,拧到吸管注射器注射器持有的锁圈。
4。装入样品池14
- 最低限度的运行缓冲液50毫升清洗样品池,并删除任何剩余的液体,用长针刺2.5毫升的玻璃注射器。
- 慢慢地画出一个进入清洁和干燥的长针2.5毫升注射器的蛋白质样品溶液1.8毫升的最低。要小心,不要采取任何气泡。
- 小心地插入样品池针,轻轻触摸单元格的底部。提高尖稍(〜1毫米),轻轻注入细胞的AAC(6')- II解决方案,直到多余的液体样品池的顶部以上可见。
- 同时确保在溢出的液体仍然慢慢提高约1厘米的针。迅速退出,并注入少量的溶液(〜0.25毫升)样品池,以消除任何被困气泡。
- 删除所有的解决方案溢出。这是通过轻轻滑动沿溢出方针进样细胞。注射器尖端将达到一个窗台,这是希望的解决方案运行的高度。删除位于这条线以上的所有液体。
5。装入注射器,并开始运行 14
- 将填写端口塑料管装载注射器。
- 下柱塞提示填写端口。
- 在吸管持有人的底部放置吸管灌浆管AcCoA解决方案。注射器尖不应该接触的灌装管的底部。
- 慢慢地绘制到注射器的解决方案,直到少量进入装载注射器管。
- 降低柱塞头,然后单击“关闭填写端口”按钮,关闭填写端口。清除清除>填充按钮,点击3次,以消除任何气泡和填充,很可能会成为被困在装载。
- 从吸管人删除灌浆管,轻轻擦拭注射器的尖端。
- 以吸管组装成的样品池,并轻轻地放下注射器。进展缓慢的注射器可以很容易地弯曲,所以需要非常谨慎。确保完全按下锁圈的基础上,插入注射器。
- 设置所需的运行温度(29 ° C在这种情况下),并选择一个参考功率,略高于预期(在这种情况下20μcal/sec)的流的最大注射热。
- 编程所需的注射量和延误。 (在这种情况下,28名注射就业。第一次注射容积2μL与60秒的延时,所有后续注射10μL330章第延迟卷。)
6。随后的运行
- 重复步骤2-5在随后的运行,同时降低AAC(6')- II和AcCoA浓度的2,4,8,16倍,而32。
7。数据分析
- 使用全球适合所有的等温线到一个单一的绑定参数设置一个合适的程序,以前10描述。
8。代表性的成果
具有代表性的数据,如图1所示。等温线的形状应与浓度的不同而有所差异。更清晰的转换,预计较高的C -值(即较高的蛋白质和配体浓度)(图2)。
AAC(6')- II的情况下,两个网站的序列模型,给出了一个更适合于描述两套相同的独立网站,具有可调节的化学计量。
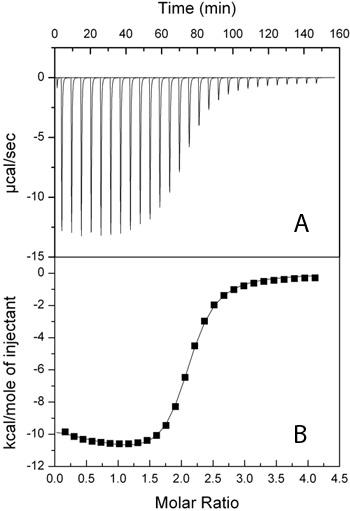
AcCoA滴定(3.86毫米)制作成AAC(6')- II(192μM) 图1等温线。一)原国际贸易中心跟踪。 b)用于确定一个适合2现场连续(绑定参数(正方形)的综合值 - )。

图2。贸易中心AcCoA等温线在不同浓度的滴定成AAC(6')- II。适合2集站点的独立模式(虚线洋红)和2现场连续模型(实心蓝色)的实验数据(空心圆)。 2现场sequentional模式显然会带来更好的整体协议。浓度分别为A)6微米,0.25毫米,二)12微米,0.25毫米,C)24微米,0.5 mm,深)48μM,1.0毫米,E),96μM,1.9毫米,和F)196μM, 3.86毫米,为AAC(6')- II和AcCoA分别。
讨论
这个变量- C管件的分析部分以前已经10详细描述。在这里,我们报告收集适合这种方法的变量- C的数据集的实际问题。重要的是,所有的蛋白质与配体样本是从同一只股票方案的制定。因此重要的是,准备充足的库存解决方案,初步完成了整个系列实验。这将确保比例的AAC(6')- II和AcCoA是不变的,所有的实验中,并降低浓度样本,以抽样方式随机波动。
在这种情?...
披露声明
致谢
这项工作是由加拿大卫生研究院研究院(CIHR),国家科学与工程研究理事会(NSERC)和CIHR培训资助奖学金(LF)的支持。我们感谢教授杰拉德D.赖特(麦克马斯特大学,加拿大)(6)为AAC - II表达质粒。
材料
| Name | Company | Catalog Number | Comments |
| Acetyl c–nzyme A (AcCoA) | Sigma-Aldrich | A2056 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Fisher Scientific | 7365-45-9 | |
| ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 431788 | |
| Spectra/Por 2 Dialysis Tubing | Spectrum Labs | 132678 | |
| Sterile Syringe Filter (0.2 μm) | VWR international | 281445-477 | |
| Cellulos Nitrate Membrane Filters (0.45 μm) | Whatman, GE Healthcare | 7184-004 | |
| VP-ITC | MicroCal | VP-ITC | Microcalorimeter used for measurements |
| ThermoVac | MicroCal | USB Thermo Vac | Temperature Controlled Degassing Station |
参考文献
- Cliff, M. J., Ladbury, J. E. A survey of the year 2002 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 16, 383-391 (2003).
- Cliff, M. J., Gutierrez, A., Ladbury, J. E. A survey of the year 2003 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 17, 513-523 (2004).
- Ababou, A., Ladbury, J. E. Survey of the year 2004: literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 19, 79-89 (2006).
- Ababou, A., Ladbury, J. E. Survey of the year 2005: literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 20, 4-14 (2007).
- Okhrimenko, O. k. s. a. n. a., J, I. A survey of the year 2006 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 21, 1-19 (2008).
- Bjelic, S., Jelesarov, I. A survey of the year 2007 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 21, 289-312 (2008).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Current Opinion in Structural Biology. 11, 560-566 (2001).
- Wiseman, T., Williston, S., Brandts, J. F., Lin, L. -. N. Rapid measurement of binding constants and heats of binding using a new titration calorimeter. Analytical Biochemistry. 179, 131-137 (1989).
- Capaldi, S. The X-Ray Structure of Zebrafish (Danio rerio) Ileal Bile Acid-Binding Protein Reveals the Presence of Binding Sites on the Surface of the Protein Molecule. Journal of Molecular Biology. 385, 99-116 (2009).
- Freiburger, L. A., Auclair, K., Mittermaier, A. K. Elucidating Protein Binding Mechanisms by Variable-c ITC. ChemBioChem. 10, 2871-2873 (2009).
- Wybenga-Groot, L. E., Draker, K. -. a., Wright, G. D., Berghuis, A. M. Crystal structure of an aminoglycoside 6'-N-acetyltransferase: defining the GCN5-related N-acetyltransferase superfamily fold. Structure. 7, 497-507 (1999).
- Draker, K., Northrop, D. B., Wright, G. D. Kinetic Mechanism of the GCN5-Related Chromosomal Aminoglycoside Acetyltransferase AAC(6')-Ii from Enterococcus faecium: Evidence of Dimer Subunit Cooperativity. Biochemistry. 42, 6565-6574 (2003).
- Wright, G. D., Ladak, P. Overexpression and characterization of the chromosomal aminoglycoside 6'-N-acetyltransferase from Enterococcus faecium. Antimicrob. Agents Chemother. 41, 956-960 (1997).
- MicroCal. . ITC Data Analysis in Origin. , (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。