Method Article
在免疫缺陷小鼠的建立和传播人类视网膜母细胞瘤肿瘤
* 这些作者具有相同的贡献
摘要
描述的方法传播人类视网膜母细胞瘤小鼠的肿瘤。肿瘤细胞直接注入免疫缺陷小鼠的眼睛。继发性肿瘤已成功地建立了使用直接从人类肿瘤和培养tumorspheres收获细胞。
摘要
培养视网膜母细胞瘤肿瘤细胞在界定干细胞媒体产生可以种植和只是一个有限的时间内保持的小学tumorspheres。原发肿瘤相比,这些培养tumorspheres可能会出现明显不同的细胞表型。示范,培养的细胞形成新的肿瘤的能力是很重要的原发肿瘤的生物学特性,以确保培养的细胞模型。
在这里,我们目前为传播使用RAG2 体内的人类视网膜母细胞瘤的协议- / -免疫缺陷小鼠。低通道或从刚收获的人类的视网膜母细胞瘤直接注入小鼠眼睛的玻璃体腔内肿瘤细胞体外培养的人类视网膜母细胞瘤tumorspheres的形成2-4个星期内肿瘤。这些肿瘤可收获,要么进一步代入小鼠体内的眼睛,或在体外tumorspheres增长。传播已成功地进行了至少有三个通道从而确立了人类视网膜母细胞瘤组织继续为进一步的实验源。
韦斯利债券和拉丽塔瓦德瓦共同第一作者。
研究方案
1。视网膜母细胞瘤tumorspheres的制备
- 视网膜母细胞瘤肿瘤样本下取得的IRB批准的协议。
- 准备好新鲜的干细胞媒体(Neurobasal的一个媒体,1X的B - 27补充零下20毫微克/毫升表皮生长因子,维生素A,1X非必需氨基酸溶液,1X L -谷氨酰胺,10纳克/毫升碱性成纤维细胞生长因子)。
- 在一个无菌,组织使用手术刀文化的跨领域技术处理的6孔板,机械分解的肿瘤组织。立即加入100μL定义的干细胞媒体组织和肉末组织使用的手术刀轻轻蔓延。添加5毫升的定义干细胞媒体向好。
- 在37℃,5%的CO 2在培养箱,每天检查。有些tumorspheres应该从中断的肿瘤组织几乎立即出现超过2-4天的过程中越来越多。
- 每周5分钟,离心tumorspheres 300xg,悬浮在新鲜配制的干细胞媒体,和吸管达10倍,破坏较大,中央坏死领域,并允许新的,健康的领域,形成。
2。注射肿瘤细胞的制备
- 如果培养tumorspheres,轻轻吸管领域注入15 mL锥形管。轻轻吸管向上和向下与血清吸管扰乱领域的10-15倍。
- 细胞被注入到一个新的管使用一个hemacytometer,等分至少50,000元注射细胞计数。准备尽可能多的基础上可用的细胞数量的注射。
- 在300xg离心5分钟。仔细吸出上清液于5 mL PBS重悬。重复离心和愿望,并在每次注射10μL的PBS重悬。
3。动物的制备
- 使用胰岛素注射器,管理的啮齿类动物麻醉鸡尾酒的腹腔注射(氯胺酮37.6毫克/毫升,甲苯噻嗪1.92毫克/毫升,acepromazine 0.38毫克/毫升),每克体重1μL(GBW)。等待5分钟的动物成为镇静剂。检查心跳和一个加热垫放在动物。保持在所有时间,直到恢复加热垫的动物。
- 镇静后,管理1右眼丙美卡因盐酸下降。更换加热垫的动物,并等待1分钟。
- 管理福林盐酸右眼1滴。更换加热垫的动物,并等待5分钟。如果未发生瞳孔扩张,重管理的1滴,等待5分钟。
- 监视运动或抽搐的迹象,这可能发生在30分钟后镇静,动物。在运动的最初迹象,管理1μL/ GBW盐酸氯胺酮(10毫克/毫升的PBS稀释),并等待5分钟。
4。注射肿瘤细胞
- 动物麻醉后,置于显微镜下,在其一侧与眼睛朝上的权利和头搁在纱布和中心,以获得红光反射的右眼眼底(瞳孔应该在这个时候扩张),当通过显微镜观察。
- 撑起轻轻推,同时用两个手指在眼皮上和程序的其余部分持有这一立场稳步全球。
- 使用连接到鲁尔锁注射器,无菌30号针头刺破全球横向通过结膜和巩膜玻璃体领域的角膜缘相邻(图1),并通过入玻璃体腔脉络膜。从开放中取出针。
- 汉密尔顿针用酒精棉签消毒。汉密尔顿注射器将细胞悬液,并绘制成针插入开幕,直到针头是通过在玻璃体视网膜附近的镜头背后的显微镜观察。第二而针稳定在这个位置上的人的帮助下,慢慢地压低柱塞。取出的针。如果有必要,用棉签从开放中吸收任何液体。
- 轻轻松开眼睑的压力,关闭鼠标眼睑。
- 管理的羟丙甲纤维素的1下降到每只眼睛和返回动物恢复加热垫。
5。监测小鼠体内肿瘤的收获
- 日报,研究注入了白瞳眼(白乳头状反射)和/或眼周,腹胀,通常2-4周注射后变得明显。
- 一旦检测到肿瘤的生长,安乐死的动物根据机构指引。
- 如果眼睛和肿瘤眼睑覆盖,使用的手术刀,使睑裂正交的两个切口,并解除皮瓣。
- 使用可视化立体显微镜下,在角膜缘圆周的切口,去除角膜和晶状体,并认真剖析其他组织使用彧大部分的肿块zers。放置在无菌的RPMI - 1640媒体肿瘤。
- 使用镊子,从插座上慢慢拉开放全球。为了确保一个附加的视神经,使肿瘤的侵袭,可以可视化,全球拉,直到神经暴露,并用剪刀切断神经,尽可能长时间。放置在10%福尔马林作病理检查的常规处理。
6。代表结果:
视网膜母细胞瘤tumorspheres将开始从分类组织几乎会立即出现,因为它们是从肿块中解放出来。在2-4天之内,更多的tumorspheres将开始形成,并会增加大小。的领域往往是经常的,表现出一个明确的,二次膜周围聚集(图2)。
动物通常呈现4个星期内注射后(图3b),其次是扩大全球和腹胀注射5-8周后,对周围组织,随着肿瘤的增长与白瞳(图3c)。
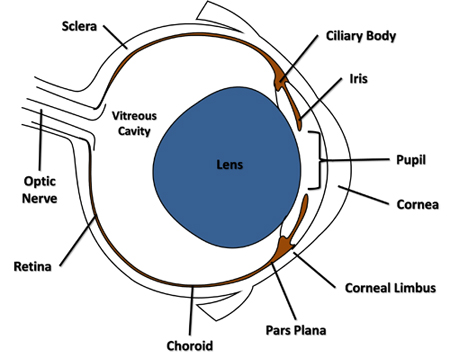
图1。横断面图鼠标的眼睛突出在协议中所引用的功能。
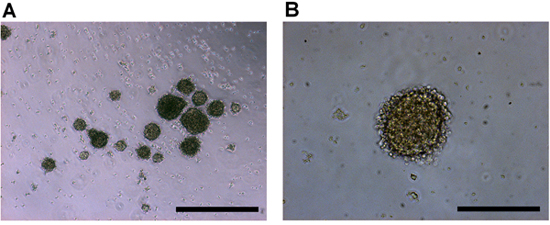
图2。文化在体外培养的人视网膜母细胞瘤细 胞成像)4X,和b)的10倍的目标放 大倍率。视网膜母细胞瘤的原发肿瘤细胞产生一个普通的球体造型和清脆的外膜tumorspheres。比例尺代表)500微米, 和b)200微米。
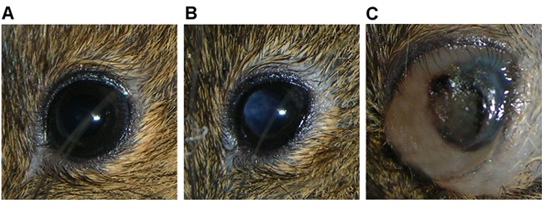
白瞳在玻璃体腔内的肿块,C)一个大肿块 。RAG2 眼图 3 - / -小鼠显示一 )正常功能,B)全球填补相关的眼周腹胀,眼内出血。
讨论
本文所述的技术有利于他们的眼,玻璃体环境传播视网膜母细胞瘤肿瘤。在过去的眼内注射技术已用于创建肿瘤的视网膜母细胞瘤衍生的细胞系 ,1以及提供人工基因治疗的病毒载体2,3。这项技术目前已成功地用于生产人类视网膜母细胞瘤肿瘤细胞从原发肿瘤和注射的tumorspheres以及裸鼠移植瘤的串行传播直喷。肿瘤形成的明显证据(通常为白瞳症)是4个星期内,通常首先指出,在5-8周后,眼内出血及全球和/或组织腹胀周围的轨道发展。少数注入小鼠体内注入眼伤害,导致眼睑永久封闭。在这种情况下,腹胀是肿瘤形成的唯一标志。
建立小鼠移植瘤肿瘤尚未成功,所有的人类视网膜母细胞瘤瘤,虽然建立的裸鼠移植瘤的传播是非常成功的。这一观察结果表明,原发肿瘤,如分化或其他一些未知因素的侵袭和水平,某些特性可能会影响这些肿瘤的能力,坚持在小鼠眼部环境。
可以从一个人的视网膜母细胞瘤瘤收购的组织是相当小,并在体外培养的人视网膜母细胞瘤细 胞,如寿命有限,失去坚实的肿瘤组织学和细胞表型的变化能力有很大的局限性。该协议提供了一种比较简单的方法传播人类肿瘤和建立人类疾病的小鼠模型。这使得进一步在体外和体内的视网膜母细胞瘤和更长的维护病人的肿瘤外的生物学实验。
披露声明
动物实验是由贝勒医学院医学IACUC委员会规定的准则和法规的规定执行。
致谢
该项目的筹资提供的研究和视网膜研究基金会的克莱顿基金会。
材料
| Name | Company | Catalog Number | Comments |
| 名称 | 公司 | 目录# | 评论 |
|---|---|---|---|
| 去氧肾上腺素盐酸2.5% | 博士伦 | 053-11 | 眼科解决方案 |
| 30 - GA针 | 屋宇署 | 305128 | 定期斜角 |
| 10毫升的鲁尔锁注射器 | 屋宇署 | 309604 | |
| 3/10-cc胰岛素注射器 | 屋宇署 | 328431 | |
| 酒精棉签 | 屋宇署 | 326895 | |
| 6孔板,组织培养处理 | 屋宇署 | 353046 | |
| 盐酸丙美卡因0.5% | 巴特勒热源 | 017239 | 眼科解决方案 |
| 氯胺酮盐酸100mg/mL | 道奇堡 | 4402A | |
| 10μL汉密尔顿注射器 | 汉密尔顿公司 | 7648-01 | |
| 32 - GA汉密尔顿针 | 汉密尔顿公司 | 7803-04 | 自定义长度 - 0.5“ |
| Neurobasal的媒体 | Invitrogen公司 | 10888-022 | |
| B - 27补充减去维生素A,50X | Invitrogen公司 | 12587-010 | |
| RPMI - 1640媒体 | Mediatech | 10 - 040 - CV | |
| 非必需氨基酸溶液,100X | Mediatech | 25 - 025 - CI | |
| L -谷氨酰胺,100X | Mediatech | 25 - 005 - CI | |
| 一次性#11手术刀 | Miltex | 4-411 | |
| 鼠患麻醉组合 | N / A | N / A | 在药剂配方(氯胺酮37.6毫克/毫升,甲苯噻嗪1.92毫克/毫升,acepromazine 0.38毫克/毫升) |
| 重组人表皮生长因子(EGF) | 干细胞技术 | 02633 | 在10微克/毫升原液的重组 |
| 重组人碱性成纤维细胞生长因子(bFGF) | 干细胞技术 | 02634 | 在10微克/毫升原液的重组 |
| OMS - 75手术显微镜 | 拓普康医疗系统 | OMS - 75 | 这种模式已停产 |
| 10%的福尔马林 | VWR | 95042-908 |
参考文献
- Chèvez-Barrios, P. Metastatic and Nonmetastatic Models of Retinoblastoma. Am. J. Pathol. 157, 1405-1412 (2000).
- Suber, M. L., Hurwitz, M. Y., Chèvez-Barrios, P., Hurwitz, R. L. Immune consequences of intraocular administration of modified adenoviral vectors. Hum. Gene Ther. 12, 833-838 (2001).
- Mallam, J. N., Hurwitz, M. Y., Mahoney, T., Chèvez-Barrios, P., Hurwitz, R. L. Efficient Gene Transfer into Retinal Cells Using Adenoviral Vectors: Dependence on Receptor Expression. Invest. Ophthalmol. Vis. Sci. 45, 1680-1687 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。