Method Article
龙工程的程序
摘要
我们已经开发出一个脱细胞肺癌细胞外基质和新型仿生生物反应器,可用于生成功能的肺组织。播种到矩阵和生物反应器培养细胞中,我们生成演示有效的气体交换时,在很短的时间体内移植的组织。
摘要
肺组织,包括肺癌和慢性阻塞性肺疾病,如慢性肺部疾病,累计约28万死亡人数每年,慢性阻塞性肺疾病是目前在美国的第四大死亡的首要原因。这种死亡率是肺不修复或再生超越了微观,细胞水平的事实。因此,变性或感染,或手术切除的肺组织受损的肺组织,是不是功能取代体内。为了探讨是否可在体外生成的肺组织,我们对待使用一个过程,去除细胞成分产生脱细胞肺癌细胞外基质支架从成年鼠的肺部。这脚手架保留气管和血管的分层分支结构,以及一个基本完好的基底膜IV型胶原,层粘连蛋白和纤维连接蛋白,其中包括。肺生理的关键方面,如负压通风和搏动的血管灌注,旨在模仿生物反应器安装在棚架。我们培养的肺上皮细胞和的生物反应器的安装支架内的血管内皮细胞,能够产生肺组织,表型与本地肺组织,并在短的时间间隔(45-120分钟)的气体交换,即能参加。这些结果是令人鼓舞的,并建议,肺矩阵的复育是可行的策略,对肺癌再生。这种可能性提供了一个机会,不仅努力增加用于移植的肺组织供应,而且要研究体外呼吸细胞和分子生物学较长的时间和更精确的微环境比以前可能。
研究方案
1。生物反应器大会
分别在图1和2,提供详细的图(S)的生物反应器的设计和组装脱细胞和文化。生物反应器的组装之前,所有组件必须经过消毒。下面具体点说:
连接:
- 动脉导管组成的油管短节段连接到一个Y -分离器一个鲁尔锁配件。露儿锁连接器连接到灌注管,不缝合肺动脉段的Y是连接到一个单向阀。单向阀的导向,可以得出这样,流体管(相反的方向作为灌注),但在所有器官灌注介质流进入肺部。
- 气管插管,还包括一个鲁尔锁连接器,一个Y -分离器与油管。露儿锁连接到气管水库和主室之间的呼吸循环。段的Y型连接器,不缝合气管也连接到一个单向阀。单向阀在同样的方式为动脉导管导向。
职能:
- 在动脉和气管插管单向阀是用来清除管路中的气泡,使管路中流动的逆转,因此允许气泡被删除。
- “呼吸循环”包括两个单向阀,定位中等如下不同的路径,进,出肺。一个更详细的描述,这个功能是提供一个从我们的实验室2前出版。
- 使用滚子泵血管灌注。中期进入肺动脉通过连接导管灌注,通过肺血管,肺静脉直接进入主要的生物反应器,用于灌注介质绘制出流量。
2。器官收获
- 安乐死的成年(3-6个月岁)菲舍尔344大鼠戊巴比妥钠过量,根据由美国兽医协会(60毫克/公斤的IP)所规定的准则。注:巴比妥解决方案,包括在100个单位/毫升抗凝肝素。
- 喷或擦用70%乙醇的胸部及腹部。
- 打开胸腔,暴露心脏和肺部,同时注意不损害肺部。慎重一个小窗口,通过膈肌进入胸腔,导致肺部收回,然后扩大切口水平揭露肺部基地。肋骨垂直两个切口,并收回胸部笼,暴露心脏和肺部。
- 准备一个重力灌注系统,即使用与活塞的注射器取出,3路阀,油管20厘米一个1.5inch,21号针头。保持注射器20厘米以上使用一个环形支架的动物〜。确保所有的空气是从灌注管中删除。
- 剪开右心房流失血液,防止它返回到肺部。切割左心房,以允许从肺部的血液和灌注液的易排水,也可能是有益的,而且是没有必要的。
- 针插入右心室的基础,并打开活塞与肝素和硝普钠(50U/ml和1ug/ml),分别在PBS溶液灌注的肺。确认肺动脉灌注液填充和血液从肺部清除。如果需要的话,笔芯额外液灌注注射器。通常情况下只有〜10毫升是必需的。
- 继续灌注,直到肺部的血液清晰,然后停止灌注。
- 解剖气管自由,同比尽可能到颈部。确保气管食道分开。解剖所有剩余的心脏,肺和气管的连接,并取出整块。
- 使用手术刀或锋利的剪刀,切断,露出左,右心室心尖。
- Cannulate通过右心室,并在地方缝合肺动脉干。删除任何多余的左心室组织。
- Cannulate到位的气管和缝合。确保气管和肺的动脉插管的位置,使气管,肺,大血管(图1)没有扭转应力。
- 确保有动脉导管无气泡,因为系统中的气泡可以防止通过器官的不断流动。在某些情况下,气泡可以完全停止流体flow.To做到这一点,放入含有PBS JAR心/肺集团。使用针头注射器心导管注入少量的PBS驱逐任何气泡。
- 灌洗4-5次,用PBS航空公司,尽可能删除尽可能多的空气从肺。
- 经过灌洗步骤S是完整的,膨胀的肺与PBS中硝普钠(SNP)在1ug/ml。一个塞子放在气管插管,这样的解决方案仍然在肺。允许肺孵育30分钟,相同的解决方案通过肺动脉血管流动,允许血管扩张。
- 心/肺连接使用的鲁尔锁与Y形套管,在“生物反应器大会”以上所述连接的第一个生物反应器。 (图1)。
3。器官脱细胞
- 将脱细胞仪器的第(肺部附加)(图1)。肺动脉导管应连接灌注线,气管插管浮动自由。确保所有线条都清晰的空气。如上所述,在线条的空气可以差脱细胞的来源,防止decllularization流体的流动。系统中被困的空气也可以坚持到文化的时候,当它可能有负面影响细胞的存活 3 。
- ,直到肺部,但没有过度膨胀,膨胀肺,用PBS / SNP。紧随第气管插管,使肺仍然膨胀。
- 灌注肺,用PBS / SNP为至少15分钟〜15毫米汞柱(20厘米H 2 O的压力)。 15分钟或更长的时间后,取出气管插管的塞子,让肺DEFLATE。
- 持续30分钟,用PBS / SNP灌注。如果有必要,笔芯PBS / SNP,以确保灌注压维持在10-15毫米汞柱。
- 开始脱细胞溶液(8MM CHAPS,1M氯化钠,25mm的EDTA在1X PBS)灌注。小心,以确保所有线条都清晰的空气。提供吸真空系统可能会有所帮助。
与脱细胞液灌注,直到通过肺灌注液500ml。最佳压力<15毫米汞柱(〜20厘米H 2 O)。这通常需要2.5小时。通常流速很慢(0.2-0.5ml/minute)最初,并迅速在第二个小时增加至约1ml/minute或更大。每隔一段时间,从生物反应器中删除使用脱细胞液,保证足够的液体仍然是支持的肺和气管插管。
4。器官清洗和消毒
- 肺和生物反应器传输到组织文化引擎盖。开始用无菌PBS冲洗删除500毫升JAR包含脱细胞液和更换含有多达1L无菌PBS用无菌JAR。使用真空吸,以确保线路清晰的空气。
- 灌注PBS通过在10-15毫米汞柱的血管,在相同的方式为脱细胞。每隔一段时间,从生物反应器中删除浪费PBS和替换和/或填充新鲜,无菌PBS PBS JAR。明智的做法是使用无菌技术。
- 继续冲洗,直到我至少2.5无菌PBS灌注肺。
- 肺癌转移到一个新的,无菌的生物反应器系统,其中包含的PBS。确保整个灌注循环和整个呼吸道线充满液体。所有后续步骤将使用一个搏动泵灌注在5ml/min肺部。
- 消毒支架,可以通过灌注0.1%过氧乙酸的PBS PBS + 10%FBS + 10%的笔链球菌的解决方案或3小时通宵。后者将需要肺3几个小时的变化为250ml PBS冲洗,以去除残留的酸。对于每个冲洗,肺应通风以及灌注,以确保组织的所有部分都彻底冲洗。
- 37℃孵化器,并用PBS灌注,有10%FBS和10%的青霉素/链霉素〜1小时,或直至温度平衡准备benzonase治疗肺转移。
- 肺癌治疗benzonase清除残余的DNA:
- 温暖benzonase缓冲液(见试剂表)至37 ° C。
- 对于每一个肺,填补benzonase缓冲区和缓冲区90U/ml benzonase 10ml注射器,10ml注射器。
- 停止灌注肺。
- 充气的气道benzonase缓冲区。
- 允许肺DEFLATE(〜1分钟)来完成。然后,膨胀肺与benzonase解决方案。在通货膨胀benzonase缓冲区及benzonase,尽量避免注射任何空气进入肺部。
- 允许肺坐无灌注或通风1小时后在37 ° C benzonase膨胀。
- 在PBS + 10%FBS,10%的青霉素/链霉素,已经在生物反应器,并继续在一夜之间恢复灌注。翌日,肺可以被存放在4℃(长达3个月)或细胞种植准备。
- 要准备细胞的复育支架,取代胎牛血清的PBS / / benzonase〜250毫升的培养基的解决方案。介绍细胞前至少一小时的灌注,ND更换新鲜培养液,直接播种前细胞。
5。 Recellularization
器官重新植入的细胞来源的选择留给了个别调查。可以利用许多细胞来源,包括市售的人群,新鲜分离的新生儿或胎儿的肺细胞,胚胎干细胞,或市售的细胞来源。这些细胞群的具体隔离协议,可以在别处找到4,5,6。在这里,我们提供了如何种子内皮细胞和上皮细胞群的说明。
内皮播种:
- 准备暂停所需的内皮细胞的人口,在适当的培养基。通过40um细胞滤网过滤去除细胞团块细胞悬液。一个典型的内皮播种在我们的实验室将利用约30万大鼠肺微血管内皮细胞在培养液60毫升。
- 免除暂时灌注生物反应器的循环(图2)注册成立的小型水库细胞悬液。确保从这个水库和整个灌注循环管是清楚的气泡。
- 3ml/min肺使用滚压泵动脉注入细胞。
- 细胞输注后,继续与主要的生物反应器所需的速率循环介质灌注。
- 在每天的基础上,确保灌注管是明确的气泡。
- 媒体应定期更换新鲜培养基,这通常是每隔3-4天。
上皮播种:
- 准备好了所需的上皮细胞群的细胞悬液。在我们的实验室,这通常由约50-100万新生儿的大鼠肺细胞。通过40um细胞滤网过滤人口和注射器在培养基15毫升中的暂停。填写培养基80毫升呼吸道水库。
- 将在37℃组织培养箱内培养的生物反应器,注射泵和连接的通风。确保所有通风线条清晰的空气。
- 种子的细胞注射到气管插管单丸细胞悬液15毫升进入肺部。
- 立即开始使用注射泵的一个单一的,缓慢的呼吸。这口气是管理60毫升撤出在3ml/minute主要生物反应器的空气,从而持续约20分钟。确保主要的生物反应器的空气过滤器的上限后,立即注射细胞悬液,才开始缓慢呼吸。
- 允许肺部静态坐约18小时,然后开始缓慢的血管灌注(约0.5毫升/分)。
6。器官培养
虽然灌注的细节和通风会根据实验设计,指出以下几点:
- 在内皮文化,灌注一般是1-3毫升/分钟使用滚子泵。在上皮文化,通风通常是提供一个1呼吸每分钟使用注射器泵连续率。撤回510毫升从主要的生物反应器的空气通常需要在一个正常的潮气量肺通气效果。由于需要保持通风过程中的生物反应器的气密性,通风应暂停每天在主室的空气交换。空气系统中的所有房间的空气,这是约21%的氧气分压。 510毫升撤出,从生物反应器(诱导的流体510毫升肺灵感)的空气是根据肺癌的大小和多少裂片正在培养(叶可以并列进行分析,而其余叶继续在文化)。选择撤回注射泵的空气量是近似的“潮水卷”培养的肺。
- 介质应改为大约每隔3-4天,期间的文化。
- 在共同培养的上皮细胞和内皮细胞,在我们的实验室通常第一种子为4-8天,在此期间,工程组织通风上皮做实验。血管内皮细胞,然后接种通过灌注后组织灌注和通风。
7。代表性的成果:
脱细胞
正确执行协议时,应无漏水举行的空气新鲜提取的肺部。夸大与空气淹没在液体中时,可以检查这一点 - 不应该有任何气泡表明漏气。随后脱细胞应该允许通过超过2.5过程中的肺 - 〜500毫升的脱细胞液流量在37℃,和PBS最终应该能够通过肺部流量约10毫升/分钟3小时(下〜15毫米汞柱的静水压力在年底)冲洗。治疗用0.1%过氧乙酸和benzonase后,肺部可以储存在4 ° C至3个月,仍然recellularization适合。
最后脱细胞细胞外基质应完全没有蜂窝材料,并保留原生肺严重,显微和超微结构特点。不足脱细胞或冲洗可能导致残余DNA的“坚持”的脚手架,可与一个标准的苏木精和曙红可视化染色(参见图3比较)。
脱细胞基质和肺组织的文化复育的
如果细胞是刚刚从7日龄新生大鼠在网上补充陪同彼得森和他的同事4工作的幼崽,孤立的,可以预期的120-150百万细胞每10幼仔乱抛垃圾的细胞产量(刚刚超过10万每个新生儿的细胞)。
在生物反应器的肺细胞种植和随后的文化应该产生的最佳条件以及分布在所有5个叶肺细胞,并应提供约70%的细胞外基质支架(图3)的覆盖面。培养细胞的人口将亲分泌蛋白C(SPC),Clara细胞分泌蛋白(CCSP),水通道蛋白5(AQP)以相对丰度(图4)键,如呼吸道细胞标记阳性。
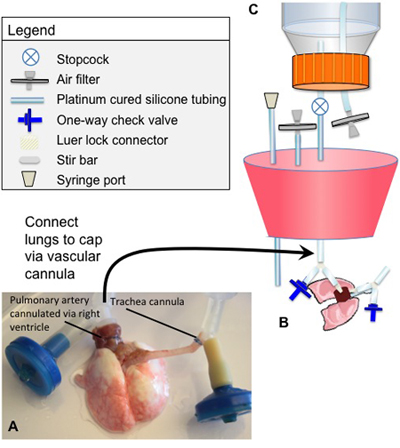
图1。插管立场和脱细胞生物反应器
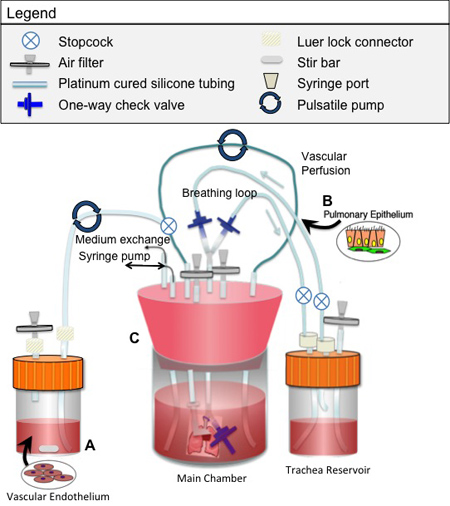
图2。生物反应器用于播种和工程肺组织的文化
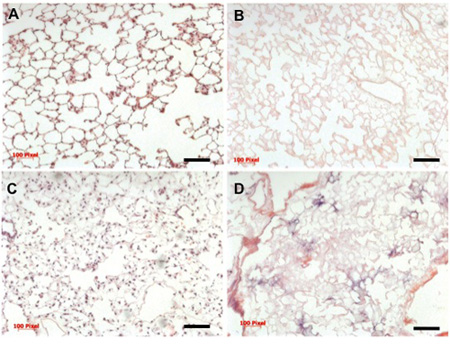
图3。母语,脱细胞,组织学和重新填充肺
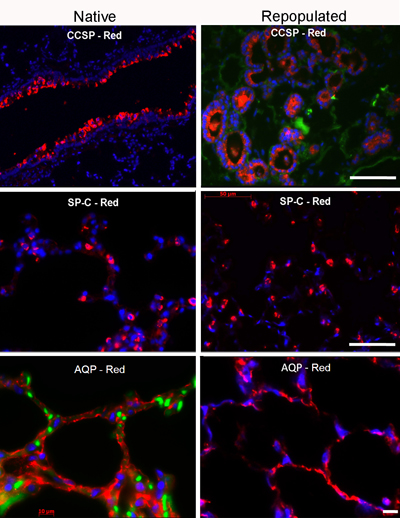
图4关键肺癌标志物的免疫荧光染色。
讨论
该系统的最关键的环节,提出了在这里包括不育,维护和应用整个过程的准备和播种的脚手架和培养重新填充肺血管床的压力密切监测。不育最好保持高压灭菌的所有材料在使用前,安装后不久外植体的封闭系统中的肺和避免后续违反这一障碍。脱细胞基质后已彻底冲洗,并转移到文化无菌生物反应器,硅胶帽和其它密封件和连接不应该受到干扰或删除。在检查中要保持压力,流量由重力驱动最好是尽可能。当泵所需的流体回流,冲洗后,用PBS和持续在文化开始,我们建议之前流体进入肺动脉压力传感器直接测量压力。施加压力的幅度不应超过15毫米汞柱。
Recellularized肺部可以培养不同的时间段,通常从4天到3个星期不等。血管灌注通常情况是在1-3毫升/分钟时内皮文化,而通风通常是在1呼吸/分钟的速度应用在上皮文化。在结合文化时期,同时通风和灌注是适当的。或者液体介质或空气可以进行通风。
在过去几十年的过程中,几组做了重要的组织工程研究工作显示肺上皮细胞在体外分化和复制肺显微解剖 7,8,9,10几个方面的可行性。然而,直到最近,这些尝试工程师肺组织的 4,5没有都导致了一种可植入的器官,是能够维持血液和呼吸道车厢之间的距离,并可能参与气体交换。因此,虽然描述的方法只是一个初始步走向生成功能的肺组织的长期目标,这项工作是朝着增加可供移植的肺组织数量的可能性迈出的令人鼓舞的一步。此外,这项工作阐述奥特等和Uygun和他的同事11,12所做的工作,展示一脱细胞细胞外基质作为组织工程复杂的三维结构脚手架的疗效和支持各类细胞的生长和生存。这项工作也很显着的贡献呼吸道的细胞和分子生物学家的医疗设备。通过提供一个独特的,立体化的环境,还可以提供适当的机械性刺激,不共享的迅速分化,随之而来的危险,可能会遇到时培养与更传统的方法13实验室老鼠的上皮细胞,科学家们可以使用我们的系统要进入细胞 - 细胞和细胞 - 基质的相互作用,发挥的作用,在细胞分化和功能的新见解。如果用于为杠杆,引导各种干细胞群的命运,Cortiella的研究小组已经在 14个初步的研究表明,这方面的知识,可能是特别强大的。
披露声明
致谢
我们感谢与生物反应器的发展的帮助Maegan B. Colehour。这些研究是由美国耶鲁大学麻醉科和美国国立卫生研究院授予HL 098220(LEN)的资助。 THP是由美国国立卫生研究院的T32 GM007171支持。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| 安乐死 | |||
| 肝素 | Sigma - Aldrich公司 | H4784 | |
| 硝普钠 | Fluka公司 | 71778 | |
| Euthasol安乐死的解决方案 | 维克AH | 710101 | 390毫克/毫升的苯巴比妥钠原液应适当稀释知识产权管理 |
| Decell解决方案 | |||
| CHAPS | Sigma - Aldrich公司 | C3023 | |
| 氯化钠 | 美国生物分析 | AB01915 | |
| EDTA | 西格玛 | E5134 | |
| 氢氧化钠 | JT贝克 | 3722-01 | |
| 1X PBS | Gibco公司 | 14190 | |
| 生物反应器组件 | |||
| 480毫升的jar | 科尔帕默 | EW - 3460560 | |
| 硅胶塞,尺寸为14 | 科尔帕默 | EW - 06298 - 26 | |
| Y型连接器 | 科尔帕默 | ED - 30614 - 08 | 用于动脉和气管插管 |
| 硅胶管 | 的Masterflex | 96420-14; 16 | L / S 14 16; |
| 压力传感器 | 爱德华生命科学 | PX - 212 | |
| 止回阀 | 科尔帕默 | EW - 98553 - 20 | 单向阀 |
| 4方法活塞 | 爱德华生命科学 | 594WSC | |
| 注射器过滤器 | 科尔帕默 | 2915-08 | PTFE,0.2微米 |
| Decell和漂洗apparati(生物反应器的增加 ) | |||
| 500和1000毫升玻璃瓶 | 康宁 | 1395-500; - 1L | 为decell使用和重力冲洗 |
| Benzonase治疗 | |||
| 青霉素/链霉素 | Gibco公司 | 15140122 | |
| 胎牛血清 | Hyclone公司 | SH30071.03 | |
| 的Tris - HCl | 美国生物分析 | AB14043 | 1M,pH值8.0 |
| MgCl 2的 | JT贝克 | 2444-01 | |
| 牛血清白蛋白 | 西格玛 | A9647 | |
| Benzonase核酸 | 西格玛 | E1014 | 用核酸内切酶从矩阵中删除残余的DNA |
参考文献
- American Lung Association. Lung Disease Data. , (2008).
- Petersen, T. H., Calle, E. A., Colehour, M. B., Niklason, L. E. Bioreactor for the Long Term Culture of Lung Tissue. Cell Transplant. , (2010).
- Bilek, A. M., Dee, K. C., Gaver, D. P. Mechanisms of surface tension induced epithelial cell damage in a model of pulmonary airway reopening. J Appl Physiol. 94, 770-783 (2003).
- Petersen, T. H. Tissue-Engineerined Lungs for in Vivo Implantation. Science. 329, 538-5341 (2010).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16, 927-9233 (2010).
- Cortiella, J. Influence of acellular natural lung matrix on murine embryonic stem cell differentiation and tissue formation. Tissue Eng. Part A. 16, 2565-2580 (2010).
- Sugihara, H., Toda, S., Miyabara, S., Fujiuyama, C., Yonemitsu, N. Reconstruction of alveolus-like structure from alveolar type II epithelial cells in three-dimensional collagen gel matrix culture. Am J Pathol. 142, 783-7892 (1993).
- Choe, M. M., Sporn, P. H., Swartz, M. A. Extracellular matrix remodeling by dynamic strain in a three-dimensional tissue-engineered human airway wall model. American Journal Respiratory Cell Molecular Biology. 35, 306-306 (2006).
- Cortiella, J. Tissue-enginered lung: an in vivo and in vitro comparison of polyglycolic acid and pluronic F-127 hydrogel/somatic lung progenitor cell constructs to support tissue growth. Tissue Engineering. 12, 1213-1213 (2006).
- Price, A. P. Development of a Decellularized Lung Bioreactor System for Bioengineering the Lung: The Matrix Reloaded. Tissue Eng Part A. , (2010).
- Ott, H. C. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nat. Med. 14, 213-221 (2008).
- Uygun, B. E. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat. Med. 16, 814-820 (2010).
- Shannon, J. M., Mason, R. J., Jennings, S. D. Functional differentiation of alveolar type II epithelial cells in vitro: effects of cell shape, cell-matrix interactions and cell-cell interactions. Biochim. Biophys. Acta. 931, 143-156 (1987).
- Cortiella, J. Influence of Acellular Natural Lung Matrix on Murine Embryonic Stem Cell Differentiation and Tissue Formation. Tissue Eng Part A. , (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。