需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
transretinal ERG的录音,从小鼠视网膜杆和锥光反应
摘要
我们描述一个transretinal视网膜电图(ERG)录音获得完整的小鼠视网膜的杆状和锥状光反应相对简单的方法。这种做法从感光细胞的突触传递块孤立的光反应,并记录他们使用场电极置于整个平板式的孤立视网膜。
摘要
有两个不同的类脊椎动物的视网膜成像感光杆和视锥细胞。棒是能够探测到单光子的光,而视锥细胞在瞬息万变的明亮的光线条件下连续运行。光杆和锥感光细胞的外节的视觉色素的吸收触发一个光传导级联反应,最终导致封闭的环核苷酸门控通道的细胞膜和细胞极化。现有的和潜在的这种膜的光致变化可以注册为光响应,无论是古典吸电极记录技术1,2或transretinal药物阻断突触后反应元件3-5孤立视网膜电图记录,从图(ERG)。后一种方法允许从小鼠感光细胞的药物访问长久的录音和获得稳定的光反应FR特别有用OM的稀缺和脆弱的鼠标锥。在视锥细胞的情况下,进行这样的试验,无论是在暗适应条件和以下强烈的光照漂白基本上所有的视觉色素,监察锥感光恢复的过程中,在暗适应6,7。在这部影片中,我们将展示如何进行暗适应小鼠视网膜棒和M / L,锥的驱动transretinal录音。使用野生型小鼠(C57BL / 6)视网膜棒的录音将进行。为简单起见,锥录音将获得杆转导的转基因α-亚基基因敲除(Tα - / - )小鼠缺乏信号8杆。
研究方案
1。使电极
- 玻璃电极的准备。重达120毫克,琼脂和混合在10毫升蒸馏水(最终琼脂浓度为1.2%)。在热水浴融化的琼脂溶液。填补玻璃毛细管(我们使用以下尺寸的Word Presision仪器TW100-4毛细血管长度为100毫米,外径/ ID = 1/0.75毫米,内部容积为44μL)琼脂解决方案,使用塑料注射器。巩固在室温下10分钟的琼脂。因此,最多可以填写200毛细血管(琼脂混合物的其余部分可以存放在-4°C和重新使用几次)。
- 使用钻石刀切成一半的毛细血管。
- 浸泡24小时,至少在4°C的玻璃电极在导致鼠标电极解决方案储存在4°C的电极,并在3-4个月内使用它们。
2。设立实验
- 一夜之间暗适应鼠标。使用野生型(例如,C57Bl / 6)小鼠控制棒驱动transretinal的录音和Tα - / -小鼠缺乏杆锥transretinal录音信号。
- 准备1升灌注液,100毫升的电极解决方案,并培养20毫升的解决方案(见下文)和过滤灌注液槽1 Millipore公司0.45微米或0.22微米过滤器(可选)。
- 使用放置在视网膜平面光度计校准光源(505 nm的LED或卤素灯泡的光刺激)。在LED光源的情况下,使用光学扩散,达到光线均匀。
- 准备灌注室实验(室结构可能会有所不同)。我们室的3毫米有机玻璃制成,从一个小塑料培养皿的盖子底部,有一个积极的〜灌注量400μL(L为25毫米,宽8毫米,H≈2毫米)。填充电极的含L-谷氨酸2毫米和10毫米氯化钡2解决方案下电极室空间。用塑料管材和玻璃毛细管,在较低的电极空间(室底部的塑料管材连接)和电极支架的解决方案之间的连接。确保无气泡在电极,连接管,或电极支架(清除解决方案,如果需要使用塑料注射器)。
- 安装在显微镜的阶段(可选:显微镜可以安装在防振表,并在一个法拉第笼屏蔽,以减少机械和电磁噪音)的录音室。较低的电极支架连接到差分放大器(如华纳仪器DP-311放大器)正探头极。中心和校准室较低的电极刺激光斑开放。灌注线连接到录音室,开启灌注。
- 泡沫灌注液与95%的O 2/5%CO 2,同时孵化,在40°çWAT呃浴。 CO 2调整的解决方案,以7.2的pH值。解决方案的流向从瓶子到录音室,通过陶瓷电阻,通过重力将它加热到36-37°C。为了减少热量损失,热水器应设为尽可能接近录音室,最好在显微镜阶段。
- 随着流量调节器调节流速约1毫升/分钟。
- 上电极连接使用第二个电极支架的探头第二(负)极。热电偶探头结合使用O形圈的上部电极。确保电极和热电偶提示并拢尽可能接近视网膜的中心,使温度读数。上电极浸入灌注液中的一角,放置在室中心。允许基线稳定10-15分钟。
- 直流电压调整加热器,使溶液的温度是36 -37°C。
3。隔离小鼠视网膜
- 在昏暗的红灯,安乐死与CO 2和颈椎脱位,暗适应的鼠标。可选:有烧灼笔或加热的解剖针烧灼巩膜最背点,通过对每个鼠标眼球的参考标记。所有后续的程序进行,使用红外图像转换器,适合在解剖显微镜下红外光。
- 解剖施加温和的压力和伸展每只眼睛的两侧皮肤弯剪刀的眼睛。 Hemisect下红外照明使用microscissors或刀片的两个眼球。
- 取下的角膜和晶状体。删除尽可能多的玻璃体。
- 从第一视网膜色素上皮细胞层和剥离,如果必要的话,彻底清洁,用钳子消除色素上皮剩余的颗粒。我们通常使用为整个视网膜杆锥transret都inal录音。不过,如果你想专门记录才剥离视网膜删除眼罩的腹侧部分,用刀片或烧灼标志作为参考使用microscissors,从背小鼠视网膜的一部分,有更多的M / L型锥体9。
- 将Petri网与孵化的解决方案中的一个小盘子的第二个半横断眼球,直到使用纯氧饱和光紧盒中孵化的准备。通常,在这些条件下第二鼠标眼罩可以被储存在室温下几个小时的录音使用。
- 使用玻璃或塑料吸管孤立的视网膜转移到培养皿的盖子上的灌注液中(约300μL)。新增5-6电极溶液氯化钡2预孵育的视网膜含有氯化钡2的小水珠。将背面的方形片(约5×5毫米)角脂(我们使用道康宁111阀门润滑剂和密封剂)微孔滤纸(0.45微米HARG型),在其中心的预制孔(直径2-2.5毫米)相同的解决方案降。使用镊子位置滤纸的顶部(感光朝上)视网膜和按平面安装的外围边缘。应集中在视网膜在滤纸开幕。
- 使用镊子转移滤纸与视网膜灌注室和凌驾于刺激点对准下电极空间。稍微按脂滤纸的边缘,债券,同室。
- 放置在视网膜中心(略触摸感光层)上电极。围绕视网膜上的电极,提高了信号的幅度(高达20-40%,而把它接近视网膜的边缘)。虽然这种电极的位置稍微歪曲的有效光刺激强度达到视网膜(其总面积的12-15%)的小部门,它仍然是放置电极的最佳方式电极。准备准备现在的transretinal记录。
4。 transretinal录音
- 根据你的鼠标线,纪录杆或M / L型锥驱动的测试闪光反应,从朦胧到明亮的校准505 nm的光从LED光源或光刺激强度。在我们的LED光源的情况下,闪光强度是由一个电脑控制的LED输入电压,切换电阻,和一套中性密度滤镜(我们用E-色#211 0.9 ND ROSCO实验室的膜过滤器的组合控制)LED和视网膜之间。由计算机控制的LED测试闪光的持续时间(20毫秒)。如果使用卤素灯泡的光刺激,测试闪光强度和波长可以由一组中性密度过滤器和窄带干涉滤光片,分别控制。测试闪光持续时间可以控制由计算机驱动的百叶窗。
- 可选:为保持高效率全天光响应与氯化钡2胶质成分的抑制,偶尔改变下电极的解决方案(例如之前测试每个视网膜)通过清除它充满了新鲜的溶液用塑料注射器。
5。代表结果
解决方案
- 小鼠视网膜的灌注液:氯化钠112.5毫米,3.6毫米,2.4毫米氯化镁氯化钾, 氯化钙 1.2毫米,10毫米的肝素钠(pH值7.2), 碳酸氢钠 20毫米,3毫米钠琥珀酸,谷氨酸钠0.5毫米,0.02毫米EDTA,和10 mM葡萄糖。此外,该解决方案的补充,与2毫米L-谷氨酸和10μM的DL - AP-4,以阻止高阶元件的光响应10,11和0.1%的MEM维生素和MEM氨基酸的解决方案(Sigma公司),以改善视网膜生存能力。
- 鼠标电极解决方案:140毫米3.6毫米2.4毫米1.2毫米,3毫米肝素钠(pH值7.4,氢氧化钠) 氯化钙氯化镁 ,氯化钾,氯化钠,。在较低的元素的解决方案ctrode空间还包含2毫米L-谷氨酸阻断突触传递10,此外,10毫米氯化钡2抑制胶质细胞的光响应3,12组成部分。
- 视网膜孵化溶液:溶解272毫克的L-15培养基(Sigma公司)和20 mg BSA在20 mL去离子水。最后的L-15和BSA浓度为13.6毫克/毫升和1毫克/毫升,分别。 1 M盐酸调整pH值至7.4。
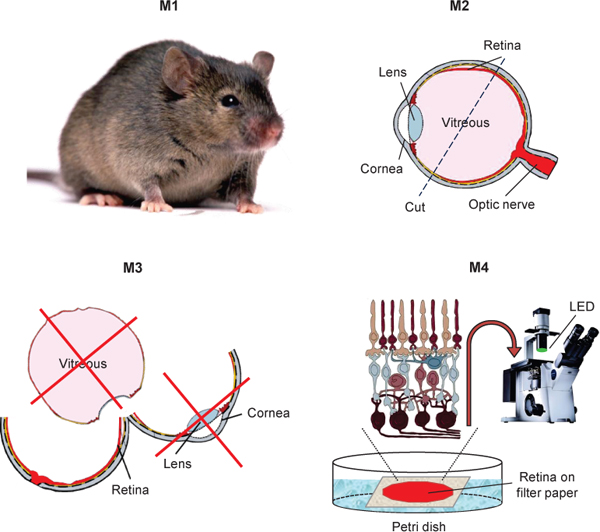
图1。示意图隔离的小鼠视网膜为transretinal ERG的记录。

图2。灌注室和记录电极与持有人的照片。红色箭头指示方向的灌注流量。
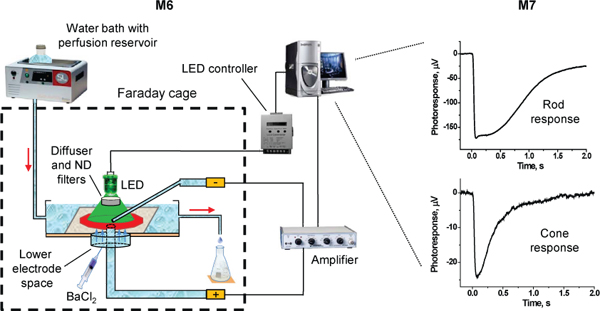
图3。的为transretinal视网膜录音实验装置示意图。红色箭头指示方向的灌注流量。
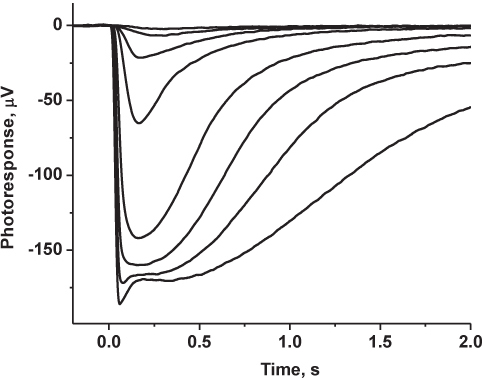
图4代表结果:记录家庭鼠标杆驱动transretinal反应。光反应是低通滤波(8极贝塞尔)在30 Hz,1 kHz时的数字化,并存储在计算机作进一步的分析。所示的痕迹,在昏暗的光线强度和饱和光照强度2-3答复代表平均5-6答复。
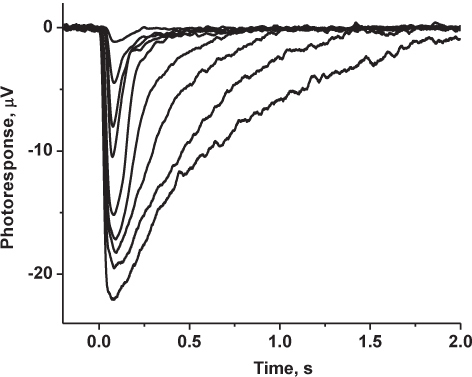
图5代表结果:记录家庭的鼠标驱动锥transretinal反应。光反应是低通滤波(8极贝塞尔)在30 Hz,1 kHz时的数字化,并存储在计算机作进一步的分析。所示的痕迹是求均值5-10反应ES在昏暗的光线强度和饱和光照强度3-5反应。
讨论
杆和锥驱动transretinal ERG的录音上面介绍的方法,正在成为一个调查,在野生型和转基因动物的鼠标感光功能强大的工具。除了基本的光响应特性的简单特征,这个简单的技术提供了很大的反响稳定性,在近乎完整的视网膜准备进行长期的实验。无论是暗适应的棒最大响应幅度和野生型小鼠光敏性至少1小时内是稳定的,从开始录音,暗适应锥最大振幅和光敏性通常不下降30-40分钟后超过10%录音。?...
披露声明
作者没有透露。
致谢
从研究职业发展奖防盲支持,国立卫生研究院资助EY19312 EY19543(VJK),以及不受限制地从研究的拨款,以防止盲目性和EY02687(华盛顿大学眼科及视觉科学系)。
材料
| Name | Company | Catalog Number | Comments | |
| 材料名称 | 类型 | 公司 | 目录编号 | 评论 |
| DL - AP-4 | TOCRIS生物科学 | 0101 | ||
| 所有其他试剂 | Sigma-Aldrich公司 | |||
| 玻璃毛细管 | 世界精密仪器 | TW100-4 | 为了使电极 | |
| 滤纸 | HARG | Millipore公司 | HABG01300 | |
| 光度计 | UDT的仪器 | S350的 | 对于光校准 | |
| 辐射硅传感器 | UDT的仪器 | 221 | 对于光校准 | |
| 抗振动表 | 技术制造公司 | 丰田汽车公司78-239-02R,TMC63-26012-01 | 为了尽量减少机械噪音 | |
| 空气压缩机豹带够15TC | 维特国际 | 带够15TC | 与防振表连接到 | |
| 体视显微镜 | 徕卡 | MZ9.5 | 鼠标眼清扫 | |
| 红外图像转换器 | BEMeyers | ProwlerTM | 绑定到立体显微镜 | |
| 差分放大器 DP-311 | 华纳仪器 | DP-311 | ||
| 轴突Digidata 1440A数字化仪 | ; | 分子器件 | 1440A | |
| 双通道8极过滤器 | 克罗恩-海特公司 | 3382 | ||
| 陶瓷电阻 | TE的连通 | 总参谋长SBCHE618RJ | 加热灌注液 | |
| 热电偶 | ţ | physitemp仪器 | IT-18 | |
| 温度监视器 | 欧米茄 | DPi32 | 连接到热电偶 | |
| LED的505纳米 | TT电子/ OPTEK技术 | 从DIGI-KEY的P / N 365-1185-ND | 申请测试闪烁/漂白光 | |
| 烧灼笔 | bovie | AA25 | 为标志的背侧鼠标眼球 | |
| pCLAMP 10电数据采集和分析软件 | 分子器件 |
参考文献
- Yau, K. W., Lamb, T. D., Baylor, D. A. Light-induced fluctuations in membrane current of single toad rod outer segments. Nature. 269, 78-80 (1977).
- Nikonov, S. S., Kholodenko, R., Lem, J., Pugh, E. N. Physiological features of the S- and M-cone photoreceptors of wild-type mice from single-cell recordings. J. Gen. Physiol. 127, 359-374 (2006).
- Nymark, S., Heikkinen, H., Haldin, C., Donner, K., Koskelainen, A. Light responses and light adaptation in rat retinal rods at different temperatures. J. Physiol. 567, 923-938 (2005).
- Heikkinen, H., Nymark, S., Koskelainen, A. Mouse cone photoresponses obtained with electroretinogram from the isolated retina. Vision Res. 48, 264-272 (2008).
- Frank, R. N., Dowling, J. E. Rhodopsin photoproducts: effects on electroretinogram sensitivity in isolated perfused rat retina. Science. 161, 487-489 (1968).
- Wang, J. S., Kefalov, V. J. An alternative pathway mediates the mouse and human cone visual cycle. Curr. Biol. 19, 1665-1669 (2009).
- Kolesnikov, A. V., Tang, P. H., Parker, R. O., Crouch, R. K., Kefalov, V. J. The mammalian cone visual cycle promotes rapid M/L-cone pigment regeneration independently of the interphotoreceptor retinoid-binding protein. J. Neurosci. 31, (2011).
- Calvert, P. D. Phototransduction in transgenic mice after targeted deletion of the rod transducin alpha -subunit. Proc. Natl. Acad. Sci. U.S.A. 97, 13913-13918 (2000).
- Applebury, M. L. The murine cone photoreceptor: a single cone type expresses both S and M opsins with retinal spatial patterning. Neuron. 27, 513-523 (2000).
- Sillman, A. J., Ito, H., Tomita, T. Studies on the mass receptor potential of the isolated frog retina. I. General properties of the response. Vision Res. 9, 1435-1442 (1969).
- Vinberg, F., Koskelainen, A. Calcium sets the physiological value of the dominant time constant of saturated mouse rod photoresponse recovery. PLoS One. 5, e13025-e13025 (2010).
- Bolnick, D. A., Walter, A. E., Sillman, A. J. Barium suppresses slow PIII in perfused bullfrog retina. Vision Res. 19, 1117-1119 (1979).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。