È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Transretinal Recordings ERG di retina di topo: Rod e fotorisposte Cone
In questo articolo
Riepilogo
Descriviamo un metodo relativamente semplice di transretinal elettroretinogramma (ERG) per l'ottenimento di registrazioni fotorisposte asta e cono da retina di topo intatto. Questo approccio sfrutta il blocco della trasmissione sinaptica da fotorecettori per isolare le loro risposte chiare e registrarli usando elettrodi posizionati sul campo in tutto il isolato piatto montato retina.
Abstract
Ci sono due classi distinte di formazione di immagini fotorecettori della retina dei vertebrati: bastoncelli e coni. I bastoncelli sono in grado di rilevare singoli fotoni di luce, mentre i coni operano continuamente sotto rapida evoluzione delle condizioni di luce intensa. L'assorbimento della luce da parte di asta-e pigmenti visivi cono-specifiche nei segmenti esterni dei fotorecettori fototrasduzione innesca una cascata che porta alla chiusura dei ciclici nucleotide-gated canali sulla membrana plasmatica delle cellule e la iperpolarizzazione. Questa luce cambiamento indotto nella membrana attuale e potenziale può essere registrato come fotorisposta, da una classica tecnica di aspirazione 1,2 elettrodo di registrazione o da registrazioni elettroretinografico transretinal (ERG) da retine isolate con farmacologicamente bloccate componenti risposta postsinaptica 3-5. Quest'ultimo metodo consente di droga accessibili a lunga durata delle registrazioni da fotorecettori del mouse ed è particolarmente utile per ottenere fotorisposte stabili from i coni del mouse scarse e fragile. In caso di coni, tali esperimenti possono essere eseguiti sia in condizioni di buio adeguate e seguenti illuminazione intensa che candeggianti essenzialmente il pigmento visivo, per monitorare il processo di recupero cono fotosensibilità durante l'adattamento al buio 6,7. In questo video, ci mostrerà come eseguire le registrazioni transretinal asta e M / L-cone-driven da dark-adattato retina mouse. Registrazioni stelo sarà effettuata utilizzando retina di tipo selvatico (C57BL / 6) topi. Per semplicità, cono le registrazioni saranno ottenute da organismi geneticamente modificati asta transducina α-subunità knockout (Tα - / -) topi che mancano di asta di segnalazione 8.
Protocollo
1. Fare Elettrodi
- Preparare elettrodi di vetro. Pesare 120 mg agar e mescolare in 10 mL di acqua distillata (concentrazione finale di agar 1,2%). Sciogliere la soluzione di agar in bagno di acqua calda. Riempire il bicchiere capillari (usiamo Instruments Presision Word TW100-4 capillari con le seguenti dimensioni: lunghezza = 100 mm, OD / ID = 1/0.75 mm, e il volume interno = 44 mL), con la soluzione di agar con siringa di plastica. Solidificare la agar a temperatura ambiente per 10 min. Così, fino a ~ 200 capillari può essere riempito (il resto della miscela agar può essere conservato a -4 ° C e riutilizzato più volte).
- Tagliare i capillari in due metà con un coltello di diamante.
- Bagnare gli elettrodi vetro con conseguente soluzione topo elettrodo per almeno 24 ore a 4 ° C. Conservare gli elettrodi a 4 ° C e di usare il periodo di 3-4 mesi.
2. Configurazione del test
- Dark-adattare il mouse durante la notte. Utilizzare wild-type (per esempio, C57Bl / 6) i topi per le registrazioni transretinal asta T-driven e alfa - / - asta di topi privi di segnalazione 8 per le registrazioni cono transretinal.
- 1 Preparare la soluzione di perfusione L, 100 ml di soluzione di elettrodi, e 20 ml di soluzione di incubazione (vedi sotto) e filtrare il liquido di perfusione attraverso un Millipore 0,45 um o 0,22 um filtro (opzionale).
- Calibrare la sorgente luminosa (505-nm LED o lampadina stimolatore alogena ottica) con un fotometro posto al piano della retina. Nel caso della sorgente di luce LED, utilizzare un diffusore ottico per ottenere uniformità della luce.
- Preparare la camera di perfusione per l'esperimento (costruzioni camera può variare). La camera è fatta di plexiglas 3 mm, con un fondo fatta dal coperchio di una piccola capsula di Petri di plastica, e ha un volume attivo perfusione di ~ 400 pl (L = 25 mm, L = 8 mm, H ≈ 2 mm). Riempire il spazio elettrodo inferiore della camera con soluzione elettrodo contenente 2 mM L-glutammato e 10 mM BaCl 2. Utilizzo di tubi in plastica e un capillare di vetro, un collegamento tra la soluzione nello spazio di elettrodo inferiore (fatta di connettore del tubo in plastica attaccato al fondo della camera) e il porta-elettrodo. Assicurarsi che non vi siano bolle nel elettrodi, le tubazioni di collegamento, o il titolare elettrodo (eliminare la soluzione con siringa di plastica, se necessario).
- Montare la camera di registrazione sulla scena del microscopio (opzionale: il microscopio può essere montato su un anti-vibrazione tavolo e schermati all'interno di una gabbia di Faraday per minimizzare il rumore meccanica ed elettromagnetica). Collegare il portaelettrodo inferiore al polo headstage positivo dell'amplificatore differenziale (ad es Warner Instruments DP-311 amplificatore). Centro e allineare l'elettrodo camera bassa apertura con lo spot luminoso stimolo. Collegare la linea di perfusione alla camera di registrazione e attivare la perfusione via.
- Bubble la soluzione di perfusione con% O 95 2/5% CO 2 mentre in incubazione a 40 ° C water bagno. CO 2 regola il pH della soluzione a 7,2. La soluzione fluisce dal flacone alla camera di registrazione per gravità passando attraverso un resistore ceramico riscaldamento a 36-37 ° C. Per ridurre la perdita di calore, la stufa deve essere posizionato il più vicino alla camera di registrazione possibile, idealmente sul palco del microscopio.
- Con un regolatore di flusso regolare la portata di circa 1 mL / min.
- Collegare l'elettrodo superiore al secondo (negativa) del polo headstage utilizzando un supporto secondo elettrodo. Associare la sonda termocoppia all'elettrodo superiore utilizzando un O-ring. Assicurarsi che le punte degli elettrodi e termocoppia sono vicine in modo che la lettura della temperatura viene preso come vicino al centro della retina come possibile. Immergere la punta dell'elettrodo superiore nel liquido di perfusione e posizionarlo nel centro della camera. Lasciare 10-15 min per la stabilizzazione basale.
- Regolare la tensione DC per il riscaldatore in modo che la temperatura della soluzione è di 36 -37 ° C.
3. Isolamento della retina di topo
- Sotto fioca luce rossa, l'eutanasia il mouse adattato al buio con CO 2 e dislocazione cervicale. Opzionale: lasciare un segno di riferimento su ogni bulbo oculare mouse cauterizzare il punto più dorsale della sclera con una penna cauterizzazione o riscaldata pin dissezione. Tutte le procedure successive sono eseguite sotto la luce a infrarossi utilizzando convertitori di immagine all'infrarosso idonei a un microscopio da dissezione.
- Dissect gli occhi con forbici curve applicando una leggera pressione e distendendo la pelle sui lati di ciascun occhio. Hemisect entrambi i bulbi oculari con l'illuminazione ad infrarossi utilizzando microscissors o una lama di rasoio.
- Rimuovere la cornea e la lente. Rimuovere tanto del vitreo possibile.
- Peel la retina primo strato dell'epitelio pigmentato e, se necessario, accuratamente pulirla con pinze per rimuovere granuli rimanenti di dell'epitelio pigmentato. Ci sono tipicamente usando retina complesso sia per asta e cono transretregistrazioni dolosi. Tuttavia, se si desidera registrare in particolare dalla parte dorsale della retina di topo che ha più M / L-coni 9, prima di sbucciarli retina rimuovere la parte ventrale del oculare con una lametta o microscissors utilizzando il marchio cauterio come riferimento.
- Posizionare il bulbo oculare secondo hemisected in una piccola scatola di Petri con soluzione di incubazione e incubare il preparato in una scatola a tenuta di luce saturata con ossigeno puro fino al momento dell'uso. Tipicamente, in queste condizioni l'oculare secondo mouse può essere conservato per diverse ore a temperatura ambiente e utilizzato per le registrazioni.
- Usando una pipetta di vetro o plastica trasferire la retina isolato di una goccia di soluzione di perfusione (ca. 300 ul) sul coperchio di una capsula di Petri. Aggiungere 5-6 gocce di soluzione di piccoli elettrodi contenenti BaCl 2 di pre-incubazione la retina con BaCl 2. Posizionare un pezzo quadrato (ca. 5x5 mm) del lato posteriore angolo ingrassato (usiamo Dow Corning 111 lubrificante valvola e sigillante) Millipore filtro di carta (0,45 um HARG tipo) con pre-made foro nel suo centro (2-2,5 mm di diametro) alla goccia stessa soluzione. Uso posizione pinze la retina sopra la carta da filtro (lato fotorecettori alto) e premere i bordi sulla periferia di piatto montarlo. La retina deve essere centrato sopra l'apertura nella carta da filtro.
- Uso pinze trasferire la carta da filtro con la retina alla camera di perfusione e posizionarlo sopra del punto stimolo allineato spazio di elettrodo inferiore. Leggermente premere i bordi ingrassati della carta da filtro di legame con la camera.
- Posizionare l'elettrodo superiore sopra il centro della retina (un po 'toccare lo strato dei fotorecettori). Centraggio l'elettrodo superiore sulla retina aumenta l'ampiezza del segnale (fino al 20-40% ~ rispetto dell'immissione più vicino al bordo retina). Sebbene posizione degli elettrodi come distorce leggermente l'effettiva intensità dello stimolo luce che raggiunge un piccolo settore della retina (~ 12-15% della sua superficie totale), è ancora il modo migliore di porre gli elettrodidell'elettrodo. La preparazione è ora pronto per le registrazioni transretinal.
4. Registrazioni Transretinal
- A seconda della linea di mouse, record di asta o M / L-cone-driven risposte flash di prova da dim all'intensità luminosa di luce calibrata 505 nm LED fornita da fonte di luce o stimolatore ottico. Nel caso della nostra sorgente luminosa a LED, l'intensità del flash è controllato da una combinazione di controllo computerizzato della tensione di ingresso LED, resistori selezionabili, e un insieme di filtri a densità neutra (usiamo E-colore # 211 0,9 filtri ND films da Laboratories Rosco ) posto tra il LED e la retina. La durata della prova LED lampo (20 ms) è controllato da un computer. Se si utilizza uno stimolatore lampada alogena ottico, l'intensità del flash prova e lunghezza d'onda può essere controllato da un insieme di filtri a densità neutra e filtri di interferenza a banda stretta, rispettivamente. Test di durata del flash può essere controllata da computer basati su persiane.
- Optional: per mantenere efficientesoppressione della componente gliale di fotorisposta con BaCl 2 durante il giorno, cambiare la soluzione elettrodo inferiore volte (ad esempio prima della prova ciascuna retina) di spurgo utilizzando una siringa di plastica pieno di soluzione fresca.
5. Risultati rappresentativi
Soluzioni
- Mouse perfusione soluzione retina: 112,5 mM NaCl, 3.6 mM KCl, 2,4 mM MgCl 2, 1.2 mM CaCl 2, 10 HEPES (pH 7,2), 20 mM NaHCO 3, 3 mM Na succinato, 0,5 mM Na glutammato, 0,02 mM EDTA, e 10 mM di glucosio. Inoltre, la soluzione è addizionato con 2 mM L-glutammato e 10 pM DL-AP-4 per bloccare i componenti di ordine superiore della fotorisposta 10,11, e con 0,1% MEM vitamine e MEM soluzioni aminoacidi (Sigma) per migliorare la retina redditività.
- Topo soluzione elettrodo: 140 mM NaCl, 3,6 mM KCl, 2,4 mM MgCl 2, 1,2 mM CaCl 2, 3 mM HEPES (pH 7,4, NaOH). La soluzione in elementi più bassospazio ctrode contiene anche 2 mM L-glutammato di bloccare la trasmissione sinaptica 10 e, inoltre, 10 mM BaCl 2 per sopprimere la componente gliale del fotorisposta 3,12.
- Incubazione della soluzione Retina: sciogliere 272 mg L-15 (Sigma) e 20 mg di BSA in 20 mL di acqua deionizzata. Finale L-15 e concentrazioni di BSA sono 13,6 mg / ml e 1 mg / ml, rispettivamente. Regolare il pH a 7,4 con 1 M HCl.
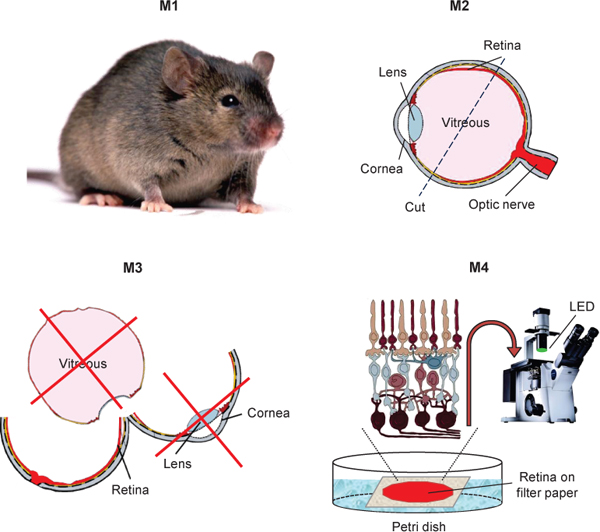
Figura 1. Schema che mostra l'isolamento di retina di topo per transretinal registrazioni ERG.

Figura 2. Fotografia della camera di perfusione e gli elettrodi di registrazione con i loro titolari. Frecce rosse indicano la direzione del flusso perfusione.
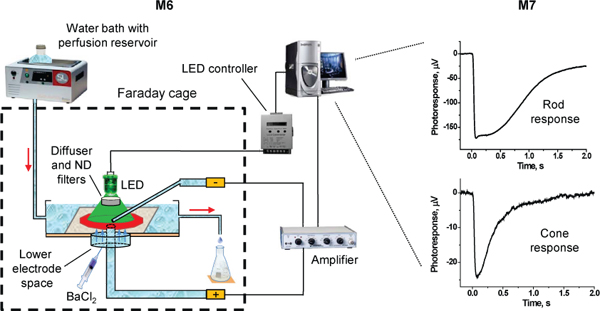
Figura 3. Schema del setup sperimentale per transretinal registrazioni ERG. Frecce rosse indicano la direzione del flusso perfusione.
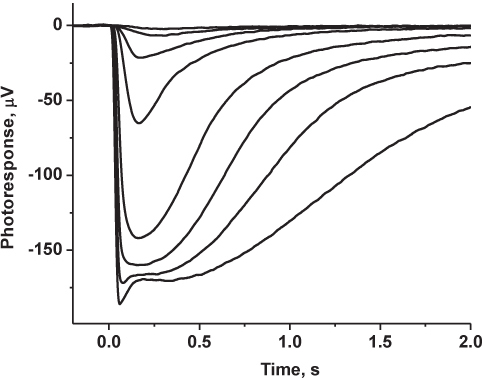
I risultati rappresentativi Figura 4:. Registrato famiglia di topo risposte transretinal rod-driven. Fotorisposte erano filtro passa-basso a 30 Hz (8 poli Bessel), digitalizzato a 1 kHz e memorizzati su un computer per ulteriori analisi. Tracce indicate corrispondono alle medie di 5-6 risposte con intensità di luce fioca e 2-3 risposte con intensità di luce saturazione.
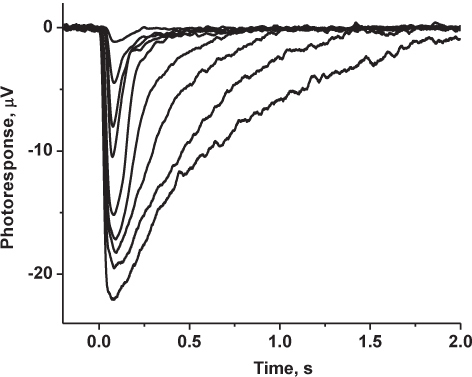
Figura 5: I risultati rappresentativi. Famiglia di mouse registrata risposte transretinal cono-driven. Fotorisposte erano filtro passa-basso a 30 Hz (8 poli Bessel), digitalizzato a 1 kHz e memorizzati su un computer per ulteriori analisi. Tracce indicate sono Averages di risposte 5-10 con intensità di luce fioca e 3-5 risposte con intensità di luce saturazione.
Discussione
Il metodo di asta-e cono-driven transretinal registrazioni ERG sopra descritto sta diventando un potente strumento per studiare la funzione dei fotorecettori del mouse sia nel tipo selvatico e animali geneticamente modificati. Oltre alla caratterizzazione delle proprietà di facile fotorisposta base, questa semplice tecnica fornisce una grande stabilità durante risposta durature esperimenti condotti su prossima al intatte preparati retina. Sia adattato al buio dell'ampiezza della risposta massima asta fotosensibili...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Supportato da Career Development Award dalla ricerca per prevenire la cecità, le sovvenzioni NIH EY19312 e EY19543 (VJK), così come da sovvenzione illimitata di ricerca per la Prevenzione della Cecità e EY02687 (Dipartimento di Oftalmologia e Scienze visiva presso la Washington University).
Materiali
| Name | Company | Catalog Number | Comments | |
| Nome del materiale | Tipo | Azienda | Numero di catalogo | Commento |
| DL-AP-4 | Bioscienze Tocris | 0101 | ||
| Tutti gli altri reagenti | Sigma-Aldrich | |||
| Vetro capillari | Mondo Strumenti di precisione | TW100-4 | Per la realizzazione di elettrodi | |
| Carta da filtro | HARG | Millipore | HABG01300 | |
| Fotometro | UDT Instruments | S350 | Per la calibrazione della luce | |
| Sensore di silicio radiometrica | UDT Instruments | 221 | Per la calibrazione della luce | |
| Anti-vibrazioni tavolo | Technical Manufacturing Corporation | TMC 78-239-02R, TMC63-26012-01 | Per ridurre al minimo rumore meccanico | |
| Compressore d'aria Panther P 15TC | Werther International | P 15TC | Collegato al tavolo anti-vibrazioni | |
| Stereomicroscopio | LEICA | MZ9.5 | Per la dissezione del mouse gli occhi | |
| Convertitori di immagini a infrarossi | BEMeyers | ProwlerTM | Bound to stereomicroscopio | |
| Amplificatore differenziale DP-311 | Warner Instruments | DP-311 | ||
| Axon Digidata 1440A Digitizer | ; | Molecular Devices | 1440A | |
| Dual Channel a 8 poli Filter | KROHN-HITE Corporation | 3382 | ||
| Resistenza in ceramica | TE Connectivity | CGS SBCHE618RJ | Per riscaldare il liquido di perfusione | |
| Termocoppia | T | Physitemp Instruments | IT-18 | |
| Temperature Monitor | Omega | DPi32 | Collegato a termocoppia | |
| LED 505 nm | TT Electronics / Optek Technology | Digi-Key P / N 365-1185-ND | Per applicare lampi di analisi e di luce sbiancamento | |
| Pen cauterio | Bovie | AA25 | Per marcare la parte dorsaledel bulbo topo | |
| PClamp 10 Elettrofisiologia di acquisizione dati e software per l'analisi | Molecular Devices |
Riferimenti
- Yau, K. W., Lamb, T. D., Baylor, D. A. Light-induced fluctuations in membrane current of single toad rod outer segments. Nature. 269, 78-80 (1977).
- Nikonov, S. S., Kholodenko, R., Lem, J., Pugh, E. N. Physiological features of the S- and M-cone photoreceptors of wild-type mice from single-cell recordings. J. Gen. Physiol. 127, 359-374 (2006).
- Nymark, S., Heikkinen, H., Haldin, C., Donner, K., Koskelainen, A. Light responses and light adaptation in rat retinal rods at different temperatures. J. Physiol. 567, 923-938 (2005).
- Heikkinen, H., Nymark, S., Koskelainen, A. Mouse cone photoresponses obtained with electroretinogram from the isolated retina. Vision Res. 48, 264-272 (2008).
- Frank, R. N., Dowling, J. E. Rhodopsin photoproducts: effects on electroretinogram sensitivity in isolated perfused rat retina. Science. 161, 487-489 (1968).
- Wang, J. S., Kefalov, V. J. An alternative pathway mediates the mouse and human cone visual cycle. Curr. Biol. 19, 1665-1669 (2009).
- Kolesnikov, A. V., Tang, P. H., Parker, R. O., Crouch, R. K., Kefalov, V. J. The mammalian cone visual cycle promotes rapid M/L-cone pigment regeneration independently of the interphotoreceptor retinoid-binding protein. J. Neurosci. 31, (2011).
- Calvert, P. D. Phototransduction in transgenic mice after targeted deletion of the rod transducin alpha -subunit. Proc. Natl. Acad. Sci. U.S.A. 97, 13913-13918 (2000).
- Applebury, M. L. The murine cone photoreceptor: a single cone type expresses both S and M opsins with retinal spatial patterning. Neuron. 27, 513-523 (2000).
- Sillman, A. J., Ito, H., Tomita, T. Studies on the mass receptor potential of the isolated frog retina. I. General properties of the response. Vision Res. 9, 1435-1442 (1969).
- Vinberg, F., Koskelainen, A. Calcium sets the physiological value of the dominant time constant of saturated mouse rod photoresponse recovery. PLoS One. 5, e13025-e13025 (2010).
- Bolnick, D. A., Walter, A. E., Sillman, A. J. Barium suppresses slow PIII in perfused bullfrog retina. Vision Res. 19, 1117-1119 (1979).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon