需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
为含量测定一氧化氮生物活性分析技术
摘要
内源性一氧化氮(NO)的生产,调节多种生物功能。人们越来越清楚NO基于信号中断或失调,在涉及人类的许多疾病。量化方法有关NO的代谢产物可能为人类疾病提供新的诊断或预后标志物。
摘要
一氧化氮(NO)是一种双原子自由基是极短的住在生物系统(血液循环小于1秒)1。 NO可能被认为是最重要的信号分子在我们的身体产生的,规范的基本职能,包括但不限于调节血压,免疫反应和神经通讯。因此,其准确的检测和生物样品的定量是在健康和疾病的认识没有任何作用的关键。与这种无生理半衰期短,检测NO的生物化学反应产物的替代战略已经制定出来。有关NO的代谢产物在多个生物舱的量化提供有价值的信息,对于体内没有生产,生物利用度和代谢。简单采样,如血液或血浆的单室可能并不总是准确的评估提供了一个全波DY没有地位,特别是在组织。的能力比较与选择组织实验动物的血液,将有助于弥合尽可能NO的生物标志物在健康和疾病的诊断和预后实用的基础科学和临床医学之间的差距。因此,血浆或血液利益的具体组织无状态的推断已经不再是一个有效的方法。因此,方法不断得到发展和验证允许NO和NO相关产品/多个车厢在实验动物体内的代谢产物的检测和定量。建立了从生产模式,通过NO合成酶的激活可溶性鸟苷酸环化酶(sGC)的最终氧化为亚硝酸盐(NO 2 - )和硝酸盐(NO - 3)NO的生物化学只可代表体内 NO的影响的一部分。与蛋白质巯基,二级胺,金属NO和NO源性代谢物形成的S-nitrosothi的相互作用OLS(RSNOs),N-亚硝胺(RNNOs),亚硝基血红素分别代表NO cGMP独立的作用,并有可能通过NO激活SGC一样重要生理。一个真正了解NO在生理来自体内实验,同时采样多个车厢。一氧化氮(NO)的方法,是一个复杂的,往往是混淆不清的科学和关于NO的生物化学许多辩论和讨论的焦点。阐明新的机制和我们的能力,具体涉及无铰链的信号通路,选择性和灵敏的检测和量化NO和所有相关的NO产品和复杂的生物样品中的代谢产物。在这里,我们提出了一个为亚硝酸盐和硝酸盐的快速,灵敏的高效液相色谱分析方法以及使用与化学derivitazation 在体外臭氧的化学发光法测定分子源NO以及体外与生物样品的检测不含器官浴myography。
研究方案
1。全采血车
- 从人类或实验动物在NEM,/ EDTA含有管收集静脉血。
- 立即降速血液14,300 RCF(相对离心力)7分钟准备血浆和红血细胞沉淀在台式离心机。
- 准备高效液相色谱(HPLC)和化学发光检测(CLD)分析血浆样品。
高效液相色谱法:1:1血浆,涡旋离心10分钟沉淀血浆蛋白,在13200转冷甲醇的体积。高效液相色谱分析收集上清。
慢性肺病:等分样品和磺胺和升汞专门检测亚硝基垫上预温育。 - 准备红细胞颗粒高效液相色谱法和CLD分析。
高效液相色谱法:添加1:4红细胞颗粒低渗裂解液中含有10毫米NEM的,2.5毫米EDTA和10毫米的铁氰化钾。涡彻底,然后加入1:1的甲醇,涡和centrif的威热10分钟,沉淀蛋白在13200转。高效液相色谱分析收集上清。
慢性肺病。加入1:4红细胞颗粒低渗裂解液中含有10 mM的EDTA,EDTA的2.5毫米和10毫米的赤血。等分样品含有亚硝基具体检测磺胺和升汞管。
2。组织提取和制备
- 以确定NO的代谢产物的组织水平,这是首先要收获的血液样品制备游离组织如上所述。全血交换将通过注入左心室心尖生理缓冲的地方。一旦被删除,所有的血液组织的利益,然后可以收获。
- 均质组织样本,并准备高效液相色谱法和CLD分析以上所述的样品。
3。血管内皮功能的主动脉环隔离
组织器官浴
- 小鼠将是ANEST乙醚hetized的,直到没有再回应从头到脚捏,并接受颈椎脱位,手术前。进行开胸手术暴露胸,腹主动脉。 25计注射器插入左心室心尖和灌注血液含氧克雷布斯Henseleit缓冲。
- 右心房被切断,提供血液的出口。将被删除腹主动脉外膜清洗。
- 戒指将被切成2毫米长的段,并安装一个四通道的组织器官浴沐浴在生理缓冲溶液(大唐720MO,公元仪器)。
- 含氧,克雷布斯缓冲区(95%O 2和5%CO 2)保持在37°C,在10毫升的器官浴血管环一克的预紧被放置在每个主动脉环(最佳的血管舒缩功能的张力适当的起点在以前的实验确定)。一个八进制八通道桥(PowerLab系统)和数据采集软件(图5.2.2版本)重新用来记录所有的测力。
- 环缓冲区各器官浴80分钟改为每20分钟允许平衡。平衡80分钟后,1μM的福林添加到每个亚最大收缩环。
- 稳定后,将被添加到内皮细胞乙酰胆碱受体激动剂如确定没有生产和血管松弛的程度。乙酰胆碱的剂量反应后,浴池将被冲洗和recontracted然后处理与外源性一氧化氮,硝普钠,以确定平滑肌的反应,并得到一个价值100%放宽。
- 洗澡可以增加NO的拾荒者,清楚地说明了NO的释放和抑制血管松弛。
4。代表结果
使用的ENO-20专用高效液相色谱法提供了一个易于使用的高通量方法的特异性和敏感性,亚硝酸盐和硝酸盐检测生物样品。检测和原始色谱的原理如图1所示。这种方法可用于任何生物样品的测定亚硝酸盐和硝酸盐。 CLD的NO的代谢产物的检测,需要化学derivitization步骤,确定了NO分子源。同时的氧化denitrosation和化学发光检测器还原denitrosation的实验装置如图2所示。反应釜上的权利是充满800MM在PBS pH值7.4的铁氰化钾和左侧的反应容器与碘化钾/碘醋酸减少denitrosation的( 图2A)的混合物填充。整个安装如图2B所示。 图3说明了具体denitrosation组检测,可以检测和量化亚硝酸盐,亚硝基,亚硝胺以及亚硝基血红素产品。这种方法已经被先前descri床和验证的4,5。这些重要的生化分析,可以很容易地与对离体主动脉环的功能研究,以确定内皮细胞NO的实验动物生产。这种古典的药理实验,可以轻松,准确地评估内皮功能和生产。血管反应性的测量,如内皮细胞乙酰胆碱受体激动剂,可直接确定内皮细胞NO的生化标志物检测实验动物血液和组织中,然后可以与相关的生产。 如图4所示剂量乙酰胆碱的反应的一个典型代表。内皮功能正常的健康对照组乙酰胆碱放宽。小鼠血管内皮功能障碍(高胆固醇血症小鼠)由于减少NO生成的相同的刺激,减少松弛。
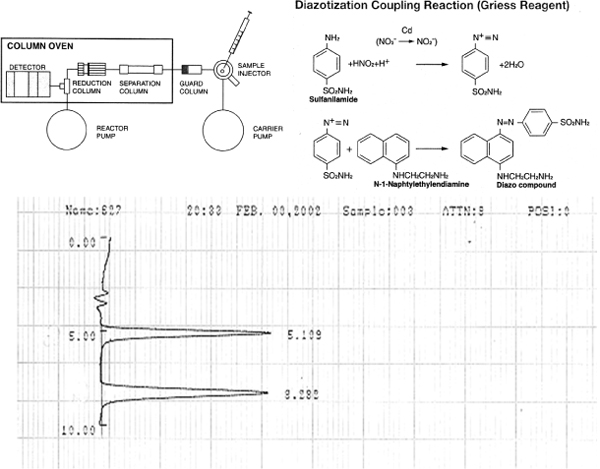
无花果余吕杏茜1。亚硝酸盐和硝酸盐的ENO-20和样品色谱检测原理。 ENO-20的亚硝酸盐和硝酸盐的检测方法示意图(上)。 (底部)10 pmol亚硝酸盐和硝酸盐的标准chromotogram注入的ENO-20(100μL亚硝酸盐和硝酸盐为100纳米的解决方案)。 1纳米为每100μL注射量的阴离子的灵敏度。没有与蛋白质或彩色物种的干扰。

图2。CLD的实验装置,用铁氰化钾还原使用碘化物/碘检测与清除一氧化氮气体的气相位检测denitrosation都氧化denitrosation。
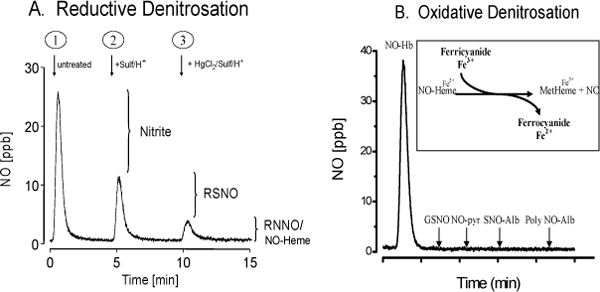
图3(A组)化学发光法检测亚硝酸盐,RSNO,在还原denitrosation的检测RNNO样品孵育组特定的化学人的试剂。峰面积的增减允许检测亚硝酸盐和RSNOs。 (B组)化学发光法检测亚硝基血红素利用铁氰化钾的氧化denitrosation解决方案的物种。这种方法是针对无血红素产品没有RSNOs(谷胱甘肽或白蛋白,SNO),或RNNO(NO-吡咯烷N-亚硝基-白蛋白)的交叉反应。
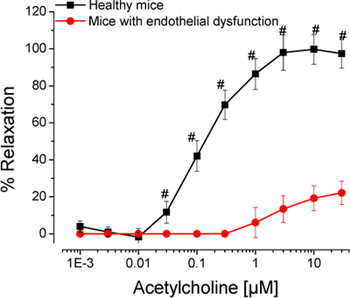
图4。 体外器官离体主动脉环浴内皮细胞NO,然后可以用相关的生化标志物检测高效液相色谱法和CLD的生产提供了一个直接的措施。这个数字足以说明在小鼠血管内皮功能障碍的减少松弛,由于NO产量下降。
讨论
在这里介绍了有关NO的代谢产物,在多个生物车厢量化的方法将允许没有测量由血管内皮细胞NO的功能,可与相关的健康和疾病的生物学指纹。为适应高吞吐量的潜力,这些方法需要简单的样品制备。这些分子的相对数量,可以帮助了解NO的生产和其代谢的命运,在一些疾病,甚至从人类患者的串行样品实验模型。检测没有基于生物标志物和许多分析方法,人为地制造一些样品制备过程中,这些产?...
披露声明
没有利益冲突的声明。
致谢
作者要感谢江红,博士和Deepa Parathasarthy,公共卫生,为企业发展服务的技术援助的
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| N - 乙基 | Thermo Scientific的 | 23030 | |
| EDTA的 | Sigma-Aldrich公司 | E7889 | |
| 铁氰化钾 | Fluka公司 | 60299 | |
| 高效液相色谱法 | eicom公司 | 的ENO-20 | |
| 自动进样器 | 奥尔科特 | ||
| 大唐肌动描记 | 公元仪器 | ||
| PowerLab系统 | 公元仪器 | ||
| 化学发光 | EcoPhysics | CLD的88Y | |
| 离心分离 | Eppendorf公司 | 5415D | |
| 乙酰胆碱 | Sigma-Aldrich公司 | A6625 | |
| ,R-( - )苯肾上腺素 | Sigma-Aldrich公司 | P6126 |
参考文献
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411, 273-289 (1999).
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetycholine. Nature. 288, 373-376 (1980).
- Ignarro, L. J. Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide. Proc. Natl. Acad Sci. U.S.A. 84, 9265-9269 (1987).
- Feelisch, M. Concomitant S-, N-, and heme-nitrosylation in biological tissues and fluids: implications for the fate of NO in vivo. FASEB J. 16, 1775-1785 (2002).
- Wang, X. Measurement of nitric oxide levels in the red cell: validation of tri-iodide-based chemiluminescence with acid-sulfanilamide pretreatment. J. Biol. Chem. 281, 26994-27002 (2006).
- Angelo, M., Singel, D. J., Stamler, J. S. An S-nitrosothiol (SNO) synthase function of hemoglobin that utilizes nitrite as a substrate. Proc. Natl. Acad. Sci. U.S.A. 103, 8366-8371 (2006).
- Bryan, N. S. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10, 221-228 (2004).
- Feelisch, M. Tissue Processing of Nitrite in Hypoxia: An Intricate Interplay of Nitric Oxide-Generating and -Scavenging Systems. J. Biol. Chem. 283, 33927-33934 (2008).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radic. Biol. Med. 43, 645-657 (2007).
- Lundberg, J. O., Weitzberg, E. NO generation from inorganic nitrate and nitrite: Role in physiology, nutrition and therapeutics. Arch. Pharm. Res. 32, 1119-1126 (2009).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nat. Rev. Drug. Discov. 7, 156-157 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。