需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生物医学植入物的石墨涂料
摘要
石墨烯具有潜在的生物医学植入物的涂层材料。在这项研究中,我们展示了一个涂层镍钛记忆合金合金纳米厚的石墨层的方法,并确定如何石墨烯可能会影响植入物的反应。
摘要
作为表面涂层具有原子级平滑的石墨烯的潜力,以改善植入物的性质。这表明涂层镍钛记忆合金合金作为支架材料的应用与纳米厚的石墨层的方法。石墨烯是通过化学气相沉积铜基板上生长,然后转印到镍钛合金基板。为了了解石墨烯涂层可以改变生物反应的大鼠主动脉内皮细胞和大鼠主动脉平滑肌细胞,细胞存活率的影响。此外,用荧光共焦显微镜检查细胞粘附和形态上的石墨烯涂层的效果。细胞进行染色,肌动蛋白和核,和原始的镍钛合金样品之间有明显的差异相比,石墨烯涂覆的样品。总大鼠主动脉平滑肌细胞的肌动蛋白表达被发现使用免疫印迹。蛋白质吸附特性,潜在的血栓形成的指标,WERE琼脂糖凝胶电泳血清白蛋白和纤维蛋白原。此外,纤维蛋白原的电荷转移到基板推导出了利用拉曼光谱。有人发现,石墨烯涂层的镍钛合金基板满足的支架材料的功能要求和改善的生物反应相比,未涂覆的镍钛合金。因此,石墨涂层镍钛记忆合金的支架材料是一个可行的候选人。
引言
过去三十年目睹发现的新型材料为基础的治疗和疾病的治疗和诊断设备。新型合金材料,例如镍钛合金(NiTi合金)和不锈钢通常用在生物医学植入物的制造,由于其优异的机械特性。1-3,但众多的挑战仍然由于外源性材料的细胞毒性,生物和血液相容性。的金属的性质,这些合金的结果较差的生物和血液相容性由于金属浸出,缺乏的细胞粘附,增殖,血栓形成,当涉及在流动的血液接触(如导管,血管移植物,血管支架,人工心脏瓣膜与植入物表面的蛋白质或活细胞等 )。1,4,5的相互作用可导致强烈的生化反应的免疫学反应和随后的级联可能产生不利影响的移动设备的功能。因此,它被pertin耳鼻喉科在生物医学植入物和其周围的生物环境之间的相互作用来实现控制。通常采用的表面改性,以减少或防止不利的生理响应,源自植入材料。一个理想的表面涂层,预计有高的粘合强度,化学惰性,高平滑性,和良好的血液和生物相容性。在此之前,许多材料包括类金刚石碳(DLC),碳化硅,氮化钛,TiO 2和许多聚合物材料已被测试的生物相容的植入物表面涂层1,6-23然而,这些材料仍然无法满足所有一个合适的植入物表面涂层的功能标准。
发现SP 2,被称为石墨烯,碳原子厚的一层敞开了大门,为发展新型多功能材料。石墨烯是种植体表面涂层的,因为它是一个理想的候选人是化学惰性的,原子级平滑和高度耐用的。在这封信中,我们研究了石墨烯的可行性,为生物医学植入物的表面涂层。我们的研究表明,石墨涂层镍钛记忆合金(GR-镍)满足所有的功能标准,同时还支持优秀的平滑肌和内皮细胞的生长,导致细胞增殖,以更好地。我们还发现,血清白蛋白吸附在镍GR-高于纤维蛋白原。更重要的是,(i)本详细的光谱测量证实了缺乏表明,石墨涂层石墨,纤维蛋白原之间的电荷转移抑制血小板活化植入物,(ii)石墨烯的涂料不表现出任何重大的体外毒性内皮细胞和平滑肌细胞系的确认其生物相容性,及(iii)的石墨烯涂层是化学惰性的,耐用的和不可渗透的,在流动的血液环境。这些血液和生物相容性,随着高STrength,化学惰性和耐用性,使石墨烯作为一个理想的表面涂层涂料。
Access restricted. Please log in or start a trial to view this content.
研究方案
1。石墨涂层的镍
- 铜(Cu)的基板使用的化学气相沉积技术,在本研究中所用的石墨烯样品上生长,并随后将其转移至4.5毫米2 NiTi合金基板。
- 铜箔(1厘米×1厘米)被放置在一个1英寸的石英管式炉,和50sccm的H 2,450sccm的Ar的存在下,在加热到1000℃。
- 往下,甲烷(1和4 sccm的)引入炉中20-30分钟,在不同的流率。对样品进行了最终冷却至室温,在流动下的Ar和H 2,CH 4。
- 接着,旋涂的Cu箔与PMMA(用4%苯甲醚)稀释,在4,000 rpm下,随后在150℃下5分钟的热处理得到石墨烯PMMA层上,通过蚀刻的Cu箔使用Transene公司公司,CE-100腐蚀剂,并随后在10%HCl和去离子水冲洗10分钟。
- 的samples被转移到:NiTi合金基板(4.5毫米2),退火温度在450℃下,在Ar(300 sccm的)和H 2(700 sccm)的2小时以除去的PMMA。最后,底物用丙酮洗涤,溶解残留的聚甲基丙烯酸甲酯,得到的Gr-NiTi合金样品。一个Dilor XY三联光栅单色仪被用于微的拉曼表征(使用100X客观)的所有GR-NiTisamples 514.5nm的氩离子激光激发。
2。 体外毒性的GR-镍
培养大鼠主动脉内皮细胞(细胞应用公司),明胶涂层8室幻灯片。为了测试细胞的生长,质朴的和GR-NiTisubstrates的被安置在井没有任何明胶涂层。用Hitachi S-4800扫描电镜扫描电子显微镜图像。此外,大鼠主动脉平滑肌细胞生长在CellBind 96孔板中都作为对照组(康宁)lbecco的改良的Eagle培养基(ATCC)。
- 为了测试细胞活力,细胞(内皮细胞和平滑肌细胞)接种在10 5个细胞/孔在井含有原始的NiTi合金,1 sccm的或4 sccm的的Gr-NiTi合金基板,其中所述sccm的对应中所用的甲烷流的石墨烯CVD增长。细胞生长所需的时间段的培养箱中在37℃和5%CO 2,交换介质隔日。
- 在结束时间点,除去培养基,含0.5毫克/毫升噻唑基溴化四氮唑蓝(或MTT得自Sigma)的新鲜培养基加入到各孔。额外的3小时,然后将细胞孵育。对于MTS测定,媒体除去在最后的时间点,用120μl的MTS工作液(细胞层96水溶液,Promega)中,温育3小时代替。
- 接着,媒体轻轻地除去和100毫升二甲亚砜(Sigma公司)加入到各孔。移植后翼10分钟溶解的MTT晶体,将该溶液转移到另一个孔板。对于MTS测定,没有二甲基亚砜加入到孔中。好内容被转移到一个新的平板。
- 吸光度在490nm处读出,并通过正火纯净的NiTi合金样品的平均吸光度,吸光度测定的百分存活率。至少有五个重复进行对每个样品类型。
3。共聚焦显微镜细胞形态研究
- 共聚焦成像的大鼠主动脉平滑肌细胞,基板放置在8室幻灯片(Thermo Scientific的)。在接种细胞以25,000细胞/腔室中,在37℃和5%CO 2下培养3天。
- 细胞被固定在基板上,用4%甲醛的磷酸盐缓冲盐水中20分钟。
- 透性为0.1%的Triton-X 1分钟。
- 肌动蛋白染色用Alexa Fluor 488鬼笔环肽(LIFË技术)。在甲醇中的200单位/ ml加入100μl的488 alexafluor,鬼笔环肽在溶液中加入1.9毫升磷酸盐缓冲盐水。细胞进行染色,用250微升488 alexafluor鬼笔环肽45分钟,然后用磷酸盐缓冲盐水洗涤两次。
- 核安装VectaShield荧光安装介质含DAPI(向量实验室)的。共聚焦图像采集使用的是尼康共聚焦TI。甲腔室接种没有任何基板与细胞中被用作对照。
4。蛋白质吸附的研究
- 基板尺寸蛋白质吸附实验开始前用卡尺测量。采取三个测量值的大致正方形的样品的每一侧和平均得到的长度和宽度。
- 每个样品,原始的NiTi合金,1sccm和4sccm的Gr-NiTiwere孵育用1毫克/毫升白蛋白的磷酸盐缓冲盐水(PBS)或1毫克/毫升纤维蛋白原在PBS中在室温吨emperature为3小时。
- 相同方式样本合并还原样品缓冲液中的200μl的微量离心管中,并煮沸5分钟。
- 然后将样品稀释的Tris /甘氨酸/ SDS缓冲液(Bio-Rad公司),并运行通过4-15%Tris聚丙烯酰胺电泳凝胶(Bio-Rad公司),在100分钟的90 V。
- 凝胶染色与SYPRO红。稀释:SYPRO红(Life Technologies公司)的股票在7.5%(V / V)醋酸溶液,1:5000。染色凝胶60分钟。
- 影像的凝胶使用Flourchem SP(阿尔法INNOTECH公司)。荧光强度定量使用ImageJ的软件。从每个样品的荧光强度进行归一由基板的总面积和纤维蛋白原吸附相比,白蛋白吸附。
5。 Western印迹蛋白表达
- Western blot检测进行分析总肌动蛋白的大鼠主动脉平滑肌细胞。细胞接种在10,000个细胞/底物,在96瓦特埃尔板。
- 3天前取出介质细胞生长。用RIPA缓冲液,和一个标准的BCA测定(LAMDA)进行量化总蛋白提取细胞总蛋白。
- 将样品稀释到相同浓度在RIPA,然后煮沸5分钟,在还原性样品缓冲液。
- 由4-15%Tris聚丙烯酰胺凝胶通过电泳分离蛋白质,在90 V为100分钟。一个万花筒蛋白标准(BIO-RAD)是用来评估蛋白质分子量。
- 蛋白质转移到PVDF膜上,并用1%无脂干牛奶(Bio-Rad公司)溶液中断。
- 总肌动蛋白标记的兔抗鼠的肌动蛋白抗体(Sigma)。甲BM化学发光试剂盒(Roche),用于检测第一抗体。膜使用FlourChem SP成像设备和使用ImageJ软件测量荧光强度成像。荧光强度比较归一化的初级斯坦NiTisample。
Access restricted. Please log in or start a trial to view this content.
结果
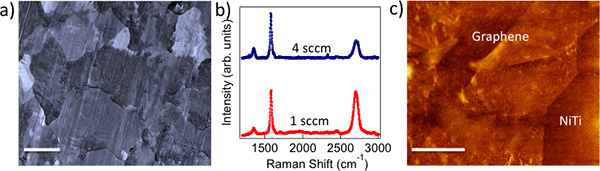
图1。)CVD法生长的多晶石墨在Cu箔模仿金属晶粒(比例尺:10微米)。 B)1的SCCM(4 SCCM)石墨烯的拉曼光谱显示了强烈的(相对较弱)G'带指示单层(数层)所制备的石墨烯的性质。三)转印到NiTi合金的石墨烯的AFM图像显示为〜5 nm的粗糙度。比例尺= 500纳米。
Access restricted. Please log in or start a trial to view this content.
讨论
生物相容性和细胞毒性:化学气相沉积(CVD)方法,得到多晶石墨烯样品,模仿铜的晶粒,如在图1a中所示。我们采用拉曼光谱,以确认存在的数层(单层)石墨烯1 SCCM(4 SCCM)样品( 见图1b)。很显然,1 sccm的(4 sccm)的样品表现出强烈的(相对较弱)G'带表示单层的(少数层)石墨烯。 图1c示出了在NiTi基板少数层石墨烯的原子力显微镜(AFM)图...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
材料
| Name | Company | Catalog Number | Comments |
| 试剂 | |||
| 的Dulbecco改良的Eagle培养基 | ATCC | 30-2002 | |
| 噻唑蓝四甲基偶氮唑蓝 | Sigma-Aldrich公司 | M2128 | |
| CellTiter 96水溶液中的一种解决方案细胞增殖试验(MTS)的 | Promega公司 | G3582 | |
| 二甲基亚砜 | Sigma-Aldrich公司 | D8418 | |
| 36.5%的甲醛 | Sigma-Aldrich公司 | F8775 | |
| 的Triton X-100的 | Sigma-Aldrich公司 | T8787 | |
| Alexafluor 488鬼笔环肽 | Life Technologies公司 | A12379 | |
| VECTASHIELD安装介质与DAP我 | 矢量实验室 | H-1200 | |
| 人血清白蛋白 | Sigma-Aldrich公司 | A9511 | |
| 人纤维蛋白原 | |||
| 的Tris /甘氨酸/ SDS | Bio-Rad公司 | 161-0732 | |
| 准备凝胶的Tris-HCl凝胶 | Bio-Rad公司 | 161-1158 | |
| 醋酸 | Sigma-Aldrich公司 | 45726 | |
| SYPRO红 | Life Technologies公司 | S-6653 | |
| 高蛋白低BCA分析 | LAMDA生物技术 | G1003 | |
| 精密加蛋白万花筒标准 | Bio-Rad公司 | 161-0375 | |
| IMMUN印迹PVDF膜 | Bio-Rad公司 | 162-0177 | |
| 印迹级阻滞剂非脂肪干乳 | Bio-Rad公司 | 170 6404XTU | |
| 产生的兔的抗肌动蛋白抗体 | Sigma-Aldrich公司 | A2066 | |
| BM化学发光免疫印迹试剂盒(鼠/兔) | 罗氏应用科学部 | 11520709001 | |
| RIPA缓冲 | Sigma-Aldrich公司 | R0278 | |
| NiTi合金(51%的Ni,49%的Ti) | α-(天津)化学有限公司 | 44953 | |
| 设备 | |||
| 堀场JobinYvon | 拉曼光谱仪 | Dilor XY 98 | |
| 尼康 | 共聚焦显微镜 | Eclipse的TI显微镜 | |
| Thermoscientific | 微孔板检测仪 | ||
| Bio-Rad公司 | 电源 | 164-5050 | PowerPac的基本电源 |
| Bio-Rad公司 | 电泳槽 | 165-8004 | 迷你PROTEAN四单元的 |
| Bio-Rad公司 | 凝胶支架盒 | 170-3931 | 迷你凝胶支架盒 |
参考文献
- Roy, R. K., Lee, K. -R. Biomedical applications of diamond-like carbon coatings: A review. Journal of Biomedical Materials Research Part B-Applied Biomaterials. 83 B (1), 72-84 (2007).
- Shah, A. K., Sinha, R. K., Hickok, N. J., Tuan, R. S. High-resolution morphometric analysis of human osteoblastic cell adhesion on clinically relevant orthopedic alloys. Bone. 24 (5), 499-506 (1999).
- Huang, N., Yang, P., Leng, Y. X., Chen, J. Y., Sun, H., Wang, J., Wang, G. J., Ding, P. D., Xi, T. F., Leng, Y. Hemocompatibility of titanium oxide films. Biomaterials. 24 (13), 2177-2187 (2003).
- Gutensohn, K., Beythien, C., Bau, J., Fenner, T., Grewe, P., Koester, R., Padmanaban, K., Kuehnl, P. In vitro analyses of diamond-like carbon coated stents: Reduction of metal ion release, platelet activation, and thrombogenicity. Thrombosis Research. 99 (6), 577-585 (2000).
- Gillespie, W. J., Frampton, C. M. A., Henderson, R. J., Ryan, P. M. The Incidence of Cancer Following Total Hip-Replacement. Journal of Bone and Joint Surgery-British Volume. 70 (4), 539-542 (1988).
- Sperling, C., Schweiss, R. B., Streller, U., Werner, C. In vitro hemocompatibility of self-assembled monolayers displaying various functional groups. Biomaterials. 26 (33), 6547-6557 (2005).
- Mikhalovska, L. I., Santin, M., Denyer, S. P., Lloyd, A. W., Teer, D. G., Field, S., Mikhalovsky, S. Fibrinogen adsorption and platelet adhesion to metal and carbon coatings. Thrombosis and Haemostasis. 92 (5), 1032-1039 (2004).
- Airoldi, F., Colombo, A., Tavano, D., Stankovic, G., Klugmann, S., Paolillo, V., Bonizzoni, E., Briguori, C., Carlino, M., Montorfano, M., Liistro, F., Castelli, A., Ferrari, A., Sgura, F., Mario, C. D. i Comparison of diamond-like carbon-coated stents versus uncoated stainless steel stents in coronary artery disease. American Journal of Cardiology. 93 (4), 474-477 (2004).
- Allen, M., Myer, B., Rushton, N. In vitro and in vivo investigations into the biocompatibility of diamond-like carbon (DLC) coatings for orthopedic applications. Journal of Biomedical Materials Research. 58 (3), 319-328 (2001).
- Butter, R., Allen, M., Chandra, L., Lettington, A. H., Rushton, N. In-vitro Studies of DLC Coatings with Silicon Intermediate Layer. Diamond and Related Materials. 4 (5-6), 857-861 (1995).
- Dearnaley, G., Arps, J. H. Biomedical applications of diamond-like carbon (DLC) coatings: A review. Surface & Coatings Technology. 200 (7), 2518-2524 (2005).
- Dorner-Reisel, A., Schurer, C., Nischan, C., Seidel, O., Muller, E. Diamond-like carbon: alteration of the biological acceptance due to Ca-O incorporation. Thin Solid Films. 420, 263-268 (2002).
- Dowling, D. P., Kola, P. V., Donnelly, K., Kelly, T. C., Brumitt, K., Lloyd, L., Eloy, R., Therin, M., Weill, N. Evaluation of diamond-like carbon-coated orthopaedic implants. Diamond and Related Materials. 6 (2-4), 390-393 (1997).
- Grill, A. Diamond-like carbon coatings as biocompatible materials - an overview. Diamond and Related Materials. 12 (2), 166-170 (2003).
- Hauert, R. A review of modified DLC coatings for biological applications. Diamond and Related Materials. 12 (3-7), 583-589 (2003).
- Windecker, S., Mayer, I., De Pasquale, G., Maier, W., Dirsch, O., De Groot, P., Wu, Y. P., Noll, G., Leskosek, B., Meier, B., Hess, O. M. Working Grp Novel Surface, C., Stent coating with titanium-nitride-oxide for reduction of neointimal hyperplasia. Circulation. 104 (8), 928-933 (2001).
- Zhang, F., Zheng, Z. H., Chen, Y., Liu, X. G., Chen, A. Q., Jiang, Z. B. In vivo investigation of blood compatibility of titanium oxide films. Journal of Biomedical Materials Research. 42 (1), 128-133 (1998).
- Bolz, A., Schaldach, M. Artificial-Heart Valves - Improved Blood Compatibility By PECVD a-SiC-H COATING. Artificial Organs. 14 (4), 260-269 (1990).
- Haude, M., Konorza, T. F. M., Kalnins, U., Erglis, A., Saunamaki, K., Glogar, H. D., Grube, E., Gil, R., Serra, A., Richardt, H. G., Sick, P., Erbel, R., Invest, C. T. Heparin-coated stent placement for the treatment of stenoses in small coronary arteries of symptomatic patients. Circulation. 107 (9), 1265-1270 (2003).
- Suggs, L. J., Shive, M. S., Garcia, C. A., Anderson, J. M., Mikos, A. G. In vitro cytotoxicity and in vivo biocompatibility of poly(propylene fumarate-co-ethylene glycol) hydrogels. Journal of Biomedical Materials Research. 46 (1), 22-32 (1999).
- Clarotti, G., Schue, F., Sledz, J., Benaoumar, A. A., Geckeler, K. E., Orsetti, A., Paleirac, G. Modification of the biocompatible and haemocompatible properties of polymer substrates by plasma-deposited fluorocarbon coatings. Biomaterials. 13 (12), 832-840 (1992).
- Gombotz, W. R., Guanghui, W., Horbett, T. A., Hoffman, A. S. Protein adsorption to poly(ethylene oxide) surfaces. Journal of Biomedical Materials Research. 25 (12), 1547-1562 (1991).
- Ishihara, K., Fukumoto, K., Iwasaki, Y., Nakabayashi, N. Modification of polysulfone with phospholipid polymer for improvement of the blood compatibility. Part 2. Protein adsorption and platelet adhesion. Biomaterials. 20 (17), 1553-1559 (1999).
- Jung, N., Kim, B., Crowther, A. C., Kim, N., Nuckolls, C., Brus, L. Optical Reflectivity and Raman Scattering in Few-Layer-Thick Graphene Highly Doped by K and Rb. ACS Nano. 5 (7), 5708-5716 (2011).
- Rao, A. M., Eklund, P. C., Bandow, S., Thess, A., Smalley, R. E. Evidence for charge transfer in doped carbon nanotube bundles from Raman scattering. Nature. 388 (6639), 257-259 (1997).
- Bunch, J. S., Verbridge, S. S., Alden, J. S., vander Zande, A. M., Parpia, J. M., Craighead, H. G., McEuen, P. L. Impermeable atomic membranes from graphene sheets. Nano Letters. 8 (8), 2458-2462 (2008).
- Chen, S., Brown, L., Levendorf, M., Cai, W., Ju, S. -Y., Edgeworth, J., Li, X., Magnuson, C. W., Velamakanni, A., Piner, R. D., Kang, J., Park, J., Ruoff, R. S. Oxidation Resistance of Graphene-Coated Cu and Cu/Ni Alloy. Acs Nano. 5 (2), 1321-1327 (2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。