このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
メディカルインプラントのグラフェンコーティング
要約
グラフェンは、生物医学インプラントのコーティング材料としての可能性を秘めています。本研究では、グラフェンのナノメートル厚さの層でコーティングニチノール合金のための方法を示し、グラフェンは、インプラントの応答に影響を与える可能性がある方法を決定します。
要約
表面コーティングとして原子的に平滑なグラフェンは、インプラントの性質を改善する可能性を秘めている。これはステント材料などの用途にグラフェンのナノメートル厚さの層でコーティングニチノール合金のための方法を示しています。グラフェンは、化学蒸着を介して銅基板上に成長させた後、ニチノール基材に転写した。グラフェンコーティングは生物学的応答を変えることができる方法を理解するためには、ラット大動脈内皮細胞およびラット大動脈平滑筋細胞の細胞生存率を調べた。また、細胞接着と形態上のグラフェンのコーティングの効果は蛍光共焦点顕微鏡を用いて検討した。細胞は、アクチンと核を染色し、グラフェンでコーティングされたサンプルと比較して自然のままのニチノールサンプル間の顕著な差は認められていた。ラット大動脈平滑筋細胞からの総アクチンの発現をウェスタンブロットを用いて発見された。タンパク質吸着特性、潜在的な血栓形成の指標で、wEREは、ゲル電気泳動による血清アルブミン、フィブリノゲンについて決定された。また、フィブリノゲンから基板への電荷の移動は、ラマン分光法を用いて推定した。これは、ニチノール基板上グラフェンコーティングはステント材料の機能要件を満たし、コーティングされていないニチノールに比べて生物学的応答を改善することがわかった。このように、グラフェンでコーティングされたニチノールは、ステント材料のための実行可能な候補である。
概要
過去30年間は、病気の治療や診断のための新規材料ベースの治療とデバイスの検出を目撃しました。ニチノール(NiTiの)やステンレス鋼のような斬新な合金材料は、多くの場合、彼らの優れた機械的特性に起因する生物医学インプラントの製造に使用されています1月3日ただし、多くの課題は、外因性物質の細胞毒性、バイオ·HEMO互換性のために残っています。カテーテル、血管移植片、血管ステント、人工心臓弁など貧しいバイオ·金属浸出、細胞接着性の欠如、増殖、および血栓症による血液適合性におけるこれらの合金の結果、それが血流に接触(の金属の性質等 )。1,4,5、タンパク質またはインプラント表面と生体細胞との相互作用に悪影響デバイスの機能に影響を及ぼす可能性があり、強力な免疫反応および生化学反応のその後のカスケードにつながることができます。したがって、それはpertinさ生物医学のインプラントとその周囲の生物学的環境との相互作用の制御を達成するための耳鼻咽喉科。表面改質は、多くの場合、インプラント材料から発する有害な生理学的応答を低減または防止するために採用されている。理想的な表面コーティングは、高い接着強度、化学的不活性、高い平滑性、および良好なHEMOと生体適合性を有することが期待される。以前は、ダイヤモンドライクカーボン(DLC)は、SiCやTiN、TiO 2と多くの高分子材料は、生体適合性インプラント表面コーティングとしてテストされています1、6月23日を含む多数の材料には、しかしながら、これらの材料は、まだすべてを満たすことができない適切なインプラント表面をコーティングするための機能的な基準。
グラフェンとして知られているsp 2炭素原子の厚さの層の発見は、新規多機能材料の開発のために門戸を開いた。グラフェンは、それ以来、インプラント表面のコーティングのための理想的な候補であると予想され、化学的に不活性な原子的に平滑で耐久性に優れています。この手紙の中で、我々は、生物医学インプラントの表面コーティングとしてグラフェンの実行可能性を調査する。我々の研究は、グラフェンのコーティングされたニチノール(NiTiのGR-)は、機能のすべての条件を満たしていることを示し、さらに優れた平滑筋と優れた細胞増殖につながる内皮細胞増殖をサポートしています。また、GR-NiTiの上の血清アルブミン吸着フィブリノゲンよりも高くなることがわかります。重要なのは、(ⅰ)当社の詳細な分光測定は、グラフェンのコーティングを示唆グラフェンおよびフィブリノゲン間の電荷移動の欠如を確認したインプラントによる血小板活性化を阻害すること、(ii)グラフェンのコーティングは、確認の内皮細胞と平滑筋細胞株のin vitro毒性に有意性を示さないそれらの生体適合性、および(iii)グラフェンのコーティングは、化学的に不活性、耐久性と血液環境を流れる中で不透過性である。高聖と一緒にこれらのHEMOと生体適合性特性、rength、化学的不活性と耐久性は、理想的な表面コーティングとしてグラフェンのコーティングをレンダリングします。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1。 NiTiのグラフェン·コーティング
- 本研究で使用したグラフェン試料は化学蒸着法を用いて銅(Cu)基板上に成長させ、その後、4.5ミリメートル2 NiTiの基板に移した。
- 銅箔(1センチ×1cmの)石英管炉1インチ内に配置し、H 2 50sccmのとArの450 sccmの存在下で℃の千に加熱した。
- 次に、メタンは(1と4 sccm)の20〜30分間の異なる流量で炉内に導入した。サンプルは、最終的に、H 2、ArおよびCH 4を流れる下で室温まで冷却した。
- 次に、Cu箔は150℃で5分間熱処理し、4,000 rpmで、PMMA(4%アニソールで希釈)を用いてスピンコートされていたPMMA層に接続されているグラフェンを10分間、10%塩酸と脱イオン水ですすぎTransene社、CE-100エッチング液、及びそれに続くによるCu箔をエッチングすることにより得た。
- のamplesはNiTiの基板(4.5ミリメートル2)に移し、Ar中で℃(300 SCCM)とH 2時間2(700 SCCM)はPMMAを除去するために450℃でアニールした。最後に、基板は、GR-NiTiのサンプルを取得するために残存PMMAを溶解するためにアセトンで洗浄した。 Dilor XY三重格子モノクロメータは、Ar +イオンレーザーの514.5 nm励起ですべてGR-NiTisamplesの顕微ラマン分光特性(100倍対物レンズを使用して)のために使用された。
GR-NiTiの2。 インビトロ毒性
ラット大動脈内皮細胞(セルアプリケーション株式会社)ゼラチンコート8チャンバースライド上で培養した。細胞増殖をテストするために、自然のままとGr-NiTisubstratesはどのゼラチンコーティングせずに井戸の中に置かれた。走査型電子顕微鏡画像は、日立S-4800 SEMを用いて得られた。さらに、ラット大動脈平滑筋細胞はまた、杜における対照群(コーニング)としてCellBind 96ウェルプレート中で増殖させたlbeccoダルベッコ改変イーグル培地(ATCC)。
- 細胞生存率をテストするために、細胞(内皮細胞と平滑両方の筋細胞)手付かずのNiTi、1 SCCMまたはトライSCCMがで使用されてメタンの流れに対応して4 SCCM GR-NiTiの基板を含むウェルに10 5細胞/ウェルで播種したグラフェンのCVD成長。細胞は、一日おきに培地を交換し、Cおよび5%CO 2、37℃のインキュベータ内で所望の時間増殖させた。
- 終了時点で、培地を除去し、0.5 mg / mlのチアゾリルブルーテトラゾリウムブロマイド(又はMTT Sigmaから入手)を含む新鮮な培地を各ウェルに添加した。次いで、細胞をさらに3時間インキュベートした。 MTSアッセイのために、メディアは、最終時点で削除されたとMTS作業溶液を120μl(セルティア96水性、Promega)で置き換えられ、3時間インキュベートした。
- 次に、メディアが優しく除去し、ジメチルスルホキシドの100ミリリットル(Sigma)を各ウェルに添加した。アロ後に溶解するMTT結晶の翼10分、溶液を別のウェルプレートに移した。 MTSアッセイのために、何ジメチルスルホキシドをウェルに添加しなかった。ウェルの内容物を新しいプレートに移した。
- 吸光度を490nmで読み取ったとパーセント生存率は手付かずのNiTiサンプルの平均吸光度を吸光度を正規化することによって決定した。少なくとも5リピートは各サンプルタイプのために行われた。
3。細胞形態の共焦点顕微鏡研究
- ラット大動脈平滑筋細胞の共焦点イメージングのために、基板は8チャンバースライド(サーモサイエンティフィック)に入れた。細胞は、25,000細胞/チャンバーに播種し、37℃、5%CO 2で3日間インキュベートした。
- 細胞を20分間、リン酸緩衝生理食塩水で4%ホルムアルデヒドで基板上に固定した。
- 1分間0.1%トリトン-Xで透過。
- アクチンのAlexa Fluor 488ファロイジン(LIFで染色した電子技術)。緩衝生理食塩水、メタノールで200単位/ mlでalexafluor 488ファロイジン100μlのリン酸塩の1.9ミリリットルに追加されました。細胞は、45分間alexafluor 488ファロイジン250μlので染色し、その後リン酸緩衝生理食塩水で2回洗浄した。
- 核はDAPI(Vector Laboratories社)を含むVectaShield蛍光封入剤でマウントされた。共焦点画像は、Nikon共焦点TIを用いて収集した。任意の基板なしで細胞を播種室を対照として用いた。
4。タンパク質吸着の研究
- 基板寸法は、タンパク質吸着実験を開始する前にキャリパーを用いて測定した。 3つの寸法はほぼ正方形の試料の各側に取られ、長さと幅を取得するには平均化した。
- リン酸アルブミン1 mg / mlのと一緒にインキュベートし、各サンプル、手付かずのNiTi、1sccmと4sccm GR-NiTiwereは、生理食塩水(PBS)または部屋tにおけるPBS中1 mg / mlのフィブリノゲンをバッファリング3時間emperature。
- 同様にサンプルがサンプルバッファを減らし、200μlの微量遠心チューブ中で混合し、5分間煮沸した。
- 次いで、サンプルをトリス/グリシン/ SDS緩衝(Bio-Rad社)で希釈し、100分間90 Vで4から15までパーセントトリスポリアクリルアミド電気泳動ゲル(Bio-Rad)を介して実行された。
- 次いで、ゲルをSYPROレッドで染色した。 7.5 / v%の酢酸中で1:5,000 SYPROレッド(Life Technologies)を原液を希釈します。 60分間ゲルを染色します。
- Flourchem SP(アルファイノテック)を使用して画像のゲル。蛍光強度はImageJのソフトウェアを用いて定量した。各試料からの蛍光強度は、基材の総面積で規格化した、フィブリノーゲン吸着はアルブミン吸着と比較した。
5。ウエスタンタンパク質発現のためブロッティング
- ウエスタンブロット法を用いて、ラット大動脈平滑筋細胞の総アクチンを分析するために行った。細胞を96ワットに10,000細胞/基質で播種したエルプレート。
- 細胞は、メディアを削除する前に3日間増殖させた。総タンパク質をRIPAバッファーおよび標準BCAアッセイ(ラムダ)を用いて抽出した総タンパク量を定量化するために行った。
- サンプルをRIPAで同じ濃度に希釈した後、5分間削減試料緩衝液中で煮沸した。
- タンパク質は、100分の場合は90 Vでの電気泳動を経由して 4から15パーセントトリスポリアクリルアミドゲルで分離した。万華鏡タンパク質標準(Bio-Rad社製)をタンパク質の分子量を評価するために使用されていました。
- タンパク質をPVDF膜に転写し、1%脱脂粉乳(Bio-Rad社製)溶液でブロッキングした。
- 合計アクチンはウサギ抗ラットアクチン抗体(Sigma)でタグ付けされていた。 BMの化学発光キット(Roche)を一次抗体を検出するために使用されていました。膜はFlourChem SPのイメージング装置を用いて画像化し、蛍光強度をImageJのソフトウェアを使用して測定した。蛍光強度はpriと比較することにより正規化したスタインNiTisample。
Access restricted. Please log in or start a trial to view this content.
結果
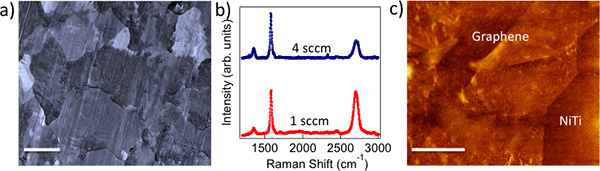
10ミクロン): 図1のCu箔上)は、CVD成長した多結晶グラフェンは、金属結晶粒(スケールバーを模倣しています。 b)は1 SCCM(4 sccm)とグラフェンのラマンスペクトルは、強烈な(比較的弱い)G 'のバンドを示す単分子層(数層)として準備されたグラフェンの性質を示し...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
生体適合性や細胞毒性:化学蒸着(CVD)法では、 図1aに示すCu結晶粒を、模倣した多結晶グラフェンの試料が得られた。私達は1 SCCM(4 sccm)のサンプル( 図1bを参照してください)単分子層(数層)グラフェンの存在を確認するためにラマン分光法を用いた。明らかに、1 SCCM(4 sccm)のサンプルは、単層を示す強烈な(相対的に弱い)、G 'バン...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | |||
| ダルベッコ改変イーグル培地 | ATCC | 30から2002 | |
| チアゾリルブルーテトラゾリウムブロマイド | シグマアルドリッチ | M2128 | |
| CellTiter 96水相溶液の細胞増殖アッセイ(MTS) | プロメガ | G3582 | |
| ジメチルスルホキシド | シグマアルドリッチ | D8418 | |
| 36.5%ホルムアルデヒド | シグマアルドリッチ | F8775 | |
| トリトンX-100 | シグマアルドリッチ | T8787 | |
| Alexafluor 488ファロイジン | ライフテクノロジーズ | A12379 | |
| VECTASHIELDはDAPで媒体をマウント私 | ベクターラボラトリーズ | H-1200 | |
| ヒト血清アルブミン | シグマアルドリッチ | A9511 | |
| ヒトフィブリノゲン | |||
| トリス/グリシン/ SDS | バイオ·ラッド | 161-0732 | |
| レディーゲルトリス-HClゲル | バイオ·ラッド | 161-1158 | |
| 酢酸 | シグマアルドリッチ | 45726 | |
| SYPRO赤 | ライフテクノロジーズ | S-6653 | |
| タンパク低BCAアッセイ | λはバイオ | G1003 | |
| プレシジョンプラスプロテイン万華鏡標準 | バイオ·ラッド | 161-0375 | |
| IMMUNブロットPVDF膜 | バイオ·ラッド | 162-0177 | |
| グレードブロッカー脱脂粉乳をブロッティング | バイオ·ラッド | 170-6404XTU | |
| ウサギで産生された抗アクチン抗体 | シグマアルドリッチ | A2066 | |
| BMの化学発光ウェスタンブロッティングキット(マウス/ウサギ) | ロシュ·ダイアグノスティックス | 11520709001 | |
| RIPAバッファー | シグマアルドリッチ | R0278 | |
| NiTiの(51%のNi、49%のTi) | アルファAesar社 | 44953 | |
| 機器 | |||
| 堀場JobinYvon | ラマン分光計 | Dilor XY 98 | |
| ニコン | 共焦点顕微鏡 | EclipseのTIの顕微鏡 | |
| Thermoscientific | プレートリーダー | ||
| バイオ·ラッド | パワーサプライ | 164-5050 | PowerPacの基本的な電源 |
| バイオ·ラッド | 電気泳動セル | 165-8004 | ミニプロティアンテトラセル |
| バイオ·ラッド | ゲルホルダーカセット | 170-3931 | ミニゲルホルダーカセット |
参考文献
- Roy, R. K., Lee, K. -R. Biomedical applications of diamond-like carbon coatings: A review. Journal of Biomedical Materials Research Part B-Applied Biomaterials. 83 B (1), 72-84 (2007).
- Shah, A. K., Sinha, R. K., Hickok, N. J., Tuan, R. S. High-resolution morphometric analysis of human osteoblastic cell adhesion on clinically relevant orthopedic alloys. Bone. 24 (5), 499-506 (1999).
- Huang, N., Yang, P., Leng, Y. X., Chen, J. Y., Sun, H., Wang, J., Wang, G. J., Ding, P. D., Xi, T. F., Leng, Y. Hemocompatibility of titanium oxide films. Biomaterials. 24 (13), 2177-2187 (2003).
- Gutensohn, K., Beythien, C., Bau, J., Fenner, T., Grewe, P., Koester, R., Padmanaban, K., Kuehnl, P. In vitro analyses of diamond-like carbon coated stents: Reduction of metal ion release, platelet activation, and thrombogenicity. Thrombosis Research. 99 (6), 577-585 (2000).
- Gillespie, W. J., Frampton, C. M. A., Henderson, R. J., Ryan, P. M. The Incidence of Cancer Following Total Hip-Replacement. Journal of Bone and Joint Surgery-British Volume. 70 (4), 539-542 (1988).
- Sperling, C., Schweiss, R. B., Streller, U., Werner, C. In vitro hemocompatibility of self-assembled monolayers displaying various functional groups. Biomaterials. 26 (33), 6547-6557 (2005).
- Mikhalovska, L. I., Santin, M., Denyer, S. P., Lloyd, A. W., Teer, D. G., Field, S., Mikhalovsky, S. Fibrinogen adsorption and platelet adhesion to metal and carbon coatings. Thrombosis and Haemostasis. 92 (5), 1032-1039 (2004).
- Airoldi, F., Colombo, A., Tavano, D., Stankovic, G., Klugmann, S., Paolillo, V., Bonizzoni, E., Briguori, C., Carlino, M., Montorfano, M., Liistro, F., Castelli, A., Ferrari, A., Sgura, F., Mario, C. D. i Comparison of diamond-like carbon-coated stents versus uncoated stainless steel stents in coronary artery disease. American Journal of Cardiology. 93 (4), 474-477 (2004).
- Allen, M., Myer, B., Rushton, N. In vitro and in vivo investigations into the biocompatibility of diamond-like carbon (DLC) coatings for orthopedic applications. Journal of Biomedical Materials Research. 58 (3), 319-328 (2001).
- Butter, R., Allen, M., Chandra, L., Lettington, A. H., Rushton, N. In-vitro Studies of DLC Coatings with Silicon Intermediate Layer. Diamond and Related Materials. 4 (5-6), 857-861 (1995).
- Dearnaley, G., Arps, J. H. Biomedical applications of diamond-like carbon (DLC) coatings: A review. Surface & Coatings Technology. 200 (7), 2518-2524 (2005).
- Dorner-Reisel, A., Schurer, C., Nischan, C., Seidel, O., Muller, E. Diamond-like carbon: alteration of the biological acceptance due to Ca-O incorporation. Thin Solid Films. 420, 263-268 (2002).
- Dowling, D. P., Kola, P. V., Donnelly, K., Kelly, T. C., Brumitt, K., Lloyd, L., Eloy, R., Therin, M., Weill, N. Evaluation of diamond-like carbon-coated orthopaedic implants. Diamond and Related Materials. 6 (2-4), 390-393 (1997).
- Grill, A. Diamond-like carbon coatings as biocompatible materials - an overview. Diamond and Related Materials. 12 (2), 166-170 (2003).
- Hauert, R. A review of modified DLC coatings for biological applications. Diamond and Related Materials. 12 (3-7), 583-589 (2003).
- Windecker, S., Mayer, I., De Pasquale, G., Maier, W., Dirsch, O., De Groot, P., Wu, Y. P., Noll, G., Leskosek, B., Meier, B., Hess, O. M. Working Grp Novel Surface, C., Stent coating with titanium-nitride-oxide for reduction of neointimal hyperplasia. Circulation. 104 (8), 928-933 (2001).
- Zhang, F., Zheng, Z. H., Chen, Y., Liu, X. G., Chen, A. Q., Jiang, Z. B. In vivo investigation of blood compatibility of titanium oxide films. Journal of Biomedical Materials Research. 42 (1), 128-133 (1998).
- Bolz, A., Schaldach, M. Artificial-Heart Valves - Improved Blood Compatibility By PECVD a-SiC-H COATING. Artificial Organs. 14 (4), 260-269 (1990).
- Haude, M., Konorza, T. F. M., Kalnins, U., Erglis, A., Saunamaki, K., Glogar, H. D., Grube, E., Gil, R., Serra, A., Richardt, H. G., Sick, P., Erbel, R., Invest, C. T. Heparin-coated stent placement for the treatment of stenoses in small coronary arteries of symptomatic patients. Circulation. 107 (9), 1265-1270 (2003).
- Suggs, L. J., Shive, M. S., Garcia, C. A., Anderson, J. M., Mikos, A. G. In vitro cytotoxicity and in vivo biocompatibility of poly(propylene fumarate-co-ethylene glycol) hydrogels. Journal of Biomedical Materials Research. 46 (1), 22-32 (1999).
- Clarotti, G., Schue, F., Sledz, J., Benaoumar, A. A., Geckeler, K. E., Orsetti, A., Paleirac, G. Modification of the biocompatible and haemocompatible properties of polymer substrates by plasma-deposited fluorocarbon coatings. Biomaterials. 13 (12), 832-840 (1992).
- Gombotz, W. R., Guanghui, W., Horbett, T. A., Hoffman, A. S. Protein adsorption to poly(ethylene oxide) surfaces. Journal of Biomedical Materials Research. 25 (12), 1547-1562 (1991).
- Ishihara, K., Fukumoto, K., Iwasaki, Y., Nakabayashi, N. Modification of polysulfone with phospholipid polymer for improvement of the blood compatibility. Part 2. Protein adsorption and platelet adhesion. Biomaterials. 20 (17), 1553-1559 (1999).
- Jung, N., Kim, B., Crowther, A. C., Kim, N., Nuckolls, C., Brus, L. Optical Reflectivity and Raman Scattering in Few-Layer-Thick Graphene Highly Doped by K and Rb. ACS Nano. 5 (7), 5708-5716 (2011).
- Rao, A. M., Eklund, P. C., Bandow, S., Thess, A., Smalley, R. E. Evidence for charge transfer in doped carbon nanotube bundles from Raman scattering. Nature. 388 (6639), 257-259 (1997).
- Bunch, J. S., Verbridge, S. S., Alden, J. S., vander Zande, A. M., Parpia, J. M., Craighead, H. G., McEuen, P. L. Impermeable atomic membranes from graphene sheets. Nano Letters. 8 (8), 2458-2462 (2008).
- Chen, S., Brown, L., Levendorf, M., Cai, W., Ju, S. -Y., Edgeworth, J., Li, X., Magnuson, C. W., Velamakanni, A., Piner, R. D., Kang, J., Park, J., Ruoff, R. S. Oxidation Resistance of Graphene-Coated Cu and Cu/Ni Alloy. Acs Nano. 5 (2), 1321-1327 (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved