Method Article
作为脑微血管内皮细胞(CEND)的伸展
摘要
在体外创伤性脑损伤的车型正在研发中再现体内脑变形。伸展损伤已受聘为星形胶质细胞,神经元,神经胶质细胞,主动脉,脑血管内皮细胞。然而,我们的系统采用了血脑屏障(BBB)模型,该模型具有BBB构成一个合法的模型建立在体外 TBI模型的属性。
摘要
可用于治疗由于死亡率高的事件带来的创伤性脑损伤(TBI)的方法,使一个更好的了解相关机制参与。有在体内和体外方法可用于这一目的。 体内模型可以模拟实际的头部受伤,因为它发生在脑外伤。然而, 在体内的技术可能无法被利用在细胞的生理水平的研究。因此, 在体外培养的方法是更有利的用于此目的,因为它们提供了更容易获得的细胞和细胞外环境进行操纵。
我们的协议提出了一个TBI使用牵拉损伤脑微血管内皮细胞的体外模型。它利用压力细胞培养灵活底孔。可以很容易地控制和施加的压力可以产生药害,范围从低到严重。鼠脑微血管内皮细胞(CEND)的在我们的实验室中产生的,是一个非常适合的模型血脑屏障(BBB),从而提供了一个到其他系统,采用了类似的技术优势。此外,由于简单的方法,实验装置很容易被复制。因此,这种模式可以用来研究细胞和分子机制参与TBI在BBB。
引言
创伤性脑损伤(TBI)是领先全球的死亡原因之一。脑外伤的一个主要的健康和医疗问题1,每年约有10万人受到影响。由于这个原因,各种在体内和体外模型TBI已建立和发展,研究其机 制2,3,4更好地了解脑外伤可以帮助改善病人的治疗和减少相关的死亡率,发病率和成本。
利用在体内和体外方法存在许多脑损伤模型, 在体内模型可以模仿实际发生的事件,头部受伤。然而,由于体内情况的复杂性,无障碍组织的利益变得有限2。在理解的生理反应的单个细胞的伤害,作为结果,它是重要的细胞分离的全身效应可能会抑制或改变他们的个人响应5。出于这个原因,提供了有价值的细胞模型的创伤在动物模型的优点,因为可以精确地控制6的细胞的机械环境。
在体外系统中,采用机械负载的细胞或组织损伤引起的这样的方法来确定改变的使用已经开发出来。例如,已建立了一种用于研究细胞的机械性损伤的效果为星形胶质细胞,神经元,神经胶质细胞和血管内皮细胞7,8,9。 在体外创伤模型研究啮齿动物和人类的星形胶质细胞反应10的压力控制装置相同,我们用什么为我们的模型建立。同样的方法适用于诱导损伤小鼠脑微血管内皮细胞(bEnd3)11和皮层神经元,脑endoth 12,13以及通过伸展新生仔猪14。的elial细胞培养装置的底部变形以及由此产生机械牵拉伤10。伤害时培养的细胞中细胞的空气压力,由应用程序。此压力可偏转膜细胞的生长,从而拉伸细胞。通过设置相应的空气压力脉冲的持续时间和强度,可以实现不同程度的伸展( 即 “低,”温和的“,或”严重“)拉伸损伤此方法已在体内 7与外伤,而且损伤此方法允许细胞外环境的精确控制,可以很容易地被再现。
虽然已被用于许多其他的脑细胞类型,包括bEnd3类似的方法,我们的模型中使用的小鼠脑微血管内皮细胞(CEND)产生一个优点,即它使在我们的实验室。该细胞系是一个非常适合用作BBB模型在体外细胞培养模型血脑屏障(BBB)。应具备的特点,这将使他们能够作为渗透屏幕。 体外细胞模型的预测血脑屏障通透性的重要标准之一是,它应该具有生理现实细胞结构15。即使bEnd3细胞显示独特的主轴,如鳞状形态文化16,他们表现出体外形态不规则行为,使他们形成囊肿样腔,而不是常规的管状结构中纤维蛋白凝胶17。此外,当细胞注入胚胎和新生小鼠,诱导快速增长的肿瘤,但不是在新生儿和年轻小鼠致死小鼠胚胎。因此,建议管正常的内皮细胞生长,迁移和分化的一个或多个进程已经改变或消除在此细胞株18。另一方面,形态学,免疫细胞化学评价内皮细胞和BBB标志物的表达,生物电,和细胞旁通量测量表明,我们的BBB模型CEND确实是一个合适的模型是BBB 19。
脑血管内皮细胞在体内具有极其严密的渗透与跨内皮电阻(TEER)从2,000-5,000欧姆厘米2。对于研究脑微血管系统的阻隔性能,医药品,细胞旁限制性和气密性应予以考虑。在大多数脑微血管内皮细胞(BCEC),这是不保存细胞展览TEER从50-100欧姆厘米2 20。永生化的脑内皮细胞株bEnd3生成TEER值不大于60欧姆厘米2 15。 CEND细胞的培养基中含有相比之下分化降低血清显示屏TEER值范围从300-500Ωcm的2 19,21。
至目前为止, 在体外培养的脑血管内皮细胞牵拉损伤模型是稀缺的。因此,通过牵拉伤,用培养的脑血管内皮细胞作为模型是BBB创伤体外模型可能会被证明是有用的。在这个协议中,我们提出的体外模型,可以模仿的脑细胞,特别是大脑的血脑屏障的微血管内皮细胞,在TBI收到的实际影响。该模型的主要优点是,受伤的量施加的细胞,以及细胞外的环境中,可以很容易地控制,以精确的方式,能够容易重现性实验设置。
研究方案
1。播种内皮细胞孔板
- 在T75培养瓶中,培养小鼠脑微血管内皮细胞(CEND)的改变培养基(DMEM中含有10%FCS,50单位/ ml青霉素/链霉素,1%L-谷氨酰胺),每周两次,直到达到合流。 (脑微血管内皮细胞生成和永生,请看到布列克等 ,2012年,福斯特等人 ,2005年21,19)。
- 清洗细胞,用磷酸盐缓冲盐水(PBS)。取出PBS及胰蛋白酶消化细胞,用2毫升温暖的胰蛋白酶-EDTA溶液。
- 孵育的细胞在37℃下持续5分钟或直到细胞层分散。
- 进入细胞的培养基中加入8毫升。点击烧瓶数次分离细胞。
- 查看细胞在显微镜下,以确保完全脱离烧瓶。
- 移液器介质分离的细胞上下。摇动烧瓶混合细胞suspensi上。
- 取20微升细胞悬浮液,放入血球计数器计数的细胞数。
- 确定细胞密度和种子入井20,000细胞/ cm 2。
- 细胞悬液转移到collagen1预包被的6孔柔性底培养板中(57.75厘米2),总体积为3ml /孔。每个孔的面积为9.62厘米2。
- 细胞生长在37℃直至汇合一个星期。改变培养基每周两次。
2。之前伸展损伤的细胞分化
- 改变细胞分化培养基(含1%血清简装的胎牛血清(ssFCS)的50单位/ ml青霉素/链霉素的DMEM)的培养基中。
- 培养的细胞在37℃24小时。
3。牵张诱导的内皮细胞损伤
- 打开的细胞损伤的控制器设备。
- 设置延迟为50毫秒。
- 设置调节到15 psi的压力,并几次,直到按下扳机的注册高峰压力变得稳定。
- 调节器的压力设定为所需的值。使用表1为指导,产生不同程度的牵拉伤。
- 到托盘架灵活有底将6孔培养板(57.75厘米2)。确保该井选择设置为正确以及大小( 即大井)。
- 将适配器插头牢牢井。用一只手牢牢握住插头到位,而另一方面推动触发。
- 记录产生的压力峰值。
- 立即把盘子放回37℃培养箱所需的时间长度或立即使用后续实验或评估。
4。染料摄取试验拉伸损伤评估
- 后立即将细胞海峡蚀刻(步骤3.7)中,加入30微升的1毫克/毫升溶液中的活力染色细胞培养基中( 注:染料溶液10μl的细胞毒性标记(请参阅的材料和设备的补充表),作为用于细胞培养液中的每毫升 )。
- 细胞的染料加入后,立即在荧光显微镜下检视。
5。评估牵拉损伤乳酸脱氢酶(LDH)
- 拉伸后的细胞(步骤3.7),立即取出200微升细胞培养液中,从井里。做同样的伤后各时间点你想包括在LDH释放( 即如 30分钟,1小时,2小时, 等你的调查。)
- 离心细胞培养液中离心5分钟以除去任何细胞碎片在最高设置。除去上清液,并使用当前的随后的步骤。
- 一旦。1AVE完成步骤5.1,并已采取了必要的样本,你想从不同的时间点,你想调查,裂解细胞裂解液中乳酸脱氢酶测定试剂盒(请参阅的材料和设备的补充表)。
- 将100μl的测定培养基中,包括在套件中提供的在96 - 孔板的每一个孔中测定基托。
- 成两个平行的测定试剂盒包括在96孔板的孔中,将100μl的无细胞的细胞培养基。
- 在37°C下孵育30分钟。
- 读取492nm处的吸光度。
结果
我预涂胶原细胞培养6以及灵活的平底培养板(57.75厘米2)受到不同程度的牵拉伤,使用电池担架设备。细胞损伤后,在显微镜下检查细胞形态的伸展引起的损伤的影响。有人指出,为更大程度的弹力施加的细胞( 图1),也可以观察到细胞有更大程度的失真。 图1A中所示,控制不受到损伤的细胞,这些细胞没有任何指示细胞肿胀或失真为规则形状的脑血管内皮细胞(CEND)的出现。当牵拉伤( 图1B-D),变形可以在光学显微镜下观察。拉伸的细胞后,严重的峰值压力3.5-4.5磅之间,CEND细胞出现明显回缩,肿胀,变形,不能够间隙。此外,吸收的可行性污垢(100nM的最终浓度)也增加了牵拉损伤的程度的显着升高( 图2)。的可行性染色使用的是染料不能渗透对健康细胞的细胞质膜完整性受到损害时,成为透性。的染料排除在大部分的控制单元,因此,只有少数的细胞进行染色( 图2A)相比,拉伸的细胞( 图2B-D)。更多的绿色荧光蛋白细胞牵拉损伤的程度增加。
由于损伤,乳酸脱氢酶(LDH)释放酶的生化指标也根据制造商的指导检查。 图3可以看出 ,增加细胞牵拉损伤引起乳酸脱氢酶(LDH)释放增加。
928/50928fig1.jpg“宽度=”500px的“/>
图1。光镜检查正常与受伤的细胞(A)普通拉伸融合细胞单层istightly包装和拉长。当细胞被拉伸通过施加峰值压力脉冲1.8-2.0磅( 即低拉伸),他们显得不那么紧凑,空间的箭头(B)所示。当细胞与2.5-3.0压力峰值脉冲中度受伤,其中一些出现肿胀和变形(C)。细胞变得严重3.5-4.5磅,如箭头(D)表示的伸展与缩回。 100X的放大倍率。 点击这里查看大图 。
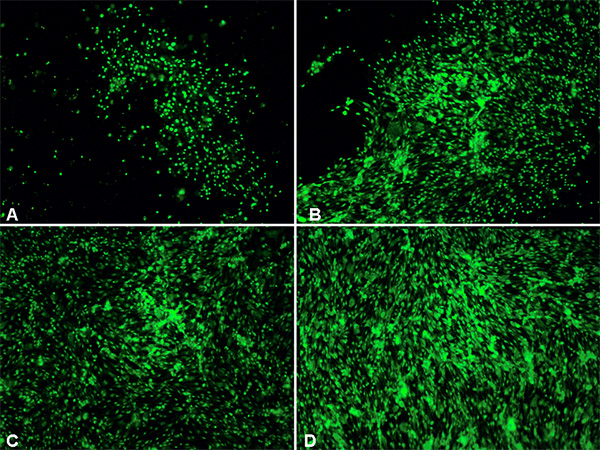
图2。萤石escence镜检正常与受伤的细胞,细胞可行性染色2小时,伤后处理。 答:控制拉伸细胞BD:拉伸细胞(B -低-中度,C,D中-重度)。 100X的放大倍率。 点击这里查看大图 。

图3。伸展损伤后在不同的时间间隔,测定乳酸脱氢酶(LDH)酶的释放到上清液后伸展损伤。释放到培养基中的乳酸脱氢酶。 LDH表达的总释放LDH乳酸脱氢酶(LDH媒体加细胞)的百分比。值是±SEM。各时间点的n是5,除0 HR V值受到严重拉伸,其中n = 3。 LDH释放低,适中弹力细胞没有差异拉伸控制,并从对方明显。造成严重的拉伸的细胞,它们被释放的LDH量,作为一个显着更大的比其他所有样品,除了适度拉伸的样品在1小时。 (P <0.05,单因素方差分析,霍尔姆-通富法)。 点击这里查看大图 。
表1中。引导产生不同程度的牵拉伤。
| 调压阀 | 峰值压力 | 损伤程度 |
|---|---|---|
| 15磅 | 1.2-1.5磅 | <低 |
| 20-25磅 | 1.8-2.0磅 | 低 |
| 30-35磅 | 2.5-3.0磅 | 中度 |
| 40-50磅 | 3.5-4.5磅 | 严重 |
| 60psi的 | 4.8-6.0磅 | >严重 |
讨论
在体外的机械性损伤的影响进行了研究和方法已被建立为星形胶质细胞,神经元,神经胶质细胞和血管内皮细胞8,9,22。有,然而,迄今为止,仍然没有已知的伸展培养的脑损伤的内皮细胞的体外模型。细胞模型的创伤提供了有价值的动物模型的优势,因为可以精确地控制6的细胞的机械环境。因此,通过牵拉伤,用培养的脑血管内皮细胞在体外创伤模型,行为模型血脑屏障(BBB),如我们的协议是什么礼物可能被证明是有用的。
该协议利用CEND细胞,在我们的实验室建立BBB模型。由于BBB击穿往往是记录在颅脑损伤患者脑外伤往往与破坏的血脑屏障,这可能会导致水肿形成23,24,PRES的方法这里ented具体可以TBI进行BBB研究中使用。
在此模型中,重要的是照顾多少牵拉损伤程度被施加到细胞。在尽可能多的在任何情况下,无论施加的压力量受伤细胞,损伤的程度,可以影响内皮细胞多大差别很大的其他细胞类型。主动脉内皮细胞更耐牵拉伤比星形胶质细胞的或混合神经胶质细胞的9。此外,他们更迅速地修复损伤后,相比于其他类型的细胞。因此,对于脑血管内皮细胞,特别是CEND细胞,更大量的牵拉损伤是必要的,以产生一个高程度的损伤。人们可以通过施加相应的压力示于表1中达到所需程度的损伤。然而,对于CEND细胞,严重伤害是首选,由于其电阻应变。 LDH进行的分析表明作为程度伸展的增加,更多的乳酸脱氢酶分泌到上清液中。与此相反,分别获得了低的数量牵拉损伤的细胞生产的乳酸脱氢酶的量控制细胞相似。如上文在协议中,必须注意,使用适量的介质,因为介质的量的增加或减少,可能会导致施加到各孔中的峰值压力的差异。例如,一个含有5毫升的流体寄存器中的平均为4.0 psi的峰值压力而空以及寄存器45 psi的压力被施加时,平均为3.8磅。因此,最好是推多次触发以及一个控制,以确保产生的峰值压力,对应到所需的量。
在我们的实验中,我们使用的可行性染色伸展,以确定影响细胞膜的通透性。光学系统使我们能够灵活底培养板,我们用vi的EW染色细胞在显微镜下直接。然而,当你想进行免疫标记研究,直接拉伸损伤后,可能会出现困难。首先,板的尺寸和厚度,可能会引起问题与一些显微镜观察平台。第二,以及柔性膜的光学系统可能是一个障碍清除观看。
然而,尽管有上述的限制,所描述的过程可以用作体外血脑屏障的机械性损伤的模型。创伤性脑损伤(TBI)包括两部分,即,局部缺血和创伤。为脑外伤后继发性损伤的情况时,存在着严重的失血导致血压低,或由于脑肿胀限制氧气供应到大脑缺血发生。它被认为是延迟的,非机械的损伤,较上面的那一刻开始,损伤25的连续的病理过程。一个缺氧的发生FTER重型颅脑损伤是常见的26。氧糖剥夺(OGD)是目前正在使用的方法, 在体外缺血模型。因此,受到细胞OGD后作为辅助侮辱细胞弹力,可以模仿缺血脑外伤后的发病率。因此,要改善我们目前的体外模型TBI和模式,它尽可能接近实际TBI,因为它发生在体内 ,在未来,我们也将聘请OGD结合牵拉伤。
披露声明
没有利益冲突的声明。
致谢
这项研究得到了德意志研究联合会(DFG,德国研究基金会)根据授权号FO 315/4-和欧盟第七框架计划(FP7/2007-2013)根据出让协议HEALTH-F2-2009-241778号CF。
材料
| Name | Company | Catalog Number | Comments |
| Cell Injury Controller II | Custom Design and Fabrication, Virginia, USA | ||
| Bioflex Culture Plate - Collagen Type I | Flexcell, Dunn Labortechnik | BF - 3001C | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Sigma-Aldrich | D5796 | |
| Fetal Calf Serum (FCS) | PAA Laboratories | A15110-1333 | final concentration 10%, heat-inactivated (30 min at 56 °C) |
| L-glutamine | Biochrom AG | K0282 | Storage: ≤ -15 °C |
| MEM Vitamin | Biochrom AG | K0373 | Storage: ≤ -15 °C |
| Na-pyruvate | Biochrom AG | L0473 | |
| Non-essential amino acids (NEA) | Biochrom AG | K0293 | Storage at 4 °C |
| Penicilin/Streptomycin | Biochrom AG | A2212 | Storage: ≤ -15 °C |
| Fetal Calf Serum, charcoal stripped (ssFCS) | Life Technologies | 12676-011 | |
| Trypsin-EDTA solution | PAA Laboratories | L11-004 | Storage: ≤ -15 °C |
| Image-iT DEAD Green | Life Technologies | I10291 | Storage: ≤ -15 °C, protected from light |
| Cytotoxicity Detection Kit PLUS (LDH) | Roche | 4744926001 | Storage: ≤ -15 °C |
参考文献
- Hyder, A. A., Wunderlich, C. A., Puvanachandra, P., Gururaj, G., Kobusingye, O. C. The impact of traumatic brain injuries: a global perspective. NeuroRehabilitation. 22 (5), 341-353 (2007).
- Morrison, B., Saatman, K. E., Meaney, D. F., McIntosh, T. K. In vitro centralnervoussystemmodels of mechanicallyinducedtrauma: a review. J. Neurotrauma. 15 (11), 911-928 (1998).
- Albert-Weissenberger, C., Sirén, A. L. Experimental traumatic brain injury. Exp. Transl. Stroke Med. 2 (16), 1-8 (2010).
- Morrison, B., Elkin, B., Dollé, J. P., Yarmush, M. In vitro models of traumatic brain injury. Annu. Rev. Biomed. Eng. 13, 91-126 (2011).
- Cargill, R. S., Thibault, L. E. Acute alterations in [Ca2+]i in NG108-15 cells subjected to high strain rate deformation and chemical hypoxia: an in vitro model for neural trauma. J. Neurotrauma. 13 (7), 395-407 (1996).
- Geddes-Klein, D., Schiffman, K., Meaney, D. Mechanisms and Consequences of neuronal stretch injury in vitro differ with the model of trauma. J. Neurotrauma. 23 (2), 93-204 (2006).
- Ellis, E. F., McKinney, J. S., Willoughby, K. A., Liang, S., Povlischock, J. T. A new model for rapid stretch-induced injury of cells in culture: characterization of the model using astrocytes. J. Neurotrauma. 12 (3), 325-339 (1995).
- McKinney, J. S., Willoughby, K. A., Liang, S., Ellis, E. F. Stretch-induced injury of cultured neuronal, glial and endothelia cells (Effect of polyethylene glycol-conjugated superoxide dismutase. Stroke. 27 (5), 934-940 (1996).
- Wanner, I. B., Deik, A., et al. A new in vitro model of the glialscarinhibitsaxongrowth. Glia. 56 (15), 1691-16709 (2008).
- Wanner, I. B. An In Vitro Trauma Model to Study Rodent and Human Astrocyte Reactivity. Methods Mol. Biol. 814, 189-219 (2012).
- Berrout, J., Jin, M., O'Neil, R. G. Critical role of TRPP2 and TRPC1 channels in stretch-induced injury of blood-brain barrier endothelial cells. Brain Res. 1436, 1-12 (2011).
- Weber, J. T., Rzigalinski, B. A., Willoughby, K. A., Moore, S. F., Ellis, E. F. Alterations in calcium-mediated signal transduction after traumatic brain injury of cortical neurons. Cell Calcium. 26, 289-299 (1999).
- Zhang, L., Rzigalinski, B. A., Ellis, E. F., Satin, L. S. Reduction of voltage-dependent Mg2+ blockade of NMDA current in mechanically injured neurons. Science. 274, 1921-1923 (1996).
- Gidday, J. M., Beetsch, J. W., Park, T. S. Endogenous glutathione protects cerebral endothelial cells from traumatic brain injury. J. Neurotrauma. 16 (1), 27-36 (1999).
- Gumbleton, M., Audus, K. L. Progress and limitations in the use of in vitro cell cultures to serve as permeability screen for the blood-brain barrier. J. Pharm. Sci. 90, 1681-1698 (2001).
- Omidi, Y., Campbell, L., Barar, J., Connell, D., Akhtar, S., Gumbleton, M. Evaluation of the immortalised mouse brain capillary endothelial cell line, b.End3, as an in vitro blood-brain barrier model for drug uptake and transport studies. Brain Res. 990 (1-2), 95-112 (2003).
- Montesano, R., Pepper, M. S., Mohle-Steinlein, U., Risau, W., Wangner, E. F., Orci, L. Icreased proteolytic activity is responsible for the aberrant morphogenetic behaviour of endothelial cells expressing the middle T oncogene. Cell. 62, 435-445 (1990).
- RayChaudhury, A., Frazier, W., D'Amore, P. Comparison of normal and tumorigenic endothelial cells: differences in thrombospondin production and responses to transforming growth factor-beta. J. Cell Sci. 107, 39-46 (1994).
- Förster, C., Silwedel, C., et al. Occludin as direct target for glucocorticoid-induced improvement of blood-brain barrier properties in a murine in vitro system. J. Physiol. 565 (Pt 2), 475-486 (2005).
- Rubin, L. L., Hall, D. E., et al. A cell culturemodel of the blood-brain barrier. J. Cell Biol. 115 (6), 1725-1735 (1991).
- Burek, N. M., Salvador, E., Förster, C. Y. Generation of an immortalized murine brain microvascular endothelial cell line as an in vitro blood brain barrier model. J. Vis. Exp. (66), (2011).
- Weber, J. T., Rzigalinski, B. A., Gabler, H. C. Alterations in calcium-mediated signal transduction after traumatic injury of cortical neurons. Cell Calcium. 26, 289-299 (1999).
- Shlosberg, D., Benifla, M., Kaufer, D., Friedman, A. Blood brain barrier breakdown as a therapeutic target in traumatic brain injury. Nat. Rev. Neurol. 6, 393-403 (2010).
- Thal, S. C., Schaible, E. V., et al. Inhibition of proteasomal glucocorticoid receptor degradation restores dexamethasone-mediated stabilization of the blood-brain barrier after traumatic brain injury. Crit. Care Med. , (2013).
- Werner, C., Engelhard, K. Pathophysiology of traumatic brain injury. Br. J. Anaesth. 99 (1), 4-9 (2007).
- Tanno, H., Nockels, R. P., Pitts, L. H., Noble, L. J. Breakdown of the blood-brain barrier after fluid percussion brain injury in the rat: Part 2: Effect of hypoxia on permeability to plasma proteins. J. Neurotrauma. 9 (4), 335-347 (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。