Method Article
从个人污秽苍蝇检测食源性细菌病原体
摘要
A PCR-based protocol was adapted to detect Cronobacter spp., Salmonella enterica, and Listeria monocytogenes from body surfaces and alimentary canals of individual wild-caught flies. The goal of this protocol is to detect and isolate bacterial pathogens from individual insects collected as part of an environmental sampling program during foodborne outbreak investigations.
摘要
There is unanimous consensus that insects are important vectors of foodborne pathogens. However, linking insects as vectors of the pathogen causing a particular foodborne illness outbreak has been challenging. This is because insects are not being aseptically collected as part of an environmental sampling program during foodborne outbreak investigations and because there is not a standardized method to detect foodborne bacteria from individual insects. To take a step towards solving this problem, we adapted a protocol from a commercially available PCR-based system that detects foodborne pathogens from food and environmental samples, to detect foodborne pathogens from individual flies.Using this standardized protocol, we surveyed 100 wild-caught flies for the presence of Cronobacter spp., Salmonella enterica, and Listeria monocytogenes and demonstrated that it was possible to detect and further isolate these pathogens from the body surface and the alimentary canal of a single fly. Twenty-two percent of the alimentary canals and 8% of the body surfaces from collected wild flies were positive for at least one of the three foodborne pathogens. The prevalence of Cronobacter spp. on either body part of the flies was statistically higher (19%) than the prevalence of S. enterica (7%) and L.monocytogenes (4%). No false positives were observed when detecting S. enterica and L. monocytogenes using this PCR-based system because pure bacterial cultures were obtained from all PCR-positive results. However, pure Cronobacter colonies were not obtained from about 50% of PCR-positive samples, suggesting that the PCR-based detection system for this pathogen cross-reacts with other Enterobacteriaceae present among the highly complex microbiota carried by wild flies. The standardized protocol presented here will allow laboratories to detect bacterial foodborne pathogens from aseptically collected insects, thereby giving public health officials another line of evidence to find out how the food was contaminated when performing foodborne outbreak investigations.
引言
昆虫起到与食品有关的疾病的传播中起重要作用,因为它们可以传播病菌沾染到食物或食物接触的表面和器具1。其中昆虫,蝇,蟑螂,蚂蚁和表现有利于食源性病原体的传播行为。这些行为包括与腐烂的物质的关联,垃圾和粪便,endophily(进入建筑物),以及synanthropy(与人同居)2。 。食源性病原体如沙门氏菌 , 李斯特菌 , 弯曲杆菌 , 大肠杆菌 O157:H7和属Cronobacter(原崎肠杆菌 )的成员已经被报道由昆虫3-5被发送。住区(synanthropic)藏污纳垢苍蝇从他们的污染身体表面传递的病原体传播的机械食源性细菌。然而,食源性致病菌在苍蝇的消化道中存在可多达三倍比对自己的身体表面(身体,头部,腿和翅膀)5观察到更大。食源性致病菌也可以留在苍蝇的消化道的时间比在身体表面6,7,在某些情况下,更大的长度,所以能大量繁殖,定植蝇消化道4,8,9。这增加了苍蝇的矢势,因为他们可以通过排便和返流10,11进一步蔓延食源性致病菌。
如今,有改进的监视系统,其能够更迅速地检测食源性疾病的爆发。在执行食源性疫情调查,公共卫生官员寻找食物,可能是源(S)或感染的车辆(S)。调查人员还可以进行参与,找出食物是如何被污染的设施(或设施)的环境评估,并可能收集样本作为调查12的一部分。 DESP伊特有关昆虫为食源性病原携带者,链接昆虫病原体的载体造成特定的食源性疾病的爆发已经具有挑战性的科学文献的大量。这主要是因为昆虫没有被无菌收集作为环境采样方案中的食源性暴发调查的一部分。包括昆虫,特别是那些表现出有利于食源性病原体的传播行为,作为一种环境取样过程中,一个规范,快速,灵敏,可靠的协议来检测食源性致病菌从单一的昆虫需要到位的一部分。
传统的电镀技术,从昆虫食源性致病菌的检测都费力,取决于目标细菌在不同的文化传媒竞争力的增长,克服了昆虫的先天共生微生物的快速增长。大多数具有关联的昆虫与BA的研究cterial病原体已通过汇集在一起几种昆虫而不是识别针对每个个别的病原体的存在增加了该方法的灵敏度。因此,这些研究并没有区分在发现病原体13-18昆虫的身体部分。以确定是否食源性致病菌位于身体表面或在个体的昆虫消化道的能力是很重要的,因为这可能有流行病学影响,并可能导致不同的缓解策略。作为机械载体,蝇上的食物,土地的时间很短可以仅传送细菌水平低,从他们的身体表面,而那些苍蝇反刍和排便的食物增加在潜在的更高水平的感染的转印病原体的概率。因此,为了估算一个食源性病原体的流行每一个个体的昆虫,并区分昆虫,其中细菌p的主体部分是很重要的 athogen所在。
即使使用非培养的方法来检测食源性致病菌越来越多地被实施,它们还没有被商业上使用,以由一个单一的昆虫检测食源性致病菌。目前,有验证了在市场上可用于快速检测食源性致病菌的食物,正在使用的行业和监管机构的分子协议。这些方法包括对病原体在多种食物样本的检测DNA为基础的系统。虽然分子协议比传统电镀方法快,样品的富集仍需要获得的10 2个菌落形成单位所需的聚合酶链反应(PCR)的细菌病原体(CFU)系的方法19的灵敏度水平。此外,来自PCR阳性样品纯的细菌菌落隔离是必要的,以确认使用适当的方法的病原体。
内容">该协议的目的是标准化用于检测食品和环境样品的病原体为从身体表面的检测食源性细菌和单飞散的消化道并进一步隔离这些市售的PCR为基础的系统从此处描述的协议的samples.The灵敏度病原体被第一校准用实验室饲养的成虫家蝇( 家蝇 ),这些实验与每个细菌病原体的连续稀释进料。该标准化协议随后用来调查100野外捕捉苍蝇为食源性致病菌从他们的身体表面和/或消化道运河的存在。这种标准化的协议将允许公共卫生实验室检测由昆虫造成的健康威胁,允许执行食源性疾病时,他们收集的环境取样计划的一部分的可能性疫情调查。研究方案
1.收集苍蝇
- 使用无菌昆虫学扫网收集个人苍蝇。把网在冷却器并将其传输到实验室。
2.解剖蝇
- 7分钟 - 通过将它们放置在-20℃下5固定无菌收集苍蝇。
- 在无菌2毫升管含有1ml的预热(37℃)缓冲蛋白胨水(BPW)用无菌镊子地方1飞行。混合管轻轻倒置2分钟。至关重要的是,苍蝇的整个身体在与媒体接触,从而使本上飞的身体表面(S)的微生物将被转移到BPW(BPW-S)。标记管与飞的数目和主体部件( 即,1S)。
注意:请参见表特定试剂/设备的用于在这个协议中提到的原料和试剂的详细描述。 - 使用无菌镊子取出从BPW-S媒体和转移飞它是空的,干净的2 ml管表面消毒飞。孵育含有BPW-S媒体在37℃,同时进行消毒并解剖协议的管中。
- 通过浸渍于1ml的70%乙醇1分钟,接着用无菌蒸馏水漂洗浸渍于1ml新鲜制备的0.05%(体积/体积)的漂白剂溶液之前表面消毒的飞行。冲洗3次,用无菌蒸馏水。从最后一个冲洗水转移到高压灭菌2毫升管。
注:每次用1000微升微量或通过颠倒管子,确保飞行保持在管内丢弃该液体。通过倒置轻轻地混合在表面消毒过程的每个步骤。 - 来评价在消毒过程的有效性,从最后一个冲洗转移100微升的水到胰胨豆胨琼脂(TSA)平板和散布使用无菌L形的一次性吊具。孵育板在37℃下24小时。后cubation,注册的任何细菌菌落的存在。
注:细菌菌落对TSA板的存在表明一种低效的表面消毒过程。如果发生这种情况,食源性病原体的存在只应在飞行的身体表面报道,因为身体表面和消化道之间的交叉污染,不能排除。
- 通过浸渍于1ml的70%乙醇1分钟,接着用无菌蒸馏水漂洗浸渍于1ml新鲜制备的0.05%(体积/体积)的漂白剂溶液之前表面消毒的飞行。冲洗3次,用无菌蒸馏水。从最后一个冲洗水转移到高压灭菌2毫升管。
- 后表面消毒的飞行,它转移到一张蒸压纸巾以除去过量的水,然后以无菌60毫米一次性培养皿。
- 放置在培养皿下解剖范围,并确定了苍蝇用二分法键双翅目家族20,21种的水平。
- 使用高压灭菌精尖镊子轻轻拉动肛门和整个消化道(A)的出飞并无菌它用0.5mM的氧化锆/二氧化硅转移到另一个无菌2毫升管含有1ml预热(37℃)BPW的珠(BPW-A)。标签次Ë管与选定的个别苍蝇和苍蝇( 即 1A)的主体部分相同的编号。
- 调匀包含BPW-A 5管 - 采用细胞破碎10分钟。在培养36±1°C,而执行协议的剩余部分。
- 代金券和/或储存样品用于长期,将飞的其余部分在一个干净的2毫升管,并添加1 - 2毫升95%的乙醇。
3.中小学富集
- 标签根据样品数和苍蝇的本体部分含有媒体所有主要和次要富集管。
- 在无菌罩,转移300微升BPW-S(表面)的无菌2ml管含有以下介质:
- 沙门氏菌 ,使用1毫升预热(42°C)BPW的。孵育在循环水浴42.5℃,22 - 24小时。对于次生富集,转移100微升丰富BPW的400µ升预热(37℃)的脑心脏浸液(BHI)肉汤预先置于无菌簇管中。孵育在37℃下3小时。
- 对于Cronobacter,使用1毫升预热(37℃)BPW与新生霉素(10毫克/升;华莱士,M。,私人通讯)。另外,使用方法1毫升富力阪崎肠杆菌富集肉汤与补充(万古霉素和头孢磺啶)作为主要富集。在37℃,22 - 26小时。对于二次富集,转移100μl的富集BPW与新生霉素至400微升预热(37℃)的BHI液体培养基中预先放置在无菌的簇管中。孵育在37℃下3小时。
- 对于L.单核细胞增生 ,使用1毫升新鲜配制RT 24 李斯特菌增菌液(24 LEB)选择性补充。孵育在37℃下为44±5小时。无二次富集需要L.检测菌等 。
- 上面使用标示为BPW-A管3.2.3 - 重复步骤3.2.1。
4.准备扩增目标食源性病原和检测的PCR为基础的系统
步骤4-8使用市售的PCR循环仪/检测器系统,计算机工作站,并准备使用的试剂盒,筛选沙门氏菌 ( 沙门氏菌 2标准测定试剂盒),Cronobacter物种( 阪崎肠杆菌标准测定试剂盒),和李斯特菌 ( 单增李斯特菌 24E检测试剂盒)。标准测定法使用PCR终点检测。每个试剂盒的PCR就绪片剂嵌入染料,当结合到双链DNA发出的荧光信号。在PCR系统程序的检测相位的信号被捕获,从而产生熔融曲线是由软件为阳性或阴性的解释。
- 所指定的manufactu制备试剂和设备RER的人均每一个目标的食源性致病菌协议。
注意:用于检测沙门氏菌和Cronobacter该协议要求一步法裂解过程,而该协议,用于检测L。菌等需要一个两步骤的裂解过程(参见第5和6,分别地)。 - 开启自动加热块选择具体方案为目标病原体上。另外,如果加热块都是手工操作,设定温度,以37℃(对沙门氏菌,Cronobacter菌属,和李斯特菌 。),或55±2℃(对李斯特菌溶胞的第2部分-见步骤6.2)和95±3°C。
- 确保冷却块已被冷藏O / N,否则他们的寒意,在2 - 8°C,至少2小时。
- 使用基于PCR的检测系统的计算机软件,创建以下制造商的说明齿条文件。
- 标签和集群安排含在机架中裂解试剂管,根据机架文件。
- 初始化基于PCR检测系统的仪器。
5.执行裂解沙门氏菌和Cronobacter的检测
- 通过加入150微升蛋白酶一个12毫升瓶的裂解缓冲液制备的裂解试剂。
- 转移200μl的裂解试剂的每一个的先前标记的群集管子。
可存放在2包含裂解试剂集群管 - 8°C长达2周:注意。 - 使用长的枪头,转移20微升二级丰富样品(见步骤3.2.1和3.2.2),以相应的含200微升裂解试剂集群管。用于每个样品的新的枪头。
注意:保持对初级和二级浓缩管在冰箱( 沙门氏菌 ),或在RT(Cronobacter)的PCR阳性/阴性样品的进一步确认分析。 - 通过加入20微升无菌BHI培养基加入含有200微升裂解试剂的簇管制备阴性对照。
- 加入20微升任 何已知的沙门氏菌或Cronobacter菌株含有200微升裂解试剂集群管的O / N细菌培养(BHI中生长)准备阳性对照。
- 盖集群管上,并用封盖工具紧密。
- 放置簇管在自动化加热块的齿条选择特定节目的目标病原体之后。可替代地,孵育簇管在37±2℃20分钟,随后温育95±3℃,10分钟。最后,群集管传送到冷却块(2 - 8℃)5分钟。
可以储存在-20℃下含溶解物群集管长达2周:注。
6.执行裂解为L的检测菌
- 完成第一部分裂解如下:
- 添加1.8毫升无菌去离子水至瓶子完全解冻溶解剂1。
注:存储裂解剂1 2 - 8°C,直到准备使用。长达6个月 - (30℃,20)在RT下开口和稀释液,储存后。 - 结合裂解剂1和2在一个4:1的比例(40微升稀释的裂解剂1和10μl裂解每各样品剂2)。转移50微升合并裂解剂的集群管中。在4小时使用该混合物。
- 加入500μl初级富集样品的(见步骤3.2.3),以含有50微升合并裂解剂的簇管。
- 制备阴性对照,加入500微升无菌的24 LEB至50μl组合裂解剂。
- 通过增加Ø500微升/ N L.准备阳性对照菌培养物中生长的24 LEB至50μl组合裂解剂。
- 帽集群管,轻轻混匀和地点在加热块在37±1℃下进行30分钟。
注:请从初级浓缩管在冰箱PCR阳性/阴性样品的进一步确认分析。
- 添加1.8毫升无菌去离子水至瓶子完全解冻溶解剂1。
- 执行裂解的第2部分如下:
- 按照指示的步骤5.1和5.2准备裂解试剂。
- 使用长的枪头转移20微升第一部分裂解液含200微升裂解试剂集群管。用于每个样品的新的枪头。
- 盖集群管上,并用封盖工具紧密。
- 地方产业集群管自动化加热块选择为L.具体方案菌等 。可替代地,孵育簇管在55±2℃30分钟,接着温育95±3℃,10分钟。最后,群集管传送到冷却块(2 - 8℃)5分钟。
可以储存在-20℃下含溶解物群集管长达2周:注。
7.水合物PCR就绪片
- 选择已冷却(4℃)的PCR冷却块,并放置在PCR管架在插入件。
- 放置对应含有PCR就绪片剂(包含在每个试剂盒),用于在所述保持器的目标食源性病原体的PCR管,根据机架文件。
- 使用脱帽工具,小心地取出从PCR-管帽。丢弃帽和验证每个管中含有的片剂。
- 转移50微升( 沙门氏菌和Cronobacter)或30微升裂解液(用于单增李斯特菌 ),以特异性PCR管。采用新的光学帽紧紧固定到使用封盖工具的PCR管。
注: - 8℃直至装入基于PCR检测系统中添加溶胞产物,以PCR为就绪片剂后,样品必须保持在2冷却。 PCR试管可在2500 xg离心离心几秒钟,以确保充分量是在底吨他管。 - 打开仪器抽屉加载PCR管放置在PCR循环仪/检测系统仪器。
- 将PCR管架入井在抽屉里,并检查管道安装正确。
- 关闭抽屉,并启动该程序所描述的制造商的协议。
注意:基于PCR的仪器已为每个食源性病原体预置循环参数。 - 验证PCR循环状态栏上显示一个蓝色的条表明程序的放大部分正在运行。
注:对于标准PCR测定中,全部程序(扩增和检测)的处理时间大约需要3 - 3.5小时内完成。
8.查看结果
- 处理完成后,按照从PCR为基础的系统的仪器屏幕上的提示删除样品和审查结果。
- 如果目标食源性病原体是存在于样品中(无论是表面或飞行的消化道)井是红色的,带有"加"号(阳性)。如果病原体不存在,该井为绿色,带'减'号(负)。
- 如果井是黄色与整个中心的红色条,这表示一个信号错误。
从PCR阳性结果9隔离细菌病原体
- 选择试管从主(对于单增李斯特菌 )或二级( 沙门氏菌和Cronobacter)的样本是PCR阳性的富集。此外,随机选择3 - 这是PCR阴性样本的5%,并进行如下操作:
- 沙门氏菌 :
- 加入100微升的次生富集媒体至10ml拉帕波特-Vassiliadis(RV)中,并1毫升连四中(TT)肉汤。 24小时 - 在循环水浴22孵育管在42.5℃。
- 每个孵化,RV是的,连胜3毫米菌环(10微升)后ðTT媒体对亚硫酸铋(BS)琼脂,木糖赖氨酸去氧胆酸盐(XLD)琼脂和Hektoen肠道(HE)琼脂。孵育板在35±1℃的22 - 24小时。
- 培养结束后,检查板为典型的沙门氏菌菌落每个媒体的存在。如果没有分离的菌落可以经过多次传代培养步骤中获得,考虑样本为阴性,并报告作为假阳性的PCR为基础的系统。
注:对于典型的沙门氏菌菌落特定的媒体上看到22。选择5推定典型的沙门氏菌菌落和传代他们BS,XLD,否则他直到隔离/单菌落纯培养获得。 - 选择一个纯集落,并通过使用生化商业测试,例如在VITEK 2识别卡或API的生化鉴定系统中,按照制造商的说明确定推定沙门氏菌 。
- 对于Cronobacter:<OL>
- 条纹二次富集培养基的3毫米铂环量(10微升)在生色培养基如富力阪崎肠杆菌(Cronobacter)生色电镀介质,和/或ChromID 阪崎琼脂的两个板。孵育板在35℃下为22 - 24小时。
- 培养结束后,检查板为典型的Cronobacter殖民地(蓝黑色,以蓝灰色)的存在。选择5推定Cronobacter殖民地和传代他们到富力阪崎肠杆菌(Cronobacter)显色电镀中,ChromID 阪崎肠杆菌琼脂或TSA得到隔离/单菌落纯培养,直到。
注意:如果没有分离的菌落可以经过多次传代培养步骤中获得,考虑样本为阴性,并报告作为假阳性的PCR为基础的检测系统。 - 选择一个纯粹的殖民地,并通过生化得到商业鉴定推定CronobacterCIAL测试如VITEK 2识别卡或API 20E生化鉴定系统,按照制造商的说明进行操作。
- Streak的主要富集媒体3毫米菌环(10微升)的两个板块华晨李斯特菌琼脂(BLA)。孵育板在36±1°C为22 - 26小时。
- 培养结束后,检查板的推定L.存在菌 (蓝绿色)的殖民地。选择5推定L.菌 殖民地和传代培养他们BLA直到获得隔离/单菌落纯培养。再孵育负极板在36±1℃进行另外22 - 26小时。
- 选择一个纯粹的殖民地,并确定推定L.菌等通过使用商业生化试验如VITEK 2识别卡或API的李斯特菌生化鉴定系统,按照生产商的我nstructions。
结果
该协议第一次校准一套实验室饲养的家蝇那进行了实验喂养24小时液体飞食品(2%奶粉)含连续稀释(2月10日至八月10日CFU /毫升)的C.阪崎肠杆菌,S.肠道,L.单核细胞增生 ,或C.空肠弯曲菌 (N = 21为每个细菌病原体)。浓缩介质以及孵育时间和温度分别调整为每食源性病原体,直到基于PCR系统能够从身体表面和一个单一的消化道实验馈送检测细菌的最低水平(10 2 CFU / ml)的飞。使用在协议部分中描述的富集培养基和条件下,基于PCR的系统中检测到C.阪崎肠杆菌,S.肠炎 ,和L.菌从苍蝇与细菌接种> 10 3 CFU / ml的( 图1A)供给的100%的身体表面。当苍蝇饲喂102 CFU / ml时,检测C的百分比阪崎肠杆菌,S.肠炎 ,和L.从他们的身体表面的单核细胞分别为100%,66%和33%,分别为( 图1A)。基于PCR的系统也检测到这三个食源性致病菌从苍蝇百分数≥33%( 图1B)供给与所有细菌浓度的消化道。然而,C的检测菌在实验室饲养的苍蝇含有最高细菌接种(10 8 CFU /毫升)的液体食品进行了实验美联储才能实现。因此,C.菌被排除在该组的食源性病原体,可以从个体住区(synanthropic)污秽苍蝇使用此基于PCR的检测系统进行检测。
与此标准化协议,我们能够确定Cronobacter属的患病率。,沙门氏菌,和L.从身体表面和/或第菌等百野蝇是单独和无菌从设在华盛顿特区的大都市区5污物收集苍蝇能代表至少有6种,包括M.十个城市餐饮垃圾站区抓住电子商务消化道家蝇 (47%), 铜绿蝇(33%),L。蝇(14%),Cochliomyia macellaria(2%),麻haemorrhoidalis(2%),和Ophyra leucostoma(1%)。一飞被认定只正科级(花蝇科; 1%)。表面消毒的协议是在避免身体部位的苍蝇之间的交叉污染,因为没有细菌生长,观察在TSA板为水从每个单独的蝇的最后漂洗消毒有效。因此,区分可能存在于身体部位的每个飞的食源性细菌之间进行。
从身体表面的样品和消化道中没有检测到假阳性使用这种商用的PCR为基础的系统,当个人苍蝇为S的检测肠道和L.单核细胞增生 ,以及在琼脂平板上存活的病原体的确认是利用PCR阳性结果一致。然而,这是不可能的,分离Cronobacter属的纯培养物。所有PCR阳性样品。因此,这种病原体由所述的检测基于PCR 系统显示出从体表误报(50%; 9/18)和消化道(48%; 16/33)单野外捕获苍蝇。接种特定的媒体随机选择PCR阴性样本,证实没有的食源性致病菌。因此,无假阴性从任何样品使用这种商用的PCR为基础的系统,以检测Cronobacter属时,S检测。 肠道或L.菌等 。
只有那些PCR阳性样品,其中所述病原体被分离,并确认被认为是阳性并列入统计分析。食源性致病菌在野外捕捉苍蝇藏污纳垢的消化道中的整体存在较体表显著较高(χ2 = 6.8772,自由度= 1,P = 0.0087)。消化道运河的22%,并收集野生苍蝇的身体表面的8%为阳性的三个食源性病原体的至少一种( 图2)。总体而言,Cronobacter菌属的患病率。不论是从身体表面或收集苍蝇的消化道有统计学差异(19%; Fisher精确检验p = 0.0165),比S的患病率肠道 (7%)和单增李斯特菌 (4%)。然而,对于每个细菌病原体( 图3进行身体部位的苍蝇之间成对比较时没有观察到统计学的差异; Fisher精确检验p = 0.1464,P = 0.1184 和p = 0.6212对Cronobacter属,S。肠道和单增李斯特菌 ,分别)。无苍蝇呈阳性评估所有三个病原体。然而,三苍蝇(2 L.蝇和一个L.蝇 )进行沙门氏菌 。和L.单核细胞的表面或消化道。
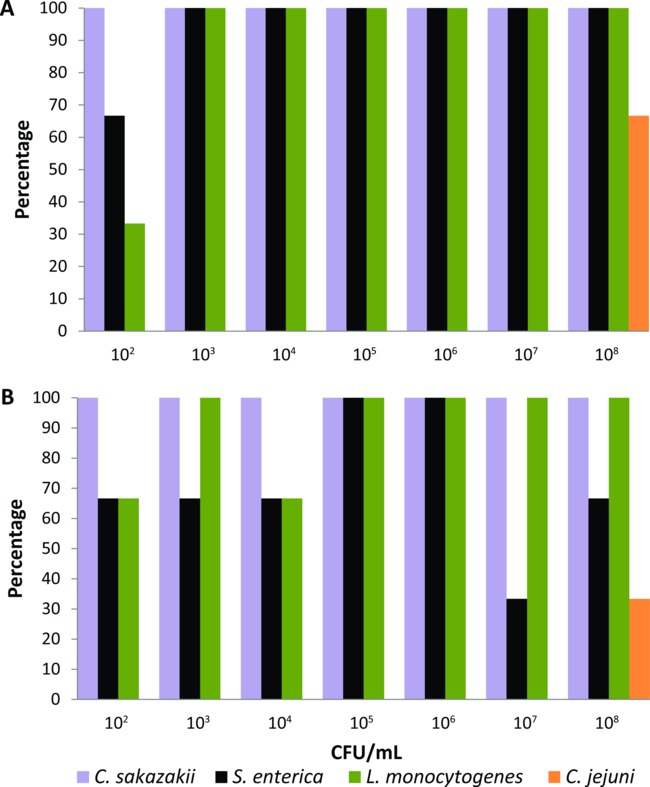
Cronobacter阪崎肠杆菌 , 沙门氏菌,单增李斯特菌和空肠弯曲菌从(A)的机身表面和(B)各实验室饲养的家蝇的消化道与含不同的细菌接种液体食物喂养图1.检测水平 (N = 21对每个细菌病原体,N = 3元每个细菌浓度)。

身体表面和个人苍蝇的消化道图2.百分比发现阳性的任何目标食源性致病菌。
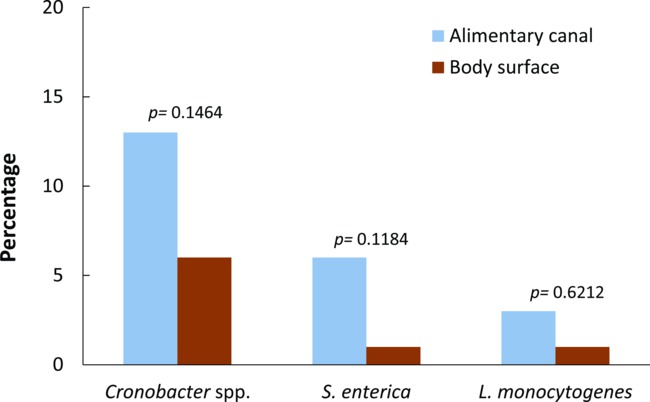
图3.患病Cronobacter属。, 沙门氏菌和李斯特菌从身体表面和住区(synanthropic)野外捕捉苍蝇的消化道。报道的P值是从身体表面和消化道每个细菌病原体之间的成对比较(Fisher精确检验,p值<0.05表示统计显着性)。版权所有©美国微生物学会,[应用与环境微生物学78(22):7891-902,2012 DOI:10.1128 / AEM.02195-12。
讨论
已检测到的从野生昆虫食源性致病菌已经使用了各种各样的协议,可能不包括必要的信息,以准确地评估在食品或与食品有关的环境13,15的单个飞行的存在的与食物有关的风险以往的研究, 23,24。在这里,我们证明了使用该标准化的协议,它可以检测并隔离Cronobacter属。,S。肠炎,和L.单核细胞从身体表面和单苍蝇夹在野外的消化道。因为昆虫可以携带靶食源性病原体的数量少和高数量的其他土著菌群25,26的,该协议需要在特定培养基样品的初级(和有时辅助)富集以增加检测目标食源性病原体的敏感性。结果从PCR为基础的检测系统分别在大约30小时得到(对于DETEction Cronobacter属。和S.肠炎 )和48小时(用于后开始处理样品的检测单增李斯特菌 )的。因此,该协议是可靠以及快速和足够敏感以筛选的食源性病原体的存在的单个飞。
进行PCR阳性结果确认活菌和隔离是许多实验室的标准作业程序的一部分。此外,对于流行病学的目的,从PCR阳性样品纯的细菌培养都需要进一步确认和使用生化,免疫,或遗传方法血清型的食源性病原体。虽然没有误报,观察检测S.当肠道和L.从主体部件单野生捕获苍蝇的单核细胞增生 ,使用这个协议中,我们发现到的Cronobacter属误报50%的比率。这表明,基于PCR的检测系统,用于菌属Cronobact呃可以与其它肠杆菌科的高度复杂的小型生物群的苍蝇携带之间存在交叉反应。因此,隔离和从PCR阳性标本属Cronobacter纯菌落净化需要更多的选择性电镀比评估的其他病原体。
此协议已主要被标准化以筛选个体野外捕获苍蝇为Cronobacter属的存在。,S。肠炎,和L.使用商业的基于PCR的检测系统菌等 。但是,这个协议也容易适应屏体部分单苍蝇的其他食源性致病菌如肠出血性大肠杆菌 O157存在:H7(使用大肠杆菌 O157:H7 MP标准的检测试剂盒,或大肠杆菌 O157:H7实时检测试剂盒)和志贺毒素大肠杆菌大肠杆菌 (STEC)基团(使用实时STEC套件),获得的灵敏度> 80%(取消发布编辑数据)。另外,该协议可以潜在地适用于从已知的疾病(蟑螂和蚂蚁)载体等昆虫检测食源性病原体,但需要更多的这方面的研究。
食源性疾病暴发的调查是非常动态的,包括一个多步骤的过程,可根据具体情况和当地的环境正在调查12,27而有所不同。这些调查是重要的,因为它们提供了防止未来疾病的即时保护公众健康。此外,这些研究可以阐明由食源性微生物分布的新机制,提高导致新的研究领域28的重要问题。侦查技术以及标准化,快速,敏感的协议是必要的,从个人的昆虫检测食源性致病菌。这种标准化的协议打开了机会无菌采集昆虫,如苍蝇,WHICH可以矢量食源性细菌病原体,作为环境取样计划的一部分。可以从这个来获得的流行病学资料将利用在构建由昆虫传播的食源性致病菌的机制的一个准确的描述( 即照射时间长度:a。通过登陆与苍蝇落地,排粪和反刍飞)。
最后,尽管这里描述的商用基于PCR检测系统是切合实际的使用,并简化了PCR扩增和属级扩增子的可视化,它绝不是唯一的适当的系统。从富集的样品裂解物替代,可以使用通过使用公开可用的物种特异性引物对筛选的食源性病原体的存在。然而,检测灵敏度应之前,他们使用的证明。
披露声明
The use of specified instrumentation is not an endorsement by the U.S. Food and Drug Administration. The authors certify that there is no conflict of interest with any financial organization regarding the material discussed in this article.
致谢
Thanks to Ben D. Tall, Yi Chen, and Thomas Hammak from the U.S. Food and Drug Administration (FDA), Center for Food Safety and Applied Nutrition (CFSAN) for critically reviewing the manuscript. The authors also thank Hannah Lee (research internship program, Joint Institute for Food Safety and Applied Nutrition (JIFSAN), University of Maryland) for laboratory assistance and David Weingaertner (FDA, CFSAN) for preparing the figure of the schematic overview shown in the video.
材料
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
参考文献
- Zurek, L., Gorham, J. R., Voeller, J. G. . Wiley Handbook of Science and Technology for Homeland Security. , 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. . Houseflies and how they spread disease. , (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, 269-296 (1991).
- Greenberg, B. . Flies and disease, Vol I. Ecology, classification and biotic associations. , (1971).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。