Method Article
Bireysel Filth Sinekler gelen Gıda Kaynaklı Bakteriyel Patojenler Algılama
Bu Makalede
Özet
A PCR-based protocol was adapted to detect Cronobacter spp., Salmonella enterica, and Listeria monocytogenes from body surfaces and alimentary canals of individual wild-caught flies. The goal of this protocol is to detect and isolate bacterial pathogens from individual insects collected as part of an environmental sampling program during foodborne outbreak investigations.
Özet
There is unanimous consensus that insects are important vectors of foodborne pathogens. However, linking insects as vectors of the pathogen causing a particular foodborne illness outbreak has been challenging. This is because insects are not being aseptically collected as part of an environmental sampling program during foodborne outbreak investigations and because there is not a standardized method to detect foodborne bacteria from individual insects. To take a step towards solving this problem, we adapted a protocol from a commercially available PCR-based system that detects foodborne pathogens from food and environmental samples, to detect foodborne pathogens from individual flies.Using this standardized protocol, we surveyed 100 wild-caught flies for the presence of Cronobacter spp., Salmonella enterica, and Listeria monocytogenes and demonstrated that it was possible to detect and further isolate these pathogens from the body surface and the alimentary canal of a single fly. Twenty-two percent of the alimentary canals and 8% of the body surfaces from collected wild flies were positive for at least one of the three foodborne pathogens. The prevalence of Cronobacter spp. on either body part of the flies was statistically higher (19%) than the prevalence of S. enterica (7%) and L.monocytogenes (4%). No false positives were observed when detecting S. enterica and L. monocytogenes using this PCR-based system because pure bacterial cultures were obtained from all PCR-positive results. However, pure Cronobacter colonies were not obtained from about 50% of PCR-positive samples, suggesting that the PCR-based detection system for this pathogen cross-reacts with other Enterobacteriaceae present among the highly complex microbiota carried by wild flies. The standardized protocol presented here will allow laboratories to detect bacterial foodborne pathogens from aseptically collected insects, thereby giving public health officials another line of evidence to find out how the food was contaminated when performing foodborne outbreak investigations.
Giriş
Onlar yiyecek veya gıda ile temas eden yüzeyleri ve eşyaları 1 patojenleri yayılabilir, çünkü böcekler yiyecek-ilişkili hastalıkların bulaşmasında önemli rol oynar. Böcekler arasında, sinekler hamamböceği ve karıncalar gıda kaynaklı patojenlerin yayılmasını tercih davranışlar sergilerler. Bu davranışlar çöp ve dışkı, endophily (giren binalar), ve synanthropy (insanlar ile birlikte yaşayan), çürüyen madde ile bir ilişki bulunmaktadır 2. .. Salmonella spp gibi gıda kaynaklı patojenler, Listeria monocytogenes, Campylobacter spp Escherichia coli O157: H7, ve cins Cronobacter (eski Enterobacter sakazakii'nin) üyeleri böcekler 3-5 iletilecek bildirilmiştir. Synanthropic pislik mekanik onların kontamine vücut yüzeylerinden patojenleri aktararak gıda kaynaklı bakteri yayılır sinekler. Bununla birlikte, sinekler, sindirim borusu içinde gıda ile taşınan patojenlerin varlığı ile üç kez kadar olabilirvücut yüzeyleri (vücut, baş, bacaklar ve kanatlar) 5 gözlenen daha büyük. Gıda kaynaklı patojenler de vücut yüzeyi 6,7 ziyade ve bazı durumlarda süre daha uzun süreyle sineğin sindirim kanalında kalabilir, bunlar sineğin sindirim yolu 4,8,9 kolonize, çarpma edebiliyoruz. Onlar daha dışkılama ve regürjitasyon 10,11 ile gıda kaynaklı patojenler yayılabilir çünkü bu sinekler vektör potansiyelini arttırır.
Günümüzde, daha hızlı gıda kaynaklı hastalık salgınları tespit edebiliyoruz gözetim sistemleri var geliştirilmiştir. Gıda kaynaklı salgın soruşturma yapılırken, kamu sağlığı yetkilileri enfeksiyon kaynağı (ler) veya araç (lar) olabilir gıda için bakmak. Araştırmacılar ayrıca, gıda kirlenmiş öğrenmek için ilgili tesis (veya tesislerin) bir çevresel değerlendirme yapabilir ve soruşturma 12 kapsamında örnekleri toplamak olabilir. DespBilimsel literatürde, gıda kaynaklı patojenlerin taşıyıcıları olarak böceklerle ilgili belirli bir gıda kaynaklı hastalık salgını zorlu olmuştur neden olan patojen vektörleri gibi böcekler bağlayan büyük miktarda ite. Böcekler aseptik gıda kaynaklı salgın soruşturmalar sırasında çevre örnekleme programlarının bir parçası olarak tahsil edilmemesi Bunun başlıca nedeni olduğunu. Böcekler, çevre örnekleme prosedürü, bir tek böcek yerde olması gerekir gelen gıda kaynaklı patojenlerin tespit etmek için bir standart hızlı, hassas ve güvenilir bir protokol kapsamında, gıda kaynaklı patojenlerin yayılmasını lehine davranışlar sergilediği özellikle de dahil etmek.
Böceklerden gıda kaynaklı patojenlerin saptanması için geleneksel kaplama teknikleri zahmetli ve böceğin doğal ortakçı mikrobiyota hızlı büyümesini üstesinden gelmek için, farklı kültür ortamı içinde, hedef bakteri rekabetçi büyüme bağlıdır. Ba ile böcekleri ilişkili çalışmaların çoğucterial patojenler birlikte birkaç böcekler havuzu ziyade bireysel bazda başına patojenlerin varlığı tespit ederek yöntemin duyarlılığını artırmıştır. Böylece, bu çalışmalar patojenler 13-18 bulundu böceğin vücut parçası ayırt etmedi. Bu epidemiyolojik etkileri olabilir ve farklı azaltma stratejileri yol açabilir gibi gıda kaynaklı patojenler vücut yüzeyinde veya bireysel böceğin sindirim kanalında bulunan olup olmadığını belirlemek için yeteneği önemlidir. Mekanik vektörleri olarak, sadece enfeksiyonun potansiyel olarak daha yüksek seviyelerde aktarma patojenlerin olasılığını arttırmak akmak bu sinekler ise, vücut yüzeyinden bakteri düşük seviyelerde transferi ve gıda dışkılama olabilir kısa bir süre için gıda araziyi uçar. Sonuç olarak, bir birey böcek başına bir gıda kaynaklı patojen prevalansını tahmin etmek ve bu böcek bakteriyel p vücut parçası ayırt etmek önemlidir athogen bulunmaktadır.
Gıda kaynaklı patojenleri saptamak için kültür-bağımsız yöntemlerin kullanılması giderek yürütülmektedir olsa, onlar ticari bir tek böcek gıda kaynaklı patojenlerin tespit etmek için kullanılan değil. Şu anda, ticari, sanayi ve düzenleyici kurumlar tarafından kullanılmakta olan gıdalardan gıda kaynaklı patojenlerin hızlı tespiti için kullanılabilir moleküler protokolleri var doğrulanır. Bu yöntemler, gıda örnekleri çeşitli patojenlerin saptanması için DNA bazlı sistemler yer alır. Moleküler protokoller, geleneksel kaplama yöntemlerine göre daha hızlı olsa da, örnek zenginleştirilmesi hala polimeraz zincir reaksiyonu (PCR) 'de gerekli olan bakteriyel patojen 10 2 koloni oluşturan birim (CFU) tabanlı yöntemler 19 duyarlılık seviyesinin elde edilmesi için gereklidir. Buna ek olarak, PCR pozitif numuneler saf bakteri kolonilerinin izolasyon uygun yöntemler kullanılarak patojen teyit etmek için gereklidir.
İçerik "> Bu protokolün amacı, vücut yüzeyinden gıda kaynaklı bakterilerin tespiti ve tek sinek sindirim kanalına gıda ve çevresel örneklerden patojenleri tespit etmek ve daha fazla olanlar izole etmek için kullanılan bir piyasada mevcut PCR tabanlı bir sistemin standardize etmek Burada tarif edilen protokol samples.The hassasiyeti patojenlerin ilk deneysel her bir bakteri patojeninin seri seyreltileri ile beslenen hayvanlar lab-destekli yetişkin ev sinekleri (Musca domestica) ile kalibre edilmiştir. standart bir protokol, daha sonra incelemek için kullanılmıştır 100 vahşi yakalanmış vücut yüzeyleri ve / veya sindirim kanallarından gıda kaynaklı patojenlerin varlığı için uçar. Bu standart bir protokol halk sağlığı laboratuarları gıda kaynaklı yaparken çevresel örnekleme programının bir parçası olarak toplama imkanı sağlayarak, böcekler tarafından yöneltilen sağlık tehditleri tespit sağlayacak salgın incelemeleri.Protokol
Sinek 1. Koleksiyonu
- Steril entomolojik süpürme ağları kullanarak bireysel sinekler toplayın. Bir soğutucu ağları koyun ve laboratuara aktarabilirsiniz.
Sineklerin 2. Diseksiyon
- 7 dakika - 5 -20 ° C sıcaklıkta tekrar yerleştirilmesi, aseptik bir toplanan sinekler hareketsiz.
- Önceden ısıtılmış (37 ° C) tamponlu pepton su (BPW) 1 ml içeren steril 2 ml tüp steril forseps yerde bir sinek kullanma. 2 dakika için ters çevirme ile tüp hafifçe karıştırın. Bu anında vücut yüzey (S) üzerinde bulunan mikrobiyota BPW (BPW-G) aktarılır ve böylece fermuar kısmının tüm vücut ortam ile temas halinde olması esastır. Sinek sayısı ve gövde parçası (yani, 1 S) ile tüp etiketleyin.
NOT: Bu protokolde belirtilen maddeleri ve ayrıntılı bir açıklama için özel Reaktifler / Ekipman Tablosuna bakınız. - Steril forseps kullanarak BPW-S medya ve transfer sinek kaldırmakBoş ve temiz 2 ml'lik bir tüp bu sinek dezenfekte yüzeye. Dezenfeksiyon ve diseksiyon protokolü yaparken 37 ° C'de BPW-S medya içeren tüp inkübe.
- Taze hazırlanmış% 0.05 (h / h) ağartıcı çözeltisi, 1 ml içinde daldırarak önce steril damıtılmış su ile bir durulama aşaması ve ardından, 1 dakika boyunca% 70 etanol içinde 1 ml içinde daldırarak sinek Yüzey dezenfekte. Steril damıtılmış su ile 3 kez yıkayın. Bir otoklavlanmış 2 ml tüp son durulama suyu aktarın.
NOT: 1000 ul mikropipet kullanılarak ya, tüp tersini sinek tüp içinde kaldığından emin yaparak sıvı her zaman atın. Yüzey dezenfeksiyon işleminin her adımında çevirerek yavaşça karıştırın. - , Dezenfeksiyon işleminin etkinliğini değerlendirmek bir triptik soya agar (TSA) plakaya son durulama suyu 100 ul aktarmak ve steril bir L şeklinde tek serpme kullanarak yaymak için. 24 saat boyunca 37 ° C'de plaka inkübe edin. Sonrasıcubation, herhangi bir bakteri kolonilerinin varlığı kayıt.
NOT: TSA plakaları üzerinde bakteri kolonilerinin varlığı verimsiz yüzey dezenfeksiyon işlemi gösterir. Bu durum ortaya çıkarsa vücut yüzeyi ve sindirim kanalı arasında çapraz-bulaşma göz ardı edilemez, çünkü gıda kaynaklı patojenlerin varlığı sadece sinek vücut yüzeyinde rapor edilmelidir.
- Taze hazırlanmış% 0.05 (h / h) ağartıcı çözeltisi, 1 ml içinde daldırarak önce steril damıtılmış su ile bir durulama aşaması ve ardından, 1 dakika boyunca% 70 etanol içinde 1 ml içinde daldırarak sinek Yüzey dezenfekte. Steril damıtılmış su ile 3 kez yıkayın. Bir otoklavlanmış 2 ml tüp son durulama suyu aktarın.
- Sinek yüzey dezenfekte sonra, steril 60 mm'lik tek Petri kabı daha sonra fazla su ve kaldırmak için otoklava kağıt havlu parçası transfer.
- Diseksiyon kapsamında Petri kabı yerleştirin ve dipteran aileleri 20,21 için dikotom tuşlarını kullanarak tür düzeyinde sinek belirlemek.
- Yavaşça aseptik sinek dışarı anüs ve tüm sindirim kanalı (A) çekin ve otoklavlanmıştır ince uçlu forseps kullanarak 0,5 mm zirkonya / silika ile önceden ısıtılmış (37 ° C) BPW 1 ml içeren başka bir steril 2 ml tüp transfer Boncuklar (BPW-A). Etiket inciBireysel sinek ve sinek (yani, 1A) vücut bölümü için seçilen aynı sayıda e tüp.
- Bir hücre Topu kullanarak 10 dakika - 5 için iyice BPW-A içeren tüp karıştırın. Protokol geri kalanını yaparken 36 ± 1 ° C'de inkübe edin.
- Voucher ve / veya uzun vadede numune saklamak, temiz bir 2 ml tüp içinde sinek kalanını yerleştirin ve 1 eklemek için -% 95 etanol 2 ml.
3. Birincil ve İkincil zenginleştirilmesi
- Örnek numarası ve sinek vücut kısmına göre medya içeren tüm birincil ve ikincil zenginleştirme tüplerini etiketleyin.
- Steril bir kaput altında, aşağıdaki ortamları içeren 2 ml'lik tüpler steril alanlar BPW-S (yüzey) 300 ul transferi:
- Salmonella için, önceden ısıtılmış (42 ° C), BPW 1 ml kullanılır. - 24 saat 22 42.5 ° C 'de, bir devri daim banyosu içinde inkübe edin. İkincil zenginleşme için, 400 & # zenginleştirilmiş BPW 100 ul transferi181; daha önce steril bir küme borular içine yerleştirilir, önceden ısıtılmış (37 ° C), beyin kalp infüzyon (BHI) et l. 3 saat 37 ° C'de inkübe edilir.
- Cronobacter için, novobiosinin ile önceden ısıtılmış (37 ° C), BPW 1 ml (; Wallace, M., kişisel iletişim, 10 mg / L) kullanın. Alternatif olarak, birincil zenginlik olarak ek (vankomisin ve sefsulodin) ile R & F Enterobacter sakazakii zenginleştirme suyu 1 ml kullanın. 26 saat - 22 ve 37 ° C'de inkübe edilir. İkinci zenginleştirme, daha önce steril bir küme borular içine yerleştirilir, önceden ısıtılmış (37 ° C), BHI et suyu 400 ul, novobiosinin zenginleştirilmiş BPW 100 ul aktarın. 3 saat 37 ° C'de inkübe edilir.
- L. monocytogenes, seçici takviyesi ile taze hazırlanmış RT 24 Listeria zenginleştirme suyu (24 LEB) 1 ml kullanın. 44 ± 5 saat boyunca 37 ° C'de inkübe edilir. Sekonder bir zenginleştirme L. tespiti için gerekli olan monocytogenes.
- BPW-A olarak etiketlenmiş tüp kullanarak yukarıdaki 3.2.3 - Tekrar 3.2.1 adımları.
Hedef Gıda Kaynaklı Patojen büyütülmesi ve Algılama için PCR-Tabanlı Sistemi 4. Hazırlık
4-8 Salmonella (Salmonella 2, standart bir test kiti), Cronobacter türleri (E. sakazakii standart tahlil kiti) ve Listeria monocytogenes taranması için ticari bir PCR döngü / detektör sistemi, bir bilgisayar, iş istasyonu ve hazır kullanımlı kitleri adımlar (L. 24E deney kiti monocytogenes). Standart testler PCR uç nokta algılama kullanın. Her kit çift kollu DNA'ya bağlanma sırasında bir floresan sinyalini yayan bir araya eklenen boyanın PCR hazır tabletler içerir. Sinyal pozitif veya negatif olarak yazılım tarafından yorumlanır erime eğrisi oluşturma, PCR sistemi programın algılama aşamasında yakalanır.
- Üreticilerinin tarafından belirtilen reaktifler ve donanımları hazırlayınHer hedef gıda kaynaklı patojen başına RER'ye protokol.
Not: Salmonella ve Cronobacter tespit edilmesi için protokoller L. tespit edilmesi için protokol ise tek-aşamalı bir parçalama işlemine tabi tutulması gerekir monocytogenes iki aşamalı bir parçalama işlemi (sırasıyla bölümleri 5 ve 6 ya bakınız) gerektirir. - Hedef patojen için özel bir program seçerek otomatik ısıtma bloğu açın. (- Adım 6.2 L liziz parçası 2 monocytogenes için) ısıtma ve blok kılavuzu, alternatif olarak, (. Salmonella, Cronobacter spp ve L. monocytogenes) 37 ° C ya da 55 ± 2 ° C sıcaklığa ayarlanmış 95 ± 3 ° C.
- En az 2 saat 8 ° C - Aksi 2 onları soğuk, soğutma blokları O / N buzdolabında edilmiş olduğundan emin olun.
- PCR bazlı tespit sistemi bilgisayar yazılımı kullanılarak, imalatçının talimatları izlenerek bir raf dosyası oluşturmak.
- Etiket ve küme düzenlemektüpler raf dosyasına göre, rafa parçalama reaktifi içeren.
- PCR-tabanlı algılama sistemi cihazı başlatılamıyor.
5. Salmonella ve Cronobacter tespiti için lizizini gerçekleştirin
- Liziz tamponu, bir 12 ml şişe proteazın 150 ul ekleyerek liziz reaktifi hazırlayın.
- Daha önceden işaretlenmiş küme tüplerin her birine, liziz reaktif maddesi 200 ul aktarın.
Not: - en fazla 2 hafta boyunca 8 ° C'de liziz reaktifi ihtiva eden Cluster tüplerine 2 saklanabilir. - İkincil zenginleştirilmiş numunelerin 20 ul, uzun pipet uçları giriş transfer kullanma parçalama reaktifi 200 ul içeren küme tüpleri karşılık gelen (adımları 3.2.1 ve 3.2.2 bakınız). Her numune için, yeni pipet uçları kullanın.
NOT: PCR pozitif / negatif örneklerin ileri onay analizi için RT (Cronobacter) buzdolabı (Salmonella) ya da birincil ve ikincil zenginleşme tüpleri tutun. - Parçalama reaktifi 200 ul içeren küme tüplere steril BHI medya 20 ul ekleyerek negatif kontrolleri hazırlayın.
- Liziz reaktifi 200 ul ihtiva eden grup tüplerine herhangi bir bilinen Salmonella veya Cronobacter soyunun (BHI yetiştirilen) O / N bakteri kültürleri 20 ul eklenmesi ile pozitif kontrol hazırlayın.
- Cap küme tüpleri sıkıca kapatma aracını kullanarak sabitleyin ve.
- Hedef patojen için özel bir program seçtikten sonra otomatik ısıtma bloğu küme tüplerin raf yerleştirin. Seçenek olarak ise, 10 dakika boyunca 95 ± 3 ° C 'de inkübasyon, ardından 20 dakika boyunca 37 ± 2 ° C'de, kümelenme tüpleri inkübe edin. 5 dakika boyunca - (8 ° C'de 2) Son olarak, blok soğutma küme tüpleri aktarın.
Not: lizat içeren Cluster tüplerine 2 hafta boyunca -20 ° C'de muhafaza edilebilir.
6. L. tespiti için lizizini gerçekleştirin monocytogenes
- Bölümünü bir gerçekleştirinaşağıdaki gibi liziz:
- Tamamen çözülmüş yokedici maddenin 1 şişeye steril deiyonize su, 1.8 ml ilave edilir.
NOT: Mağaza 2 de ajan 1 yokedici - Kullanıma hazır olana kadar 8 ° C. En fazla 6 ay süreyle - 30 ° C (20), oda sıcaklığında açma ve sulandırma, depolama sonrası. - 1 oranında (seyreltilmiş yokedici madde, 1 40 ul ve her bir örnek başına 2 madde yokedici 10 ul), bir 4 Maddeleri 1 ve 2 yokedici birleştirin. Kombine parçalama ajanların Transferi 50 ul tüpleri küme. 4 saat içerisinde karışımı kullanılır.
- Birincil zenginleştirilmiş numune 500 ul ekle Birleştirilen eritici maddeler 50 ul ihtiva eden küme tüpüne (adım 3.2.3 bakınız).
- Birleştirilen eritici maddeler, 50 ul steril 24 kolluk 500 ul ilave edilerek bir negatif kontrol hazırlayın.
- / K L, O 500 ul ilave edilerek bir pozitif kontrol hazırlanması monocytogenes, kültür kombine eritici maddeler, 50 ul 24 kolluk içinde büyütülür.
- , Küme tüpleri Cap hafifçe karıştırın ve yer30 dakika süreyle 37 ± 1 ° C 'de ısıtma bloğu.
NOT: PCR pozitif / negatif örneklerin ileri onay analizi için buzdolabında birincil zenginleştirme tüpleri tutun.
- Tamamen çözülmüş yokedici maddenin 1 şişeye steril deiyonize su, 1.8 ml ilave edilir.
- Aşağıdaki gibi lizis bölümünü 2 gerçekleştirin:
- Adımlar 5.1 ve 5.2 belirtildiği gibi parçalama reaktifi hazırlayın.
- Kullanarak uzun pipet uçları parçalama reaktifi 200 ul içeren küme tüplerine parçası bir lizatın 20 ul transfer. Her numune için, yeni pipet uçları kullanın.
- Cap küme tüpleri sıkıca kapatma aracını kullanarak sabitleyin ve.
- L. için özel bir program seçerek otomatik ısıtma bloğu yerleştirin küme tüpler monocytogenes. Seçenek olarak ise, 10 dakika boyunca 95 ± 3 ° C 'de inkübasyon, ardından 30 dakika boyunca 55 ± 2 ° C'de, kümelenme tüpleri inkübe edin. 5 dakika boyunca - (8 ° C'de 2) Son olarak, blok soğutma küme tüpleri aktarın.
Not: lizat içeren Cluster tüplerine 2 hafta boyunca -20 ° C'de muhafaza edilebilir.
7. Hidrat PCR Hazır Tabletler
- Soğutulmuş (4 ° C), PCR soğutma bloğu seçip ekin üzerinde bir PCR tüpü raf yerleştirin.
- Raf dosyasına göre, tutucu hedef gıda kaynaklı patojen için (her kit ile birlikte), PCR-hazır tablet içeren PCR tüpleri gelen yerleştirin.
- Dekapaj aracını kullanarak, dikkatle PCR tüpleri kapakları çıkarın. Kapaklar atın ve her tüp bir tablet içerdiğini doğrulayın.
- Transferi (Salmonella ve Cronobacter için) 50 ul veya spesifik PCR tüplerine lizatın (L. monocytogenes için) 30 ul. Yeni optik kapaklar kullanın ve kapaklama aracını kullanarak PCR tüpleri sıkıca sabitleyin.
Not: - PCR bazlı tespit sistemi yüklenen kadar 8 ° C PCR hazır tabletlere lisat ilave edildikten sonra, numuneler 2 soğutulmaktadır kalmalıdır. PCR tüpleri tam birim alt t olduğundan emin olmak için, bir kaç saniye için 2500 x g hızında santrifüj edilebilirO tüp. - Alet çekmecesini açarak PCR döngü / algılama sistemi aracı haline PCR tüpleri yükleyin.
- Çekmecede kuyulara PCR tüplerinin raf yerleştirin ve tüpler doğru yerleştirildiğinden emin olun.
- Çekmece kapatın ve üreticinin protokolü tarafından tarif edildiği gibi bir program başlatır.
NOT: PCR tabanlı enstrüman her gıda kaynaklı patojen için bisiklet parametrelerini önceden etti. - PCR bisiklet durum çubuğu programının amplifikasyon kısmı çalıştığını belirten mavi bir çubuk görüntüler doğrulayın.
NOT: - tamamlamak için 3.5 saat standart PCR deneyleri için, tam bir program (amplifikasyon ve algılama) işlem süresi yaklaşık 3 sürer.
8. İnceleme Sonuçları
- Işleme tamamlandıktan sonra, ekran örnekleri ve inceleme sonuçlarını ortadan kaldırmak için PCR-tabanlı sistem aracından ister izleyin.
- Hedef gıda kaynaklı patojeni (ya da numune içerisinde mevcut olması halindeYüzey veya sinek sindirim kanalı) de bir 'artı' işareti (pozitif) ile kırmızı. Patojen yoksa, iyi bir 'eksi' işareti (negatif) ile yeşil.
- Kuyu merkezi boyunca kırmızı bar ile sarı ise, bir sinyal hatası gösterir.
PCR pozitif Sonuçlarından Bakteriyel Patojenler 9. izolasyonu
- (L. monositogenlerini) birincil veya ikincil PCR-pozitif bu numuneler zenginleştirilmesi (Salmonella ve Cronobacter için) Belirli borular. Aşağıdaki gibidir: PCR-negatif örneklerin% 5 ve devam - Ayrıca, rastgele 3 seçin
- Salmonella için:
- 10 Rappaport-Vassiliadis (RV) orta ml tetratiyonat 1 ml (TT) suyu sekonder zenginleştirme ortamı 100 ul ekle. 24 saat - 22 devirdaim su banyosunda 42.5 ° C'de inkübe edin.
- Her RV An inkübasyonundan çizgi 3 mm halka dolusu (10 ul), sonrabizmut sülfit (BS) ağar, ksiloz lizin desoksikolat (XLD) agar d TT medya ve Hektoen enterik (HE) ağar. 24 saat - 22 35 ± 1 ° C'de inkübe edin.
- İnkübasyondan sonra, her bir ortam tipik Salmonella kolonilerin mevcudiyetinde için tabak inceliyoruz. Hiçbir izole koloniler birkaç alt-kültürleme adımlardan sonra elde edilebilir ise, negatif olarak örnek düşünün ve PCR tabanlı sistem için bir yanlış pozitif olarak rapor.
NOT: Tipik Salmonella kolonilerinin için belirli bir ortam 22 görmüyorum. Beş olası tipik Salmonella kolonileri seçin ve BS, XLD bunları altkültürü, ya HE izole / tek kolonilerin saf kültürleri elde edilinceye kadar. - Bir saf koloni seçin ve, örneğin VITEK 2 kimlik kartı veya API biyokimyasal tanımlama sistemi olarak biyokimyasal ticari testler kullanılarak üreticinin yönergelerini izleyerek olası Salmonella tespit.
- Cronobacter için:
- Şerit örneğin R & F Enterobacter sakazakii'nin (Cronobacter) kromojenik kaplama orta ve / veya chromID sakazakii Agar gibi kromojenik kültür ortamı iki levha üzerindeki orta zenginleştirme ortamı 3 mm halka dolusu (10 ul). 24 saat - 22 için 35 ° C'de inkübe edin.
- Inkübasyondan sonra, (mavi-gri, mavi-siyah), tipik Cronobacter kolonilerinin varlığı için plakaları inceleyin. 5 varsayımsal Cronobacter koloniler seçin ve izole / tek kolonilerin saf kültürleri elde edilinceye kadar R & F Enterobacter sakazakii'nin (Cronobacter) kromojenik kaplama ortamı, chromID sakazakii Agar veya TSA üzerine onları altkültürü.
NOT: Hiçbir izole koloniler birkaç alt-kültürleme adımlardan sonra elde edilebilir ise, negatif olarak örnek düşünün ve PCR-tabanlı algılama sistemi için bir yanlış pozitif olarak rapor. - Bir saf koloni seçin ve biyokimyasal ticari ürünler kullanarak olası Cronobacter tanımlamaküreticinin talimatlarına aşağıdaki gibi VITEK 2 kimlik kartı veya API 20E biyokimyasal tanımlama sistemi gibi sal testler,.
- L. monocytogenes:
- Şerit Parlaklık Lısterıa agar iki plakası (BLA) birincil zenginleştirme ortamı 3 mm halka dolusu (10 ul). 26 saat - 22 36 ± 1 ° C'de inkübe edin.
- İnkübasyondan sonra, olası L. varlığı plakaları incelemek monocytogenes (mavi-yeşil) koloniler. Seçin 5 olası L. monocytogenes koloniler ve izole / tek kolonilerin saf kültürleri elde edilene kadar BLA onları altkültürü. 26 saat - ek 22 için 36 ± 1 ° C'de olumsuz plakaları inkübe Yeniden.
- Bir saf koloni seçin ve olası L. tanımlamak Üreticinin i takip gibi VITEK 2 kimlik kartı veya API Listeria biyokimyasal tanımlama sistemi gibi ticari biyokimyasal testler kullanılarak monocytogenesnstructions.
- Böcekler izole olası gıda kaynaklı patojenler daha teyit ve bir referans laboratuvarında serotiplendirme edilmelidir.
Sonuçlar
C - Bu protokol, önce deneysel sıvı uçucu gıda (% 2 süt tozu) ihtiva eden bir seri seyreltmeleri (10 8 CFU / mL 10 2) ile, 24 saat süre ile beslenen hayvanlar lab-destekli karasineklerin bir dizi kalibre edilmiştir sakazakii S. enterica L. monocytogenes, ya da C jejuni (n = 21 her bakteriyel patojenin). PCR tabanlı sistem vücut yüzeyi ve deneysel beslenen bir tek sindirim kanalından bakteri düşük seviyelerde (10 2 CFU / ml) tespit başardı kadar Zenginleştirme medya yanı sıra kuluçka süreleri ve sıcaklıkları her gıda kaynaklı patojen için ayarlandı sinek. Protokol bölümünde açıklanan zenginleştirme ortamı ve koşulları kullanarak, PCR bazlı sistem C tespit sakazakii S. enterica ve L. bakteriyel aşı kısmı> 10 3 cfu / ml (Şekil 1A) ile beslenen sinek% 100 vücut yüzeyinden monocytogenes. Sinekler 10 ile beslenen edildiğinde2 CFU / mL, C saptama yüzdesi sakazakii S. enterica ve L. vücut yüzeyinden monocytogenes% 100,% 66 ve% 33, sırasıyla, (Şekil 1A) idi. PCR bazlı sistem, aynı zamanda yüzde ≥33% (Şekil 1B) tüm bakteri konsantrasyonları ile beslenen sinek beslenme kanalı bu üç gıda kaynaklı patojenlerin tespit edildi. Bununla birlikte, C algılama lab-destekli sinekler deneysel sıvı gıda yüksek bakteriyel inokulum (10 8 CFU / mL) içeren beslendiğinde jejuni sadece elde edildi. Bu nedenle, C jejuni Bu PCR bazlı tespit sistemi kullanılarak sinekler tek synanthropic pislik test edilebilir gıda ile taşınan patojenlerin grubu çıkarıldı.
Bu standart protokol ile, Cronobacter spp yaygınlığını belirlemek başardık., S. enterica, ve L. vücut yüzeyinde ve / veya tarihleri arasında monocytogenesbireysel ve aseptik vardı M. de dahil olmak üzere, en az altı türün temsilcisi olan 5 Toplanan pislik sinekler Washington, DC metropolitan alanda bulunan on kentsel restoranlar çöplüğü alanından yakalandı 100 yaban sinekler e sindirim kanalı domestica (% 47), Lucilia cuprina (% 33), L. sericata (% 14), Cochliomyia macellaria (% 2), Sarcophaga haemorrhoidalis (% 2) ve Ophyra leucostoma (% 1). Bir sinek sadece aile düzeyinde tespit edilmiştir (Anthomyiidae;% 1). yüzey dezenfeksiyon protokolü hiçbir bakteri üremesi her anında son dezenfeksiyon durulama su için TSA plakaları gözlendi çünkü sineğin vücut parçaları arasında çapraz bulaşmayı önlemek etkili oldu. Bu durumda, bir ayrım her anında vücut parçaları üzerinde mevcut olan gıda kaynaklı bakteriler arasında yapılabilir.
Hiçbir yanlış pozitif vücut yüzeyinin örneklerinin ve sindirim kanalından tespit edildiBireysel sinekler S. tespiti için bu ticari PCR-temelli bir sistem kullanırken enterica ve L. monocytogenes ve agar plakaları üzerinde canlı patojenlerin onay PCR pozitif sonuçlar ile anlaşmaya vardı. Bununla birlikte, Cronobacter spp saf kültürleri izole etmek mümkün değildi. Tüm PCR pozitif örneklerden. Bu nedenle, bu patojenin PCR tabanlı (; 18/09% 50) ve sindirim kanalı (% 48; 16/33) Tek vahşi yakalanmış sinekler sistem vücut yüzeyinden yanlış pozitif gösterdi. Özel bir ortam üzerinde plakalanmıştır rastgele seçilen PCR-negatif numuneler, gıda ile taşınan patojenlerin olmadığını göstermektedir. Cronobacter spp algılamak için bu ticari PCR tabanlı sistemi kullanarak nedenle, hiçbir yanlış negatif numunelerin herhangi birinden tespit edilmiştir. S. enterica veya L monocytogenes.
Sadece patojen izole ve teyit edildi o PCR pozitif örnekler pozitif kabul edildive istatistiksel analiz dahil. vahşi yakalanmış pislik sineklerin sindirim kanalında gıda kaynaklı patojenlerin genel varlığı (df = 1, p = 0.0087 χ 2 = 6,8772) vücut yüzeyinde anlamlı olarak daha yüksek idi. Sindirim kanallarından% 22 ve toplanan yabani sineklerin vücut yüzeyleri% 8 üç gıda ile taşınan patojenlerin en az biri için (Şekil 2) pozitif çıkmıştır. Genel olarak, Cronobacter spp sıklığı. S. prevalansı daha vücut yüzeyleri veya toplanan sinekler sindirim kanallar ya da üzerinde (Fisher kesin testi p = 0.0165% 19) istatistiksel olarak daha yüksekti enterica (% 7) ve L. monositogenleri (% 4). Her bakteriyel patojen (Şekil 3 sineklerin vücut parçaları arasındaki ikili karşılaştırmalar yaparken Ancak, istatistiksel fark gözlenmemiştir; Cronobacter için Fisher'in kesin testi p = 0,1464, p = 0,1184, p = 0,6212spp., S. enterica ve L. monocytogenes, sırasıyla). Sinekler hiçbiri değerlendirilen her üç patojenler için pozitif idi. Ancak, sinekler (iki L. cuprina ve bir L. sericata) taşınan Salmonella spp üç. ve L. yüzeyde veya sindirim borusu içinde monocytogenes.
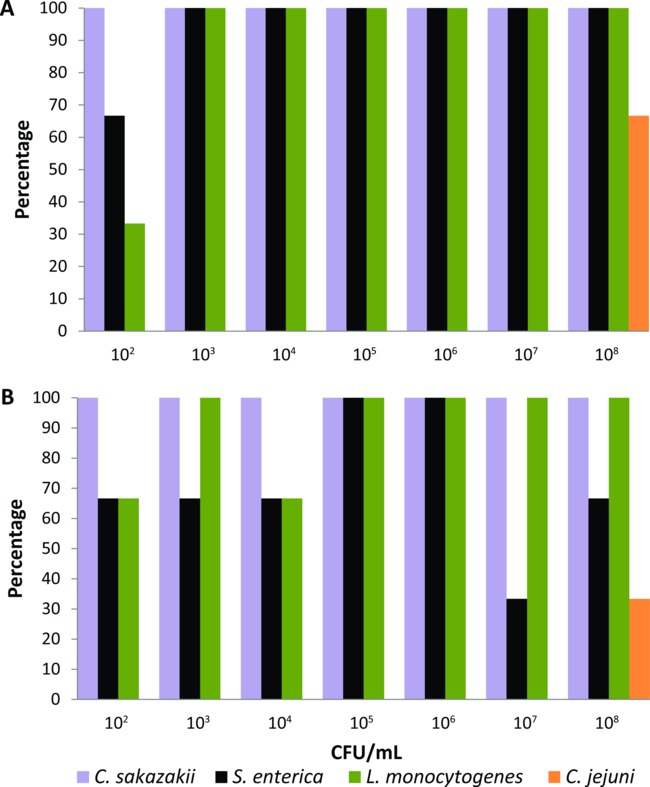
(A) 'vücut yüzeyi ve (B) farklı bakteriyel inokulum ihtiva eden sıvı gıda ile beslenen ayrı hayvanlar lab-destekli karasineklerin sindirim kanalına Cronobacter sakazakii'nin Salmonella enterica, Listeria monocytogenes, ve Campylobacter jejuni Şekil 1 tespit seviyeleri (n = Her bir bakteriyel patojen 21, n, her bir bakteri konsantrasyonu başına = 3).

Vücut yüzeyleri ve bireysel sineklerin sindirim kanalların Şekil 2. yüzdesi hedef gıda kaynaklı patojenlerin herhangi pozitif bulundu.
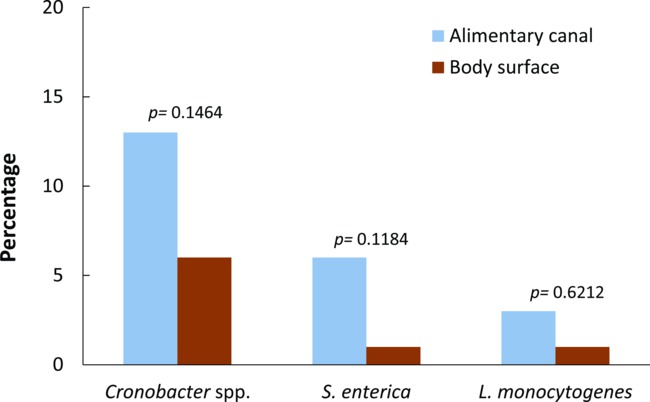
Cronobacter spp Şekil 3. prevalansı., Salmonella enterica ve vücut yüzeyinden Listeria monocytogenes ve synanthropic vahşi yakalanmış sinekler sindirim kanalı. rapor p değerleri vücut yüzeyi ve her bakteriyel patojen için sindirim kanalına arasındaki ikili karşılaştırmalar vardır (Fisher testi, p değeri <0.05 istatistiksel anlamlılık göstermektedir). Copyright © Amerikan Mikrobiyoloji Derneği, Uygulamalı Dergisi ve Çevresel Mikrobiyoloji 78 (22): 7891-902, 2012. doi: 10,1128 / AEM.02195-12.
Tartışmalar
Doğru gıdalar veya gıda ile ilgili ortamlarda 13,15 tek sinek varlığı gıda ile ilgili riski değerlendirmek için gerekli bilgileri içerir olmayabilir protokolleri büyük bir çeşitlilik kullanmış yabani böceklerin gıda kaynaklı patojenlerin tespit ettik Önceki çalışmalar, 23,24. Burada, bu standart protokol kullanılarak, tespit ve Cronobacter spp mümkün olduğunu göstermiştir. S. enterica ve L. vücut yüzeyi ve vahşi yakalanmış tek sinek sindirim kanalına monocytogenes. Böcekler hedef gıda kaynaklı patojen düşük numaraları ve diğer yerli Mikrobiyota 25,26 yüksek sayıda taşıyabilir, çünkü bu protokol hedef gıda kaynaklı patojen tespit hassasiyetini artırmak için belirli bir kültür ortamında örneklerin birincil (ve bazen ikincil) zenginleştirme gerektirir . PCR bazlı tespit sistemi ile ilgili sonuçlar deterjanları için (yaklaşık olarak 30 saat içinde elde edildiCronobacter spp ölü m. ve S. enterica) ve ilk olarak numune işleme sonrası L. monocytogenes) saptanması için 48 st (. Böylece, bu protokol, güvenilir hem hızlı ve gıda ile taşınan patojenlerin varlığı için bir sinek taranması için yeterince hassastır.
Canlı bakteri PCR pozitif sonuçların doğrulanması ve izolasyon bir çok laboratuarda standart dışı çalışma prosedürün bir parçasıdır. Buna ek olarak, epidemiyolojisi amacıyla PCR-pozitif numunelerinin saf bakteri kültürleri daha onaylamak ve biyokimyasal, bağışıklık veya genetik yöntemlerle gıda kaynaklı patojen serotipine gerekmektedir. Hiçbir yanlış pozitif gözlenmiş olmasına rağmen S. tespit ettiğinde enterica ve L. Tek vahşi yakalanmış sinekler vücut bölgelerinden monocytogenes, bu protokolü kullanarak, biz Cronobacter spp yanlış pozitif% 50 oranına kadar buldum. Bu durum, cins Cronobact için PCR bazlı tespit sistemier sinekler tarafından taşınan son derece karmaşık Mikrobiyota arasında mevcut diğer Enterobacteriaceae ile çapraz-reaksiyona girebilir. Böylece, izolasyon ve PCR-pozitif örneklerden cins Cronobacter saf kolonilerin arıtma değerlendirilen diğer patojenlerin daha seçici kaplama gerektirir.
Bu protokol, öncelikle Cronobacter spp varlığı için bireysel vahşi yakalanmış sinekler taramak için standardize edilmiştir. S. enterica ve L. ticari bir PCR bazlı tespit sistemi kullanılarak monocytogenes. H7 (ya E. coli O157 kullanarak: H7 MP standart deney seti veya E. coli Ancak, bu protokol de kolayca enterohemorrhagic E. coli O157 gibi diğer gıda kaynaklı patojenlerin varlığı için tek sinek vücut parçaları taramak için uyarlandı O157: Gerçek zamanlı tahlil kiti H7) ve shiga-toksijenik E. yayından coli (STEC) grubu (gerçek-zamanlı STEC paketi kullanarak), elde duyarlılıkları>% 80 (ed verileri). Ayrıca, bu protokol potansiyel hastalıklar (hamamböceği ve karıncalar) vektörler bilinen diğer böceklerden gıda kaynaklı patojenlerin tespit etmek için adapte edilebilir, ancak bu alanda daha fazla araştırmaya ihtiyaç vardır.
Gıda kaynaklı hastalık salgını soruşturma çok dinamik ve özel durum ve yerel olmak ortam 12,27 araştırıldı göre değişebilir bir çok adım süreci içermektedir. Gelecek hastalıkların önlenmesi ile anında halk sağlığı koruma sağlamak çünkü bu araştırmalar önemlidir. Ayrıca, bu araştırmalar gıda kaynaklı mikroorganizmalar yayılır hangi yeni mekanizmaları aydınlatmak ve araştırma 28 için yeni alanlara yol önemli soruları gündeme olabilir. Soruşturma teknikleri yanı sıra, standart, hızlı ve hassas protokoller bireysel böceklerden gıda kaynaklı patojenlerin tespiti için gereklidir. Bu standart bir protokol w, aseptik sinek gibi böcekler toplamak için fırsat açarhich bir çevre örnekleme programının bir parçası olarak, gıda kaynaklı patojen bakteri vektör olabilir. Bu elde edilebilir epidemiyolojik bilgiler böcekler tarafından gıda kaynaklı patojenlerin bulaşma mekanizmaları doğru bir resim yapımında kullanılmak olacaktır (yani, pozlama süresi: açılış sinekler karşı iniş tuvaletimi ve regurgitating bir sinek).
Hayır sadece uygun sistemi yoluyla Son olarak, burada açıklanan ticari PCR-tabanlı algılama sistemi kullanmak için pratik ve PCR ve cins düzeyinde amplikonunu görselleştirme kolaylaştırır olsa, öyle. zenginleştirilmiş örneklerden lizat alternatif olarak kamuya açık olabildiği için, türe özgü primer çiftleri kullanılarak gıda kaynaklı Patojenlere taranması için kullanılabilir. Bununla birlikte, algılama hassasiyeti, kullanmadan önce gösterilmelidir.
Açıklamalar
The use of specified instrumentation is not an endorsement by the U.S. Food and Drug Administration. The authors certify that there is no conflict of interest with any financial organization regarding the material discussed in this article.
Teşekkürler
Thanks to Ben D. Tall, Yi Chen, and Thomas Hammak from the U.S. Food and Drug Administration (FDA), Center for Food Safety and Applied Nutrition (CFSAN) for critically reviewing the manuscript. The authors also thank Hannah Lee (research internship program, Joint Institute for Food Safety and Applied Nutrition (JIFSAN), University of Maryland) for laboratory assistance and David Weingaertner (FDA, CFSAN) for preparing the figure of the schematic overview shown in the video.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
Referanslar
- Zurek, L., Gorham, J. R., Voeller, J. G. . Wiley Handbook of Science and Technology for Homeland Security. , 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. . Houseflies and how they spread disease. , (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, 269-296 (1991).
- Greenberg, B. . Flies and disease, Vol I. Ecology, classification and biotic associations. , (1971).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır