需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
反应执行使用连续流处理的实时监控:3 - 乙酰基香豆素的制备为例
摘要
实时监控允许使用连续流动处理进行的反应的快速优化。这里的3-乙酰基香豆素,制剂被用作示例。用于进行原位拉曼监测装置进行说明,因为都是以优化反应所需的步骤。
摘要
通过使用内嵌的监测,可以优化以简单和快速的方式使用连续流动处理进行的反应。另外,也可以确保在一段时间一致的产品质量使用这种技术。我们在这里显示了如何用拉曼光谱仪接口的市售流动单元。拉曼流动池被放置在回压调节器后,这意味着它可以在大气压力下操作。此外,该产品流通过管道进入流动池之前的长度的事实意味着该材料是在室温下。重要的是,该光谱等温条件下获得的,因为拉曼信号强度取决于温度。具有组装的装置中,我们然后显示如何监视一个化学反应中,哌啶催化的合成将3-乙酰基香豆素从水杨醛和乙酰乙酸乙酯被用作一个例子。该反应可以在一定范围的流率的执行Ð的温度下, 在现场监测工具被用于简单而容易地优化条件。
引言
通过采用连续流动加工,化学家们发现他们可以执行一系列的化学反应,安全,高效,轻松,1,2。其结果是,流动化学设备正在成为在学术机构同时运行在工业设置的反应以及研究实验室的整工具。各种各样的合成化学转化已进行了在流反应器3,4。在选择的情况下,反应不以间歇工作已显示出平滑连续流动条件下5继续。对于这两种反应优化和质量控制,串联反应监测与流处理的掺入提供显著优点。在在线监测提供连续的分析与实时响应,以实际样品条件。这是更快的,并且在一些情况下,比同类的离线技术更可靠。若干的在线分析技术已接口和f低电抗器7。实施例包括红外8,9,紫外可见10,11,12,13核磁共振,拉曼光谱14,15,和质谱16,17。
我们的研究小组接口拉曼光谱仪用科学的微波单元18。使用此,一系列的反应已经从监测都有了质19和定量的20立场。在此基础上的成功,我们最近接口我们的拉曼光谱仪与我们的连续流单元中的一个,并采用它用于线反应的一个数字键医药相关的有机转化的监视。21在每种情况下,有可能监视反应以及在一个实例中,由校准曲线的装置,我们可以判断从拉曼光谱数据产品转化。在这里,我们介绍如何设置设备,并用它来监视反应。我们使用的哌啶催化的合成的3 - 交流etylcoumarin(1)从水杨醛与乙酰乙酸乙酯(图1)作为此处的模型反应。
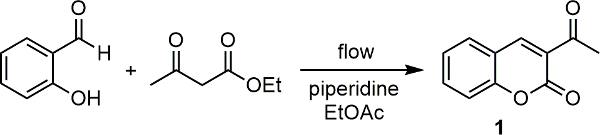
图1.碱催化水杨醛与乙酰乙酸乙酯的缩合反应,得到3-乙酰基香豆素(1)。 请点击此处查看该图的放大版本。
研究方案
1.查找反应监测合适信号。
- 获得的拉曼光谱对所有的起始原料和产物。
- 叠加光谱并确定一个强烈频带是唯一的产物。
- 使用该拉曼频带以监测反应的进度。在1608厘米的带-1在这种情况下被选中。
2.设置流动池
- 获得合适的流动池。这里使用一个具有以下尺寸:宽度为6.5毫米,20毫米的高度,并且为5毫米(图2A)的路径长度。
- 将流动池的容器中,提供了一个自由的环境光的环境中。
- 连接管道到流动池的入口和出口(在此情况下1毫米的ID的PFA管)。
3.接口拉曼光谱仪的流动池
- 获得合适的拉曼光谱仪与柔性光学组件,其可以放置在C失去接近流通池。
- 通过在含有流动池装置(图2B)的框合适尺寸的孔放置光学组件。
- 光学组件滑动,直到它触及流动池,然后将它拉回来留下〜2毫米的间隙。
- 填用100%丙酮流动池。
- 打开拉曼光谱仪,并获得谱在连续扫描模式。
- 通过一次轻轻移动所述光管的一部分聚焦激光。保持移动光管,直到信号处于其最大的强度和峰尖锐且明显。

图2.(A)流动池,并用(B)拉曼接口。 请点击此处查看大图已经rsion这个数字。
4.准备试剂和溶剂溶液
- 添加水杨醛(六点一〇六克,50毫摩尔,1当量)和乙酰乙酸乙酯(6.507克,50毫摩尔,1当量)到50ml容量瓶中。
- 加入乙酸乙酯至50毫升的总体积,然后彻底混合内容。
- 转移10ml的等分试样原液含有磁性搅拌棒的20ml玻璃小瓶中。标签此瓶"试剂"。
- 在100毫升的瓶代替90毫升乙酸乙酯。标签这瓶"溶剂"。在100毫升一瓶的地方90毫升丙酮。标签这瓶"溶剂拦截"。
5.准备流动设备的
- 确保该流动单元具有至少两个泵和标签他们"P1"和"P2"。确定每个泵溶剂和试剂入口线。将在"收"和"废物"生产线出口线路分成两个我,ndividual100毫升瓶标有"产品"和"浪费"分别。
- 作为反应器,用10毫升容量PFA线圈能够被加热的。
- 管排出P1连接到PFA反应器盘管的入口。
- 电感线圈后,安装一个三端口聚醚醚酮(PEEK)发球混合器。
- 管排出的P2连接到T型混合器,从反应器中线圈的出口管道180°。一管件连接到三通混频器的第三端口。在此管的另一端放置一个背压调节器。
- 从回压调节到流通池的输入输出端连接的线。从流动池的输出线连接到"废/收集"开关。
- 素的溶剂线为P1和P2以及为P1中的试剂线用溶剂。从溶剂瓶的试剂瓶移动试剂线P1上。
- 利用P1,通过反应器通过乙酸乙酯线圈在2毫升/分钟,直到它被充满。至P2通过丙酮以2ml /分的流速分钟2分钟。
- 调节溶剂的流速为P1和P2,以1毫升/分钟。设置回压调节到7巴的压力下。设置在反应器线圈温度到所需的温度。
- 仔细检查设备被配置为图 3所示的原理图。
- 一旦系统达到恒定的温度和压力,检查是否漏水,然后运行反应。
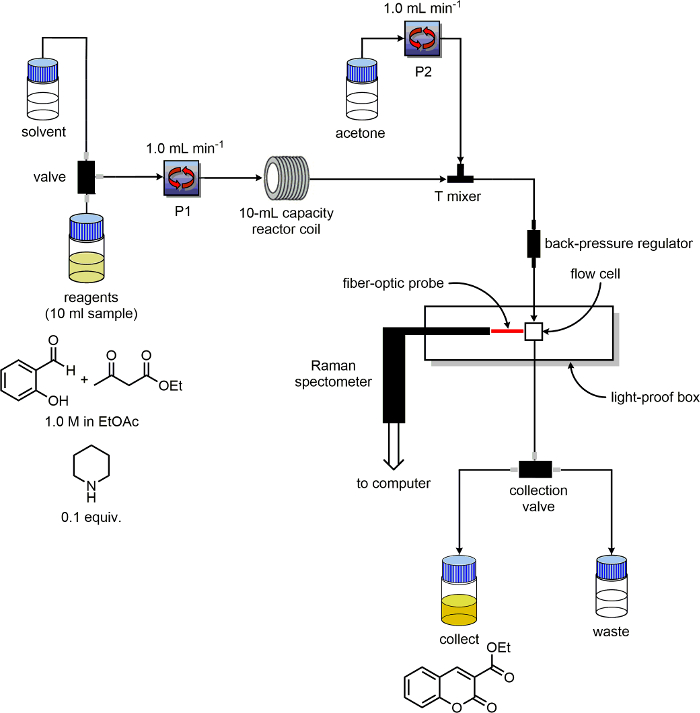
图3.原理用于反应监测实验设备的配置。 请点击此处查看该图的放大版本。
6.监控反应
- 德的乙酸乙酯/丙酮溶剂体系EA后台扫描因为它通过流动池。这将从所有后续的扫描自动扣除。
- 配置分光计采取扫描每15秒(在此情况下,拉曼光谱仪被设定为10秒的积分时间,棚车= 3,平均值= 1)。
- 注射哌啶(0.05毫升,0.05毫摩尔,0.1当量)一次全部进入标有"试剂"的玻璃小瓶。
- 从后充分混合,开关P1"溶剂"到"试剂"将退出流"收集"。
- 当所有材料完全加载从"试剂",切换P1回"溶剂"。继续通过电感线圈另外30分钟流淌的溶剂。一旦超过这个时间,关掉暖气。
- 转泵P1和P2时关闭反应器线圈温度已冷却至低于50℃。
7.分析数据
- 在拉曼光谱仪的数据导出到电子表格和情节拉曼强度1608厘米-1主场迎战时间。
- 为了优化的条件下,进行跨越多个流速和反应器温度的以迭代的方式进行反应。
- 叠加图拉曼强度的1608厘米-1主场迎战时间。
注:更高的拉曼强度与较高的产品转化。
8.运行反应使用优化的条件
- 有筛选各种条件(不同的流速/反应器温度),运行使用优化的条件下,得到最高的产品转化的反应。
9.隔离产品
- 取产物烧瓶的内容,并将其倒入含有100毫升冰水和20毫升的2M的HCl的烧杯中。
- 冲洗产物烧瓶用乙酸乙酯(2ml)中,并转移到烧杯最小量。
- 搅拌冰冷混合物直到所有的冰完全融化。
- 设置一个过滤系统,具有赫希漏斗,侧臂烧瓶中,橡胶圈和橡胶真空管的长度。
- 过滤所得沉淀在真空下,冲洗用冷乙醚(10ml)中,并允许它在热灯下(2-3小时)或干燥O / N在真空下干燥。
- 确认产品的通过 1 H核磁共振(NMR)波谱使用为 CDCl 3溶剂的身份。为500MHz的NMR波谱仪,是3-乙酰基香豆素的1 H NMR数据如下:δ= 2.73(S,3H)7.31 - 7.40(米,2H)7.65(DDD,J = 7.53,4.37,2.60 Hz的,2H)8.51(S,1H)ppm的,13 C NMR数据;δ= 30.84(CH 3)117.00(CH)118.56(C)的124.86(CH)125.27(CH)130.51(CH)134.68(C)的147.74 (CH),155.64(C)159.52(C)195.77(C)PPM。
结果
连续流动制备3-乙酰基香豆素被选定为在在线监测一个代表反应。在分批,反应进行很好,使用乙酸乙酯作为溶剂时。然而,产物(1)是不完全溶解在RT。为了防止回压调节器的潜在的堵塞,以及减轻在流动池这会扰乱信号采集具有固体颗粒的风险,我们使用了我们先前开发针对此等反应22技术。我们将反应线圈用丙酮后截获产品流以溶解产物,并允许它穿过流动池和背压调?...
讨论
在该拉曼光谱仪可以与流动单元被接口易于使这一直列技术反应监测有价值。一些反应变量可以探测在加速方式,允许用户在优化的反应条件下使用脱机方法时,速度比到达。本文所述也技术应用允许监视的副产物的形成的,假设一个合适的带都可以找到。条件可筛选和选择,这使得既为最高的转换产物,并还杂质的最低量。反应的定量监测也是可能的。由于拉曼信号强度与浓度成正比,校?...
披露声明
The authors have nothing to disclose.
致谢
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
材料
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
参考文献
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。