È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Monitoraggio in tempo reale delle reazioni eseguita utilizzando la lavorazione a flusso continuo: La preparazione di 3-Acetylcoumarin come un esempio
In questo articolo
Riepilogo
Monitoraggio in tempo reale consente la rapida ottimizzazione delle reazioni eseguite utilizzando l'elaborazione a flusso continuo. Qui la preparazione di 3-acetylcoumarin viene utilizzato come esempio. L'apparecchiatura per l'esecuzione in-situ monitoraggio Raman è descritto, come lo sono i passaggi necessari per ottimizzare la reazione.
Abstract
Utilizzando il monitoraggio in linea, è possibile ottimizzare le reazioni eseguite utilizzando l'elaborazione a flusso continuo in modo semplice e rapido. E 'anche possibile per garantire la qualità del prodotto costante nel tempo utilizzando questa tecnica. Siamo qui mostriamo come interfacciare una unità di flusso disponibile in commercio con uno spettrometro Raman. La cella di flusso Raman posto dopo il regolatore di contropressione, che significa che può essere azionato a pressione atmosferica. Inoltre, il fatto che il flusso di prodotto passa attraverso un tratto di tubo prima di entrare nella cella di flusso significa che il materiale è a RT. È importante che gli spettri sono acquisiti in condizioni isoterme poiché intensità di segnale Raman dipende dalla temperatura. Dopo aver assemblato l'apparato, abbiamo poi mostrato come monitorare una reazione chimica, la sintesi piperidina-catalizzata di 3 acetylcoumarin da salicilaldeide e acetoacetato di etile viene utilizzato come un esempio. La reazione può essere eseguita su una gamma di PORTATE untemperature d, lo strumento di monitoraggio in situ utilizzati per ottimizzare le condizioni in modo semplice e veloce.
Introduzione
Utilizzando lavorazione a flusso continuo, chimici stanno scoprendo che possono eseguire una serie di reazioni chimiche in modo sicuro, efficace, e con facilità 1,2. Come risultato, attrezzature chimica flusso sta diventando uno strumento per l'esecuzione di reazioni integrante sia in ambienti industriali e laboratori di ricerca in istituti accademici. Un'ampia varietà di trasformazioni chimica sintetica sono state eseguite in reattori a flusso 3,4. In casi selezionati, reazioni che non funzionano in modalità batch hanno dimostrato di procedere senza intoppi in condizioni di flusso continuo 5. Sia per l'ottimizzazione di reazione e controllo di qualità, l'incorporazione di monitoraggio reazione in linea con l'elaborazione di flusso offre vantaggi significativi. In linea di monitoraggio fornisce un'analisi continuo con risposta in tempo reale alle condizioni reali del campione. Questo è più veloce e, in alcuni casi, più affidabile rispetto ai tradizionali tecniche off-line. Un certo numero di tecniche analitiche in linea è stato interfacciato con freattori bassi 7. Esempi includono infrarossi 8,9, UV-visibile 10,11, 12,13 NMR, spettroscopia Raman 14,15, 16,17 e spettrometria di massa.
Il nostro gruppo di ricerca ha interfacciato uno spettrometro Raman con un gruppo a microonde scientifica 18. Usando questo, una serie di reazioni sono state monitorate da sia qualitativa e quantitativa 20 19 punto di vista. Questo successo, abbiamo recentemente interfacciato nostro spettrometro Raman con una delle nostre unità a flusso continuo e impiegato per il monitoraggio reazione di un certo numero di importanti trasformazioni organiche medicamentoso rilevanti in linea. 21 In ogni caso è stato possibile monitorare la reazioni e anche in un esempio, per mezzo di una curva di taratura, si potrebbe determinare la conversione del prodotto da dati spettrali Raman. Nel Qui si descrive come impostare il dispositivo e utilizzarlo per monitorare le reazioni. Usiamo la sintesi piperidina-catalizzata di 3-acetylcoumarin (1) da salicylaldehyde con acetoacetato di etile (Figura 1) come la reazione del modello qui.
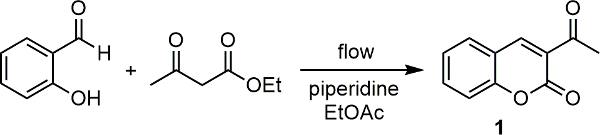
Figura 1. Base catalizzata reazione di condensazione tra salicilaldeide e acetoacetato di etile per dare 3 acetylcoumarin (1). Cliccate qui per vedere una versione più grande di questa figura.
Protocollo
1. Trovare Segnali adatto per il monitoraggio di reazione
- Ottenere spettri Raman per tutte le materie prime e il prodotto.
- Sovrapposizione spettri e identificare una banda di intenso che è unico per il prodotto.
- Utilizzare questa band Raman per monitorare l'andamento della reazione. Una banda a 1.608 cm -1 è stato selezionato in questo caso.
2. Impostare la cella di flusso
- Ottenere una cella di flusso adatto. Qui usare uno con le seguenti dimensioni: larghezza di 6,5 mm, altezza di 20 mm e una lunghezza di percorso di 5 mm (Figura 2A).
- Posizionare la cella di flusso in un contenitore che fornisce un ambiente privo di luce ambientale.
- Collegare il tubo di ingresso e uscita della cella di flusso (in questo caso la tubazione ID PFA 1 mm).
3. Interfaccia Raman spettrometro con la cella di flusso
- Ottenere uno spettrometro Raman adeguato con un gruppo ottico flessibile, che può essere posizionato in cperdere vicinanza alla cella di flusso.
- Posizionare il gruppo ottico attraverso un'apertura di dimensioni adeguate nella scatola contenente il gruppo della cella di flusso (Figura 2B).
- Far scorrere il gruppo ottico fino a toccare la cella di flusso e poi tirare indietro lasciando uno spazio di ~ 2 mm.
- Riempire la cella di flusso con il 100% di acetone.
- Accendere il spettrometro Raman e acquisire spettri in modo continuo a scansione.
- Mettere a fuoco il laser muovendo delicatamente il tubo di luce una frazione alla volta. Continuate a muovervi il tubo di luce fino a quando il segnale è al suo massimo di intensità e le cime sono nitide e ben definite.

Figura 2. (A) Portata cellulare e l'interfaccia (B) Raman usato. Cliccate qui per vedere una più grande version di questa figura.
4. Preparare reagente e solventi Soluzioni
- Aggiungere salicilaldeide (6,106 g, 50 mmol, 1 equiv) e acetoacetato di etile (6,507 g, 50 mmol, 1 equiv) in un pallone tarato da 50 ml.
- Aggiungere acetato di etile per un volume totale di 50 ml e poi mescolare il contenuto.
- Trasferire un'aliquota da 10 ml della soluzione madre di un flaconcino di vetro da 20 ml contenente una ancoretta magnetica. Etichettare questa fiala "reagente".
- In un flacone 100 ml posto 90 ml di acetato di etile. Etichettare questa bottiglia "solvente". In un flacone 100 ml posto 90 ml di acetone. Etichettare questa bottiglia "intercettare solvente".
5. Preparare il flusso di apparecchi
- Assicurarsi che l'unità di flusso ha almeno due pompe e li etichetta "P1" e "P2". Identificare solventi e reagenti linee di ingresso per ogni pompa. Posizionare le linee di uscita dalle linee e "Collect", "rifiuti" in due individual 100 ml bottiglie etichettate "prodotto" e "rifiuto", rispettivamente.
- Come un reattore, utilizzare 10 ml PFA bobina poter essere riscaldato.
- Collegare il tubo uscita P1 all'ingresso della bobina reattore PFA.
- Installare una tre porte chetone polietere etere (PEEK) tee-mixer dopo la bobina del reattore.
- Collegare il tubo di uscita P2 al tee-mixer, a 180 ° dal tubo di uscita della bobina del reattore. Collegare un pezzo di tubo alla terza porta del Tee-mixer. Sull'altra estremità di questo tubo inserire un regolatore di contropressione.
- Collegare una linea dall'uscita del regolatore di contropressione all'ingresso della cella di flusso. Collegare una linea dall'uscita della cella di flusso allo switch "rifiuti / raccogliere".
- Prime le linee del solvente sia per P1 e P2 e la linea del reagente per P1 con solvente. Spostare la linea del reagente per P1 dalla bottiglia di solvente nel flacone.
- Utilizzando P1, passare acetato di etile attraverso il reattorecoil a 2 ml / min fino a riempirlo. Passare acetone attraverso P2 ad un flusso di 2 ml / min per 2 min.
- Regolare le portate solvente sia per P1 e P2 di 1 ml / min. Impostare il regolatore di contropressione per una pressione di 7 bar. Impostare la temperatura della bobina del reattore alla temperatura desiderata.
- Doppio controllare l'apparecchio è configurato come mostrato nello schema di figura 3.
- Una volta che il sistema raggiunge temperatura e pressione costante, controllare eventuali perdite e quindi eseguire la reazione.
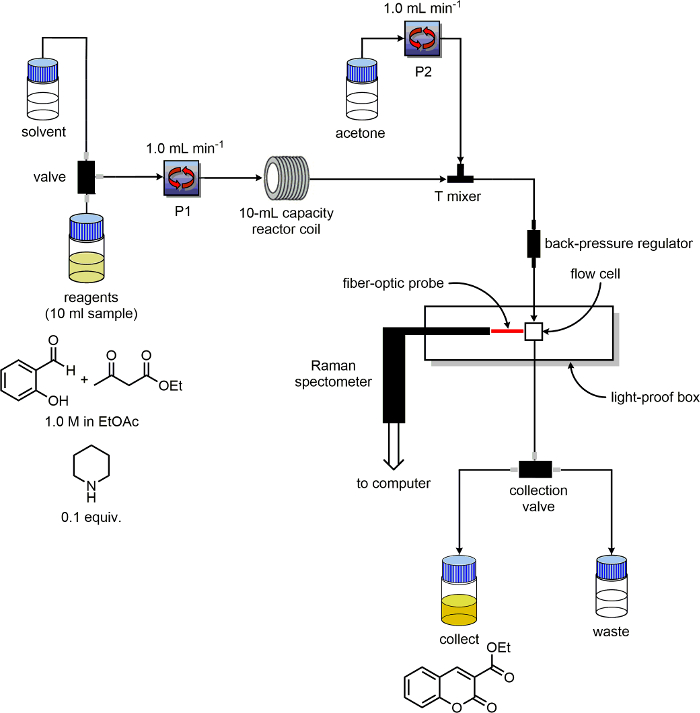
Figura 3. Schema della configurazione attrezzature utilizzate per gli esperimenti di controllo reazione. Cliccate qui per vedere una versione più grande di questa figura.
6. Monitorare la reazione
- Taksfondo ea scansione del sistema solvente acetato di etile / acetone come è passato attraverso la cella di flusso. Questo sarà automaticamente sottratto da tutte le scansioni successive.
- Configurare lo spettrometro di prendere scansioni ogni 15 secondi (in questo caso lo spettrometro Raman stato impostato un tempo di integrazione 10 sec, vagone = 3, e media = 1).
- Iniettare piperidina (0,05 ml, 0,05 mmol, 0,1 equiv) tutti in una volta nel flacone di vetro con l'etichetta "reagente".
- Dopo aver accuratamente la miscelazione, interruttore P1 da "solvente" a "reagente". Impostare il flusso di uscita di "raccogliere".
- Quando tutto il materiale è completamente caricata, passare da P1 "reagente" torna a "solvente." Continua scorre solvente attraverso la bobina reattore per altri 30 minuti. Una volta trascorso questo tempo, spegnere il riscaldamento.
- Pompe turno P1 e P2 quando la temperatura della batteria del reattore è raffreddato al di sotto di 50 ° C.
7. Analizzare i dati
- Esportare i dati dello spettrometro Raman a un foglio di calcolo e la trama intensità Raman a 1.608 centimetri -1 vs. orario.
- Per ottimizzare le condizioni, effettuare la reazione in una serie di portate e temperature del reattore in modo iterativo.
- Trame sovrapposizione di intensità Raman a 1.608 centimetri -1 vs. orario.
Nota: Più alta intensità Raman correla con la conversione del prodotto superiore.
8. Eseguire la reazione Usando condizioni ottimizzate
- Avere varie condizioni schermati (diverse le portate / temperature del reattore), eseguire la reazione utilizzando le condizioni ottimali per permettere la conversione del prodotto più alto.
9. Isolare il prodotto
- Prendere il contenuto del pallone prodotto e versarlo in un becker contenente 100 ml di ghiaccio e 20 ml di 2 M HCl.
- Risciacquare la beuta prodotto con una quantità minima di acetato di etile (2 ml) e trasferimento al becher.
- Mescolate il composto di ghiacciofino a quando tutto il ghiaccio è completamente sciolto.
- Impostare un sistema di filtrazione con un imbuto Hirsch, beuta braccio laterale, guarnizione di gomma e una lunghezza di tubo a vuoto in gomma.
- Filtrare il precipitato sotto vuoto, lavare con etere etilico freddo (10 ml) e lasciarlo asciugare sotto una lampada di calore (2-3 ore) e O secco / N sotto vuoto.
- Confermare l'identità del prodotto da 1 H risonanza magnetica (NMR) nucleare usando CDCl 3 come solvente. Per un 500 MHz spettrometro NMR, i 1 dati H NMR di 3 acetylcoumarin è il seguente: δ = 2.73 (s, 3 H) 7.31 - 7,40 (m, 2 H) 7.65 (ddd, J = 7.53, 4.37, 2.60 Hz , 2 H) 8.51 (s, 1 H) ppm, 13 C NMR dati: δ = 30.84 (CH 3) 117.00 (CH) 118.56 (C) 124.86 (CH) 125.27 (CH) 130.51 (CH) 134.68 (C) 147.74 (CH) 155.64 (C) 159.52 (C) 195.77 (C) ppm.
Risultati
La preparazione flusso continuo di 3-acetylcoumarin stato scelto come rappresentante reazione per il monitoraggio in linea. In batch, la reazione procede bene usando acetato di etile come solvente. Tuttavia, il prodotto (1) non è completamente solubile a RT. Per evitare il potenziale intasamento del regolatore di contropressione, nonché ridurre il rischio di avere particelle solide nella cella di flusso che perturbare acquisizione del segnale, abbiamo utilizzato una tecnica abbiamo sviluppato in prece...
Discussione
La facilità con cui lo spettrometro Raman può essere interfacciato con l'unità di flusso rende questa tecnica in linea prezioso per il monitoraggio di reazione. Un certo numero di variabili di reazione può essere sondato in modo accelerato, permettendo all'utente di arrivare a condizioni di reazione più veloce rispetto ottimizzate quando si utilizzano metodi fuori linea. Applicazione delle tecniche descritte qui anche consente il monitoraggio della formazione di prodotti collaterali, assumendo una banda ada...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
Materiali
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
Riferimenti
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon