Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Echtzeit-Überwachung von Reaktionen durchgeführt mit Continuous-Flow-Verarbeitung: Die Herstellung von 3-Acetylcoumarin als Beispiel
In diesem Artikel
Zusammenfassung
Echtzeit-Überwachung ermöglicht eine schnelle Optimierung der Reaktionen unter Verwendung von Durchlaufverarbeitung. Hier wird die Herstellung von 3-acetylcoumarin wird als Beispiel verwendet. Die Vorrichtung zur Durchführung in situ Raman Überwachung beschrieben, da die erforderlich ist, um die Reaktion zu optimieren Schritte sind.
Zusammenfassung
Mithilfe Inline-Überwachung, ist es möglich, Reaktionen unter Verwendung von Durchlaufverarbeitung in einer einfachen und schnellen Art und Weise zu optimieren. Es ist auch möglich, eine konstante Produktqualität über die Zeit sicherzustellen, mit dieser Technik. Wir hier zeigen, wie man einen handelsüblichen Durchflusseinheit mit einem Raman-Spektrometer-Schnittstelle. Die Raman Durchflußzelle nach der Gegendruckregler angebracht, was bedeutet, dass es bei Atmosphärendruck betrieben werden. Darüber hinaus ist die Tatsache, dass der Produktstrom durch eine Rohrlänge vor dem Eintritt in die Durchflusszelle durchläuft, dass das Material bei Raumtemperatur ist. Es ist wichtig, dass die Spektren werden unter isothermen Bedingungen erworben da Raman-Signalintensität ist temperaturabhängig. Nachdem die Vorrichtung zusammengebaut, dann zeigen wir, wie man eine chemische Reaktion zu überwachen, wobei das Piperidin-katalysierte Synthese von 3-acetylcoumarin aus Salicylaldehyd und Acetessigsäureethylester als Beispiel verwendet. Die Reaktion kann über einen Bereich durchgeführt werden, von Durchflussmengen eind Temperaturen, die in situ-Monitoring-Tool verwendet werden, um Bedingungen einfach und leicht zu optimieren.
Einleitung
Durch Dauerstrom-Verarbeitung werden Chemiker finden, dass sie eine Reihe von chemischen Reaktionen, sicher, effektiv und mit Leichtigkeit 1,2 ausführen kann. Als Ergebnis wird Strömungschemie Geräte zu einem festen Instrument für die laufende Reaktionen sowohl im industriellen Umfeld als auch Forschungslabors in akademischen Institutionen. Eine Vielzahl von Synthesechemie Transformationen wurden in Durchflußreaktoren 3,4 durchgeführt. In ausgewählten Fällen Wirkungen, die nicht in Stapel funktionieren wurde gezeigt, glatt unter kontinuierlichen Flussbedingungen 5 fortzufahren. Für beide Reaktionsoptimierung und Qualitätskontrolle, Einbau von In-Line-Reaktionsüberwachung mit Flow-Verarbeitung bietet signifikante Vorteile. In-line-Überwachung bietet kontinuierliche Analyse mit Echtzeit-Reaktion auf tatsächliche Probenbedingungen. Dies ist schneller, und in einigen Fällen viel zuverlässiger als vergleichbare off-line Verfahren. Eine Reihe von in-line analytische Techniken wurden mit f angeschlossen wordenNieder Reaktoren 7. Beispiele umfassen 8,9-Infrarot, UV-VIS 10,11 NMR 12,13, 14,15 Raman-Spektroskopie und Massenspektrometrie 16,17.
Unsere Arbeitsgruppe hat ein Raman-Spektrometer mit einem wissenschaftlichen Mikrowelleneinheit 18 angeschlossen. Mit diesem, haben eine Reihe von Reaktionen, sowohl aus qualitativen und quantitativen 20 19 Standpunkt überwacht. Aufbauend auf diesem Erfolg haben wir vor kurzem eine Schnittstelle unserer Raman-Spektrometer mit einem unserer Durchlaufeinheiten und verwendet es für die Inline-Reaktionsüberwachung einer Reihe von Schlüssel medizinisch-relevanten organischen Transformationen. 21 In jedem Fall kann der Monitor Reaktionen und auch bei einem Beispiel mit Hilfe einer Eichkurve, könnten wir die Produktumwandlung von Raman-Spektraldaten zu bestimmen. In Hier beschreiben wir, wie Sie das Gerät und es verwenden, um Reaktionen zu überwachen. Wir verwenden den Piperidin-katalysierte Synthese von 3-acetylcoumarin (1) von Salicylaldehyd mit Ethylacetoacetat (Abbildung 1) als Modellreaktion hier.
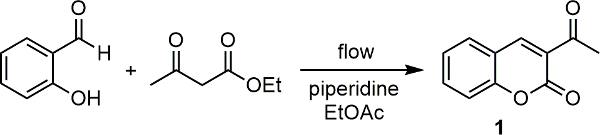
Abbildung 1 Basis katalysierten Kondensationsreaktion zwischen Salicylaldehyd und Ethylacetoacetat, um 3-acetylcoumarin ergeben (1). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protokoll
1. Finden Sie geeignete Signale für Reaction Monitoring
- Erhalten Ramanspektren für alle Ausgangsmaterialien und dem Produkt.
- Overlay-Spektren und eine intensive Bande, die spezifisch für das Produkt zu identifizieren.
- Verwenden Sie diese Raman-Bande, um den Fortschritt der Reaktion zu überwachen. Eine Bande bei 1608 cm -1 wurde in diesem Fall ausgewählt.
2. Richten Sie die Durchflusszelle Set
- Besorgen Sie sich eine geeignete Durchflusszelle. Hier verwenden eine mit den Abmessungen: Breite 6,5 mm, Höhe 20 mm und einer Schichtdicke von 5 mm (Abbildung 2A).
- Setzen Sie die Durchflusszelle in einem Behälter, die eine Umgebung frei von Umgebungslicht bietet.
- Schlauch mit dem Einlass und dem Auslass der Durchflusszelle zu verbinden (in diesem Fall 1 mm ID PFA-Schlauch).
3. Interface Das Raman-Spektrometer mit der Durchflusszelle
- Besorgen Sie sich eine geeignete Raman-Spektrometer mit einem flexiblen optischen Anordnung, die in C platziert werden könnenverlieren die Nähe zu der Durchflusszelle.
- Legen Sie das optische Anordnung durch eine ausreichend große Öffnung in der Box mit dem Durchflußzellenanordnung (2B).
- Schieben Sie das optische Baugruppe, bis sie die Durchflusszelle berührt und ziehen Sie sie dann wieder, wobei ein Spalt von ca. 2 mm.
- Füllen Sie die Durchflusszelle mit 100% Aceton.
- Schalten Sie das Raman-Spektrometer und erwerben Spektren im Dauer-Scan-Modus.
- Fokus des Lasers durch leichtes Bewegen des Lichtleiters einen Bruchteil zu einer Zeit. In Bewegung bleiben die Lichtleitung, bis das Signal am größten Intensität und die Spitzen sind scharf und gut definiert.

Abbildung 2. (A) Durchflusszelle und (B) verwendet Raman-Schnittstelle. Bitte klicken Sie hier, um eine größere version dieser Figur.
4. Bereiten Reagenz und Lösungsmittel-Lösungen
- Hinzufügen Salicylaldehyd (6,106 g, 50 mmol, 1 Äquivalent) und Ethylacetoacetat (6,507 g, 50 mmol, 1 Äquivalent) in einen 50 ml-Meßkolben.
- In Ethylacetat auf ein Gesamtvolumen von 50 ml und dann den Inhalt gründlich mischen.
- Übertragen einer 10 ml-Aliquot der Stammlösung in einen 20 ml-Glasgefäß, das ein Magnetrührstab. Beschriften Sie diese Fläschchen "Reagenz".
- In einem 100-ml-Flasche statt 90 ml Essigester. Beschriften Sie diese Flasche "Lösungsmittel". In einem 100-ml-Flasche statt 90 ml Aceton. Beschriften Sie diese Flasche "Lösungsmittel abfangen".
5. Bereiten Sie die Durchlaufvorrichtung
- Stellen Sie sicher, dass die Durchflusseinheit zumindest zwei Pumpen und beschriften "P1" und "P2". Identifizieren Lösungsmittel und Reagenz Einlassleitungen für jede Pumpe. Legen Sie die Ausfahrt Leitungen von den "sammeln" und Linien "Abfall" in zwei iNDIVIDUELLE 100 ml-Flaschen mit der Bezeichnung "Produkt" und "Abfälle" bezeichnet.
- Als Reaktor, mit einem 10-ml-PFA Spule geeignet ist, erhitzt.
- Verbinden des Rohres austretende P1 auf den Einlass des PFA Reaktanzspule.
- Installieren Sie ein Drei-Port-Polyetheretherketon (PEEK) tee-Mischer nach dem Reaktorspule.
- Schließen Sie den Schlauch austretende P2 an den Abschlag-Mixer, um 180 ° aus der Reaktorspule Austrittsrohr. Schließen Sie einen Schlauch an den dritten Anschluss des T-Mixer. Am anderen Ende dieses Rohres legen einen Gegendruckregler.
- Verbinden einer Leitung von dem Ausgang der Gegendruckregler an den Eingang des Durchflusszelle. Schließen Sie eine Linie vom Ausgang der Durchflusszelle an den "Abfall / sammeln" Schalter.
- Ansaugen der Lösungsmittelleitungen für beide P1 und P2 sowie die Reagenzienleitung P1 mit Lösemittel. Bewegen Sie den Reagenzienlinie für P1 aus der Lösungsmittelflasche auf die Reagenzflasche.
- Verwendung P1, passieren Ethylacetat durch den ReaktorSpule bei 2 ml / min, bis sie gefüllt ist. Geben Aceton durch P2 bei einer Fließgeschwindigkeit von 2 ml / min für 2 min.
- Einstellen der Lösungsmittelströmungsrate sowohl P1 und P2 bis 1 ml / min. Stellen Sie den Gegendruckregler zu einem Druck von 7 bar. Gesetzt den Reaktor Spulentemperatur auf die gewünschte Temperatur.
- Überprüfen Sie das Gerät so konfiguriert ist, wie in der schematischen Darstellung in Abbildung 3 dargestellt.
- Sobald das System bei konstanter Temperatur und Druck erreicht, auf Dichtheit prüfen und führen Sie dann die Reaktion.
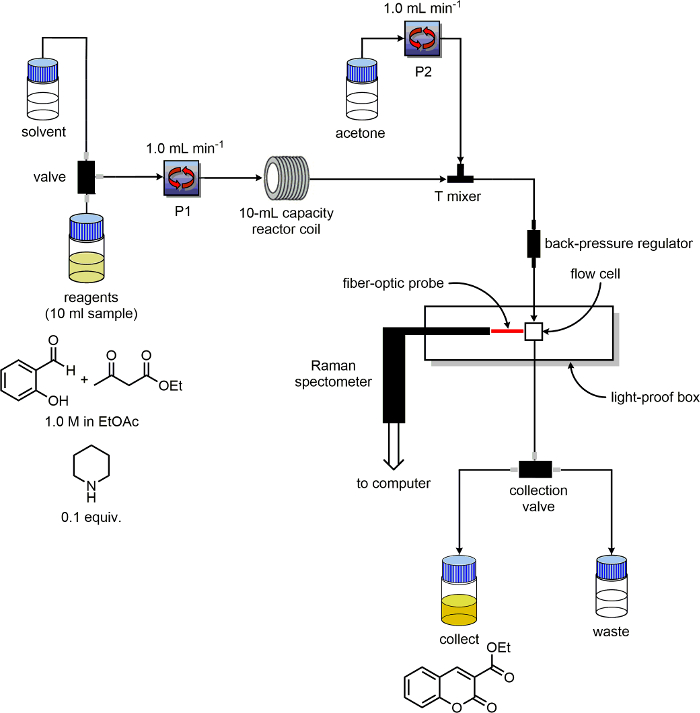
Abbildung 3. Schematische Darstellung der Anlagenkonfiguration für die Reaktionsüberwachung Experimente verwendet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
6. Überwachen Sie die Reaktion
- Takea Hintergrund Scan des Ethylacetat / Aceton-Lösungsmittelsystem, wie es durch die Flusszelle geleitet. Dies wird automatisch von allen nachfolgenden Abtastungen subtrahiert werden.
- Konfigurieren Sie das Spektrometer zu Scans alle 15 Sekunden dauern (in diesem Fall das Raman-Spektrometer wurde auf eine 10 sec Integrationszeit eingestellt, Boxcar = 3 und mittel = 1).
- Injizieren Piperidin (0,05 ml, 0,05 mmol, 0,1 Äquivalente) auf einmal in das Glasfläschchen "Reagenz" bezeichnet.
- Nach gründlichem Mischen Schalter P1 von "Lösemittel" auf "Reagenz". Stellen Sie den Ausgangsstrom zu "sammeln".
- Wenn alle Material vollständig, Schalter P1 von "Reagenz" zurück zu "Lösungsmittels." Geladen Weiter fließenden Lösungsmittels durch die Drosselspule für weitere 30 min. Sobald diese Zeit abgelaufen ist, schalten Sie die Heizung.
- Wiederum die Pumpen P1 und P2 ausgeschaltet, wenn die Reaktanzspule Temperatur auf unter 50 ° C abgekühlt.
7. Analysieren Sie die Daten
- Exportieren Sie die Raman-Spektrometer-Daten in eine Tabellenkalkulation und Plot-Raman-Intensität bei 1608 cm -1 vs. Zeit.
- Um Bedingungen zu optimieren, führen Sie die Reaktion auf eine Reihe von Durchflussraten und Reaktortemperaturen iterativ.
- Overlay Grund Raman-Intensität bei 1608 cm -1 vs. Zeit.
Hinweis: Höhere Raman Intensität korreliert mit höheren Produktumwandlung.
8. Führen Sie die Reaktion unter Verwendung von optimierten Bedingungen
- Mit abgeschirmten verschiedene Bedingungen (sich verändernden Mengenströmen / Reaktortemperaturen), führen Sie die Reaktion unter Verwendung der optimierten Bedingungen, um die höchste Produktumwandlung leisten.
9. Trennen Sie das Produkt
- Nehmen die Inhalte des Produktkolbens abgemessen und in ein Becherglas mit 100 ml Eis und 20 ml 2 M HCl.
- Produkt Kolben mit einer minimalen Menge Ethylacetat (2 ml) werden in das Becherglas zu spülen.
- Rühren Sie die eisige Mischungbis das gesamte Eis vollständig geschmolzen ist.
- Einrichtung eines Filtersystems mit einem Hirsch-Trichter, Seitenarm Kolben, Gummimanschette und einer Länge von Vakuumschlauch Kautschuk.
- Filtern Sie das anfallende Niederschlag unter Vakuum gründlich mit kaltem Diethylether (10 ml) und lassen Sie ihn unter einer Wärmelampe (2-3 h) oder trockenem O / N im Vakuum zu trocknen.
- Bestätigen die Identität des Produkts durch 1 H-Kernresonanzspektroskopie (NMR) unter Verwendung von CDCl 3 als Lösungsmittel. Für einen 500 MHz-NMR-Spektrometer ist das 1 H-NMR-Daten von 3-acetylcoumarin wie folgt: δ = 2.73 (s, 3H) 7,31-7,40 (m, 2H) 7,65 (ddd, J = 7,53, 4,37, 2,60 Hz , 2 H) 8,51 (s, 1H) ppm, 13 C-NMR-Daten: δ = 30,84 (CH 3) 117,00 (CH) 118,56 (C) 124,86 (CH) 125,27 (CH) 130,51 (CH) 134,68 (C) 147,74 (CH) 155,64 (C) 159.52 (C), 195,77 (C) ppm.
Ergebnisse
Des Durchlauf Herstellung von 3-acetylcoumarin als repräsentatives Reaktion zur in-line-Überwachung ausgewählt. Im Batch verläuft die Reaktion auch bei Verwendung von Essigsäureethylester als Lösungsmittel verwendet. Das Produkt (1) ist jedoch nicht bei RT vollständig löslich. Um mögliche Verstopfung des Gegendruckreglers zu verhindern, ebenso wie eine Verringerung des Risikos von mit festen Teilchen in der Strömungszelle, die Signalerfassung zu stören würden, haben wir eine Technik, die wir...
Diskussion
Die Leichtigkeit, in der das Raman-Spektrometer kann mit dem Strom-Einheit angeschlossen werden macht diese Inline-Technik wertvoll für die Reaktionsüberwachung. Eine Reihe von Reaktionsvariablen können in einem beschleunigten Weise untersucht werden, so dass der Benutzer bei optimierten Reaktionsbedingungen schneller als bei der Verwendung von Offline-Methoden zu gelangen. Anwendung der hier beschriebene Techniken ermöglicht die Überwachung der Bildung von Nebenprodukten, vorausgesetzt, ein geeignetes Band gefunde...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
Materialien
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
Referenzen
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten