需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
减数分裂纺锤体评估在小鼠卵母细胞的siRNA介导沉默
摘要
在这里,我们提出了一个协议,用于特定的siRNA介导的mRNA枯竭其次是免疫荧光分析来评估减数分裂纺锤体组装和组织在小鼠卵母细胞。这个协议是适合体外转录耗尽的和不同的主轴和/或微管组织中心相关因子中的卵母细胞的功能评价。
摘要
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
引言
减数分裂是发生在配子(卵子和精子),涉及两个连续的部门不干预DNA合成减数分裂我和减数分裂-II, 分别为1时分离的同源染色体和姊妹染色单体独特的分裂过程。在卵母细胞在减数分裂中染色体分离错误可能导致非整倍体,它是由胚胎在受精过程中继承。值得注意的是,非整倍体在发育中的胚胎的发生率的增加而前进产妇年龄和是先天性出生缺陷的主要原因,以及在妇女妊娠1,2-损失,因此,强调理解非整倍体的过程中减数分裂的分子基础的重要需求。
在细胞分裂,染色体分离是关键取决于微管主轴装置,并建立稳定的染色体微管相互作用进行正确连接到对面纺锤体组装极。重要的是,减数分裂纺锤体形成在哺乳动物卵母细胞不同于有丝分裂中的体细胞,并通过独特的微管组织中心(MTOCs)缺乏中心粒3,4-调节。必要的微核和组织必需的蛋白质定位于卵母细胞MTOCs,包括γ - 微管蛋白的催化微管组装。另外,粒周功能作为必要支架蛋白,其结合和锚γ微管蛋白以及其他因素在MTOCs 5。值得注意的是,我们的研究表明,主要的微管组织中心相关蛋白的耗尽扰乱减数分裂纺锤体组织,并导致在卵母细胞的染色体分离的错误,这是不充分的主轴组件的检查点(SAC)6,7-解决。因此,在主轴的稳定性的缺陷,即不会触发减数分裂阻滞,姿势在促进非整倍体一个显著风险。尽管在纺锤体组装和组织下,卵母细胞微管组织中心PROT的重要作用EIN组成和功能仍然知之甚少。
测试特定的目标蛋白质的功能在哺乳动物卵母细胞是具有挑战性的,因为细胞变得转录静止恢复减数分裂8,9前不久。因此,排卵前的卵母细胞依靠产妇基因店恢复减数分裂和支持减数分裂和受精10,11后的第一次卵裂的分裂。 RNA干扰(RNAi)介导的mRNA转录物在哺乳动物卵母细胞退化的功效是公认的,并在减数分裂成熟招募翻译母系RNA是特别适合于siRNA的靶向12-14中 。因此,短干扰RNA显微注射(的siRNA)为卵母细胞提供了一个有价值的方法来耗尽目标基因进行功能测试。
在这里,我们描述了小鼠卵母细胞和具体的transcri siRNA-介导的耗尽的分离方法点测试的必要微管组织中心相关蛋白的功能,粒周。此外,我们描述免疫荧光分析条件来评估减数分裂纺锤体形成在卵母细胞。
研究方案
该协议被批准的机构动物护理和使用委员会(IACUC)在佐治亚大学。
1.准备
- 对卵母细胞培养,购买或新鲜制备最低必需培养基(MEM)和补充用3毫克/毫升牛血清白蛋白(BSA),如表1中概述 。将聚苯乙烯瓶上的装载平衡(皮重至零)。加入所有试剂,除了BSA,为了带来与MQ水最终体积(重量)总共250克。然后加入BSA,让溶解,过滤消毒。
注意:所述的MEM培养基中,需要的平衡和细胞温育,用5% 的 CO 2,5%O 2和90%的N 2的医疗用气体混合物。然而,其他的媒体(例如,CZB)可用于在允许在5%CO 2温育细胞的大气条件下。 - 对卵母细胞显微注射,购买或准备M2网上平台。
- 准备p统治马血清促性腺激素(PMSG)至5 IU / 100微升的浓度。
- 购买和重构的siRNA股1μM的一个工作浓度。
2.小鼠卵母细胞采集
- 第1天:为了刺激卵泡发育,提高排卵前卵泡的数量,辖5 IU PMSG的腹腔内雌性小鼠48小时之前,卵母细胞的采集。
- 第3天:卵母细胞的收集和培养,设立了35个100mm培养菜肴用3ml MEM / BSA的添加1微克/毫升米力农。这种磷酸二酯酶抑制剂维持卵母细胞在前期,我逮捕,并防止生发泡破裂(GVBD)。平衡的培养皿在医疗气体混合物至少15分钟。
需要在整个卵母细胞的采集,以及卵母细胞显微注射和24小时的文化持有期后的siRNA米力农补充媒体:注意。 - 检索使用已建立实验室雌性小鼠卵巢实行15和转移到新的培养皿预热和平衡MEM / BSA /米力农。
- 放置在一个立体的卵母细胞的收集阶段培养皿。发布丘卵母细胞复合体(COC的)通过手动穿刺卵泡与27G的针头。固定一个卵巢到培养皿的底部,与连接到一个1ml注射器一个27G的针头,并用第二针穿刺所有大卵泡。重复每个卵巢。
- 使用标准的嘴移液过程或卵母细胞抽吸等方式,收集了由2层以上紧凑的卵丘细胞包围着所有的卵母细胞。转移COC的一个新盘,37℃下1小时。
- 小心取出周围的卵丘细胞反复轻柔吹打用1毫升吸管设置为750微升的吸液容量。重复移液步约12倍并允许卵母细胞恢复5分钟。继续以这种方式,直到所有的或大部分的卵丘细胞已被删除。传送裸卵到另一培养皿中,并允许平衡在37℃下进行15分钟。
- 分配裸露的卵母细胞分成三个实验组,以用于:特异性siRNA(ⅰ)显微注射针对感兴趣的靶,(ⅱ)注射的非特异性(对照)的siRNA,和(iii)一个未注射对照组占培养条件。
3.卵母细胞显微注射
- 设置培养皿补充有米力农(1微克/毫升)3毫升M2媒体为卵母细胞注射。制备含MEM / BSA /米力农清洗并注入卵母细胞的后续培养培养皿。
注意:M2培养基包含HEPES缓冲液,并且需要预先升温在37℃大气条件下15分钟。 MEM需要预热和平衡使用医用气体作为描述d以上。 - 准备显微注射系统。加载注射针,用5微升1μM的特异siRNA溶液。固定固定吸管和注射针显微注射系统的显微操作,并设置了校准的体积和压力的注射装置。
- 放置一个200μl的微滴的M2培养基上3厘米培养皿的盖的内侧,并添加一个卵母细胞用于设置和显微注射系统的对齐。
- 利用卵母细胞为指导,调整持有和注射针头的位置。施加负压到保持吸管轻轻固定卵母细胞和调节注射针的位置的小区的最宽直径。调整设置,使大约10 PL的siRNA溶液的注射任何地方进入卵母细胞的细胞质中。
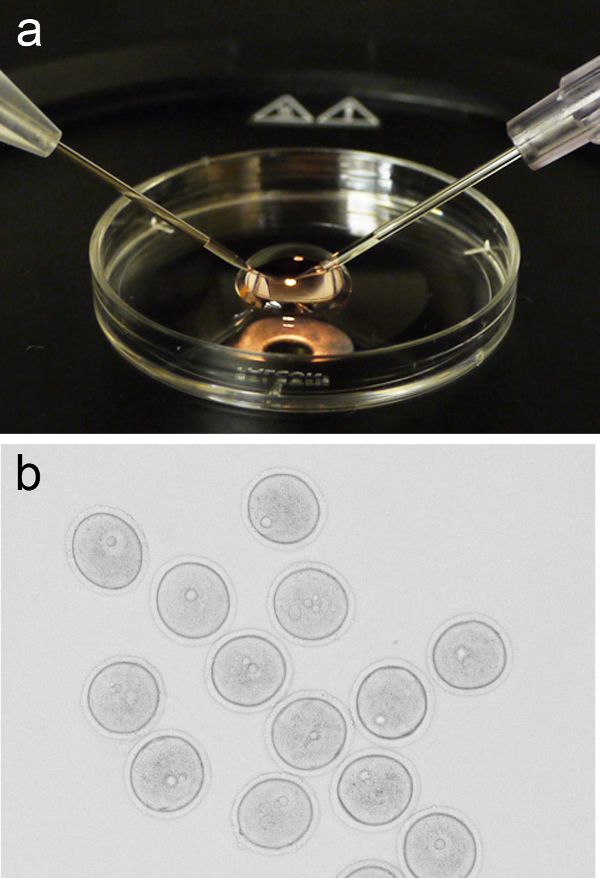
图1.卵母细胞显微注射成立。( 200μl的微滴的M2媒体的放置在盖子从一个3厘米的培养皿,用固定吸管和注射针定位在左侧和右侧,分别A)的代表性的图像。 (二)集团前期,我被捕前显微注射的卵母细胞(GV期)。 请点击此处查看该图的放大版本。 - 返回到盖体视显微镜阶段,并添加200μl的微滴新鲜M2的介质。添加组卵母细胞(〜10),以微滴通过口移液,或其他方法,然后返回该盖与微滴的显微注射阶段。
- 继续microinject个人卵母细胞。固定一根卵母细胞与保持吸管,缓缓插入注射针的尖端进入细胞质和驱逐的siRNA溶液的注射体积。仔细缩回注射针和莫已经注入的卵母细胞的位置在微滴的底部。动失败的卵母细胞注射到一位置,在微滴的顶部。
- 每个卵母细胞重复注射过程。以保持最佳的卵母细胞的生存能力,microinject只有少数的卵母细胞在一个时间。确保这一过程不超过几分钟采取更多,以防止温度和pH的变化在微滴。
- 抽吸成功注入的卵母细胞或小心地移动所述盖与微滴喷射的卵母细胞,以立体显微镜。传输所注入的卵母细胞存活由口移液或替代方法,为MEM / BSA /米力农介质洗并平衡在37℃。
- 使用另一组卵母细胞,用新的注射针装入为对照组的非特异性的siRNA重复显微注射过程。洗MEM / BSA /米力农和转让的卵母细胞,以一个单独的培养皿。
- 文化各组医疗气体气氛下的卵母细胞24小时的MEM / BSA /米力农,在37℃。
注:需要高效的靶mRNA /蛋白枯竭的"米力农块"文化时期。
4,卵母细胞培养的卵母细胞减数分裂
- 第4天:对于每个实验组的卵母细胞建立4培养皿(35毫米)用3ml MEM / BSA中。补充每组一个媒体盘,用10%(高品质)胎牛血清(FBS)的用于卵母细胞成熟。允许所有培养皿在37℃,平衡医疗气体混合物。
- 从'米力农块"释放的卵母细胞,依次在含有MEM / BSA的碗碟洗涤卵母细胞3次,然后将卵母细胞转移到含有10%FBS的培养基中成熟的菜。培养卵母细胞的所有组17小时,在37℃,以使恢复和减数分裂的进展。
- 第5天:卵母细胞的FIXa准备解决方案灰,主要包括:(ⅰ)4%低聚甲醛(PFA)的PEM缓冲液(100毫摩尔PIPES [pH值6.9],1mM的MgCl 2的,1mM的EGTA)用0.5%Triton-X 100,和(ii)的PBS补充有5 %FBS中,将用于洗涤和阻断的卵母细胞。
注意:这些解决方案需要预先温热至37℃之前,卵母细胞的固定。 - 对卵母细胞的固定(在17小时培养后),迅速通过含有750微升口移液或替代方法为单独的孔中(一个4孔培养皿的)转移的每个实验组的卵母细胞的预热4%PFA溶液和在37 °下进行1小时。在750微升预热的PBS含有5%FBS随后清洗各组卵母细胞3次(15分钟的每个)。
- 阻止卵母细胞在200微升PBS / 5%FBS O / N在4°C到非特异性抗体减少结合。
5.免疫荧光分析
- 第6天:
注意:免疫染色是在一个多井板和OOC完成ytes被串行传送到顺序井,含有各自的抗体和洗涤溶液。 48或96孔板可以使用,简单地基于以及大小调整溶液体积。对于96孔板用每孔200μl的。卵母细胞被转移到不同的解决方案中的顺序如下:初级抗体溶液 - 3洗井 - 二级抗体溶液 - 3洗涤井。为了减少曝光的板可以用铝箔纸覆盖。
制备新鲜的PBS / 5%FBS和使用此解决方案,制备抗体稀释液( 例如,兔抗粒周蛋白(1 / 1,000),小鼠抗微管蛋白(1 / 1,000))。 - 转移的每个实验组与初级抗体溶液含有200微升(或100微升,如果少体积期望)单独孔的固定卵母细胞并覆盖井用封口膜。根据最佳抗体的特定条件下孵育(例如,37℃1小时,或4℃的CO / N)。
注意:一抗dilutioN作为以及具体的培养时间和温度需要测试,以确定所使用的不同抗体的最佳条件。 - 温育与第一抗体后,清洗的卵母细胞三次在PBS / 5%FBS(每10-15分钟)。
- 转移卵母细胞成含有荧光标记的二抗的溶液(例如,1/1000稀释的抗兔和抗小鼠抗体偶联有不同波长的荧光染料)。孵育1小时,在37℃。
- ( - 15每分钟10)在PBS / 5%FBS的洗涤卵母细胞三次。
- 在最后的洗涤步骤后,转移到卵母细胞干净的载玻片上,轻轻地吸出任何过量的洗涤溶液。这将固定在玻璃表面上的卵母细胞。添加8微升安装介质(含DAPI),小心地覆盖安装媒体22毫米×22毫米遮滑。降低盖玻片缓慢,以避免俘获气泡和/或损坏的卵母细胞。
注意:可替换地,保持卵母细胞进行共聚焦显微镜分析的3-维属性,添加少量的100微米的玻璃珠(与凡士林混合)到盖玻片的角部安装在滑动之前。 - 商店载玻片在4℃,或者进行到减数分裂进展的评估,以及使用配备了必要的过滤器在荧光显微镜来匹配所用的第二抗体的表达水平和亚细胞蛋白质定位进行分析。
结果
siRNA的显微注射提供了一种有效的方法对mRNA降解和随后的蛋白耗竭的卵母细胞,从而使不同的目标因子在体外的高效率和高特异性的功能测试。随后,免疫荧光被用于特定的表型分析以及验证蛋白耗竭的siRNA注射卵母细胞。在当前的例子,用DAPI个别的卵母细胞的抗微管蛋白和抗粒周蛋白抗体荧光标记一起启用:粒周枯竭(i)认可,以及(ii)以控制这两个染色质和减数分裂纺锤体结构进行?...
讨论
尽管有多种方法外源核酸转移进入体细胞,例如电穿孔和转染,显微注射是用于递送RNA分子的转录成静止小鼠卵母细胞的最佳方法。目前的协议提供了一种有效的方法用于体外耗尽特异mRNAs,使不同的主轴和/或微管组织中心相关因子中的卵母细胞的功能测试。这种做法会导致效率的成绩单枯竭和高度的适应性。虽然的siRNA被用于特异性靶向PCNT转录,类似的条件,可以采用靶向感兴趣?...
披露声明
The authors have nothing to disclose
致谢
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
材料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
参考文献
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。