Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Meiotic évaluation de la broche dans la souris ovocytes par silençage siRNA médiation
Dans cet article
Résumé
Ici, nous présentons un protocole de l'épuisement de l'ARNm de siRNA médiation spécifique suivie d'une analyse d'immunofluorescence pour évaluer l'assemblage du fuseau méiotique et de l'organisation dans des ovocytes de souris. Ce protocole est approprié pour l'appauvrissement de produits de transcription in vitro et l'évaluation fonctionnelle de broche différents et / ou des facteurs de MTOC associée dans les ovocytes.
Résumé
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
Introduction
La méiose est un processus de division unique qui se produit dans les gamètes (spermatozoïdes et les ovocytes) et comporte deux divisions successives sans intervenir la synthèse d'ADN à séparer les chromosomes homologues et des chromatides sœurs cours de la méiose et de la méiose-I-II, respectivement 1. Erreurs dans la ségrégation des chromosomes lors de la division de la méiose dans les ovocytes peuvent résulter de l'aneuploïdie, qui est héritée par l'embryon lors de la fécondation. Notamment, l'incidence de l'aneuploïdie dans les embryons en développement augmente avec l'âge de la mère et est une cause majeure de malformations congénitales ainsi que la perte de la grossesse chez les femmes 1,2, donc, soulignant un besoin important de comprendre la base moléculaire de l'aneuploïdie lors de la division de la méiose .
Au cours de la division cellulaire, la ségrégation des chromosomes dépend essentiellement de l'assemblage de l'appareil de la broche de microtubules et l'établissement d'interactions chromosomiques-microtubules stables pour la fixation correcte de la broche opposéepôles. Surtout, la formation du fuseau méiotique dans des ovocytes de mammifères diffère de la mitose dans les cellules somatiques, et est régie par les centres de microtubules organisation uniques (MTOCs) qui manquent centrioles 3,4. Protéines essentielles nécessaires à la nucléation des microtubules et l'organisation localisent à MTOCs d'ovocytes, y compris γ-tubuline qui catalyse l'assemblage des microtubules. En outre, pericentrin fonctionne comme une protéine d'échafaudage essentiel, qui se lie et les ancrages y-tubuline, ainsi que d'autres facteurs en MTOCs 5. En particulier, nos études montrent que l'épuisement des protéines clés associés perturbe MTOC-organisation de fuseau méiotique et conduit à des erreurs de ségrégation des chromosomes dans les ovocytes qui ne sont pas complètement résolus par le point de contrôle de montage de broche (SAC) 6,7. Par conséquent, les défauts de stabilité broche, qui ne déclenchent pas arrêt de la méiose, représentent un risque important en contribuant à l'aneuploïdie. Malgré leur rôle essentiel dans l'assemblage de broche et de l'organisation, prot ovocyte de MTOCcomposition et la fonction ein reste mal comprise.
Test de la fonction des protéines cibles spécifiques dans des ovocytes de mammifères est difficile, car les cellules deviennent la transcription de repos peu avant la reprise de la méiose 8,9. Par conséquent, les ovocytes pré-ovulatoire comptent sur les magasins d'ARNm maternels de reprendre la méiose et soutiennent division méiotique ainsi que les premières divisions de clivage après la fécondation 10,11. L'efficacité de l'interférence ARN (ARNi) la dégradation médiée par des transcrits d'ARNm dans les ovocytes de mammifères est bien établie et ARN maternels recrutés pour la traduction lors de la maturation méiotique se prêtent particulièrement bien à siRNA ciblant 12-14. Par conséquent, la micro-injection de courts ARN interférents (siRNA) dans des ovocytes fournit une approche valable pour épuiser ARNm cibles pour le test fonctionnel.
Ici, nous décrivons les méthodes pour l'isolement des ovocytes de souris et l'épuisement des siRNA médiation de transcri spécifiquepts pour tester la fonction d'une protéine associée MTOC essentielle, pericentrin. En outre, nous décrivons des conditions d'analyse par immunofluorescence pour évaluer la formation du fuseau méiotique dans les ovocytes.
Protocole
Ce protocole a été approuvé par le Comité institutionnel de protection des animaux et l'utilisation (IACUC) à l'Université de Géorgie.
1. Préparatifs
- Pour la culture de l'ovocyte, l'achat ou fraîchement préparer milieu essentiel minimal (MEM) et compléter avec 3 mg / ml de sérum albumine bovine (BSA) comme indiqué dans le tableau 1. Placez une bouteille de polystyrène sur une balance de chargement (de tare à zéro). Ajouter tous les réactifs, sauf BSA, dans l'ordre et faire apparaître le volume final avec MQ-eau en poids pour un total de 250 g. Puis ajouter le BSA, laisser dissoudre et stériliser par filtration.
Remarque: Le milieu MEM décrit nécessite l'équilibrage et l'incubation de la cellule avec un mélange de gaz à usage médical de 5% de CO 2, 5% d'O 2 et 90% N 2. Cependant, d'autres milieux (par exemple, CZB) peuvent être utilisés qui permettent une incubation des cellules dans 5% de CO 2 dans des conditions atmosphériques. - Pour ovocyte microinjection, acheter ou préparer le milieu M2.
- Préparer pla gonadotrophine de sérum de jument régnante (PMSG) à une concentration de 5 UI / 100 ul.
- Achat et reconstituer les stocks de siRNA à une concentration de travail de 1 uM.
2. Souris ovocytes Collection
- JOUR 1: Pour stimuler le développement du follicule ovarien et d'augmenter le nombre de follicules pré-ovulatoire, administrer 5 UI de PMSG voie intrapéritonéale à des souris femelles 48 heures avant la collecte des ovocytes.
- JOUR 3: Pour la collecte d'ovocytes et culture, mis en place des boîtes de culture de 35 mm avec 3 ml de MEM / BSA additionné de 1 pg / ml milrinone. Cet inhibiteur de la phosphodiestérase maintient les ovocytes en prophase-je arrestation et prévient la dégradation de la vésicule germinale (GVBD). Equilibrer les boîtes de culture dans un mélange de gaz médicale pendant au moins 15 min.
Note: Milrinone médias complété est nécessaire tout au long de la collecte des ovocytes, ainsi que la micro-injection d'ovocytes et de la culture 24 heures cale période post siRNA. - Récupérer les ovaires de souris femelles utilisant laboratoire établi des pratiques 15 et transférer à une nouvelle boîte de culture avec préchauffé et équilibrée MEM / BSA / milrinone.
- Placez la boîte de culture sur la scène d'un stéréomicroscope pour la collecte d'ovocytes. Sortie cumulus-ovocytes complexes (COC) en perforant manuellement les follicules antraux avec 27 g d'aiguilles. Fixer un ovaire au fond de la boîte de culture, avec une aiguille 27 G fixée à une seringue de 1 ml, et en utilisant une seconde aiguille pour perforer tous les grands follicules. Répétez l'opération pour chaque ovaire.
- En utilisant des procédures bouche de pipetage standard ou d'autres moyens de l'aspiration des ovocytes, de collecter toutes les ovocytes qui sont entourés par 2 ou plusieurs couches de cellules du cumulus compacts. Transférer le COC à un nouveau plat et incuber à 37 ° C pendant 1 heure.
- Retirez délicatement les cellules du cumulus environnants par un léger pipetage répété avec une pipette de 1 ml réglé sur un volume d'aspiration de 750 pi. Répétez l'étape de pipetage environ 12 foiset permettent de récupérer les ovocytes pendant 5 min. Continuer de cette manière jusqu'à ce que la totalité ou la plupart des cellules cumulus ont été supprimés. Transférer les ovocytes dénudés à une autre boîte de culture et de permettre à l'équilibre à 37 ° C pendant 15 min.
- Allouer les ovocytes dénudés en trois groupes expérimentaux à être utilisés pour: (i) la micro-injection de siRNA spécifiques contre la cible d'intérêt, (ii) la micro-injection de non spécifiques (contrôle) siRNA, et (iii) un groupe de contrôle non-injecté pour tenir compte de des conditions de culture.
3. ovocytes microinjection
- Mettre en place des boîtes de culture de 3 ml de milieu M2 additionné de milrinone (1 ug / ml) pendant ovocytes micro-injection. Préparer des plats de culture contenant MEM / BSA / milrinone pour le lavage et la culture subséquente de ovocytes injectés.
Remarque: le milieu M2 contient tampon Hepes et nécessite le préchauffage à 37 ° C pendant 15 min dans des conditions atmosphériques. MEM exige pré-réchauffement et l'équilibre en utilisant des gaz médicaux comme décritD ci-dessus. - Préparer le système de micro-injection. Charger l'aiguille d'injection de 5 ul d'une solution de siRNA spécifique de 1 uM. Fixez la pipette de maintien et aiguille d'injection micromanipulateurs du système de micro-injection et mettre en place l'unité d'injection avec le volume et la pression calibrée.
- Placez un 200 pi micro-goutte de M2 médias sur l'intérieur du couvercle d'une boîte de culture de 3 cm et d'ajouter un ovocyte pour mettre en place et l'alignement du système de micro-injection.
- Utilisation de l'ovocyte comme un guide, ajuster les positions de l'exploitation et injection aiguilles. Appliquer une pression négative à la pipette de maintien pour fixer doucement l'ovocyte et ajuster la position de l'aiguille d'injection pour le diamètre le plus large de la cellule. Modification des réglages pour permettre à la micro-injection de 10 pl environ de la solution de siRNA n'importe où dans le cytoplasme de l'ovocyte.
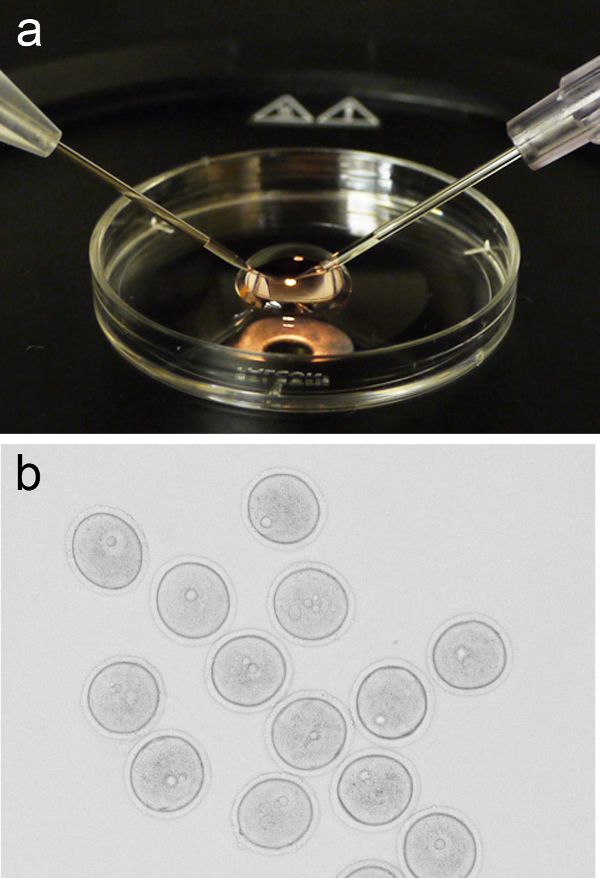
Figure 1. ovocytes microinjection mis en place. ( A) Représentant l'image d'un 200 pi micro-goutte de M2 médias placé sur le couvercle d'une boîte de culture de 3 cm, avec l'aiguille de pipette de maintien et d'injection positionné sur la gauche et la droite, respectivement. (B) Groupe de la prophase-je arrêté ovocytes (GV-scène) avant microinjection. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure. - Retourner le couvercle à l'étape de la loupe binoculaire et ajouter un pl 200 micro-goutte de support M2 frais. Ajouter un groupe d'ovocytes (~ 10) pour la micro-goutte par voie orale pipetage, ou d'autres méthodes, puis retourner le couvercle à micro-goutte à la phase de la micro-injection.
- Passez à la micro-injection des ovocytes individuels. Fixer un ovocyte avec la pipette de maintien, insérez-la délicatement la pointe de l'aiguille d'injection dans le cytoplasme et expulser le volume d'injection de solution siRNA. Rétracter délicatement l'aiguille d'injection et move de l'ovocyte injecté à une position au fond de la micro-goutte. Déplacez ovocytes injectés en vain à une position au sommet de la micro-goutte.
- Répétez la procédure de micro-injection avec chaque ovocyte. Pour maintenir la viabilité des ovocytes optimale, micro-injection seulement un petit nombre d'ovocytes à la fois. Assurez-vous que ce processus ne prend pas plus de quelques minutes pour éviter température et de pH des changements dans la micro-goutte.
- Aspirer injecté avec succès ovocytes ou déplacer le couvercle avec précaution avec le micro-goutte de ovocytes injectés à la loupe binoculaire. Transférer les ovocytes viables injectés par pipetage à la bouche ou des méthodes alternatives, à MEM / BSA moyen / milrinone à laver et équilibrer à 37 ° C.
- Utilisation d'un autre groupe d'ovocytes, répétez le processus de micro-injection avec une nouvelle aiguille d'injection chargé avec des ARNsi non spécifiques pour le groupe de contrôle. Laver les ovocytes dans MEM / BSA / milrinone et transfert à une boîte de culture distincte.
- Culture tous les groupes deovocytes pendant 24 heures dans du MEM / BSA / milrinone à 37 ° C sous une atmosphère de gaz médical.
Remarque: La période de culture «bloc de milrinone 'est nécessaire pour cible efficace ARNm / protéine épuisement.
4. Culture pour la maturation des ovocytes Meiotic
- JOUR 4: Pour chaque groupe expérimental d'ovocytes mis en place 4 boîtes de culture (35 mm) avec 3 ml de MEM / BSA. Compléter un plat de médias par groupe avec 10% (de haute qualité) de sérum fœtal bovin (FBS) à utiliser pour la maturation des ovocytes. Permettre à tous les plats de culture pour équilibrer à 37 ° C avec un mélange de gaz médicaux.
- Pour libérer des ovocytes à partir de 'bloc de milrinone', successivement laver les ovocytes à trois reprises dans les plats contenant MEM / BSA et ensuite transférer les ovocytes à l'antenne de la maturation des milieux contenant 10% de FBS. Culture tous les groupes d'ovocytes pendant 17 heures à 37 ° C, afin de permettre la reprise et la progression de la méiose.
- Jour 5: Préparer des solutions pour ovocyte fixation, y compris: (i) 4% de paraformaldehyde (PFA) dans du tampon PEM (100 mM de PIPES [pH 6,9], 1 mM de MgCl2, 1 mM d'EGTA) avec 0,5% de Triton-X 100, et (ii) du PBS additionné de 5 FBS% qui seront utilisés à laver et à bloquer les ovocytes.
Note: Ces solutions nécessitent préchauffage à 37 ° C avant l'ovocyte fixation. - Pour la fixation de l'ovocyte (après la culture de 17 h), rapidement transférer chaque groupe expérimental d'ovocytes par pipetage à la bouche ou des méthodes alternatives dans des puits individuels (d'un plat 4 puits) contenant 750 pi de pré-chauffé solution PFA 4% et incuber à 37 ° C pendant 1 heure. Par la suite laver chaque groupe d'ovocytes 3 fois (15 minutes chacune) dans 750 ul de PBS préchauffé contenant 5% de FBS.
- Ovocytes de bloc dans 200 pi de PBS / 5% de FBS O / N à 4 ° C pour minimiser les anticorps non spécifique contraignant.
5. Analyse d'immunofluorescence
- JOUR 6:
Note: immunocoloration est réalisée dans une plaque multi-puits et la OOCytes sont transférées en série dans les puits séquentielles, contenant des solutions d'anticorps et de lavage respectifs. Soit 48 ou plaques à 96 puits peuvent être utilisés, il suffit de régler le volume de solution basée sur la taille bien. Pour les plaques à 96 puits en utilisant 200 pi par puits. Les ovocytes sont transférés vers les différentes solutions dans l'ordre suivant: solution d'anticorps primaire - 3 puits de lavage - solution d'anticorps secondaire - 3 puits de lavage. Pour limiter l'exposition de lumière la plaque peut être recouvert d'une feuille.
Préparer une solution fraîche PBS / 5% de FBS et utiliser cette solution pour préparer des dilutions d'anticorps (par exemple, de lapin anti-pericentrin (1/1000), de souris anti-tubuline (1/1000)). - Transférer les ovocytes fixes de chaque groupe expérimental à chaque puits contenant 200 pi (100 pi ou, si l'on souhaite moins de volume) de la solution d'anticorps primaire et couvrir le puits avec du parafilm. Incuber selon les conditions spécifiques d'anticorps optimales (par exemple, 37 ° C pendant 1 heure, ou 4 ° CO / N).
Remarque: dilutio d'anticorps primairen ainsi que le temps d'incubation spécifique et la température exigent des tests pour déterminer les conditions optimales pour différents anticorps utilisés. - Après incubation avec l'anticorps primaire, laver les ovocytes trois fois dans du PBS / 5% de FBS (10 à 15 min chacun).
- Transférer les ovocytes dans la solution contenant des anticorps secondaires conjugués par fluorescence (par exemple, 1 / 1.000 dilution d'anticorps anti-lapin et anti-souris conjugués avec des fluorochromes de longueurs d'onde différentes). Incuber pendant 1 heure à 37 ° C.
- Laver les ovocytes trois fois dans du PBS / 5% de FBS (10 - 15 min chacun).
- Après l'étape de lavage final, transférer les ovocytes sur une lame de verre propre et doucement aspirer toute solution de lavage en excès. Cela immobiliser les ovocytes sur la surface du verre. Ajouter 8 pi de milieu (contenant DAPI) montage et superposer avec soin les supports de montage avec un 22 mm x 22 mm lamelle. Abaissez la lamelle lentement pour éviter les bulles d'air et / ou d'endommager les ovocytes.
Remarque: vous pouvez, pour maintenir les propriétés 3-dimensionnelles de l'ovocyte pour l'analyse de la microscopie confocale, ajouter un petit volume de 100 perles de verre de um (mixtes avec de la gelée de pétrole) sur les coins de la lamelle avant de monter sur la diapositive. - Stocker les lames à 4 ° C, ou de procéder à l'évaluation de la progression de la méiose, ainsi que l'analyse des niveaux d'expression et la localisation subcellulaire des protéines en utilisant un microscope à fluorescence équipé des filtres nécessaires pour correspondre aux anticorps secondaires utilisés.
Résultats
La micro-injection de siRNA offre une approche efficace pour la dégradation de l'ARNm et de protéine ultérieur épuisement dans des ovocytes, ce qui permet des tests fonctionnels efficace et hautement spécifique de différents facteurs cibles in vitro. Par la suite, l'immunofluorescence est utilisée pour l'analyse du phénotype spécifique, ainsi que pour valider protéine épuisement dans des ovocytes injectés de siARN. Dans l'exemple actuel, le marquage fluorescent des ovocytes individue...
Discussion
Bien qu'il existe plusieurs méthodes pour le transfert d'acide nucléique exogène dans des cellules somatiques, telles que l'électroporation et la transfection, micro-injection est le procédé optimal pour la livraison de molécules d'ARN dans des ovocytes de souris transcriptionnellement quiescentes. Le protocole actuel fournit une approche efficace pour déplétion in vitro des ARNm spécifiques qui permettent des tests fonctionnels de la broche différente et / ou des facteurs de MTOC-ass...
Déclarations de divulgation
The authors have nothing to disclose
Remerciements
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
Références
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon