Method Article
使用新型不溶性生色底物检测试剂盒碳水化合物降解酶的高通量筛选
摘要
A high-throughput assay for enzyme screening is described. This multiplexed ready-to-use assay kit comprises of pre-chosen Chromogenic Polymer Hydrogel (CPH) substrates and complex Insoluble Chromogenic Biomass (ICB) substrates. Target enzymes are polysaccharide degrading endo-enzymes and proteases.
摘要
Carbohydrates active enzymes (CAZymes) have multiple roles in vivo and are widely used for industrial processing in the biofuel, textile, detergent, paper and food industries. A deeper understanding of CAZymes is important from both fundamental biology and industrial standpoints. Vast numbers of CAZymes exist in nature (especially in microorganisms) and hundreds of thousands have been cataloged and described in the carbohydrate active enzyme database (CAZy). However, the rate of discovery of putative enzymes has outstripped our ability to biochemically characterize their activities. One reason for this is that advances in genome and transcriptome sequencing, together with associated bioinformatics tools allow for rapid identification of candidate CAZymes, but technology for determining an enzyme's biochemical characteristics has advanced more slowly. To address this technology gap, a novel high-throughput assay kit based on insoluble chromogenic substrates is described here. Two distinct substrate types were produced: Chromogenic Polymer Hydrogel (CPH) substrates (made from purified polysaccharides and proteins) and Insoluble Chromogenic Biomass (ICB) substrates (made from complex biomass materials). Both CPH and ICB substrates are provided in a 96-well high-throughput assay system. The CPH substrates can be made in four different colors, enabling them to be mixed together and thus increasing assay throughput. The protocol describes a 96-well plate assay and illustrates how this assay can be used for screening the activities of enzymes, enzyme cocktails, and broths.
引言
Techniques for mining genomes and metagenomes have developed rapidly in recent years, and so have medium- and high-throughput strategies for cloning and expressing recombinant enzymes. Furthermore, bioinformatic resources and associated depositories, such as (CAZy)1,2 have expanded greatly. However, there are considerable challenges inherent in the exploitation of microbial enzyme diversity for industrial purposes and the empirical determination of enzyme activities has now become a serious bottleneck. For example, it is estimated that, using current methods, we can safely predict the activities of no more than 4% of the proteins within the CAZy database. Although numerous methods are available for monitoring enzyme activities they all have some limitations. Well-established techniques based on chromatography combined with mass spectrometry are available for assessing the oligomeric fragments of glycosyl hydrolase (GH) activities3,4. However, these approaches are labor intensive and generally low-throughput. Methods based on the measurement of reducing sugars such as the dinitrosalicylic acid5 and Nelson-Somogyi6 assays are widely used for assessing GH activities. However, these assays have limited throughput and can be prone to side-reactions. Individual chromogenic polysaccharide substrates, such as azurine cross-linked (AZCL) are widely used for determination of enzyme activities, but purchasing all of the substrates separately and manually distributing the substrate powders within the assay plate can be cumbersome and costly7.
We have developed a new generation of chromogenic polymer hydrogel (CPH) substrates based on chlorotriazine dyes that, when used in conjunction with a 96-well filter plate, form a high-throughput assay system. Additional Insoluble Chromogenic Biomass (ICB) substrates were developed which provide information about substrate availability within complex polymer mixtures, such as those that exist in lignocellulosic biomass. Each substrate can be produced in one of four colors, and different colored substrates can be combined in a single well. In this protocol is shown that this methodology can be applied to a wide variety of polysaccharides and proteins and the potential for screening GHs, lytic polysaccharide monooxygenases (LPMOs) and proteases. Specific protocols are provided for the use of 96 well plates and representative results illustrate the high efficiency of the CPH and ICB substrate kits as tools for enzyme screening.
One significant advantage of the assay kits described, regardless of the substrate, is that the kits are ready to use within 15 minutes, after the activation step. This eliminates the need for time-consuming assembly of the assay from raw substrate materials as it is the case with some other methods7. The CPH and ICB substrates have excellent storage (at least one year at room temperature), pH and temperature stability 8 and require no specialized equipment or training. The CPH or ICB assays are based on 96-well filter plate within which the reaction with the enzyme is conducted. If the enzyme is active with a given substrate, soluble dyed oligomers are generated, producing a colored supernatant which can then be filtered into a regular clear-well 96-well plate using a vacuum manifold or a centrifuge 8.
The substrates are dyed with chlorotriazine dyes which absorb in the visible spectrum (VIS) range and individual colors (red, blue, yellow and green) can be resolved using linear regression if different CPH substrates of different colors are mixed in a single well, and the enzyme acts on more than one substrate. The resulting plate with the supernatants can be measured using a standard microtiter-plate reader capable of measuring absorbance in the VIS range. Mixing different substrates with different colors in one well increases the throughput of the assay system, to a total of 384 experiments in a 96-well plate (4 different substrates of different colors per well).
CPH substrates provide a valuable tool for assessing the specific activity of an enzyme while ICB substrates are used to evaluate the capacity of an enzyme to digest a component within the context of complex substrate mixtures that enzymes usually encounter within biomass. Although ICB substrates do not provide information about individual enzyme specificities, they are nonetheless useful tools for assessing the commercial performance of enzymes, cocktails or broths.
研究方案
1.生色测定与CPH底物在96孔板形式
- 的测定试剂盒板的活化
- 通过加入200微升活化溶液(随试剂盒获得)到每个孔中,然后用10分钟,在室温下孵育没有搅拌激活96孔过滤器(含有蓝色CPH木聚糖)测定试剂盒板(材料清单)。
- 使用真空歧管(与内部的间隔部件与任何标准的,透明的96孔板作为收集板),以除去现存激活溶液施加真空。另外,也可以2,700 XG使用离心10分钟该步骤代替真空歧管中。
- 加入100微升无菌水冲洗CPH基板和运用真空(或离心力)删除稳定。重复此步骤两次以上,并将板现在可以使用了。
- 酶反应
注:始终包括缓冲单独作为阴性对照,如果可能以前表征的酶作为阳性对照。使用重复的统计适当数量。的CPH基材是pH为3.0至10.0,并在每个孔中的缓冲端的酶溶液的总体积应不超过180微升之间稳定的。植物提取物或培养液,也可用于代替纯化的酶溶液。- 添加150微升的100mM乙酸钠缓冲液,pH 4.5和5微升内切 -cellulase溶液(1单位/毫升的最终浓度)的测定试剂盒板的各孔中。
- 把产品板(明确孔板用微量滴定板读数器兼容)的测定试剂盒板下方摇动时,收集从反应板的任何可能的渗漏。
- 孵育测定试剂盒板在25℃下30分钟在以150rpm水平摇动器。
注:在孵育期间混合在测定试剂盒板的反应是用于实现一致和摄制关键重现的结果。 CPH基材是稳定的高达90℃。温育时间应测试含有CPH基板未知酶浓度培养肉汤时提高到24小时。注意,适当的温育时间取决于酶的活性,但一般来说,如果有24小时内没有检测到活动,则可能是这种酶不会降低测试衬底。活性酶降解CPH衬底的不溶性生色多糖成可溶性生色寡糖,这是作为有色上清液可见。 - 将干净的铭牌上的真空腔里面的垫块里面。
- 放置在顶部的测定试剂盒板和施加真空(-60千帕的最大负压)。另外,也可以2,700 XG使用离心10分钟。
注:含有着色寡糖作为反应产物的滤液现在是在产品板用于进一步分析8 。
- 检测和定量
- 检查的液体在产品板的每个孔的体积是约目测相同。
- 读出的收集盘的吸光度用酶标仪蓝色CPH木聚糖595纳米。
- 在做数据分析,从那里加入酶的水井中的值减去缓冲区只阴性对照值。计算从复制孔8的平均值和的装置(SEM)的标准误差。
2.生色测定与ICB底物在96孔格式
- 酶反应
- 添加150微升的100mM乙酸钠缓冲液,pH 4.5和5微升31单位/毫升内切木聚糖酶溶液含有红色ICB-麦秸(最终酶浓度在阱:1单位/毫升)的测定试剂盒板的各孔。
注:测定试剂盒板(96孔过滤复在文献中描述(见材料清单)含ICB基板阿泰)制造的。的ICB的基材是在pH 3.0之间的pH范围内,以10.0缓冲剂稳定。始终包括单独的缓冲液作为阴性对照,商业酶作为阳性对照,并使用副本的统计学上适当数量。- 不激活像CPH衬底板的ICB基板,但通过用100μl水,接着通过真空过滤或离心洗涤三次除去稳定剂。
- 把产品板的基片下方摇动期间收集从衬底板的任何可能的渗漏。
- 孵育在25℃下以150rpm摇动2小时进行反应。
注意:活动的酶降解的ICB基板不溶性多糖显色成可溶性低聚糖,这是有色上清可见。 ICB基材是稳定的高达90℃。孵化ŧ如果使用未纯化的酶,如培养肉汤IME应提高到24小时。 - 放置铭牌上的真空腔里面的垫块里面。
- 放置在顶部的测定试剂盒板和施加真空(-60千帕的最大负压)或使用离心机从测定试剂盒板产物滤液进入产品板的孔。
注:含有着色寡糖作为反应产物的滤液现在是在收集板用于进一步分析8。
- 添加150微升的100mM乙酸钠缓冲液,pH 4.5和5微升31单位/毫升内切木聚糖酶溶液含有红色ICB-麦秸(最终酶浓度在阱:1单位/毫升)的测定试剂盒板的各孔。
- 检测和定量
- 检查的液体在收集板的每个孔的体积是约目测相同。
- 读出的收集盘的吸光度用酶标仪红ICB-麦秸517纳米。
- 在做数据分析 - 减去缓冲区 - 从井中值仅阴性对照值,其中的酶溶液。计算从复制孔8的平均值和的装置(SEM)的标准误差。
注意:在筛选未知的酶的情况下,我们建议,以便获得关于酶的活动的动态范围更详细的数据制作稀释系列。
结果
高通量和该测定的复用容量是基于设置在96-孔过滤板不溶性生色聚合物(或蛋白质)的水凝胶(CPH)的基板。酶以及阴性对照被添加到测定试剂盒板( 图1A)和酶降解产生的着色上清液( 图1B)对应的基板。反应结束后,将上清液转移到清晰阱产品板和吸光可以直接使用适于96孔板( 图1C)的分光光度计来测量。
在不同浓度的酶CPH-阿拉伯木聚糖的剂量响应于木聚糖酶的一个例子(0.00 - 0.75单位/毫升)示于图1D,其中降低的酶浓度可以在视觉上观察到。更详细的分光光度定量ification可以用来绘制吸光度与酶浓度( 图1E)。信号强度对应于酶活性。该测定的可再现性由误差条示出(平均值的标准误差,SEM的三个副本)。关于该测定的可再现性更详细的实验别处8出版。
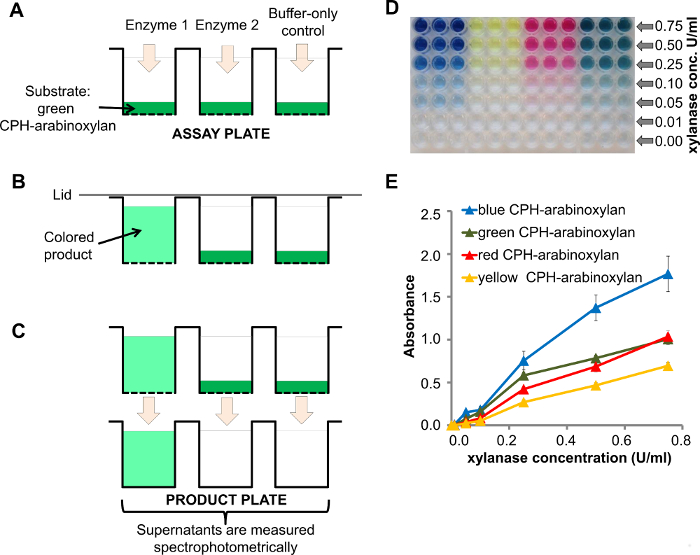
图1. 木聚糖酶处理CPH-阿拉伯木聚糖A)与CPH衬底(测定试剂盒板的计划, 例如 ,CPH-阿拉伯木聚糖)只是加酶1和2的缓冲区之前加载到96孔过滤板的孔-只控制(1酶有内切木聚糖酶的活性); B)用酶1 CPH-阿拉伯木聚糖降解生产的有色上清; c)在真空辅助filtrat在对产品板的上清液的离子,吸光度分光光度计测量;含有D-)产物板治疗CPH-阿拉伯木聚糖的后反应产物在4种不同颜色与在100mM不同浓度的内切 -β-1,4-木聚糖酶的醋酸钠缓冲液,pH值4.5,在室温下60分钟; E)由D采用分光光度法反应产物的量化请点击此处查看该图的放大版本。
有用于在酶筛选使用该测定不同的选项。一种选择是使用含有用于筛选不同的多糖, 例如,具有未知活性的少数(纯化的) 桥 -enzymes的96孔板中。在这种情况下,结果将显示哪些多糖degrad能够由目标酶。为了显示这个原理, 内切 -cellulase被针对不同CPH基板在25℃下进行测试。三种不同的酶浓度(0.5单位/毫升,1.0 U / ml和5U / ml)的温育30分钟。其结果是在产品板( 图2A)清晰可见。成品板此内切 -cellulase由供应商提供指定用于木葡聚糖(罗望子)侧的活性,大麦β-D-葡聚糖,葡甘露聚糖,大麦β-葡聚糖和半乳甘露聚糖低侧的活性。与此相一致,活动附加到纤维素酶被发现对CPH-β-D-葡聚糖(大麦),CPH-木葡聚糖(罗望子),CPH-木聚糖(山毛榉)和低活性对CPH-半乳甘露聚糖( 图2B)。葡甘聚糖未测试。在相同条件下用作阳性对照比以前的:同样CPH基板用市售酶(0.1单位/毫升,0.5U / ml和1.0单位/毫升三种不同的酶浓度)消化实验。所有基材是由阳性对照酶降解和对应于较高的酶浓度( 图2C)的信号强度增加。
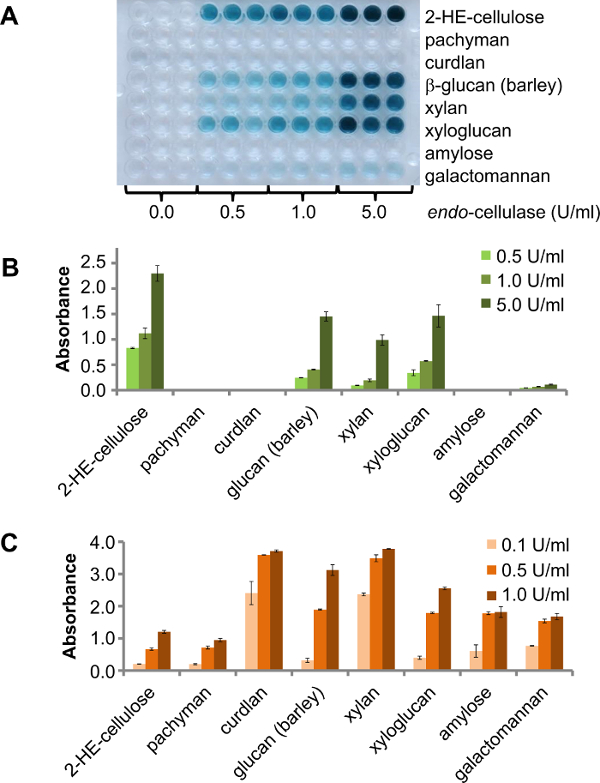
图2. 八个不同CPH基板在搅拌下温育在25℃进行30分钟。A)与内切 -cellulase消化不同CPH基材的产物板,在不同的浓度。B)的活性和各种副活性的定量远藤 -cellulase。误差条代表的三个副本C)的不同的商业酶相应CPH衬底(内切纤维素酶和2- HE-纤维素的活性平均值的标准误差; E-LAMSE和CPH-茯苓,CPH-凝胶多糖,CPH- β葡聚糖(大麦); E-XYAN4和CPH木聚糖,E-XEGP和CPH-木聚糖,E-BLAAM和CPH-直链淀粉,E-BMACJ和CPH-半乳甘露聚糖;从Megazyme的所有的酶)。误差线代表两个副本的平均值的标准误差。 请点击此处查看该图的放大版本。
不溶性生色生物量(ICB)基板是有用的除显色底剧目,因为它们的部分保留在植物细胞壁中它们是生物质的主要成分的多糖的自然布置。 CPH和ICB基板在我们的例子中使用在液体培养基中培养时,分析孢原毛平革菌的分泌酶。的测定试剂盒板的板设置示于图3A中 ,19 CPH基板和5 ICB基板(4个孔用于每个衬底, 图3B)。P. 菌是cultivat编了三天,然后将培养物上清液进行分析。因此,125微升200mM的缓冲液转移至每个孔中,将25μl培养物上清液加入。三种不同pH条件下已经使用乙酸钠缓冲液pH 4.0,磷酸钠缓冲液pH 6.0或pH 8.0( 图3C)进行测试。将板温育在25℃进行2小时的振荡(150rpm)下。
将反应产物转移到产品板( 图3D)和分析。P.菌产生的各种葡聚糖,淀粉和木聚糖( 图3E)的降解酶。低信号可以为半纤维素阿拉伯聚糖(甜菜)和果胶半乳聚糖以及用于RGI(大豆)来检测。产生的酶是在比在中性或微碱性条件下(pH 8.0)的酸性条件下(pH 4.0)更加活跃。对ICB底物活性较低( 图3F)表明当多糖是在一种更自然的情况下,酶的效率是不一样的,与纯多糖,这就是为什么ICB基板上演示酶效率的更现实的观点,如果它被施加到生或预处理过的植物材料。
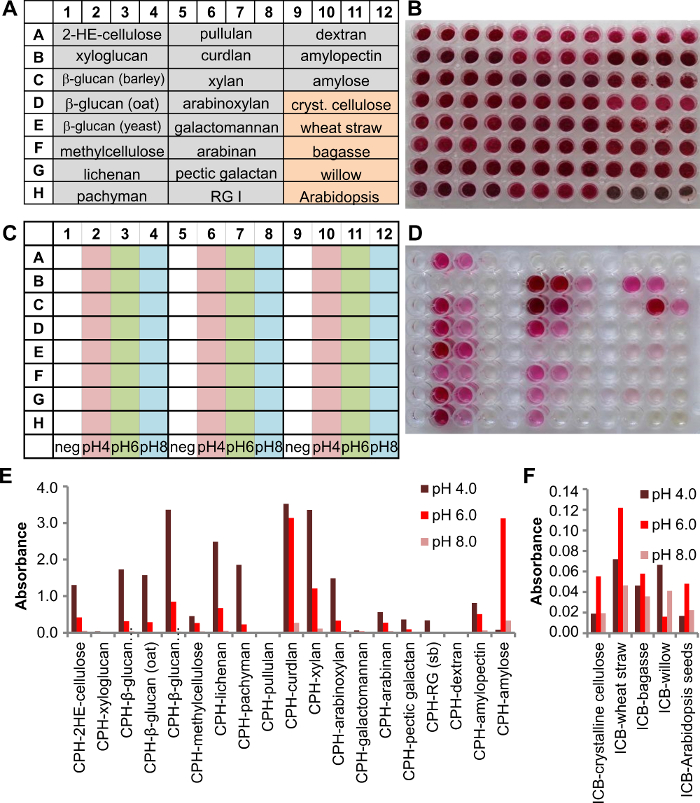
图 3. 白腐真菌 的3天的液体培养培养上清液的筛选 使用含有19 CPH和5 ICB基板。A)的板设置有4口井为每个单独衬底的方案多基片 (灰色背景= CPH基板,橙色背景= ICB衬底)。B)含基材。C中的测定板的照片)方案表示在该实验中使用的缓冲液条件(的200mM醋酸钠pH为4.0,磷酸钠pH 6.0和磷酸钠pH 8.0)中。D)在25℃。E)的吸光度2小时后的产品板的图像在517处检测并绘制为每个单独CPH基板和F )ICB基板结果各自的酶。 请点击此处查看该图的放大版本。
的发色底物,也可以使用通过在一个很好使用不同颜色的CPH衬底的混合物中,并进行分析处理后的反应上清液使用单一酶或酶鸡尾酒研究协同效应。
在图4中所示的以下示例中,红色CPH-纤维素和黄CPH木聚糖底物以大约EQU混合在一起在96孔过滤板的孔Al比率。 图4A示出1小时处理后的有色反应产物在室温下无酶(对照),纤维素CEL(2单位/毫升),木聚糖酶XYL(1U / ml)和一个两种酶的混合物(3个重复的每个的方法)在100mM乙酸钠缓冲液pH 4.5。对于分析,将反应产物通过从350纳米扫描的吸收光谱至700nm( 图4B)通过分光光度法定量。常单独视觉检查可以得到酶是否是作用于一个或多个基板的指示,但是记录吸收光谱,从不同的染料所产生的,也可以使用简单的线性回归8给每个的退化程度的更精确的指示解决基板从该混合物。
使用CPH基板作为基本的混合物增加了吞吐量测定的,从而使可控硅在一个实验中(一个孔)eening针对多达4个不同的底物。在所示的例子是使用了四种不同的衬底:蓝色CPH-β-D-葡聚糖(大麦),黄色CPH木聚糖(山毛榉),绿CPH-直链淀粉和红色CPH-果胶半乳聚糖(羽扇豆)。衬底板的布局示于图4C和图4D中的测定板的图片。将反应物在100mM乙酸钠缓冲液pH 4.5,在25℃和150rpm下进行30分钟。与酶浓度增加第一单一酶与相应CPH基板( 图4E)和着色上清液进行测试以预期的产物板被接收( 图4F,排1A - 12D)。 E行包含在两个不同的CPH基板黄CPH木聚糖和蓝色CPH-β葡聚糖,这被降解与相应的内切酶和木聚糖酶内切葡聚糖酶的不同比例。反应后,结果是visib勒在产品板:反应产物的颜色为暗绿色蓝色,当更多的内切葡聚糖酶是本( 图4F,4E-6E)和变成打火机黄绿色,当内切木聚糖酶的浓度增加( 图4F,10-12E)。同样被认为是在F行,其中两个衬底红色CPH-果胶半乳聚糖和黄色CPH木聚糖被降解与内切 -galactanase和内切木聚糖酶。所有四个不同颜色CPH衬底出席( 图4F,1G-12F)和单酶降解适当CPH基板和通过添加额外的酶被接收的有色反应产物的组合。
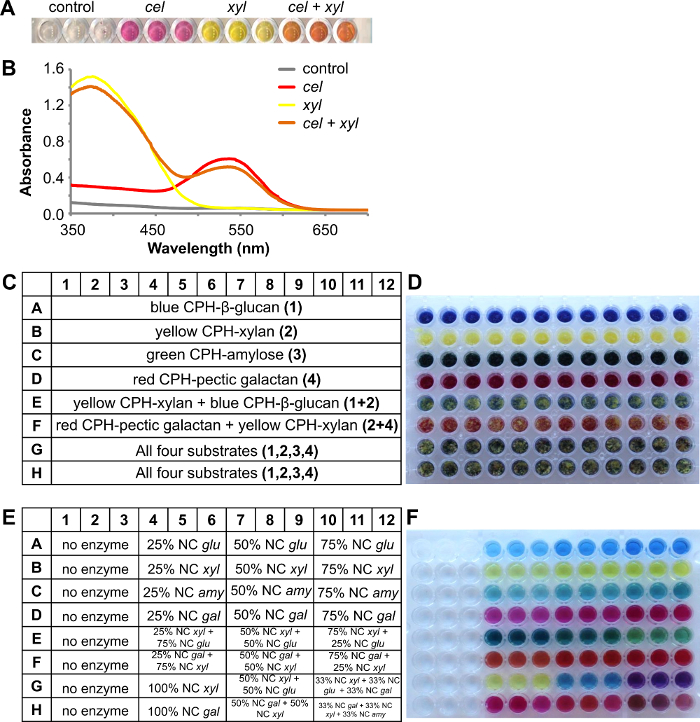
图4. 两个不同CPH基板的组合,红色CPH-纤维素和黄CPH木聚糖,具有不同的酶处理。一个)治疗内切 -cellulase(CEL两个衬底)或内切木聚糖酶(XYL)或两者的酶。B)中的反应上清液的吸收光谱的后反应上清。用不同的酶处理四个不同的CPH基材组合C)含CPH衬底基材板的方案:蓝色CPH-β葡聚糖(大麦),黄CPH木聚糖(山毛榉),绿色CPH-直链淀粉和红色CPH-果胶半乳聚糖(羽扇豆)含有不同CPH基材上测定板的D)的图片E)示出了添加的酶的比率的产品板的计划(名义浓度(NC):GLU = 1 U / ml的内切葡聚糖酶, XYL = 1 U / ml的内切木聚糖酶, 艾米 = 5 U / ml的内切淀粉酶和加仑 = 0.5 U / ml的内切 -galactanase)F)本产品板图片后保温30分钟,在25℃。 请点击此处查看该图的放大版本。
| 基质 | 资源 |
| CPH -2-羟乙基 | N / A |
| (CPH -2- HE-纤维素) | |
| CPH-支链淀粉 | 土豆 |
| CPH-直链淀粉 | 土豆 |
| CPH-阿拉伯聚糖 | 甜菜 |
| CPH-阿拉伯木聚糖 | 小麦 |
| CPH酪蛋白 | 牛乳 |
| CPH-壳聚糖 | 动物源 |
| CPH-凝固剂 | 粪产碱菌 |
| CPH葡聚糖 | 明串珠菌。 |
| CPH-半乳甘露聚糖 | 长豆角 |
| CPH-昆布 | 掌状昆布 |
| CPH-地衣 | 冰岛苔藓 |
| CPH-甲基 | N / A |
| CPH-茯苓多糖 | 茯苓 |
| CPH-果胶半乳聚糖 | 土豆 |
| CPH-普鲁兰 | 出芽短梗霉 |
| CPH-鼠李我(RG I) | 土豆 |
| CPH-鼠李我(半乳糖)* | 土豆 |
| CPH-鼠李 | 大豆 |
| CPH-木聚糖 | 山毛榉 |
| CPH-木葡聚糖 | 罗望子 |
| 大麦CPH-β葡聚糖 | 大麦 |
| 燕麦CPH-β葡聚糖 | 燕麦 |
| 从酵母CPH-β-D-葡聚糖 | 酵母 |
| ICB-拟南芥 | 从莲座叶拟南芥拟南芥的Col-0(成人厂) |
| ICB-拟南芥种子 | 拟南芥 |
| ICB-蔗渣 | 甘蔗 (干植株,茎和叶) |
| ICB-结晶纤维素(滤纸) | 商业3MM滤纸色谱人权委员会文件 |
| ICB-胡芦巴 | 胡芦属种子 |
| ICB-麻 | 大麻属 (干植株,茎和叶) |
| ICB-羽扇豆种子 | 狭叶羽扇豆种子 |
| ICB-花粉P.三叶 | 猫尾草花粉 |
| ICB-云杉 | 云杉(英里LLED树干) |
| ICB烟草 | 从本塞姆氏烟草叶(树苗) |
| ICB-麦秸 | 小麦属 (干植株,茎和叶) |
| ICB-柳 | 柳树 (干成株,研磨树干) |
| ICB-高粱 | 高粱属 (成年植物的叶子) |
| *(与除去β-1,4--D-半乳聚糖侧链内切 -β-1,4-D-半乳聚糖酶) | |
表1. 可用的显色聚合物水凝胶(CPH)和不溶性显色生物质(ICB)衬底的名单。
讨论
我们使用了新一代多色CPH和ICB基板是基于氯代三嗪染料(在表1基板的完整列表)设置在定制设计的商用测定试剂盒。基板的酶消化产生小的,可溶的,染色的产品,是在测定溶液可检测,并且可以使用读板器9进行量化。该试验被设计用于内切短效酶的评价和测定的灵敏度是类似于使用azurine交联(AZCL)所述一个基片10,而其他方法可用于外短效酶11,12。该测定试剂盒的局限性在于该检测内切 -酶的活性,如CPH以及ICB衬底不能降解的由外 -enzymes最可能是由于从染料和交联剂分子8所产生的空间位阻。
该测定在96-逢执行L格式和个人反应发生在孔中。该反应已在板被混合到接收再生的数据。所得上清液被过滤成产品板,其中每个孔的吸光度可以用吸光度法进行定量。的基本原理和测定的布局示于图1中 。该测定法包括测定板(96孔过滤板)与基板,并用酶温育后,将上清液通过过滤到一个明确的孔板和吸光度读取提供酶的特异性和活性的半定量测量。已经显示,当使用CPH基板此筛选测定所用的琼脂平板格式,其中所述可溶的反应产物创建过夜孵育后的着色卤素可使用。8
该检测试剂盒可用于筛选纯化的酶和它们电位侧活动作为证明图2。侧活动可以从一个单一的酶及其混杂的特异性,但也从一个事实,即所分析的样品是不同酶的混合物和它们的协同作用需要研究产生的。此外,因为它已经在以前的研究已经显示,从真菌8以及内源植物酶和细菌(未发表的数据),该酶鸡尾酒,肠道菌群13和培养液可以使用作为酶源。
ICB基板处理生物质击穿的工业生产过程中经常遇到的细胞壁组分的复杂混合物。这些衬底旨在评估多糖可用性,并提供有关如何有效地优化降解鸡尾酒更有效地降解输出信息。 如图3所示CPH和ICB基板可在酶的筛选并排使用-揭示了大量有关酶的特异性信息在优选的衬底(CPH)和含有除了优选底物更紧密地模仿自然界中(ICB)发现的大分子装配其它部件更自然的复杂的两个上下文D活动。使用多个颜色允许对不同酶活性同时检测针对这增加了测定的高通量和multiplexity几个衬底。不同的染料的光谱可以通过简单的线性回归和在大多数情况下,多基片活性可以通过目测单独观察来解决。这样的实验及其结果的模拟例子在图4中描绘。
此法工具箱及其应用的通用性是非常适合的酶和培养液未知活动第一级筛选。这种测定的最重要的方面是它的高通量的性质,可定制性,易用性和灵活性。考虑到这一点,WË认为,这种新型的工具集,将大大改善和加快工业用酶的筛选流程以及学术应用。
披露声明
有日提交的涉及96孔板CPH底物法及96孔ICB底物法(WO2015036000和丹麦的PA 2015年70311)两项专利申请。
致谢
我们要感谢教授J·保罗·诺克斯(利兹大学,英国),谁拍戏提供给他的实验室访问和苏珊·马库斯优秀的技术援助。 JS承认WallTraC项目(欧盟第七框架计划(赠款协议号:263916),并为21世纪的项目生物质(创新基金丹麦;案号103408)SKK的感谢SET4Future项目(丹麦战略研究理事会)在生物价值的战略由丹麦战略研究理事会,丹麦议会的技术和创新(批准案号0603-00522B)成立,并理解复杂多糖系统(格兰特案例酶降解生物学驱动的方法没有。:107279)资助本文仅反映了作者的观点,欧洲联盟不承担责任对于可以由此处提供的信息包含任何使用。
材料
| Name | Company | Catalog Number | Comments |
| assay kit plates | Glycospot | customized assay kit plates | |
| activation solution | Glycospot | for activating CPH substrates | |
| 350 ml receiver plate spacer block for vacuum manifold | Pall Corporation | 5015 | spacer block |
| 96-well MultiScreen HV filter plate, 0.45 µm, clear, non-sterile | Millipore | MSHVN4510 | assay plate |
| 96-Well Microplates, Polypropylene | Greiner Bio-One | 651201 | collection plate after washing the substrates |
| Nunc MicroWell 96-Well Microplates | Thermo Scientific | 269620 | product plate |
| Diaphragm pump MZ 2 NT | Vacuubrand | 732000 | vacuum pump used with the vacuum manifold |
| Infors HT Ecotron | Infors HT | 4950132 (Buch & Holm) | horizontal shaker |
| SpectraMax M5 | Molecular Devices | 10067-750 (VWR) | 96-well plate absorbance reader |
| Vacuum manifold | Pall Corporation | 5017 | vacuum manifold |
| endo-cellulase (EGII) (Trichoderma longibrachiatum) | Megazyme | E-CELTR | cellulase [cel] |
| endo-β-1,4-mannanase (Cellvibrio japonicus) | Megazyme | E-BMACJ | mannanase [man] |
| endo-β-1,3-glucanase (Trichoderma spp.) | Megazyme | E-LAMSE | β-glucanase [glu] |
| endo-β-1,4-D-galactanase (Aspergillus niger) | Megazyme | E-EGALN | galactanase [gal] |
| endo-β-1,4-xylanase M4 (Aspergillus niger) | Megazyme | E-XYAN4 | xylanase [xyl] |
| endo-xyloglucanase (GH5) (Paenibacillus sp.) | Megazyme | E-XEGP | xyloglucanase [xg] |
| α-amylase (Bacillus licheniformis) | Megazyme | E-BLAAM | amylase [amy] |
参考文献
- Lombard, V., Ramulu, H. G., Drula, E., Coutinho, P. M., Henrissat, B. The carbohydrate-active enzymes database (CAZy) in 2013. Nucleic Acids Res. 42 (Database issue), D490-D495 (2014).
- Cantarel, B. L., et al. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics. Nucleic Acids Res. 37, D233-D238 (2009).
- Agblevor, F. A., Murden, A., Hames, B. R. Improved method of analysis of biomass sugars using high-performance liquid chromatography. Biotechnol. Lett. 26 (15), 1207-1211 (2004).
- Black, G. E., Fox, A. Recent progress in the analysis of sugar monomers from complex matrices using chromatography in conjunction with mass spectrometry or stand-alone tandem mass spectrometry. J. Chromatogr. A. 720 (1-2), 51-60 (1996).
- Miller, G. L. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31, 426-428 (1959).
- Somogyi, M. Notes on Sugar Determination. J. Biol. Chem. 195 (1), 19-23 (1952).
- Zantinge, J. L., Huang, H. C., Cheng, K. J. Microplate diffusion assay for screening of beta-glucanase-producing microorganisms. Biotechniques. 33 (4), 798(2002).
- Kračun, S. K., et al. A new generation of versatile chromogenic substrates for high-throughput analysis of biomass-degrading enzymes. Biotechnol Biofuels. 8, (2015).
- Leemhuis, H., Kragh, K. M., Dijkstra, B. W., Dijkhuizen, L. Engineering cyclodextrin glycosyltransferase into a starch hydrolase with a high exo-specificity. J. Biotechnol. 103 (3), 203-212 (2003).
- Nyyssonen, M., et al. Coupled high-throughput functional screening and next generation sequencing for identification of plant polymer decomposing enzymes in metagenomic libraries. Front Microbiol. 4, 282(2013).
- Sweeney, M. D., Xu, F. Biomass Converting Enzymes as Industrial Biocatalysts for Fuels and Chemicals: Recent Developments. Catalysts. 2 (2), 244-263 (2012).
- Biely, P., et al. Action of xylan deacetylating enzymes on monoacetyl derivatives of 4-nitrophenyl glycosides of beta-D-xylopyranose and alpha-L-arabinofuranose. J. Biotechnol. 151 (1), 137-142 (2011).
- Mackenzie, A. K., et al. A polysaccharide utilization locus from an uncultured bacteroidetes phylotype suggests ecological adaptation and substrate versatility. Appl Environ Microbiol. 81 (1), 187-195 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。