Method Article
Criblage à haut débit d'Enzymes Glucides dégradant Utilisation Novel Insoluble chromogénique Substrat Assay Kits
Dans cet article
Résumé
A high-throughput assay for enzyme screening is described. This multiplexed ready-to-use assay kit comprises of pre-chosen Chromogenic Polymer Hydrogel (CPH) substrates and complex Insoluble Chromogenic Biomass (ICB) substrates. Target enzymes are polysaccharide degrading endo-enzymes and proteases.
Résumé
Carbohydrates active enzymes (CAZymes) have multiple roles in vivo and are widely used for industrial processing in the biofuel, textile, detergent, paper and food industries. A deeper understanding of CAZymes is important from both fundamental biology and industrial standpoints. Vast numbers of CAZymes exist in nature (especially in microorganisms) and hundreds of thousands have been cataloged and described in the carbohydrate active enzyme database (CAZy). However, the rate of discovery of putative enzymes has outstripped our ability to biochemically characterize their activities. One reason for this is that advances in genome and transcriptome sequencing, together with associated bioinformatics tools allow for rapid identification of candidate CAZymes, but technology for determining an enzyme's biochemical characteristics has advanced more slowly. To address this technology gap, a novel high-throughput assay kit based on insoluble chromogenic substrates is described here. Two distinct substrate types were produced: Chromogenic Polymer Hydrogel (CPH) substrates (made from purified polysaccharides and proteins) and Insoluble Chromogenic Biomass (ICB) substrates (made from complex biomass materials). Both CPH and ICB substrates are provided in a 96-well high-throughput assay system. The CPH substrates can be made in four different colors, enabling them to be mixed together and thus increasing assay throughput. The protocol describes a 96-well plate assay and illustrates how this assay can be used for screening the activities of enzymes, enzyme cocktails, and broths.
Introduction
Techniques for mining genomes and metagenomes have developed rapidly in recent years, and so have medium- and high-throughput strategies for cloning and expressing recombinant enzymes. Furthermore, bioinformatic resources and associated depositories, such as (CAZy)1,2 have expanded greatly. However, there are considerable challenges inherent in the exploitation of microbial enzyme diversity for industrial purposes and the empirical determination of enzyme activities has now become a serious bottleneck. For example, it is estimated that, using current methods, we can safely predict the activities of no more than 4% of the proteins within the CAZy database. Although numerous methods are available for monitoring enzyme activities they all have some limitations. Well-established techniques based on chromatography combined with mass spectrometry are available for assessing the oligomeric fragments of glycosyl hydrolase (GH) activities3,4. However, these approaches are labor intensive and generally low-throughput. Methods based on the measurement of reducing sugars such as the dinitrosalicylic acid5 and Nelson-Somogyi6 assays are widely used for assessing GH activities. However, these assays have limited throughput and can be prone to side-reactions. Individual chromogenic polysaccharide substrates, such as azurine cross-linked (AZCL) are widely used for determination of enzyme activities, but purchasing all of the substrates separately and manually distributing the substrate powders within the assay plate can be cumbersome and costly7.
We have developed a new generation of chromogenic polymer hydrogel (CPH) substrates based on chlorotriazine dyes that, when used in conjunction with a 96-well filter plate, form a high-throughput assay system. Additional Insoluble Chromogenic Biomass (ICB) substrates were developed which provide information about substrate availability within complex polymer mixtures, such as those that exist in lignocellulosic biomass. Each substrate can be produced in one of four colors, and different colored substrates can be combined in a single well. In this protocol is shown that this methodology can be applied to a wide variety of polysaccharides and proteins and the potential for screening GHs, lytic polysaccharide monooxygenases (LPMOs) and proteases. Specific protocols are provided for the use of 96 well plates and representative results illustrate the high efficiency of the CPH and ICB substrate kits as tools for enzyme screening.
One significant advantage of the assay kits described, regardless of the substrate, is that the kits are ready to use within 15 minutes, after the activation step. This eliminates the need for time-consuming assembly of the assay from raw substrate materials as it is the case with some other methods7. The CPH and ICB substrates have excellent storage (at least one year at room temperature), pH and temperature stability 8 and require no specialized equipment or training. The CPH or ICB assays are based on 96-well filter plate within which the reaction with the enzyme is conducted. If the enzyme is active with a given substrate, soluble dyed oligomers are generated, producing a colored supernatant which can then be filtered into a regular clear-well 96-well plate using a vacuum manifold or a centrifuge 8.
The substrates are dyed with chlorotriazine dyes which absorb in the visible spectrum (VIS) range and individual colors (red, blue, yellow and green) can be resolved using linear regression if different CPH substrates of different colors are mixed in a single well, and the enzyme acts on more than one substrate. The resulting plate with the supernatants can be measured using a standard microtiter-plate reader capable of measuring absorbance in the VIS range. Mixing different substrates with different colors in one well increases the throughput of the assay system, to a total of 384 experiments in a 96-well plate (4 different substrates of different colors per well).
CPH substrates provide a valuable tool for assessing the specific activity of an enzyme while ICB substrates are used to evaluate the capacity of an enzyme to digest a component within the context of complex substrate mixtures that enzymes usually encounter within biomass. Although ICB substrates do not provide information about individual enzyme specificities, they are nonetheless useful tools for assessing the commercial performance of enzymes, cocktails or broths.
Protocole
1. chromogénique Assay avec CPH Substrats dans une plaque à 96 puits Format
- L' activation de la plaque de kit de dosage
- Activez le filtre à 96 puits (contenant du bleu CPH-xylane) kit de dosage plaque (Liste des matériaux) en ajoutant une solution de 200 pi d'activation (obtenue avec le kit) dans chaque puits, suivi de 10 minutes d'incubation à la température ambiante sans agitation.
- Appliquer vide à l'aide d'un collecteur à vide (avec le bloc d'espacement à l'intérieur et toute norme, plaque de 96 puits transparente comme une plaque de collection) pour éliminer la solution d'activation existante. Il est également possible d'utiliser une centrifugeuse à 2700 g pendant 10 minutes pour cette étape à la place du collecteur à vide.
- Laver les substrats CPH en ajoutant 100 pi d'eau stérile et on applique le vide (ou d'une force centrifuge) pour éliminer le stabilisant. Répétez cette étape deux fois plus et les plaques sont maintenant prêts à utiliser.
- la réaction enzymatique
NOTE: Toujours inclure tamponseul en tant que témoin négatif et si les enzymes précédemment caractérisées possibles en tant que témoins positifs. Utilisez un nombre statistiquement approprié de répliques. Les substrats CPH sont stables entre pH 3,0 à 10,0, et le volume total de la solution d'enzyme de fin de tampon dans chaque puits ne doit pas dépasser 180 pl. Extrait de plante ou de bouillon de culture peuvent aussi être utilisés à la place d'une solution d'enzyme purifiée.- Ajouter 150 ul de 100 mM de tampon d'acétate de sodium, pH 4,5 et 5 ul de solution -cellulase endo (jusqu'à une concentration finale de 1 U / ml) à chaque puits de la plaque de kit de dosage.
- Mettez la plaque de produit (une plaque claire et compatible avec le lecteur microplaque-plaque) sous la plaque de kit de dosage pour recueillir toute fuite potentielle de la plaque de réaction pendant l'agitation.
- Incuber la plaque de kit d'essai à 25 ° C pendant 30 min dans un agitateur horizontal à 150 tours par minute.
Remarque: Le mélange de la réaction dans la plaque de kit d'essai durant l'incubation est essentiel pour parvenir à une cohérence et reprorésultat ductible. substrats CPH sont stables jusqu'à 90 ° C. Le temps d'incubation devrait être augmentée jusqu'à 24 h pour tester des bouillons de culture contenant une concentration inconnue de l'enzyme avec des substrats de MNC. A noter que les durées d'incubation appropriées dépendent de l'activité de l'enzyme (s), mais en général, s'il n'y a pas d'activité détectable dans les 24 heures, il est probable que l'enzyme ne dégrade pas le substrat testé. Une enzyme active est dégradant les polysaccharides insolubles chromogènes du substrat MNC en oligosaccharides chromogènes solubles, qui sont visibles en tant que surnageant de couleur. - Placer la plaque de produit propre à l'intérieur du collecteur de vide avec le bloc d'espacement à l'intérieur.
- Placez le test kit plaque sur le dessus et appliquer le vide (pression négative maximale de -60 kPa). Il est également possible d'utiliser une centrifugeuse à 2700 g pendant 10 min.
NOTE: Le filtrat contenant les oligosaccharides de couleur comme produit de réaction est maintenant dans la plaque de produit pour une analyse plus poussée 8 .
- Détection et quantification
- Vérifier que le volume de liquide dans chaque puits de la plaque de produit est approximativement la même par inspection visuelle.
- Lire l'absorbance de la plaque de collecte à 595 nm pour le bleu CPH-xylane en utilisant un lecteur de plaque.
- En faisant une analyse des données, soustraire la mémoire tampon, seules les valeurs de contrôle négatif à partir des valeurs provenant des puits où l'on a ajouté une enzyme. Calculer la valeur moyenne et l'erreur type de la moyenne (SEM) dans les puits réplicats 8.
2. chromogénique Assay avec AOI Substrats dans un 96 puits Format
- la réaction enzymatique
- Ajouter 150 ul de 100 mM de tampon d'acétate de sodium, pH 4,5 et 5 ul de 31 U / ml endo -xylanase solution à chaque puits de la plaque de kit de dosage contenant de la paille AOI de blé rouge (concentration enzymatique finale dans le puits: 1 U / ml) .
NOTE: Les plaques de kit d'essai (filtre à 96 puits plAtes contenant des substrats AOI) sont fabriqués comme décrit dans la littérature (voir la liste des matériaux). Les substrats d'AOI sont stables dans des tampons ayant un pH compris entre un pH de 3,0 à 10,0. Toujours inclure tampon seul comme témoin négatif, les enzymes commerciales comme un contrôle positif et utiliser un nombre statistiquement approprié de répliques.- Ne pas activer les substrats ICB comme la plaque de substrat de CPH, mais retirer le stabilisateur en lavant trois fois avec 100 pi d'eau suivie d'une filtration sous vide ou centrifugation.
- Mettez la plaque de produit sous la plaque de substrat pour recueillir toute fuite potentielle de la plaque de substrat pendant l'agitation.
- Incuber la réaction à 25 ° C sous agitation à 150 tours par minute pendant 2 heures.
NOTE: Une enzyme active est dégradant les polysaccharides chromogènes insolubles dans le substrat ICB en oligosaccharides solubles, qui sont visibles comme surnageant de couleur. substrats ICB sont stables jusqu'à 90 ° C. L'incubation time devrait être augmentée jusqu'à 24 h si enzymes non purifiées tels que des bouillons de culture sont utilisés. - Placer la plaque de produit à l'intérieur du collecteur à vide avec le bloc d'espacement à l'intérieur.
- Placez le test kit plaque sur le dessus et appliquer le vide (pression négative maximale de -60 kPa) ou utiliser une centrifugeuse pour filtrer le produit de la plaque de kit d'essai dans le puits de la plaque de produit.
NOTE: Le filtrat contenant les oligosaccharides de couleur en tant que produit de réaction est présent dans la plaque de recouvrement pour une analyse plus poussée 8.
- Ajouter 150 ul de 100 mM de tampon d'acétate de sodium, pH 4,5 et 5 ul de 31 U / ml endo -xylanase solution à chaque puits de la plaque de kit de dosage contenant de la paille AOI de blé rouge (concentration enzymatique finale dans le puits: 1 U / ml) .
- Détection et quantification
- Vérifier que le volume de liquide dans chaque puits de la plaque de recouvrement est approximativement la même par inspection visuelle.
- Lire l'absorbance de la plaque de collecte à 517 nm pour la paille de blé ICB rouge à l'aide d'un lecteur de plaque.
- En faisant une analyse des données - soustraire la mémoire tampon - seules les valeurs de contrôle négatif à partir des valeurs provenant des puits où une enzymeétait ajouté. Calculer la valeur moyenne et l'erreur type de la moyenne (SEM) dans les puits réplicats 8.
NOTE: En cas de dépistage enzymes inconnues, nous vous suggérons de faire une série de dilution afin d'obtenir des données plus détaillées sur la dynamique de l'activité de l'enzyme.
Résultats
Le haut-débit et la capacité de multiplexage de ce test est basé sur un polymère insoluble dans chromogénique (ou protéine) hydrogel (CPH) des substrats disposés dans des plaques filtrantes à 96 puits. Les enzymes ainsi que des contrôles négatifs sont ajoutés à la plaque de kit d'essai (figure 1A) et les enzymes dégradent le substrat correspondant à produire un surnageant coloré (figure 1B). Une fois la réaction terminée, le surnageant est transféré dans une plaque de produit limpide puits et l'absorbance peut être mesurée directement à l' aide d' un spectrophotomètre approprié pour des plaques à 96 puits (figure 1C).
Un exemple d'une réponse à la dose de CPH-arabinoxylane xylanase à différentes concentrations de l'enzyme (0,00 à 0,75 U / ml) est représenté sur la figure 1D , lorsque la concentration d'enzyme décroissante peut être observée visuellement. A quant spectrophotométrique plus détailléification peut être utilisé pour tracer l'absorbance en fonction de la concentration enzymatique (figure 1E). L'intensité du signal correspondant à l'activité enzymatique. La reproductibilité du test est indiquée par les barres d'erreur (erreur standard de la moyenne, SEM, de trois répliques). Des expériences plus détaillées sur la reproductibilité de cet essai sont publiés ailleurs 8.
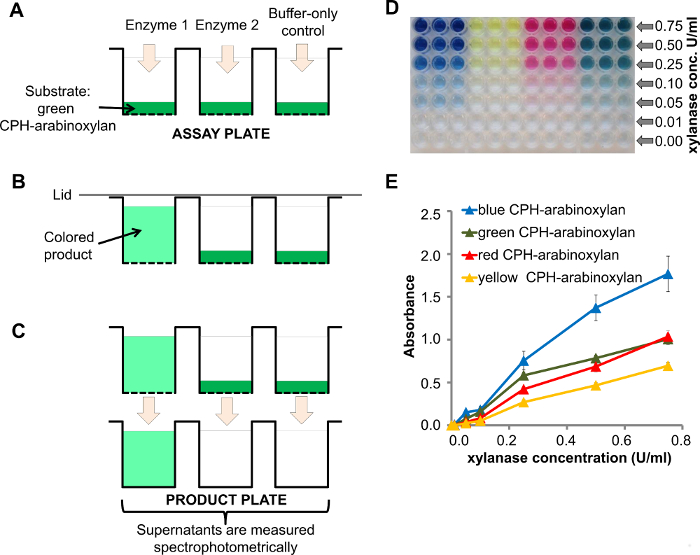
Figure 1. Traitement xylanase de CPH-arabinoxylane. A) Un schéma de la plaque de kit d'essai avec le substrat CPH (par exemple, CPH-arabinoxylane) chargé dans 96 puits puits de plaques de filtre juste avant l'addition d'enzymes 1 et 2 et le tampon contrôle -seulement (enzyme 1 avait une activité -xylanase endo); B) dégradation de CPH-arabinoxylane par l' enzyme 1 produit un surnageant de couleur; C) Sur Filtrat sous vide assistéion des surnageants de la plaque de produit, l'absorbance est mesurée par spectrophotométrie; D) , la plaque de produit contenant les produits de réaction après le traitement de CPH-arabinoxylane en 4 couleurs différentes avec différentes concentrations de l' endo -β-1,4-xylanase dans 100 mM tampon d'acétate de sodium, pH 4,5 pendant 60 min à température ambiante;. E) Quantification des produits de réaction de D à l' aide de spectrophotométrie S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Il existe différentes options pour l'utilisation de ce test dans le dépistage enzyme. Une option consiste à utiliser une plaque de 96 puits contenant différents polysaccharides pour le dépistage, par exemple, un petit nombre de (purifié) endo -enzymes avec une activité inconnue. Dans ce cas, le résultat montrera que les polysaccharides sont Dégradmesure par l'enzyme cible. Pour afficher ce principe, un -cellulase endo a été testée contre différents substrats CPH à 25 ° C. Trois concentrations différentes d'enzyme (0,5 U / ml, 1,0 U / ml et 5 U / ml) ont été incubées pendant 30 min. Le résultat est clairement visible dans la plaque de produit (figure 2A). La fiche produit pour cette endo -cellulase fourni par le fournisseur spécifie côté-activité pour le xyloglucane (tamarin), orge β-glucanes, glucomannane, xylane Birchwood et côté bas-activité pour galactomannane. Conformément à cela, l' activité supplémentaire pour cellulase a été trouvée contre CPH-β-glucane (orge), CPH-xyloglucane (tamarin), CPH-xylane (hêtre) et une faible activité contre CPH-galactomannane (figure 2B). Glucomannan n'a pas été testé. Les mêmes substrats de MNC ont été digérés avec les enzymes disponibles dans le commerce (trois différentes concentrations d'enzyme: 0,1 U / ml, 0,5 U / ml et 1,0 U / ml) utilisés en tant que témoins positifs dans les mêmes conditions que le précédentexpérience. Tous les substrats ont été dégradés par l'enzyme témoin positif et l'intensité de l' augmentation du signal correspondant à une concentration plus élevée de l' enzyme (figure 2C).
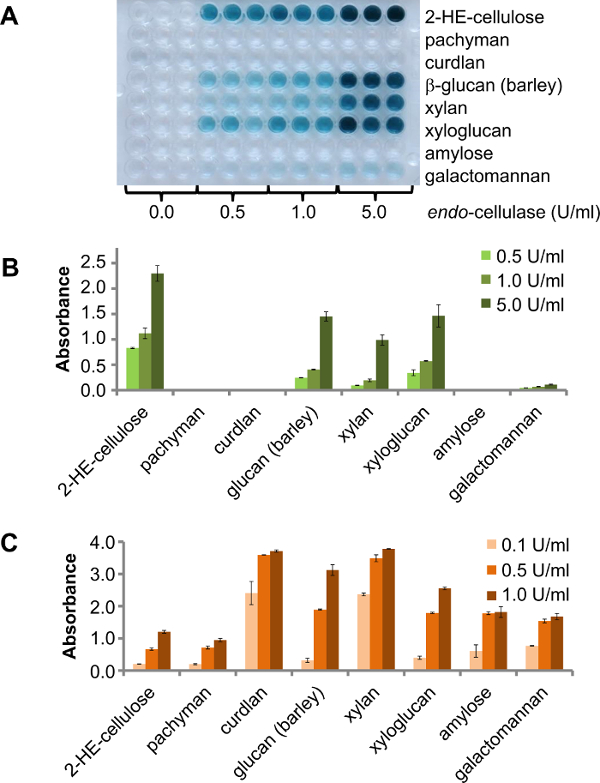
Figure 2. Huit substrats CPH différentes ont été mises en incubation sous agitation à 25 ° C pendant 30 min. A) La plaque de produit de substrats différents CPH digérées avec une endo -cellulase, à différentes concentrations. B) Quantification de l'activité et de diverses activités latérale endo -cellulase. Les barres d'erreur représentent l'erreur standard de la moyenne de trois répliques C) de l' activité de différentes enzymes commerciales au substrat correspondant CPH (endo-cellulase et 2-HE-cellulose;. E-LAMSE et CPH-pachyman, CPH-curdlan, CPH- β-glucane (orge); E-XYAN4 et CPH-xylane, E-XEGP et CPH-xyloglucane, E-BLAAM et CPH-amylose, E-BMACJ et CPH-galactomannane; toutes les enzymes de Megazyme). Les barres d'erreur représentent l'erreur standard de la moyenne des deux répliques. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
La biomasse chromogénique (ICB) substrats insolubles sont un complément utile au répertoire de substrat chromogène parce qu'ils conservent en partie la disposition naturelle des polysaccharides dans les parois des cellules végétales qui sont le constituant majeur de la biomasse. CPH et ICB substrats sont utilisés dans notre exemple pour analyser les enzymes sécrétées de Phanerochaete chrysosporium lorsqu'elles sont cultivées dans un milieu liquide. La configuration de la plaque de la plaque de kit d'essai est représenté sur la figure 3A, avec 19 CPH substrats et 5 substrats ICB (4 puits pour chaque substrat, figure 3B). P. chrysosporium était cultivated pendant trois jours, puis le surnageant de culture analysée. Par conséquent, 125 ul de tampon 200 mM a été transféré à chaque surnageant de culture bien et 25 ul ajouté. Trois conditions de pH différentes ont été testées en utilisant un tampon d'acétate de sodium à pH 4,0, un tampon de phosphate de sodium pH 6,0 ou pH 8,0 (figure 3C). La plaque a été incubée sous agitation (150 rpm) à 25 ° C pendant 2 heures.
Les produits de réaction ont été transférés dans la plaque de produit (figure 3D) et analysées. P. chrysosporium produit des enzymes pour la dégradation de divers glucanes, l' amidon et les xylanes (Figure 3E). des signaux plus faibles pourraient être détectés pour la hémicelluloses arabinan (betterave à sucre) et galactane pectique ainsi que pour RGI (soja). Les enzymes produites étaient plus actives dans des conditions acides (pH 4,0) que dans des conditions neutres ou légèrement basiques (pH 8,0). Activité inférieure vers des substrats ICB (Figure 3F)démontre que lorsque les polysaccharides sont dans un contexte plus naturel, l'efficacité de l'enzyme est pas de même qu'avec un polysaccharide pur et qui est la raison pour laquelle les substrats d'AOI montrent une vue plus réaliste de l'efficacité enzymatique, si elle était appliquée à la matière première ou pré matériel végétal traité.
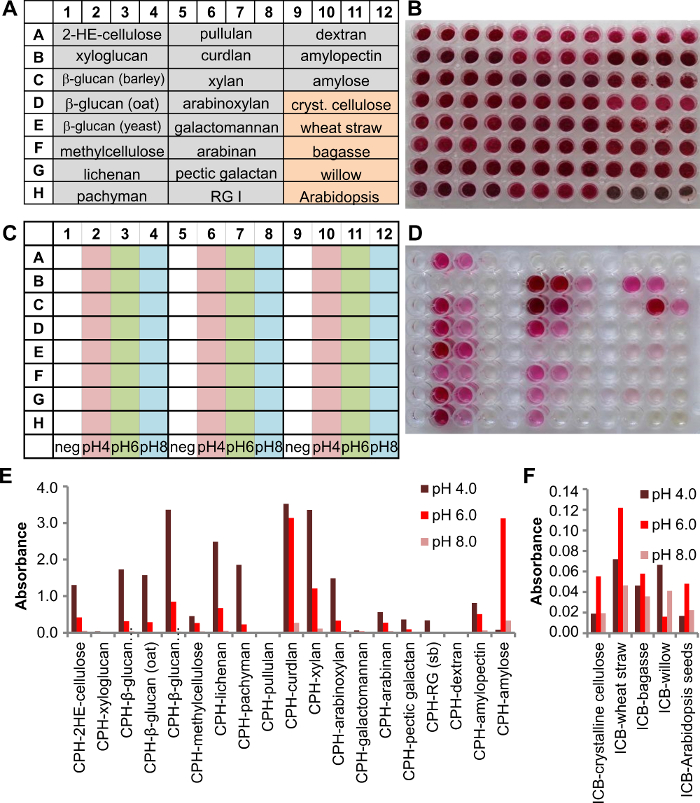
Figure 3. Projection d'un surnageant de culture à partir d' une ancienne culture de Phanerochaete chrysosporium liquide 3 jours en utilisant une plaque de substrat multicouche contenant 19 CPH et 5 ICB substrats. A) un schéma de la configuration de la plaque avec 4 puits pour chaque substrat individuel (fond gris = substrats CPH, fond orange = substrats AOI). B) Photo de la plaque d'essai contenant le substrat. C) Schéma montrant les conditions de tampon utilisées dans cette expérience (200 mM d' acétate de sodium pH 4,0, le phosphate de sodium pH 6,0 et de phosphate de sodium pH 8,0). D) image de la plaque de produit après 2 heures à 25 ° C. E) absorbances ont été détectés à 517 nm et tracées pour chaque substrat CPH individuel et F ) les résultats de substrat ICB pour les enzymes respectives. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Les substrats chromogènes peuvent également être utilisés pour étudier les effets synergiques en utilisant un mélange de différents substrats colorés MNC dans un puits et l'analyse du surnageant de réaction après le traitement en utilisant des enzymes uniques ou des cocktails d'enzymes.
Dans l'exemple suivant représenté sur la figure 4, la cellulose CPH-rouge et des substrats CPH-xylane jaune ont été mélangés à un peu près équAl dans 96 puits , les puits des plaques de filtre. La figure 4A montre les produits de réaction de couleur après un traitement de 1 heure à température ambiante, sans enzyme (témoin), de la cellulose cel (2 U / ml), la xylanase xyl (1 U / ml) et mélange des deux enzymes (3 répétitions pour chaque méthode) dans 100 mM de tampon acétate de sodium pH 4,5. Pour l' analyse, le produit réactionnel a été quantifié par spectrophotométrie en balayant le spectre d'absorbance de 350 nm à 700 nm (figure 4B). Souvent , une inspection visuelle seule ne peut donner une indication si l'enzyme agit sur un ou plusieurs substrats, cependant enregistré les spectres d'absorption provenant de différents colorants peuvent également être résolu en utilisant une régression linéaire simple 8 pour donner une indication plus précise de l'ampleur de la dégradation de chaque substrat à partir du mélange.
En utilisant des substrats sous forme de mélanges CPH sensiblement ajoute au débit de l'essai, ce qui permet screening contre un maximum de 4 substrats différents dans une expérience (un puits). Dans l'exemple illustré quatre substrats différents utilisés: CPH-de β-glucane bleu (orge), jaune CPH-xylane (hêtre), vert CPH-amylose et rouge CPH-pectique galactane (lupin). La disposition de la plaque de substrat est représentée sur la figure 4C et une image de la plaque d'essai sur la figure 4D. La réaction a été réalisée dans 100 mM de tampon acétate de sodium pH 4,5 pendant 30 min à 25 ° C et à 150 tours par minute. Premières enzymes individuelles avec augmentation de la concentration de l' enzyme ont été testées avec le substrat correspondant CPH (Figure 4E) et le surnageant de couleur a été reçu comme prévu dans la plaque de produit (Figure 4F, ligne 1A - 12D). La ligne E contenait les deux substrats différents CPH jaune CPH-xylane et le bleu CPH-β-glucanes qui ont été dégradées avec différents rapports des enzymes correspondantes endo -xylanase et d' endo - glucanase. Après la réaction, le résultat est Visible dans la plaque de produit: la couleur du produit de réaction était plus sombre vert-bleu, lorsque plus endo glucanase était présent (Figure 4F, 4E-6E) et transformé en un jaune-vert clair, lorsque la -xylanase concentration endo augmenté ( Figure 4F, 10-12E). La même chose est visible dans la ligne F, où les deux substrats rouge de galactane CPH-pectique et jaune CPH-xylane ont été dégradés avec endo -galactanase et endo -xylanase. Tous les quatre substrat MNC de couleur différente sont présents (figure 4F, 1G-12F) et des enzymes uniques dégradé le substrat CPH approprié et en ajoutant des enzymes supplémentaires d' une combinaison des produits de réaction de couleur a été reçue.
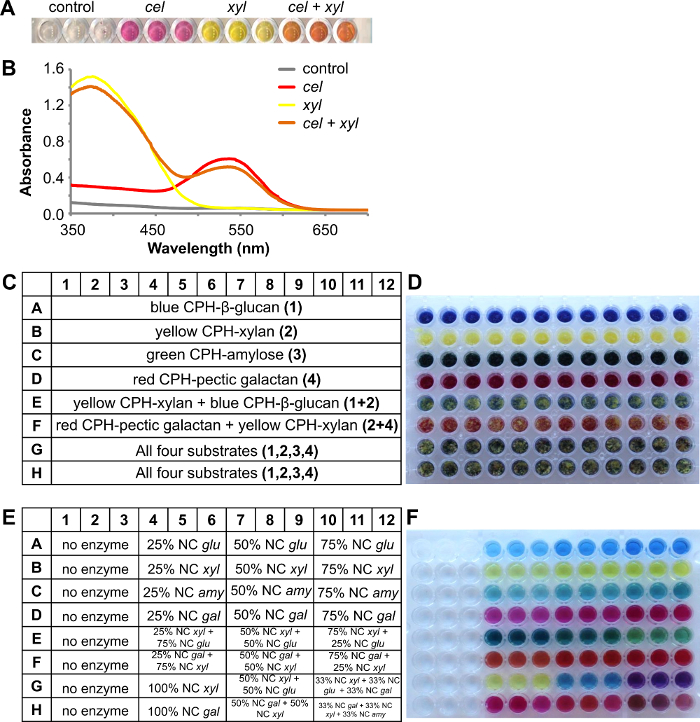
La figure 4. Une combinaison de deux substrats différents CPH, CPH-cellulose , rouge et jaune CPH-xylane, traitée avec des enzymes différentes. UNE) Surnageants de réaction après un traitement de deux substrats avec endo -cellulase (cel) ou endo -xylanase (xyl) ou les deux enzymes. B) des spectres d' absorbance des surnageants de réaction. Une combinaison de quatre substrats CPH différents traités avec différentes enzymes C) Schéma de la plaque de substrat contenant les substrats CPH:. Bleu CPH-β-glucane (orge), jaune CPH-xylane (hêtre), vert CPH-amylose et CPH- rouge galactane pectique (lupin) D) Image de la plaque d'essai contenant les différents substrats CPH E) Schéma de la plaque du produit faisant apparaître le rapport des enzymes ajoutées (concentrations nominales (NC):.. glu = 1 U / ml endo glucanase, Xyl = 1 U / ml endo -xylanase, amy = 5 U / ml endo amylase et gal = 0,5 U / ml endo -galactanase). F) Photo de la plaque de produit après incubation de 30 min à 25 ° C. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Substrat | La source |
| CPH-2-hydroxyéthylcellulose | N / A |
| (CPH-2-HE-cellulose) | |
| CPH-amylopectine | pomme de terre |
| CPH-amylose | pomme de terre |
| CPH-arabinan | Betterave à sucre |
| CPH-arabinoxylane | blé |
| CPH-caséine | lait de vache |
| CPH-chitosan | origine animale |
| CPH-curdlan | Alcaligenes faecalis |
| CPH-dextran | Leuconostoc spp. |
| CPH-galactomannane | caroube |
| CPH-laminarine | Laminaria digitata |
| CPH-lichénane | mousse islandaise |
| CPH-méthylcellulose | N / A |
| CPH-pachyman | Poria cocos |
| CPH-pectique galactane | pomme de terre |
| CPH-pullulane | Aureobasidium pullulans |
| CPH-rhamnogalacturonane I (RG I) | pomme de terre |
| CPH-rhamnogalacturonane I (Gal) * | pomme de terre |
| CPH-rhamnogalacturonane | soja |
| CPH-xylane | Beechwood |
| CPH-xyloglucane | Tamarin |
| CPH-β-glucanes de l'orge | orge |
| CPH-β-glucanes d'avoine à partir | avoine |
| CPH-β-glucane de levure | Levure |
| ICB-Arabidopsis | Rosette part de Arabidopsis thaliana Col-0 (plante adulte) |
| graines ICB-Arabidopsis | Arabidopsis thaliana |
| ICB-bagasses | Saccharum officinarum (plante adulte séchée, tige et feuilles) |
| cellulose ICB-cristallin (papier filtre) | papier Whatman 3MM Chr Chromatographie commerciale |
| graines ICB-fenugrec | Trigonella spp. Graines |
| ICB-chanvre | Cannabis spp. (Plante adulte séchée, tige et feuilles) |
| graines ICB-lupin | Lupinus angustifolius graines |
| ICB-pollen P. pratense | Phleum pratense pollen |
| ICB-épinette | Picea spp. (Miarbre LLED du tronc) |
| ICB-tabac | feuilles de Nicotiana benthamiana (jeune plante) |
| paille ICB-blé | Triticum spp. (Plante adulte séchée, tige et feuilles) |
| ICB-willow | Salix spp. (Plante adulte séché, arbre blanchi tronc) |
| ICB-Sorgho | Sorghum spp. (Feuilles de la plante adulte) |
| (chaînes latérales β-1,4-D-galactane enlevés avec endo -β-1,4-D-galactanase de) * | |
Tableau 1. Liste des disponibles chromogénique Polymer Hydrogel (CPH) et Insoluble chromogénique Biomasse (ICB) substrats.
Discussion
Nous utilisons une nouvelle génération de CPH et ICB substrats multicolores qui sont basées sur des colorants chlorotriazine (liste complète des substrats dans le tableau 1) disposé dans un kit d'essai commercial conçu sur mesure. La digestion enzymatique des substrats donne de petits produits, solubles, teints qui sont détectables dans la solution de dosage et peuvent être quantifiés en utilisant un lecteur de plaque 9. Ce dosage est conçu pour l' évaluation des enzymes endo -acting et la sensibilité de l'essai est identique celui qui utilise l' azurine réticulé (AZCL) substrats 10, tandis que d' autres méthodes sont disponibles pour exo enzymes -acting 11,12. La limitation de ce kit d'essai réside dans la détection de l' activité endo -enzyme, comme CPH ainsi que les substrats ICB ne sont pas dégradables par exo -enzymes très probablement due à un encombrement stérique résultant des colorants et des molécules réticulantes 8.
Le dosage est réalisé dans un 96 welformat l et les réactions individuelles ont lieu dans les puits. La réaction doit être mélangé dans la plaque pour recevoir des données reproductibles. Les surnageants résultants sont filtrés dans une plaque de produit où l'absorbance de chaque puits peut être quantifiée en utilisant la spectrométrie d'absorption. Les principes de base et l'agencement de l'essai sont présentés sur la figure 1. Le test se compose d'une plaque d'essai (une plaque filtrante à 96 puits) avec les substrats, et après incubation avec des enzymes, le surnageant est filtré à travers dans une plaque de puits claire et les absorbances sont lues à fournir une mesure semi-quantitative de la spécificité et l'activité enzymatique. Il a été démontré que cet essai de criblage en utilisant des substrats MNC peut également être utilisé dans un format de plaque de gélose, où les produits de réaction solubles créent un halo coloré après incubation pendant une nuit. 8
Les kits de test peuvent être utilisés pour cribler des enzymes purifiées et leurs activités secondaires potentiels comme le démontreFigure 2. Side-activités peuvent survenir à partir d' une seule enzyme et sa spécificité promiscuité , mais aussi à partir d' un fait que l'échantillon analysé est un mélange de différentes enzymes et leur effet synergique doit être étudié. En outre, comme il a été démontré dans des études précédentes, que les cocktails enzymatiques, microbiote intestinal 13 et de la culture de champignons potages 8, ainsi que l' enzyme et les bactéries (données non publiées) végétal endogène peuvent être utilisés comme source d'enzyme.
substrats AOI traitent des mélanges complexes de composants de paroi cellulaire souvent rencontrés dans les procédés industriels de décomposition de biomasse. Ces substrats sont conçus pour évaluer la disponibilité de polysaccharide et fournir des informations sur la façon d'optimiser efficacement les cocktails de dégradation pour la sortie de la dégradation plus efficace. Comme le montre la Figure 3 CPH et ICB substrats peuvent être utilisés dans l' enzyme côté criblage à côte - révélant une foule de renseignements sur l' enzyme spécificité d' und 'activité à la fois dans le contexte du substrat préféré (MNC) et un complexe plus naturel contenant d'autres composants en plus du substrat préféré mimer davantage à un assemblage macromoléculaire trouvé dans la nature (AOI). L'utilisation de couleurs multiples permet la détection simultanée de différentes activités enzymatiques contre plusieurs substrats qui augmente le haut-débit et multiplexité du dosage. Les spectres des différents colorants peut être résolu par une simple régression linéaire et dans la plupart des cas, l'activité multi-substrat peut être observé par une inspection visuelle seule. Un exemple de simulation d'une telle expérience et les résultats sont représentés sur la figure 4.
Cette boîte à outils d'analyse et de la polyvalence de son application sont très bien adaptés pour le dépistage de premier niveau des enzymes et des bouillons de culture avec des activités inconnues. Les aspects les plus importants de cet essai sont sa nature à haut débit, de personnalisation, facilité d'utilisation et la flexibilité. Avec cela à l'esprit, we crois que ce nouvel ensemble d'outils va grandement améliorer et accélérer les processus enzymatiques de dépistage dans l'industrie ainsi que des applications académiques.
Déclarations de divulgation
Il y a deux demandes de brevet déposées impliquant la plaque CPH essai de substrat de 96 puits et 96 puits substrat ICB essai (WO2015036000 et le Danemark PA 2015 70311).
Remerciements
Nous tenons à remercier le professeur J. Paul Knox (Université de Leeds, Royaume-Uni), qui a fourni l'accès à ses laboratoires pour le tournage, et Susan E. Marcus pour une excellente assistance technique. JS reconnaît le projet WallTraC (septième programme-cadre de la Commission européenne (accord de subvention n °:. 263916) et la biomasse du projet pour le 21ème siècle (l'innovation fondation Danemark cas no .: 103408) SKK est remerciait le projet SET4Future (Conseil de recherche stratégique danois), stratégique Bio-Value fondé par le Conseil danois pour la recherche stratégique, le Conseil danois pour la technologie et l'innovation (Grant Case no .: 0603-00522B), et une approche axée sur la biologie-pour la compréhension de la dégradation enzymatique du complexe polysaccharidique Systems (Grant affaire n .:. 107279) pour le financement Ce document reflète l'opinion des auteurs que l'Union européenne ne sont pas responsables de l'usage qui pourrait être fait des informations ici contiennent..
matériels
| Name | Company | Catalog Number | Comments |
| assay kit plates | Glycospot | customized assay kit plates | |
| activation solution | Glycospot | for activating CPH substrates | |
| 350 ml receiver plate spacer block for vacuum manifold | Pall Corporation | 5015 | spacer block |
| 96-well MultiScreen HV filter plate, 0.45 µm, clear, non-sterile | Millipore | MSHVN4510 | assay plate |
| 96-Well Microplates, Polypropylene | Greiner Bio-One | 651201 | collection plate after washing the substrates |
| Nunc MicroWell 96-Well Microplates | Thermo Scientific | 269620 | product plate |
| Diaphragm pump MZ 2 NT | Vacuubrand | 732000 | vacuum pump used with the vacuum manifold |
| Infors HT Ecotron | Infors HT | 4950132 (Buch & Holm) | horizontal shaker |
| SpectraMax M5 | Molecular Devices | 10067-750 (VWR) | 96-well plate absorbance reader |
| Vacuum manifold | Pall Corporation | 5017 | vacuum manifold |
| endo-cellulase (EGII) (Trichoderma longibrachiatum) | Megazyme | E-CELTR | cellulase [cel] |
| endo-β-1,4-mannanase (Cellvibrio japonicus) | Megazyme | E-BMACJ | mannanase [man] |
| endo-β-1,3-glucanase (Trichoderma spp.) | Megazyme | E-LAMSE | β-glucanase [glu] |
| endo-β-1,4-D-galactanase (Aspergillus niger) | Megazyme | E-EGALN | galactanase [gal] |
| endo-β-1,4-xylanase M4 (Aspergillus niger) | Megazyme | E-XYAN4 | xylanase [xyl] |
| endo-xyloglucanase (GH5) (Paenibacillus sp.) | Megazyme | E-XEGP | xyloglucanase [xg] |
| α-amylase (Bacillus licheniformis) | Megazyme | E-BLAAM | amylase [amy] |
Références
- Lombard, V., Ramulu, H. G., Drula, E., Coutinho, P. M., Henrissat, B. The carbohydrate-active enzymes database (CAZy) in 2013. Nucleic Acids Res. 42 (Database issue), D490-D495 (2014).
- Cantarel, B. L., et al. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics. Nucleic Acids Res. 37, D233-D238 (2009).
- Agblevor, F. A., Murden, A., Hames, B. R. Improved method of analysis of biomass sugars using high-performance liquid chromatography. Biotechnol. Lett. 26 (15), 1207-1211 (2004).
- Black, G. E., Fox, A. Recent progress in the analysis of sugar monomers from complex matrices using chromatography in conjunction with mass spectrometry or stand-alone tandem mass spectrometry. J. Chromatogr. A. 720 (1-2), 51-60 (1996).
- Miller, G. L. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31, 426-428 (1959).
- Somogyi, M. Notes on Sugar Determination. J. Biol. Chem. 195 (1), 19-23 (1952).
- Zantinge, J. L., Huang, H. C., Cheng, K. J. Microplate diffusion assay for screening of beta-glucanase-producing microorganisms. Biotechniques. 33 (4), 798 (2002).
- Kračun, S. K., et al. A new generation of versatile chromogenic substrates for high-throughput analysis of biomass-degrading enzymes. Biotechnol Biofuels. 8, (2015).
- Leemhuis, H., Kragh, K. M., Dijkstra, B. W., Dijkhuizen, L. Engineering cyclodextrin glycosyltransferase into a starch hydrolase with a high exo-specificity. J. Biotechnol. 103 (3), 203-212 (2003).
- Nyyssonen, M., et al. Coupled high-throughput functional screening and next generation sequencing for identification of plant polymer decomposing enzymes in metagenomic libraries. Front Microbiol. 4, 282 (2013).
- Sweeney, M. D., Xu, F. Biomass Converting Enzymes as Industrial Biocatalysts for Fuels and Chemicals: Recent Developments. Catalysts. 2 (2), 244-263 (2012).
- Biely, P., et al. Action of xylan deacetylating enzymes on monoacetyl derivatives of 4-nitrophenyl glycosides of beta-D-xylopyranose and alpha-L-arabinofuranose. J. Biotechnol. 151 (1), 137-142 (2011).
- Mackenzie, A. K., et al. A polysaccharide utilization locus from an uncultured bacteroidetes phylotype suggests ecological adaptation and substrate versatility. Appl Environ Microbiol. 81 (1), 187-195 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon