Method Article
High-throughput screening de enzimas Carboidratos-degradantes Usando Novel Insolúvel substrato cromogénico Kits de Ensaio
Neste Artigo
Resumo
A high-throughput assay for enzyme screening is described. This multiplexed ready-to-use assay kit comprises of pre-chosen Chromogenic Polymer Hydrogel (CPH) substrates and complex Insoluble Chromogenic Biomass (ICB) substrates. Target enzymes are polysaccharide degrading endo-enzymes and proteases.
Resumo
Carbohydrates active enzymes (CAZymes) have multiple roles in vivo and are widely used for industrial processing in the biofuel, textile, detergent, paper and food industries. A deeper understanding of CAZymes is important from both fundamental biology and industrial standpoints. Vast numbers of CAZymes exist in nature (especially in microorganisms) and hundreds of thousands have been cataloged and described in the carbohydrate active enzyme database (CAZy). However, the rate of discovery of putative enzymes has outstripped our ability to biochemically characterize their activities. One reason for this is that advances in genome and transcriptome sequencing, together with associated bioinformatics tools allow for rapid identification of candidate CAZymes, but technology for determining an enzyme's biochemical characteristics has advanced more slowly. To address this technology gap, a novel high-throughput assay kit based on insoluble chromogenic substrates is described here. Two distinct substrate types were produced: Chromogenic Polymer Hydrogel (CPH) substrates (made from purified polysaccharides and proteins) and Insoluble Chromogenic Biomass (ICB) substrates (made from complex biomass materials). Both CPH and ICB substrates are provided in a 96-well high-throughput assay system. The CPH substrates can be made in four different colors, enabling them to be mixed together and thus increasing assay throughput. The protocol describes a 96-well plate assay and illustrates how this assay can be used for screening the activities of enzymes, enzyme cocktails, and broths.
Introdução
Techniques for mining genomes and metagenomes have developed rapidly in recent years, and so have medium- and high-throughput strategies for cloning and expressing recombinant enzymes. Furthermore, bioinformatic resources and associated depositories, such as (CAZy)1,2 have expanded greatly. However, there are considerable challenges inherent in the exploitation of microbial enzyme diversity for industrial purposes and the empirical determination of enzyme activities has now become a serious bottleneck. For example, it is estimated that, using current methods, we can safely predict the activities of no more than 4% of the proteins within the CAZy database. Although numerous methods are available for monitoring enzyme activities they all have some limitations. Well-established techniques based on chromatography combined with mass spectrometry are available for assessing the oligomeric fragments of glycosyl hydrolase (GH) activities3,4. However, these approaches are labor intensive and generally low-throughput. Methods based on the measurement of reducing sugars such as the dinitrosalicylic acid5 and Nelson-Somogyi6 assays are widely used for assessing GH activities. However, these assays have limited throughput and can be prone to side-reactions. Individual chromogenic polysaccharide substrates, such as azurine cross-linked (AZCL) are widely used for determination of enzyme activities, but purchasing all of the substrates separately and manually distributing the substrate powders within the assay plate can be cumbersome and costly7.
We have developed a new generation of chromogenic polymer hydrogel (CPH) substrates based on chlorotriazine dyes that, when used in conjunction with a 96-well filter plate, form a high-throughput assay system. Additional Insoluble Chromogenic Biomass (ICB) substrates were developed which provide information about substrate availability within complex polymer mixtures, such as those that exist in lignocellulosic biomass. Each substrate can be produced in one of four colors, and different colored substrates can be combined in a single well. In this protocol is shown that this methodology can be applied to a wide variety of polysaccharides and proteins and the potential for screening GHs, lytic polysaccharide monooxygenases (LPMOs) and proteases. Specific protocols are provided for the use of 96 well plates and representative results illustrate the high efficiency of the CPH and ICB substrate kits as tools for enzyme screening.
One significant advantage of the assay kits described, regardless of the substrate, is that the kits are ready to use within 15 minutes, after the activation step. This eliminates the need for time-consuming assembly of the assay from raw substrate materials as it is the case with some other methods7. The CPH and ICB substrates have excellent storage (at least one year at room temperature), pH and temperature stability 8 and require no specialized equipment or training. The CPH or ICB assays are based on 96-well filter plate within which the reaction with the enzyme is conducted. If the enzyme is active with a given substrate, soluble dyed oligomers are generated, producing a colored supernatant which can then be filtered into a regular clear-well 96-well plate using a vacuum manifold or a centrifuge 8.
The substrates are dyed with chlorotriazine dyes which absorb in the visible spectrum (VIS) range and individual colors (red, blue, yellow and green) can be resolved using linear regression if different CPH substrates of different colors are mixed in a single well, and the enzyme acts on more than one substrate. The resulting plate with the supernatants can be measured using a standard microtiter-plate reader capable of measuring absorbance in the VIS range. Mixing different substrates with different colors in one well increases the throughput of the assay system, to a total of 384 experiments in a 96-well plate (4 different substrates of different colors per well).
CPH substrates provide a valuable tool for assessing the specific activity of an enzyme while ICB substrates are used to evaluate the capacity of an enzyme to digest a component within the context of complex substrate mixtures that enzymes usually encounter within biomass. Although ICB substrates do not provide information about individual enzyme specificities, they are nonetheless useful tools for assessing the commercial performance of enzymes, cocktails or broths.
Protocolo
1. Cromogênico Ensaio com CPH Substratos num formato de placa de 96 poços
- A activação do kit de ensaio de placa
- Activa o filtro de 96 poços (contendo azul CPH-xilano) placa kit de ensaio (Lista de Materiais) por adição de uma solução de 200 ul de activação (obtido com o kit) para cada poço, seguido de 10 minutos de incubação à temperatura ambiente sem agitação.
- Aplicar vácuo utilizando um colector de vácuo (com o bloco espaçador no interior e qualquer padrão, transparente placa de 96 bem como uma placa de recolha) para remover a solução de activação existente. É também possível usar um centrifugar a 2700 xg durante 10 min para este passo, em vez de o colector de vácuo.
- Lavar os substratos CPH pela adição de 100 ul de água estéril e aplicar vácuo (ou a força centrífuga) para remover o estabilizador. Repita este passo mais duas vezes e as placas estão agora prontos para uso.
- reacção enzimática
NOTA: Sempre inclua tampãosozinho como um controlo negativo e, se possível, enzimas anteriormente caracterizadas como controlos positivos. Utilize um número estatisticamente apropriado de repetições. Os substratos CPH são estáveis entre pH 3,0-10,0 e o volume total de solução de enzima a extremidade do tampão em cada poço não deve exceder 180 ul. extracto de planta ou caldo de cultura também pode ser usado em vez de solução de enzima purificada.- Adicionar 150 ul de 100 mM de tampão de acetato de sódio, pH 4,5 e 5 ul de solução -cellulase endo (para uma concentração final de 1 U / ml) a cada poço da placa de kit de ensaio.
- Coloque a placa produto (uma placa clara-bem compatível com o leitor de microtitulação de placa) por baixo da placa kit de ensaio para recolher qualquer vazamento potencial da placa de reacção durante a agitação.
- Incubar a placa kit de ensaio a 25 ° C durante 30 minutos num agitador horizontal a 150 rpm.
NOTA: a reacção de mistura na placa kit de ensaio durante a incubação é crucial para a obtenção de uma consistente e Reproresultado ducible. substratos CPH são estáveis até 90 ° C. O tempo de incubação deve ser aumentada até 24 horas ao testar caldos de cultura contendo concentrações desconhecidas de enzima com os substratos CPH. Note-se que os tempos de incubação apropriados dependem da actividade da enzima (s), mas em geral, se não houver qualquer actividade detectável dentro de 24 horas, é provável que a enzima não degrada o substrato testado. Uma enzima activa é degradar os polissacáridos insolúveis cromogénicos do substrato CPH em oligossacáridos cromogénicos solúveis, que são visíveis na forma de sobrenadante de cor. - Coloque a placa produto limpo no interior do tubo de vácuo com o bloco espaçador dentro.
- Colocar a placa de kit de ensaio no topo e aplicar vácuo (pressão negativa máxima de -60 kPa). É também possível usar um centrifugar a 2700 xg durante 10 min.
NOTA: O filtrado contendo os oligossacarideos coloridas como produto de reacção é agora na placa produto para análise posterior 8 .
- Detecção e quantificação
- Verificar que o volume de líquido em cada poço da placa de produto é aproximadamente o mesmo através de inspecção visual.
- Ler a absorbância da placa de coleta em 595 nm para o azul CPH-xilano usando um leitor de placas.
- Ao fazer a análise dos dados, subtraia o buffer de somente valores de controlo negativo a partir dos valores dos poços em que foi adicionada uma enzima. Calcular o valor médio e o erro padrão das médias (SEM) das cavidades replicadas 8.
2. Cromogênico Ensaio com ICB Substratos em um formato de 96 poços
- reacção enzimática
- Adicionar a 100 mM de tampão de acetato de sódio 150 ul, pH 4,5 e 5 ul de 31 U / ml de endo -xylanase solução para cada poço da placa de kit de ensaio contendo palha de trigo ICB-vermelho (concentração final de enzima no poço: 1 U / ml) .
NOTA: As placas de kit de ensaio (filtro de 96 poços plates contendo substratos ICB) são fabricados conforme descrito na literatura (veja Lista de Materiais). Os substratos de ICB são estáveis em soluções tampão com uma gama de pH entre pH 3,0 a 10,0. Sempre incluem tampão por si só como controlo negativo, as enzimas comerciais como um controlo positivo e usar um número estatisticamente apropriado de réplicas.- Não activar os substratos ICB como a placa de substrato CPH, mas remover o estabilizador por lavagem três vezes com 100 ul de água seguido por filtração a vácuo ou centrifugação.
- Coloque a placa produto por baixo da placa de substrato para recolher qualquer vazamento potencial da placa de substrato durante a agitação.
- Incubar a reacção a 25 ° C com agitação a 150 rpm durante 2 h.
NOTA: Uma enzima ativa é degradar os polissacarídeos cromogénicos insolúveis no substrato ICB em oligossacarídeos solúveis, que são visíveis na forma de sobrenadante colorido. ICB substratos são estáveis até 90 ° C. A incubação time deve ser aumentada até 24 horas, se enzimas não purificadas tais como caldos de cultura são utilizados. - Colocar a placa de produto no interior do colector de vácuo com o bloco espaçador no interior.
- Colocar a placa de kit de ensaio no topo e aplicar vácuo (pressão negativa máxima de -60 kPa), ou utilizar uma centrífuga para filtrar o produto a partir do kit de ensaio de placa para o poço da placa de produto.
NOTA: O filtrado contendo os oligossacarídeos coloridas como produto de reacção está agora no prato de coleta para análise posterior 8.
- Adicionar a 100 mM de tampão de acetato de sódio 150 ul, pH 4,5 e 5 ul de 31 U / ml de endo -xylanase solução para cada poço da placa de kit de ensaio contendo palha de trigo ICB-vermelho (concentração final de enzima no poço: 1 U / ml) .
- Detecção e quantificação
- Verificar que o volume de líquido em cada poço da placa de recolha é aproximadamente o mesmo através de inspecção visual.
- Ler a absorbância da placa de coleta em 517 nm para a palha de trigo ICB-vermelho usando um leitor de placas.
- Ao fazer a análise de dados - subtrair o tampão - apenas valores de controlo negativo a partir dos valores dos poços, onde uma enzimafoi adicionado. Calcular o valor médio e o erro padrão das médias (SEM) das cavidades replicadas 8.
NOTA: Em caso de triagem de enzimas desconhecidos, sugerimos fazer uma série de diluição de modo a obter dados mais detalhados sobre a faixa dinâmica da actividade da enzima.
Resultados
O alto rendimento e capacidade de multiplexagem deste ensaio é baseado no polímero insolúvel cromogénico (ou proteína) de hidrogel (CPH) substratos dispostos em placas de filtro de 96 poços. Enzimas, bem como controlos negativos são adicionados à placa de kit de ensaio (Figura 1A) e as enzimas degradam o substrato correspondente produzir um sobrenadante de cor (Figura 1B). Depois da reacção estar concluída, o sobrenadante é transferido para uma placa de produto clara cavidades e a absorvância pode ser medido directamente utilizando um espectrofotómetro adequado para placas de 96 poços (Figura 1C).
Um exemplo de uma resposta de dose de CPH-arabinoxilano de xilanase em diferentes concentrações de enzima (0,00-0,75 U / ml) é mostrado na Figura 1D, onde a concentração de enzima diminuição pode ser observada visualmente. A quant espectrofotometria mais detalhadaificação pode ser usada para representar graficamente a absorvância em função da concentração de enzima (Figura 1E). A intensidade de sinal corresponde à actividade da enzima. A reprodutibilidade do ensaio é mostrado pelas barras de erro (erro padrão da média, SEM, de três réplicas). Experimentos mais detalhados sobre a reprodutibilidade deste ensaio são publicados em outros lugares 8.
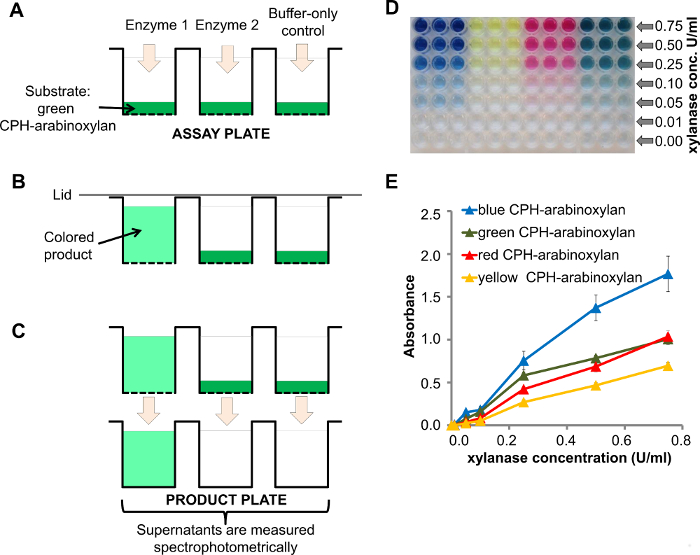
Figura 1. tratamento com xilanase de CPH-arabinoxilano. A) Um esquema da placa de ensaio com o kit de substrato de CPH (por exemplo, CPH-arabinoxilano) carregado em poços da placa de filtro de 96 cavidades pouco antes da adição de enzimas 1 e 2 e o tampão controle -apenas (enzima 1 tiveram atividade -xylanase endo); B) Degradação de CPH-arabinoxilano pela enzima 1 produziu um sobrenadante colorida; C) Após filtrat vácuo-assistidaião dos sobrenadantes em placa para o produto, a absorvância é medida espectrofotometricamente; D) placa produto contendo os produtos da reacção após o tratamento de CPH-arabinoxilano em 4 cores diferentes, com diferentes concentrações de endo-1,4--β xilanase em 100 mM tampão acetato de sódio, pH 4,5 durante 60 minutos à temperatura ambiente;. E) a quantificação dos produtos da reacção de D usando espectrofotometria por favor clique aqui para ver uma versão maior desta figura.
Existem diferentes opções para usar este ensaio na triagem enzima. Uma opção é usar uma placa de 96 cavidades contendo diferentes polissacáridos para o rastreio, por exemplo, um pequeno número de (purificada) endo -enzimas com actividade desconhecida. Neste caso, o resultado será que mostram polissacarídeos são DEGRADcapaz pela enzima alvo. Para demonstrar este princípio, um -cellulase endo foi testado contra diferentes substratos CPH a 25 ° C. Três concentrações diferentes de enzima (0,5 U / ml, 1,0 U / ml e 5 U / ml) foram incubadas durante 30 min. O resultado é claramente visível na placa produto (Figura 2A). A folha de produto para esta endo -cellulase fornecidas pelo fornecedor especifica lado de actividade xiloglucano (tamarindo), cevada β-glucana, glucomannan, xilano de bétula e baixa lado de actividade galactomanano. Coerente com isso, a atividade adicional para celulase foi encontrado contra-CPH-β glucana (cevada), CPH-xiloglucano (tamarindo), CPH-xilano (madeira de faia) e baixa atividade contra CPH-galactomanano (Figura 2B). Glucomannan não foi testado. Os mesmos substratos CPH foram digeridos com enzimas comerciais disponíveis (três diferentes concentrações de enzima: 0,1 U / ml, 0,5 U / ml e 1,0 U / ml) foram utilizados como controlos positivos nas mesmas condições do que o anteriorexperimentar. Todos os substratos foram degradadas pela enzima de controlo positivo e o aumento da intensidade de sinal correspondente a uma maior concentração de enzima (Figura 2C).
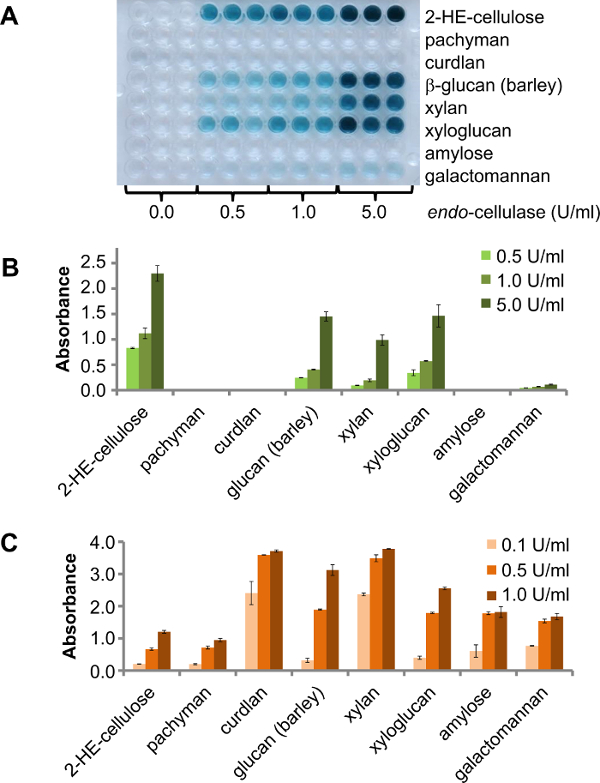
Figura 2. Oito diferentes substratos CPH foram incubadas sob agitação a 25 ° C durante 30 min. A) A placa produto de diferentes substratos CPH digeridos com uma endo -cellulase, em diferentes concentrações. B) Quantificação da actividade actividade e vários lado de endo -cellulase. As barras de erro representam o erro padrão da média de três réplicas C) Actividade de diferentes enzimas comerciais para o substrato correspondente CPH (endo-celulase e 2-HE-celulose;. E-LAMSE e CPH-pachyman, CPH-curdlan, CPH- β-glucana (cevada); e-XYAN4 e CPH-xilano, e-XEGP e CPH-xiloglucano, E-BLAAM e CPH-amilose, E-BMACJ e CPH-galactomanano; todas as enzimas de Megazyme). As barras de erro representam o erro padrão da média de duas réplicas. Por favor clique aqui para ver uma versão maior desta figura.
Os substratos insolúveis biomassa cromogénico (ICB) são uma adição útil ao repertório substrato cromogénico, porque eles mantêm, em parte, a disposição natural de polissacarídeos nas paredes celulares das plantas que são o principal constituinte da biomassa. Substratos CPH e CPI são usados no nosso exemplo, para analisar as enzimas segregadas de Phanerochaete chrysosporium, quando cultivada em meio líquido. A configuração da placa da placa de kit de ensaio é mostrado na Figura 3A, com 19 CPH substratos e 5 substratos ICB (4 poços para cada substrato, Figura 3B). P. chrysosporium foi cultivated durante três dias e, em seguida, o sobrenadante de cultura analisado. Portanto, 125 ul de tampão 200 mM foi transferido para cada poço de cultura sobrenadante e 25 ul adicionados. Três condições de pH diferentes foram testados utilizando tampão de acetato de sódio pH 4,0, tampão de fosfato de sódio a pH 6,0 ou pH 8,0 (Figura 3C). A placa foi incubada com agitação (150 rpm) a 25 ° C durante 2 h.
Os produtos da reacção foram transferidos para a placa do produto (Figura 3D) e analisadas. P. chrysosporium enzimas para a degradação de vários glucanos e xilanos, amido (Figura 3E) produzido. sinais de baixa poderia ser detectada para o arabinano hemiceluloses (beterraba sacarina) e galactano péctico, bem como para a GPI (soja). As enzimas produzidas eram mais activos em condições ácidas (pH 4,0) do que em condições neutras ou ligeiramente básicas (pH 8,0). Menor atividade no sentido de substratos ICB (Figura 3F)demonstra que quando os polissacarídeos são, num contexto mais natural, a eficiência da enzima não é o mesmo que com um polissacarídeo puro e por isso substratos ICB demonstrar uma visão mais realista sobre a eficiência da enzima, se for aplicada ao cru ou pré material vegetal tratado.
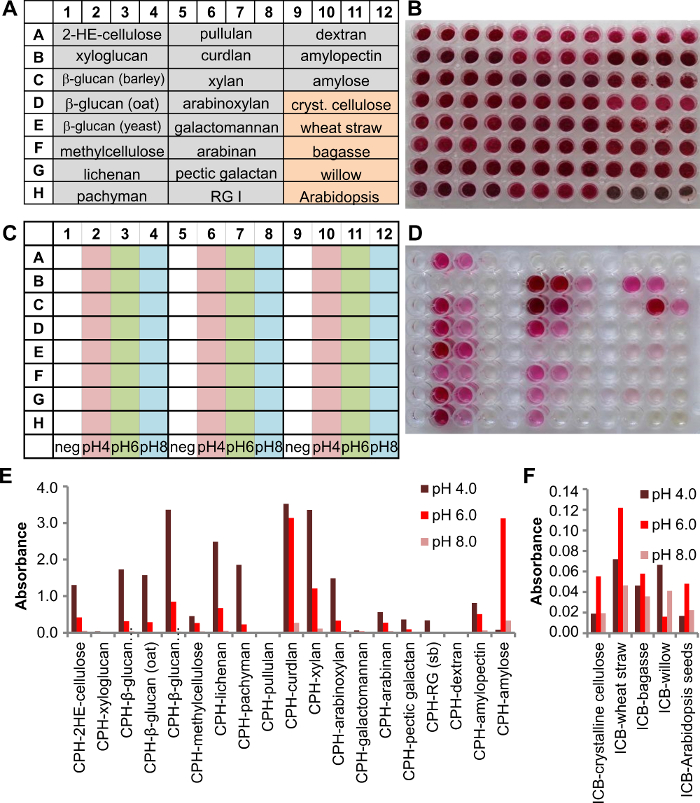
Figura 3. Triagem de um sobrenadante de cultura de uma cultura líquida de idade de 3 dias de Phanerochaete chrysosporium utilizando uma placa de multi substrato contendo 19 CPH e 5 substratos ICB. A) um esquema da configuração da placa com 4 poços para cada substrato indivíduo (fundo cinza = substratos CPH, fundo laranja = substratos ICB). B) Imagem da placa de ensaio contendo o substrato. C) Esquema mostrando as condições de tampão utilizadas nesse experimento (200 mM de acetato de sódio pH 4,0, fosfato de sódio pH 6,0 e fosfato de sódio pH 8,0). D) imagem da placa de produto após 2 h a 25 ° C. E) As absorvências foram detectados a 517 nm e representada para cada substrato CPH indivíduo e F ) resulta de substrato ICB para as respectivas enzimas. por favor clique aqui para ver uma versão maior desta figura.
Os substratos cromogénicos pode também ser usado para estudar os efeitos sinérgicos, utilizando uma mistura de diferentes substratos coloridos CPH num poço e analisando-se o sobrenadante da reacção após o tratamento utilizando enzimas individuais ou enzima cocktails.
No exemplo a seguir mostrada na Figura 4, vermelho CPH-celulose e substratos amarelo CPH-xilano foram misturados em conjunto a uma aproximadamente equrazão Al em poços de placas de filtro de 96 poços. A Figura 4A mostra os produtos de reacção de cor depois do tratamento de 1 hora à temperatura ambiente com nenhuma enzima (controlo), CEL celulose (2 U / ml), xil xilanase (1 U / ml) e um mistura de ambas as enzimas (3 repetições de cada abordagem) em 100 mM de acetato de sódio tampão pH 4,5. Para análise, o produto da reacção foi quantificada espectrofotometricamente por digitalizar o espectro de absorvância de 350 nm a 700 nm (Figura 4B). Muitas vezes, uma inspecção visual por si só pode dar uma indicação de que a enzima actue por um ou vários substratos, no entanto registada a absorvância espectros que resultam de diferentes corantes também podem ser resolvidos por meio de regressão linear simples 8 para dar uma indicação mais precisa do grau de degradação de cada substrato a partir da mistura.
Usando substratos de CPH como misturas substancialmente contribui para um rendimento do ensaio, permitindo SCReening contra até 4 substratos diferentes em uma experiência (um poço). No exemplo mostrado quatro diferentes substratos utilizados: CPH-β glucana azul (cevada), CPH-xilano amarelo (madeira de faia), CPH-amilose verde e galactan CPH-pectic vermelho (tremoço). A disposição da placa de substrato é mostrado na Figura 4C e uma imagem da placa de ensaio na Figura 4D. A reacção foi realizada em 100 mM de acetato de sódio tampão pH 4,5 durante 30 min a 25 ° C e 150 rpm. Primeira enzimas individuais com o aumento da concentração de enzima foram testados com o substrato correspondente CPH (Figura 4E) e o sobrenadante corado foi recebido como esperado na placa produto (Figura 4F, linha 1A - 12D). Fileira E continha os dois substratos diferentes CPH amarelo CPH-xilano e azul-CPH-β glucano, os quais foram degradados com diferentes proporções de enzimas correspondentes endo endo e -xylanase -glucanase. Após a reacção, o resultado é visible na placa produto: a cor do produto de reacção era mais escura verde-azul, quando mais endo -glucanase estava presente (Figura 4F, 4E-6E) e se transformou em um isqueiro verde-amarelo, quando o endo -xylanase concentração aumentada ( A Figura 4F, 10-12E). O mesmo é visto na linha F, em que os dois substratos galactano CPH-péctico vermelho e amarelo CPH-xilano foram degradados com endo endo e -galactanase -xylanase. Todos os quatro CPH substrato colorido diferente estavam presentes (Figura 4F, 1G-12F) e enzimas individuais degradou o substrato CPH apropriado e por adição de enzimas adicionais uma combinação dos produtos de reacção de cor foi recebido.
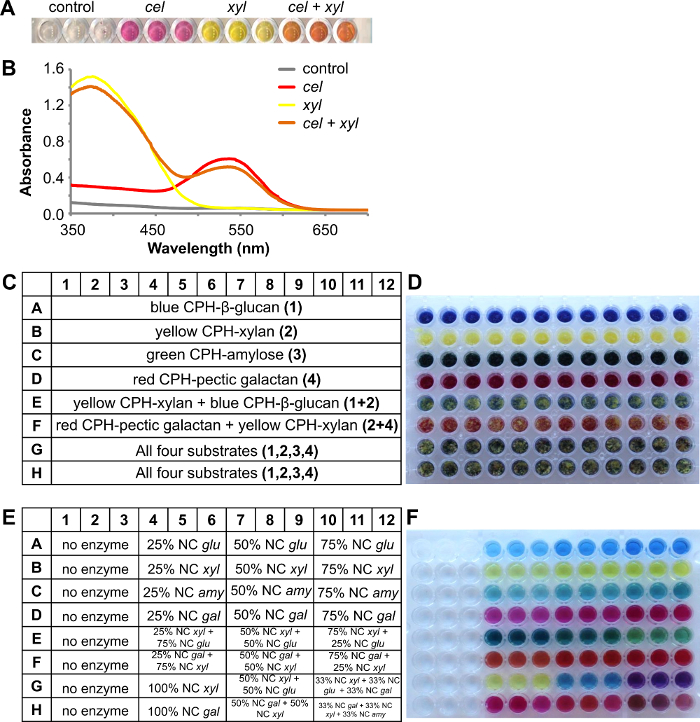
Figura 4. Uma combinação de dois substratos de CPH diferentes, vermelho CPH-celulose e amarelo CPH-xilano, tratados com diferentes enzimas. UMA) Sobrenadantes de reacção após o tratamento de substratos com dois endo -cellulase (cel) ou endo -xylanase (Xil) ou ambas as enzimas. B) os espectros de absorvância dos sobrenadantes de reacção. Uma combinação de quatro substratos CPH diferentes tratados com diferentes enzimas C) Esquema da placa de substrato contendo os substratos CPH:. Azul CPH-β-glucano (cevada), CPH-xilano amarelo (madeira de faia), verde CPH-amilose e CPH- vermelho galactano péctico (tremoço) D) Imagem da placa de ensaio contendo as diferentes substratos CPH E) Esquema da placa de produto que mostra a relação entre as enzimas adicionadas (as concentrações nominais (NC):.. glu = 1 U / ml de endo -glucanase, Xil = 1 U / ml de endo -xylanase, Amy = 5 U / ml de endo-amilase e Gl = 0,5 U / ml de endo -galactanase). F) Imagem da placa de produto após 30 minutos de incubação a 25 ° C. Por favor clique aqui para ver uma versão maior desta figura.
| Substrato | Fonte |
| CPH-2-hidroxietilcelulose | N / D |
| (CPH-2-HE-celulose) | |
| CPH-amilopectina | Batata |
| CPH-amilose | Batata |
| CPH-arabinana | beterraba sacarina |
| CPH-arabinoxilano | trigo |
| CPH-caseína | leite bovino |
| CPH-quitosana | origem animal |
| CPH-curdlan | Alcaligenes faecalis |
| CPH-dextrano | Leuconostoc spp. |
| CPH-galactomanano | alfarroba |
| CPH-laminarina | Laminaria digitata |
| CPH-liquenana | musgo islandês |
| CPH-metilcelulose | N / D |
| CPH-pachyman | Poria cocos |
| galactan CPH-pectic | Batata |
| CPH-pululano | Aureobasidium pullulans |
| CPH-ramnogalacturonano I (RG I) | Batata |
| CPH-ramnogalacturonano I (Gal) * | Batata |
| CPH-ramnogalacturonano | feijão de soja |
| CPH-xilano | Madeira de faia |
| CPH-xiloglucano | Tamarindo |
| CPH-β-glucano de cevada | cevada |
| CPH-β-glucano de aveia | aveia |
| CPH-β-glucano de levedura | fermento |
| ICB-Arabidopsis | Rosette folhas de Arabidopsis thaliana Col-0 (planta adulta) |
| sementes ICB-Arabidopsis | Arabidopsis thaliana |
| ICB-bagaço | Saccharum officinarum (planta adulta secos, caule e folhas) |
| celulose ICB-cristalino (papel de filtro) | papel Whatman 3MM Chr Cromatografia comercial |
| sementes de feno-grego ICB- | Trigonella spp. Sementes |
| ICB-cânhamo | Cannabis spp. (Planta adulta secos, caule e folhas) |
| sementes ICB-tremoço | Lupinus angustifolius sementes |
| ICB-pólen P. pratense | Pólen Phleum pratense |
| ICB-abeto | Picea spp. (Mitronco de árvore lled) |
| ICB-tabaco | folhas da Nicotiana benthamiana (planta jovem) |
| palha ICB-de trigo | Triticum spp. (Planta adulta secos, caule e folhas) |
| ICB-salgueiro | Salix spp. (Planta adulta secas, tronco de árvore branqueado) |
| ICB-Sorghum | Sorghum spp. (Sai da planta adulta) |
| (cadeias laterais β-1,4-D-galactano removidos com endo -β-1,4-D-galactanase) * | |
Tabela 1. Lista de disponíveis Cromogênico polímero de hidrogel (CPH) e substratos Insolúvel Cromogênico Biomassa (ICB).
Discussão
Estamos a utilizar uma nova geração de substratos CPH e ICB multi-coloridas, que são baseados em corantes clorotriazina (lista completa dos substratos na Tabela 1), dispostos num estojo de ensaio comercial projetados. Digestão com enzimas dos substratos produz pequenos, solúveis, produtos tingidos que são detectáveis na solução de ensaio e pode ser quantificada utilizando um leitor de placas de 9. Este ensaio é concebido para a avaliação de enzimas endo e actuando a sensibilidade do ensaio é semelhante a um utilizando azurina com ligações cruzadas (AZCL) substratos 10, enquanto que outros métodos estão disponíveis para a exo actuando enzimas 11,12. A limitação deste kit de ensaio encontra-se na detecção da actividade de endo -enzyme, como CPH, bem como os substratos de ICB não degradáveis por exo -enzimas provavelmente devido a impedimento estérico resultantes do corante e agente reticulante moléculas 8.
O ensaio é realizado em um 96-WELl formato e as reações individuais ocorrem nos poços. A reacção tem que ser misturado na placa para receber dados reprodutíveis. Os sobrenadantes resultantes são filtrados para uma placa de produto em que a absorvência de cada cavidade pode ser quantificada usando espectrometria de absorvância. Os princípios básicos e o layout do ensaio são mostrados na Figura 1. O ensaio consiste de uma placa de ensaio (uma placa de filtro de 96 poços) com os substratos e, após incubação com enzimas, o sobrenadante é filtrado através de numa placa de clara e as absorvâncias são lidas proporcionando uma medição semi-quantitativa da especificidade e actividade de enzimas. Demonstrou-se, que este ensaio de rastreio utilizando substratos CPH pode também ser utilizado num formato de placa de agar, onde os produtos de reacção solúveis em criar um halo de cor após incubação durante a noite. 8
Os estojos de ensaio podem ser utilizados para rastrear enzimas purificadas e as suas potenciais actividades-secundários como demonstrado emFigura 2. Colaterais actividades podem surgir a partir de uma única enzima e a sua especificidade promíscuo, mas também a partir de um fato de que a amostra analisada é uma mistura de diferentes enzimas e o seu efeito sinérgico necessita de ser estudado. Além disso, como foi demonstrado em estudos anteriores, que os cocktails de enzimas, da flora intestinal e 13 de cultura a partir de caldos de fungos 8, assim como enzima de planta endógeno e bactérias (dados não publicados) pode ser usado como uma fonte de enzima.
substratos ICB resolver misturas complexas de componentes da parede celular, muitas vezes encontradas em processos industriais de repartição de biomassa. Estes substratos são projetados para avaliar a disponibilidade de polissacarídeo e fornecer informações sobre como otimizar efetivamente cocktails de degradação para a saída de degradação mais eficiente. Tal como ilustrado na Figura 3 e substratos CPH ICB pode ser utilizado em rastreio enzima lado a lado - revelando uma variedade de informações sobre uma especificidade enzimaactividade d, tanto no contexto do substrato preferido (CPH) e um complexo mais natural contendo outros componentes em adição ao substrato preferido que imita mais de perto uma montagem macromolecular encontrada na natureza (ICB). O uso de várias cores permite a detecção simultânea de diferentes actividades enzimáticas contra vários substratos, o que aumenta o rendimento e alta-multiplexidade do ensaio. Espectros de diferentes corantes podem ser resolvidos por meio de regressão linear simples e, na maioria dos casos, a actividade de multi-substrato podem ser observadas por inspecção visual sozinho. Um exemplo de uma experiência simulada tais e os seus resultados são representados na Figura 4.
Esta caixa de ferramentas de ensaio e a versatilidade da sua aplicação são muito bem adaptado para o rastreio de primeiro nível de enzimas e caldos de cultura com atividades desconhecidas. Os aspectos mais importantes deste ensaio é a sua natureza de elevado rendimento, personalização, facilidade de uso e flexibilidade. Com isso em mente, we acreditam que este novo conjunto de ferramentas irá melhorar e acelerar os processos enzimáticos triagem em industrial, bem como aplicações acadêmicas.
Divulgações
Há dois pedidos de patente depositados envolvendo o ensaio de substrato placa CPH de 96 poços e o ensaio de 96 poços substrato ICB (WO2015036000 e Dinamarca PA 2015 70311).
Agradecimentos
Nós gostaríamos de agradecer ao Prof. J. Paul Knox (University of Leeds, Reino Unido), que permitiu o acesso a seus laboratórios para as filmagens, e Susan E. Marcus pela excelente assistência técnica. JS reconhece o projeto WallTraC (Sétimo Programa-Quadro da Comissão Europeia (acordo de subvenção. No: 263.916) e a biomassa projeto de século 21 (Innovation Foundation Dinamarca; caso no .: 103408) SKK está agradecendo o projeto SET4Future (dinamarquês Strategic Research Council), a Bio-Strategic Value fundada pelo Conselho Dinamarquês para a Investigação Estratégica, o Conselho Dinamarquês de Tecnologia e Inovação (Grant processo nº .: 0603-00522B), e uma abordagem baseada em Biologia para Compreender degradação enzimática de polissacarídeo Sistemas complexos (Grant processo nº .:. 107279) para financiamento Este artigo reflete as opiniões dos autores só a União Europeia não é responsável por qualquer uso que possa ser dado à informação contêm aqui..
Materiais
| Name | Company | Catalog Number | Comments |
| assay kit plates | Glycospot | customized assay kit plates | |
| activation solution | Glycospot | for activating CPH substrates | |
| 350 ml receiver plate spacer block for vacuum manifold | Pall Corporation | 5015 | spacer block |
| 96-well MultiScreen HV filter plate, 0.45 µm, clear, non-sterile | Millipore | MSHVN4510 | assay plate |
| 96-Well Microplates, Polypropylene | Greiner Bio-One | 651201 | collection plate after washing the substrates |
| Nunc™ MicroWell™ 96-Well Microplates | Thermo Scientific | 269620 | product plate |
| Diaphragm pump MZ 2 NT | Vacuubrand | 732000 | vacuum pump used with the vacuum manifold |
| Infors HT Ecotron | Infors HT | 4950132 (Buch & Holm) | horizontal shaker |
| SpectraMax M5 | Molecular Devices | 10067-750 (VWR) | 96-well plate absorbance reader |
| Vacuum manifold | Pall Corporation | 5017 | vacuum manifold |
| endo-cellulase (EGII) (Trichoderma longibrachiatum) | Megazyme | E-CELTR | cellulase [cel] |
| endo-β-1,4-mannanase (Cellvibrio japonicus) | Megazyme | E-BMACJ | mannanase [man] |
| endo-β-1,3-glucanase (Trichoderma spp.) | Megazyme | E-LAMSE | β-glucanase [glu] |
| endo-b-1,4-D-galactanase (Aspergillus niger) | Megazyme | E-EGALN | galactanase [gal] |
| endo-β-1,4-xylanase M4 (Aspergillus niger) | Megazyme | E-XYAN4 | xylanase [xyl] |
| endo-xyloglucanase (GH5) (Paenibacillus sp.) | Megazyme | E-XEGP | xyloglucanase [xg] |
| α-amylase (Bacillus licheniformis) | Megazyme | E-BLAAM | amylase [amy] |
Referências
- Lombard, V., Ramulu, H. G., Drula, E., Coutinho, P. M., Henrissat, B. The carbohydrate-active enzymes database (CAZy) in 2013. Nucleic Acids Res. 42 (Database issue), D490-D495 (2014).
- Cantarel, B. L., et al. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics. Nucleic Acids Res. 37, D233-D238 (2009).
- Agblevor, F. A., Murden, A., Hames, B. R. Improved method of analysis of biomass sugars using high-performance liquid chromatography. Biotechnol. Lett. 26 (15), 1207-1211 (2004).
- Black, G. E., Fox, A. Recent progress in the analysis of sugar monomers from complex matrices using chromatography in conjunction with mass spectrometry or stand-alone tandem mass spectrometry. J. Chromatogr. A. 720 (1-2), 51-60 (1996).
- Miller, G. L. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31, 426-428 (1959).
- Somogyi, M. Notes on Sugar Determination. J. Biol. Chem. 195 (1), 19-23 (1952).
- Zantinge, J. L., Huang, H. C., Cheng, K. J. Microplate diffusion assay for screening of beta-glucanase-producing microorganisms. Biotechniques. 33 (4), 798 (2002).
- Kračun, S. K., et al. A new generation of versatile chromogenic substrates for high-throughput analysis of biomass-degrading enzymes. Biotechnol Biofuels. 8, (2015).
- Leemhuis, H., Kragh, K. M., Dijkstra, B. W., Dijkhuizen, L. Engineering cyclodextrin glycosyltransferase into a starch hydrolase with a high exo-specificity. J. Biotechnol. 103 (3), 203-212 (2003).
- Nyyssonen, M., et al. Coupled high-throughput functional screening and next generation sequencing for identification of plant polymer decomposing enzymes in metagenomic libraries. Front Microbiol. 4, 282 (2013).
- Sweeney, M. D., Xu, F. Biomass Converting Enzymes as Industrial Biocatalysts for Fuels and Chemicals: Recent Developments. Catalysts. 2 (2), 244-263 (2012).
- Biely, P., et al. Action of xylan deacetylating enzymes on monoacetyl derivatives of 4-nitrophenyl glycosides of beta-D-xylopyranose and alpha-L-arabinofuranose. J. Biotechnol. 151 (1), 137-142 (2011).
- Mackenzie, A. K., et al. A polysaccharide utilization locus from an uncultured bacteroidetes phylotype suggests ecological adaptation and substrate versatility. Appl Environ Microbiol. 81 (1), 187-195 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados