Method Article
分析蛋白导入进强调,从植物中分离叶绿体
摘要
在这里,我们描述了一个新的方法来研究蛋白导入叶绿体中分离的压力下。该方法是快速和简单的,并且可以应用于研究的叶绿体蛋白质导入不同胁迫条件的后果,以及相应的调节机制。
摘要
叶绿体与在植物中的许多重要的角色,它不仅包括光合作用但许多其它的代谢和信令功能的细胞器。此外,叶绿体是植物对各种非生物胁迫,如盐度和渗透胁迫的关键。叶绿体可含有高达约3000种不同的蛋白质,其中的一些是由它自己的基因组编码。然而,大多数叶绿体蛋白质被编码在细胞核和细胞质合成,并且这些蛋白需要通过translocons在叶绿体被膜导入到叶绿体。最近的研究已经表明,叶绿体蛋白质导入可以通过应力积极调节。为了研究生物化学胁迫条件下蛋白质导入这样的规定,我们制定这里描述为可以很容易地在任何实验室可以实现快速,简单的程序方法。在该方法中,植物在正常conditio生长纳秒,然后暴露于强调在液体培养条件。植物材料被收集,和叶绿体然后通过均化释放。粗匀浆是通过密度梯度离心分离,使完整的叶绿体的隔离。叶绿体收率由计数评估,并叶绿体完整性是在显微镜下检查。该蛋白质导入测定中,纯化的叶绿体与35号放射性标记在体外翻译前体蛋白温育,和时程实验中进行,以使胁迫条件下基因型之间导入率的比较。我们目前使用这种方法,它表明,蛋白质进口的速度进入叶绿体从监管突变渗透胁迫条件下,特别是改变所产生的数据。
引言
叶绿体是存在于植物的绿色组织高度丰富的细胞器。他们是在光合作用中的关键作用,使用光能量将二氧化碳转化为糖,从而支持地球上的1几乎所有的生命过程知名。此外,叶绿体(以及更广泛的家庭称为质体相关的细胞器)起到在植物的许多其他重要的角色,包括氨基酸,脂类,色素的生物合成,和环境信号如重力和病原体挑战的感测。光合作用产生的活性氧(ROS)的作为副产物,这在某些情况下具有有益的作用,但如果过量产生可能导致损害或甚至致死作用。 ROS的生产过剩尤其不利的环境条件提升,因此叶绿体是密切相关的非生物胁迫,如盐度和渗透胁迫2响应。
通道loroplasts具有复杂的结构。每个叶绿体被称为包络线的双膜的外层,它由外和内膜包围。在内部,有另一个被称为类囊体,其中,光合作用的光反应发生膜系统。两个膜系统之间有一个水隔室呼叫基质,这是参与碳固定。叶绿体可含有高达约3000种不同的蛋白质,并且绝大多数这些蛋白质是在前体形式的细胞溶胶合成并需要通过在外壳膜1专用蛋白translocons导入到细胞器。有趣的是,最近的工作已表明,叶绿体蛋白质导入正在积极调节,所以能够在叶绿体蛋白质组施加控制的重要程度。例如,据报道,2015年的进口蛋白可通过丰富的日的直接调控非生物胁迫响应在叶绿体(TOC)的由泛素-蛋白酶体系统3的外被膜ë位子。
使用纯化的叶绿体并在体外合成的前体蛋白质,蛋白质导入可以在体外 4,5重构。因此, 在体外方法可以用于评估不同突变植物6,这一直是该蛋白质导入机械的推定成分的分析和用于发现蛋白质导入及其调节基础的机制的关键方法导入的速率。此外,叶绿体可以进一步分馏或蛋白酶消化, 下列体外进口,其可以促进在叶绿体蛋白质7,8的子细胞器的定位和拓扑研究处理。
为了研究由应激蛋白进口的调控,我们已经修改了常规的叶绿体隔离方法,我们将介绍这里。重要的是,叶绿体从已被生长在琼脂培养基标准Murashige和Skoog(MS)的8天,然后转移到补充有压力源的液体MS培养基中,提供了一个相对短的,受控的应力处理植物中分离。从这样的应力处理的植物中分离的叶绿体的产率和能力与体外蛋白质导入测定3下游兼容。除了叶绿体隔离协议中,我们提出我们的体外蛋白进口,这已被证明是健壮和被广泛使用3,9-12常规方法。
研究方案
1.拟南芥植物生长和应力处理
- 通过加入4.3克MS基础盐混合物,10克蔗糖,0.5克2-(N-吗啉代)乙烷磺酸(MES),以去离子水至1升制备1升的Murashige和Skoog(MS)培养基中,并调整pH至5.7与氢氧化钾(KOH)。添加6克植物琼脂和高压釜的为在120℃20分钟。
- 凝固之前,倒入中成圆形皮氏培养皿(直径9厘米,高1.5厘米,用20 - 每盘25毫升的MS培养基)。允许将板在关闭盖之前干燥在层流橱〜1小时。
- 通过加入1毫升70%含0.02%(体积/体积)的Triton X-100和5-10分钟连续摇动(体积/体积)乙醇放置拟南芥种子到1.5mL试管表面灭菌。对于每个基因型/条件,准备10培养皿各载约100 - 150苗。
- 等待大约10秒直到种子沉淀到管的底部,并且然后丢弃,通过移液上清。添加1毫升100%乙醇,并再摇晃试管10分钟。
- 而种子消毒准备层流罩。取一块每个样品的滤纸,对折,以促进播种,并在引擎盖浸泡在100%的乙醇。等到它变干彻底。需要注意的是100%的乙醇被用作它超过70%的乙醇更快速地蒸发。
- 用1毫升吸管尖切〜5从细端mm移液枪转移到种子滤纸。让他们干,这需要大约10 - 15分钟。
- 150均匀消毒的种子在每个MS培养基培养皿,并用密封胶带手术每盘 - 播种〜100。
- 存储盘倒挂在4℃下2 - 4天,以鼓励和同步发芽。老的种子可能需要在4℃停留更长的时间(最多一个星期)。
- 转板到植物组织培养室,让他们上攻了。生长长天周期下为8天的植物(16小时100微摩尔·米- 2·秒- 1光,8小时黑暗)在20℃。
- 应力治疗,当植物是8日龄,在流罩,从琼脂培养基转让,通过用手轻轻刮它们逐出穿着乙醇灭菌手套,到含有应激液体MS培养基的无菌瓶中( 例如 ,200毫甘露醇)。避免携带在琼脂培养基。盖住烧瓶口用无菌箔和允许植物在相同条件下生长在步骤1.8额外2天上轻轻摇动(〜100rpm下)轨道摇动器。
2. 通过体外转录制作前体蛋白/翻译
注意:此协议假定使用拟南芥光系统的I亚单位ð前体(pPsaD)为模板/前蛋白,但该方法是与其他兼容。
- 克隆pPsaD的编码序列(CDS)插入的pBluescript II SK载体(或与上游T7启动子的任何其他类似的载体)13的多克隆位点(MCS)。纯化使用DNA分离试剂盒的质粒(PBSK-pPsaD),并验证通过DNA测序的序列。
注意:所有这些步骤采用标准的分子克隆技术。 - 确定使用分光光度计设定在260nm测量吸光度PBSK-pPsaD质粒DNA的浓度。稀释该质粒10毫微克/微升的最终浓度。
- 运行使用稀释的质粒作为模板20微升的PCR(35个循环)。制备反应如下:2μL的10×聚合酶缓冲液,2微升2毫的dNTPs,1微升5毫M13正向引物(5'-TGT AAA ACG ACG GCC AGT-3'),1微升5毫M13反向引物(5 '-CAG GAA ACA GCT ATG ACC-3'),1微升稀释PBSK-pPsaD质粒,1U的Taq聚合酶和蒸馏水使总反应体积达到20μL。使用标准的PCR程序,方法如下:95℃,5分钟; [95℃,30秒的35个循环; 56℃,30秒; 72℃,30秒); 72℃,5分钟。
- 在1%运行PCR产物的5微升(重量/体积)在TAE缓冲液(Tris-盐酸,pH值7.6,20mM的醋酸,1mM EDTA)中的琼脂糖凝胶来验证cDNA的正确放大,并量化相关相对于标准带确认的浓度。在-20℃用于进一步的应用程序存储产品的其余部分。
- 使用兔网织红细胞裂解物基于无细胞转录/翻译应用PCR的DNA兼容系统制备50μL的反应,如下:从转录/翻译系统40微升网织红细胞裂解物,2.5微升放射性标记的[35 S]甲硫氨酸,11微居里/毫升(比活性:> 1000居里/毫摩尔),2.5微升无菌蒸馏水,和5μL的pPsaD PCR产物(100 - 800纳克)。
注意:戴上手套,实验服和安全GLAS处理放射性物质时,SES。监控和净化工作表面和设备。所有放射性废物得到批准的废物容器处理。 - 孵育在30℃的水浴中90分钟的反应。通过将样品在冰使反应停止。
- 除去反应作为测试样品(同体积也可以作为步骤5.7的输入控制),用于验证上,随后进行放射自显影,荧光自显影或磷成像标准的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)的1微升。一个好的结果是通过相应pPsaD(〜23 KD)的分子量独特而强大的乐队的观察表明。在-80℃下进一步应用商店反应的其余部分。
3.分离叶绿体
- 准备下列储备液:
- 制备叶绿体的分离缓冲液(CIB,2×):0.6 1M山梨醇,10mM氯化镁(MgCl 2的),10毫乙二醇四乙酸(EGTA),10mM的乙二胺四乙酸(EDTA),20mM的碳酸氢钠( 碳酸氢钠 ),40毫摩尔4-(2-羟乙基)哌嗪-1-乙磺酸(HEPES) ;调节至pH 8.0,用KOH。制备2升2×CIB的,使等分试样并保存在-20℃下长期储存,或在4℃下短期储存。使1倍CIB,稀释2倍CIB 1:1用蒸馏水;这可以新鲜上叶绿体隔离实验当天制备。
- 制备的HEPES- 硫酸镁 -山梨醇缓冲液(HMS,1×):50mM的HEPES,3mM的硫酸镁(硫酸镁),0.3M山梨醇;调整到与氢氧化钠(NaOH),PH值8.0。制备400mL的缓冲液中,使等分试样并保存在-20℃下长期储存,或在4℃下短期储存。
- 进行所有的下列程序在冷室或在冰上。 ST之前预冷的所有解决方案,装置,设备,和转子的arting。
- 通过混合13毫升的Percoll,13毫升2×CIB缓冲液,并在50 mL离心管5毫克谷胱甘肽,并在4℃下离心分离以43000×g下将混合物30分钟(刹车关闭)制备的连续密度梯度。离心后,处理管小心以避免扰乱梯度,并保持它在冰上待用。
- 转移100毫升1×CIB的每基因型/条件到1升烧杯中。
- 由接装它们放入筛子除去从液体介质中的幼苗,然后将它们转移到另一个含有CIB-烧杯然后,冲洗用CIB中的组织用100mL新鲜的CIB的替换它之前以除去任何残余的液体介质。
- 对于均质化,总共使用每样本100 1×毫升CIB在连续五轮均化,每一轮使用在50mL烧杯中保持新鲜CIB的20毫升。
- 对于第一轮均化,用手工转移植物组织成50毫升烧杯中,使以前持有的缓冲区,通过你的手指流失。尝试使用大多数组织在第一轮,但要确保它浸入与缓冲;如果这是不可能的,在第二轮引入剩余的未使用的组织。
- 放置在组织匀浆器探头进入组织,并与1个脉冲均匀 - 每2秒。过滤通过过滤布两层匀浆成通过轻轻挤压的250mL离心管中。保留滤液,并传送所述组织返回到50毫升的烧杯中。
- 放置一第二20毫升CIB等分进50毫升烧杯中,添加在第一轮均一化不使用任何剩余的组织,并重复均质化和过滤步骤。因而,重复步骤3.5和3.6,直到所有的100毫升CIB已用完( 即 ,20毫升的5等分),并结合所得到的滤液。
- 离心1000×克5分钟(制动),在4℃汇集匀浆,并且倒出上清液紧随离心完成后,小心不要打扰颗粒。重悬在冰上温和搅拌该管在管留的残余物上清液沉淀。不要吹打或涡旋大力悬浮。
- 轻轻匀浆转移到预制的连续密度梯度的顶部,使用巴氏吸管经由接收管的壁以进行应用。避免干扰梯度。离心机在7,800×g下一个吊桶式转子在4℃下10分钟(刹车关闭)。
注意:两个绿色带可以在梯度离心之后可以看出:较低频带包含完整叶绿体,上部频带包含破碎叶绿体。 - 通过移液丢弃顶带,然后用巴氏吸管转移低频成新鲜的50毫升离心管中,保持每梯度高达8毫升的体积。
- 添加〜25毫升1X HMS缓冲液进入管和翻转试管两次tØ从叶绿体洗珀。再次将管在吊桶式转子和离心机在1000×g下5分钟(在制动器)在4℃下。
- 倒掉上清并小心重悬叶绿体粒料通过在冰上温和搅拌该管在管留的残余HMS。如果需要的话(基于粒料的大小和第四部分的计数)300微升的HMS的,但尽量不太多稀释样品 - 增加一个额外的100。
- 置于冰上的叶绿体。在使用之前,叶绿体下游应用,每一次摇动管重悬。始终使用切割的枪头(与毛孔粗大)传输的叶绿体。
4.叶绿体的产量和完备性分析
- 添加5μL的分离叶绿体至495 1×的微升的HMS缓冲器在1.5mL管,然后通过反相管以获得1轻轻混匀:100稀释。
- 解放军铈对血球的计数室顶部的玻璃罩。慢慢吸管〜40 - 稀释叶绿体悬浮成护罩玻璃和计数室之间的间隙的60微升。用相差显微镜与10X 20X或客观,完整叶绿体看起来又圆又亮和光的光环所环绕。
注:在显微镜下,有25个大型广场,在计数室的中心每片含16个小方格1毫米2计数区域。 - 叶绿体伯爵在10大方格的数量。每个大型广场叶绿体的数量应平均10到30之间。如果过少或过多的叶绿体都存在,调整稀释倍数(步骤4.1以上),因此,并重复上述步骤。
- 计算每毫升(浓度)叶绿体的数量为:n(每个在步骤4.3计算大正方形叶绿体的平均数目)×25(大正方形的总数目)×100(稀释因子)×来表示每1毫升的数据,因为上面的25平方的体积为0.1mm 3)10 4(缩放因子。
- 通过在步骤3.12所得叶绿体悬浮液的体积的浓度乘以计算叶绿体的实际产率。通常情况下,可以得到超过50×10 6叶绿体。
5.叶绿体蛋白导入
- 准备下列储备液:
- 制备10倍HMS缓冲液:500mM的HEPES,30mM的硫酸镁和3.0 1M山梨醇;调节至pH 8.0,用NaOH。制备50毫升这种缓冲液,等分试样,并储存在-20℃下长期储存,并在4℃下短期储存。
- 制备导入终止缓冲液:50毫摩尔EDTA溶解在1×HMS缓冲器。在-20°C准备50毫升该缓冲区,分装和商店。
- 制备2×蛋白加样缓冲液:60毫摩尔的Tris-HCl,pH值6.8,10%(V / V)甘油,2%(重量/体积)SDS,0.005%(重量/体积)溴酚蓝。让50毫升,并储存于4℃。使用前,加入100微升1M的1,4-二硫苏糖醇(DTT),以缓冲的900微升。
- 与3个时间点运行时间过程,制备每片含进口终止缓冲液130微升等分试样3管,并让它们在冰上。准备在2毫升管的450微升进口反应(每个基因型/条件)。解冻所有成分只是在使用前。
- 对于一个导入反应,通常使用在一个μL体积10×10 6叶绿体;例如,如果该叶绿体浓度为2.5×10 8 /毫升,用40微升叶绿体悬浮液。三个时间点都需要3×AμL( 即 ,在我们的例子120μL)。
- 混合反应组分在冰上以下顺序:蒸馏水(使总体积600微升)中,B微升10X HMS缓冲液(其中B = [600-3×A] / 10; 也就是,48在我们的例子), 12μL的1M葡糖酸(钾盐),6微升的1M的NaHCO 3,6微升20%(重量/体积)牛血清白蛋白,30微升的100mM 5'-三磷酸腺苷镁盐(MgATP),24微升的250mM蛋氨酸(未放射性标记)和30微升的前体蛋白。立即启动导入反应前,加入3×叶绿体的微升,并轻轻拍打管混合。
- 孵育在25℃的反应管在水浴中在100微摩尔·米- 2·秒- 1的光。偶尔振动小管重悬叶绿体。
- 进行时间过程,从反应在所需的时间点的线性范围进口的,这对于pPsaD达〜12分钟(4,8和12分钟的时间点是合适的范围内撤出130微升等分试样在这种情况下)。线性范围周期可以为不同的蛋白质14而有所不同。因此,有人建议之前测试每个单独的前蛋白,以优化吨他的时间点。
- 时立即撤回,每130μL等分试样转移到冰冷的进口终止缓冲液的管,通过轻轻拍打管混合,并保留在冰上所有管,直到时间过程已经完成。
- 离心机在微量12000×g下所有样品30秒,通过移液弃上清,重悬粒料通过涡旋15 2×μL的蛋白质加样缓冲液。
- 分析所有样品加上通过标准SDS-PAGE和放射自显影,荧光自或磷光体成像15 pPsaD输入控制(含有pPsaD相当于加入到各导入反应的量的10%,从步骤2.7)。使用图像分析软件进行量化和分析结果。以提供进口效率的指示,在不同基因型导入蛋白质的量/条件可以通过测量与每个成熟频带相关的放射性评估。
结果
一个例子叶绿体蛋白质导入实验用3时间点示于图1。PSAD是光系统的一个〜18 kD的分量I暴露于基质,具有〜23 kD的16的前体形式。 PSAD在这里为体外蛋白质测定进口选择,因为它的稳态水平是在SP1突变,相对于WT升高,压力条件下,这表明在突变3的进口效率的变化。在SP1突变体携带在叶绿体蛋白质导入机械的重要调节的缺陷-的SP1蛋白3。用于从在正常条件下生长的植物中分离的叶绿体,有在SP1和WT之间PSAD进口无明显差异(数据未显示)3。但是,使用此处描述的方法来评估PSAD导入从渗透分离叶绿体强调植物,检测到明显的差异。虽然我们观察到在用两种基因型一个时间依赖性成熟蛋白质形式的积累,进口的速率是WT叶绿体比SP1叶绿体( 图1),这与我们以前的结果3一致显著降低,揭示在胁迫条件下调节PSAD的叶绿体进口为SP 1蛋白具有重要作用。
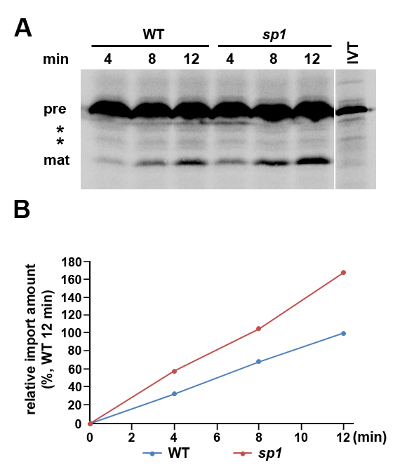
图1.蛋白质含量导入利用下渗透胁迫条件。叶绿体从10日龄WT(Col-0中)隔离种植的植物隔离叶绿体和SP1的拟南芥突变体植株胁迫条件下生长传导英寸(200毫米甘露醇) 2天。 ( 一 )进口蛋白使用进行[35 S] -Methionine标记pPsaD并允许通过SDS-PAGE和荧光成像分析之前进行4,8和12分钟。并联,包括在体外 pPsaD 10%的输入控制翻译的蛋白质(IVT)进行了分析。前体(前)和成熟(垫)pPsaD的形式表示,而在两者之间有两个波段的可能对应截断或蛋白水解翻译产品,因为它们的强度没有时间过程(*)过程中更改。 (B)导入的速率比较成从胁迫条件下生长的WT和SP1植物叶绿体中,对应于所述的导入的成熟蛋白质的每个条带的强度进行定量。所有数据都表示为从WT植物叶绿体蛋白进口的后12分钟的金额百分比。 请点击此处查看该图的放大版本。
讨论
我们最近发现,叶绿体蛋白质导入可以通过压力,这是叶绿体功能和植物生存3临界积极调节。在这项研究中,监测这些规定,我们修改的叶绿体的分离和体外实验的进口手续,以使胁迫条件下生长的植物的进口能力的评估。结果表明在叶绿体蛋白质导入调节SP1中起重要作用。
常规体外导入测定使用生长标准的MS琼脂培养基6,17,18上的植物。在这里所描述的SP1突变体的情况下,这种传统的检测没有发现在相对蛋白质导入到WT 3的任何差异。但是,当蛋白质导入使用本文所述( 图1)的方法胁迫条件下评估SP1在调节蛋白质导入的作用是清楚地表明。虽然中号唉不可能直接从压力条件测定与来自常规测定法(如在方法采用分别在液体培养在琼脂培养基上生长,植物)获得的那些进行比较导入数据,胁迫和非胁迫条件之间的比较提供的可行将植物所有生长在相同的液体培养基中,有或没有压力。
用琼脂培养基上的应力处理相比,液体培养对于大量需要在体外导入测定植物的治疗更方便。此外,它方便了压力源到所有的植物,这是短期的胁迫处理特别重要的均匀应用。这里介绍的方法已经应用甘露醇使用治疗研究渗透胁迫,但可以很容易地适应范围广等应力;例如,短期盐胁迫和氧化应激,为此,相应的压力可以bË同样通过液体MS培养基中的应用。对于其他类型的应力,我们建议应力的程度,首先优化;过于严重的治疗可能对分离细胞器的产率和/或进口能力的不利影响。
有协议内的几个重要步骤,哪一个应特别注意,详情如下。
为MS培养基的最佳琼脂浓度可以不同(0.6 - 0.9%,重量/体积)取决于制造商。因此,建议在开始实验之前,凭经验优化琼脂浓度。介质不应该这么软的,它坚持在收获步骤(步骤1.9)组织,也不应该是这么辛苦,它抑制植物根系发育。蔗糖浓度,也可根据所使用的植物调节。当具有特别病的突变体的工作,MS培养基补充有2 - 3%(重量/体积)蔗糖可有助于植物生长更好。当应用程序躺在胁迫处理,这是不好的很老厂转移到液体介质( 如 > 14天)。这是因为老厂的较为发达的根transferral过程中更容易损坏。
关于转录/翻译系统,有2个主要系统:基于小麦胚芽,和那些基于兔网织红细胞。这些试剂盒可使用不同的模板,例如线性化质粒,unlinearized质粒或PCR产物。该试剂盒也具体的T3,T7和SP6启动子。需要注意的是,我们在这里建议的试剂盒,是仅适用于PCR产物和T7启动子的使用。然而,不知什么原因,这个系统做了一些放射性preproteins可能无法有效地导入检测工作;在这种情况下,可以考虑尝试小麦胚芽提取物的系统或意味着质粒模板网织红细胞裂解物系统。一个也可改善转录/翻译再结果通过根据制造商的手册修改反应条件的动作。
它开始在清晨叶绿体隔离是很重要的(或在生长室的光周期的早期),以避免叶绿体由于光合作用,从而可以阻碍完整细胞器的隔离内部的淀粉积累。叶绿体分离过程,必须没有任何不必要的延迟快速完成,并分离出叶绿体必须始终保持低温。这是为了减轻针对该分离的叶绿体将逐渐失去其可行性,这是不好的观察。如果使用新解冻CIB或HMS缓冲区时,一定要使用前混合缓冲区,以获得均匀的溶液。对于植物材料的同质化的最佳条件已经凭经验确定,并且如果使用不同的组织匀浆可以变化。
如果不同的植物含有基因型similař叶绿素水平,叶绿素量化可以用来作为一种替代方式进行导入测定之前正常化样品。可以分光光度测定下列中的80%的分离的叶绿体的样品的提取叶绿素(体积/体积)含水丙酮19,20。然而,如果植物的导入率表示不同叶绿素含量( 例如 ,用褪绿表型的突变体)的进行比较,可以使用叶绿体数计数正常化叶绿体样品在导入实验。它是重悬叶绿体在步骤3.11彻底尤为重要。悬浮不足可能会留下叶绿体,这将使它很难准确计算数量的聚集,从而会阻碍正确装载进口的反应。如果严重聚集在显微镜下看到的( 例如 ,聚合> 10叶绿体连接在一起),继续摇冰叶绿体样品,直到骨料ES被除去。这是比较容易悬浮叶绿体中缓冲的一个较小的体积。
要知道,蛋白质导入反应(第5部分)必须以适当的预防措施,因为它们的放射性性质进行是很重要的。必要的预防措施包括:戴着一次性手套,实验服和护目镜,监测和净化工作表面和设备,并在批准的废物容器的所有放射性废物处置。也请记住,正确的渗透压是在导入反应维持叶绿体的完整性至关重要,这主要是由HMS缓冲维持。因为10倍HMS是粘性的,它应首先升温至RT,然后充分混合,并使用切枪头,以确保准确体积的测量的应用。在导入反应,冷中加入甲硫氨酸抑制游离放射性标记的甲硫氨酸掺入无关chloropl通过在温育步骤细胞器翻译AST蛋白,而牛血清白蛋白是用来通过作为蛋白酶的基板,以尽量减少蛋白水解。
披露声明
Authors have nothing to disclose.
致谢
这项工作是由来自生物技术和生物科学研究理事会资助,以支持PJ(BBSRC;授予裁判BB / K018442 / 1)。
材料
| Name | Company | Catalog Number | Comments |
| Murashige and Skoog basal salt | Melford | M0221 | |
| phytoagar | Melford | P1003 | |
| 2-(N-morpholino) ethane sulfonic acid (MES) | Melford | B2002 | |
| triton X-100 | Fisher | BPE151-500 | |
| surgical tape (e.g., Micropore, 3M) | 3M | 1530-1 | |
| filter paper | Fisher | FB59023 | |
| Percoll | Fisher | 10607095 | |
| ethylene glycol tetraacetic acid (EGTA) | Sigma | E4378 | |
| ethylenediaminetetraacetic acid (EDTA) | Fisher | D/0700/53 | |
| 4-(2-hydroxyethyl)piperazine-1-ethanesulfonic acid (HEPES) | Melford | B2001 | |
| filtration cloth (Miracloth) | Calbiochem | 475855 | |
| 50 mL centrifuge tube | Fisher | CFT-595-040M | |
| 250 mL centrifuge bottle | Fisher | CFT-891-V | |
| Polytron (e.g., Kinematica PT10-35) | Fisher | 11010070 | |
| Polytron probe (e.g., Kinematica PTA20S) | Fisher | 11030083 | |
| centrifuge (e.g., Beckman Coulter Avanti JXN-26, for 50 and 250 mL tubes) | Beckman Coulter | B34182 | |
| fixed-angle rotor for 250 mL bottles (e.g., JLA-16.250) | Beckman Coulter | 363930 | |
| fixed-angle rotor for 50 mL tubes (e.g., JA-25.50) | Beckman Coulter | 363058 | |
| swinging-bucket rotor for 50 mL tubes (e.g., JS-13.1) | Beckman Coulter | 346963 | |
| radiolabeled [35S] methionine | Perkin Elmer | NEG072002MC | |
| rabbit reticulocyte lysate based cell-free translation system (TNT T7 Quick kit for PCR DNA) | Promega | L5540 | |
| phase-contrast microscope (e.g., Nikon Eclipse 80i) | Nikon | unavailable | |
| haemocytometer (Improved Neubauer BS748 chamber) | Hawksley Technology | AC1000 | 0.1 mm depth, 1/400 mm2 |
| cover glasses | VWR | 16004-094 | 22 mm × 22 mm, thickness 0.13-0.17 mm |
| 1.5 mL microfuge tubes | Sarstedt | 72.690.001 | |
| 2 mL microfuge tubes | Starlab | S1620-2700 | |
| microfuge (e.g., Eppendorf 5415D) | Eppendorf | unavailable | |
| Nanodrop 2000 spectrophotometer or similar | Thermo Fisher | SPR-700-310L | |
| gluconic acid (potassium salt) | Fisher | 22932-2500 | |
| bovine serum albumin (BSA) | Sigma | A7906 | |
| MgATP | Sigma | A9187 | |
| methionine | Sigma | M6039 | |
| bromophenol blue | Fisher | B/P620/44 | |
| glycerol | Fisher | G/0650/17 | |
| SDS | Fisher | S/5200/53 | |
| Tris Base | Melford | B2005 | |
| dithiothreitol (DTT) | Melford | MB1015 | |
| image analysis software (e.g., Aida Image Analyzer) | Raytest | unavailable |
参考文献
- Jarvis, P., Lòpez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nat. Rev. Mol. Cell Biol. 14 (12), 787-802 (2013).
- Saibo, N. J., Lourenco, T., Oliveira, M. M. Transcription factors and regulation of photosynthetic and related metabolism under environmental stresses. Ann. Bot. 103 (4), 609-623 (2009).
- Ling, Q., Jarvis, P. Regulation of chloroplast protein import by the ubiquitin E3 ligase SP1 is important for stress tolerance in plants. Curr Biol. 25 (19), 2527-2534 (2015).
- Chua, N. H., Schmidt, G. W. In vitro synthesis, transport, and assembly of ribulose 1,5-bisphosphate carboxylase subunits. Basic Life Sci. 11, 325-347 (1978).
- Highfield, P. E., Ellis, R. J. Synthesis and transport of the small subunit of chloroplast ribulose bisphosphate carboxylase. Nature. 271, 420-424 (1978).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Lett. 529 (2-3), 215-220 (2002).
- Froehlich, J. Studying Arabidopsis envelope protein localization and topology using thermolysin and trypsin proteases. Methods Mol Biol. 774, 351-367 (2011).
- Flores-Pérez, &. #. 2. 1. 8. ;., Jarvis, P. Isolation and suborganellar fractionation of Arabidopsis chloroplasts. Methods Mol. Biol. 1511, 45-60 (2017).
- Kubis, S., et al. The Arabidopsis ppi1 mutant is specifically defective in the expression chloroplast import, and accumulation of photosynthetic proteins. Plant Cell. 15 (8), 1859-1871 (2003).
- Kubis, S., et al. Functional specialization amongst the Arabidopsis Toc159 family of chloroplast protein import receptors. Plant Cell. 16 (8), 2059-2077 (2003).
- Aronsson, H., et al. Nucleotide binding and dimerization at the chloroplast pre-protein import receptor, atToc33, are not essential in vivo but do increase import efficiency. Plant J. 63 (2), 297-311 (2010).
- Huang, W., Ling, Q., Bédard, J., Lilley, K., Jarvis, P. In vivo analyses of the roles of essential Omp85-related proteins in the chloroplast outer envelope membrane. Plant Physiol. 157 (1), 147-159 (2011).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory Manual. Second edn. 1, (1989).
- Aronsson, H., et al. Monogalactosyldiacylglycerol deficiency in Arabidopsis thaliana affects pigment composition in the prolamellar body and impairs thylakoid membrane energization and photoprotection in leaves. Plant Physiol. 148, 580-592 (2008).
- Aronsson, H., Jarvis, R. P. Rapid isolation of Arabidopsis chloroplasts and their use for in vitro protein import assays. Methods Mol. Biol. 774, 281-305 (2011).
- Haldrup, A., Lunde, C., Scheller, H. V. Arabidopsis thaliana plants lacking the PSI-D subunit of photosystem I suffer severe photoinhibition, have unstable photosystem I complexes, and altered redox homeostasis in the chloroplast stroma. J. Biol. Chem. 278 (35), 33276-33283 (2003).
- Kubis, S. E., Lilley, K. S., Jarvis, P. Isolation and preparation of chloroplasts from Arabidopsis thaliana plants. Methods Mol. Biol. 425, 171-186 (2008).
- Chen, X., Smith, M. D., Fitzpatrick, L., Schnell, D. J. In vivo analysis of the role of atTic20 in protein import into chloroplasts. Plant Cell. 14, 641-654 (2002).
- Miras, S., et al. Non-canonical transit peptide for import into the chloroplast. J. Biol. Chem. 277 (49), 47770-47778 (2002).
- Nada, A., Soll, J. Inner envelope protein 32 is imported into chloroplasts by a novel pathway. J. Cell Sci. 117 (17), 3975-3982 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。