Method Article
스트레스 식물에서 분리 된 엽록체로 단백질 가져 오기의 분석
요약
여기에서 우리는 스트레스 고립 된 엽록체로 단백질 가져 오기를 연구하는 새로운 방법을 설명합니다. 상기 방법은 신속하고 간단하고 엽록체 단백질 가져올 다른 스트레스 조건의 결과 및 대응하는 조절 메커니즘을 연구에 적용 할 수있다.
초록
엽록체는 광합성을하지만 수많은 다른 신진 대사 및 신호 기능뿐만 아니라 포함 식물의 많은 중요한 역할과 세포 기관이다. 또한, 엽록체는 염분 및 삼투 스트레스 등의 다양한 비 생물 적 스트레스에 대한 식물의 반응에 대한 중요하다. 엽록체는 자신의 게놈에 의해 인코딩 된 일부 ~ 3,000 다른 단백질까지 함유 할 수있다. 그러나, 엽록체 단백질의 대부분이 핵으로 인코딩 및 세포질에서 합성하고, 이들 단백질은 엽록체 봉투 막에 translocons 통해 엽록체 내로 가져와야된다. 최근의 연구는 엽록체 단백질 가져 오기가 적극적으로 스트레스에 의해 조절 될 수 있음을 보여 주었다. 생화학 적 스트레스 조건 하에서 단백질 수입 그러한 조절을 조사하기 위해, 우리는 쉽게 실험실에서 달성 될 수있는 신속하고 간단한 방법으로 여기에 설명 된 방법을 개발 하였다. 이 방법에서는, 식물은 일반 공조하에 성장다음 NS와 액체 배양 조건을 스트레스에 노출. 식물 재료를 수집하고, 엽록체는 다음 균질화에 의해 방출된다. 조 균질 그대로 엽록체의 분리를 가능 밀도 구배 원심 분리에 의해 분리된다. 엽록체 수율 계산에 의해 평가되고, 엽록체 intactness는 현미경으로 확인한다. 단백질 가져 오기 분석을 위해, 정제 된 엽록체는 체외 번역 전구체 단백질 35 S의 방사성 표지와 함께 배양하고, 시간 코스 실험은 스트레스 조건에서 유전자형 사이의 수입 비율의 비교를 가능하게하기 위해 실시된다. 우리는 규제 돌연변이에서 엽록체 내로 단백질 수입 비율은 특별히 삼투 스트레스 조건 변경되는 것을 보여준다이 방법을 사용하여 생성 된 데이터를 제시한다.
서문
엽록체는 식물의 녹색 조직에 존재하는 매우 풍부한 소기관이다. 이들은 광합성에서의 중요한 역할 당 이산화탄소를 변환함으로써 지구 (1)에 거의 모든 생활을 지원하는 광 에너지를 사용하는 방법으로 잘 알려져있다. 또한, 엽록체 (와 색소체라고 관련 세포 기관의 폭 넓은 제품군은) 아미노산, 지질, 색소의 생합성 및 중력과 병원체의 도전과 같은 환경 신호의 감지를 포함하여 식물의 다른 많은 중요한 역할을 재생할 수 있습니다. 광합성 특정 상황에서 유용한 역할을 부산물로서 반응성 산소 종 (ROS)을 생성하지만, 경우에 손상 또는 치명적인 영향을 일으킬 수있는 과잉. ROS의 생산 과잉은 특히 불리한 환경 조건에 의해 추진되고, 따라서 엽록체는 밀접하게 같은 염분 및 삼투 스트레스 2와 비 생물 적 스트레스에 대한 반응에 연결되어 있습니다.
장loroplasts은 복잡한 구조를 가지고있다. 각 엽록체는 외부 및 내부 막으로 구성 봉투라는 이중 막 외부 층에 의해 둘러싸여 있습니다. 내부적으로, 광합성의 빛 반응이 일어나는 틸라코이드라는 다른 막 시스템이있다. 두 개의 막 시스템 사이에 수성 구획 통화 탄소 고정에 관여하는 기질,있다. 엽록체는 3,000 ~ 서로 다른 단백질을 포함 할 수 있으며, 이러한 단백질의 대부분은 전구체 형태로 세포질에서 합성되고, 봉투 막 1 전용 단백질 translocons을 통해 세포 기관으로 수입 할 필요가있다. 흥미롭게도, 최근의 연구는 엽록체 단백질 가져 오기가 적극적으로 규제를 나타내면, 그래서 엽록체 프로테옴 통제의 중요한 레벨을 발휘 할 수있다. 예를 들면, 단백질 가져 오기 번째의 풍요의 직접 규제를 통해 비 생물 적 스트레스에 반응 할 수있는 2015 년에보고되었다유비퀴틴 - 프로 테아 좀 시스템 (3)에 의하여 엽록소 (TOC)의 외부 덮개 막에 전자 translocon.
정제 된 엽록체를 사용하여 체외 합성 전구체 단백질에서 단백질 수입은 체외 4,5에서 재구성 할 수 있습니다. 따라서, 시험 관내 방법은 단백질 수입 기계 추정 성분들의 분석, 단백질 수입 및 조절의 기초가되는 메커니즘을 발견하기위한 매우 중요한 접근법왔다 다른 돌연변이 식물 6 수입의 비율을 평가하기 위해 사용될 수있다. 또한, 엽록체는 엽록체 단백질 7,8의 서브 organellar 현지화 및 토폴로지에 대한 연구를 용이하게 할 수 시험관 가져 오기 다음 추가 분류 또는 단백질 분해 효소 분해, 처리 할 수 있습니다.
우리가 설명하는 바와 같이 스트레스에 의한 단백질의 수입 규제를 연구하기 위해, 우리는 우리의 일상 엽록체 분리 방법을 수정 한이리. 중요한 엽록체 8 일 동안 표준 한천 배지 무라 시게 및 스쿡 (MS) 상에 성장하고 상대적으로 짧은 제어 스트레스 처리를 제공 스트레스 보충 MS 액체 배지에 옮기고 있었다 식물로부터 분리 하였다. 스트레스 처리 된 식물에서 분리 된 엽록체의 수율과 역량은 체외 단백질 수입 분석 (3)의 하류와 호환됩니다. 엽록체 분리 프로토콜 외에도 강력한 것으로 입증되었다 3,9-12 널리 사용되는 시험 관내 단백질 수입, 우리의 통상적 인 방법을 제시한다.
프로토콜
1. 애기 장대 식물의 성장과 스트레스 치료
- 1 L에 순수까지 MS 바살 염 혼합물의 4.3 g 10 g의 수 크로스, 0.5 g 2- (N- 모르 폴리 노) 에탄 술폰산 (MES)을 첨가하여 무라 시게 및 스쿡 (MS) 배지 1 L를 준비하고, 조정 수산화 칼륨으로 pH를 5.7로 (KOH). 120 ℃에서 20 분 동안 phytoagar 및 오토 클레이브 6g을 추가합니다.
- 응고하기 전에 (- 판 당 25 mL의 MS 배지 (20)와 직경 9cm, 높이 1.5 cm) 라운드 페트리 접시에 매체를 붓는다. 플레이트는 뚜껑을 닫기 전에 층류 후드 1 ~위한 시간을 건조하도록 허용합니다.
- 70 %의 1 ㎖의 0.02 % (v / v) 트리톤 X-100을 함유하고 지속적으로 5-10 분 동안 진탕 (v / v)의 에탄올을 첨가하여 표면 살균 1.5 mL를 시험관에 애기 장대의 종자를 배치했다. (150) 모종 - 각 유전자형 / 상태의 경우, 10 페트리 접시 각각 들고 ~ (100)을 준비합니다.
- 씨앗이에 정착 할 때까지 약 10 초 동안 기다립니다다음 튜브의 바닥, 그리고 피펫으로 상층 액을 버린다. 100 % 에탄올 1 mL를 넣고 10 분 동안 다시 튜브를 흔들.
- 씨앗이 살균하는 동안 층류 후드를 준비합니다. 샘플 당 여과지의 한 조각을 가지고 파종을 용이하게하기 위해 반으로 접은 후드에 100 % 에탄올에 담가. 그것은 완전히 건조 될 때까지 기다립니다. 더 빠르게 70 % 에탄올보다는 증발이 100 % 에탄올을 사용하는 주.
- 미세 끝에서 1 mL를 피펫 팁 컷 ~ 5mm를 사용하여 피펫 팅하여 여과지 위에 씨앗을 전송합니다. 15 분 - 그들이 10을해야하는, 건조하도록 허용합니다.
- 각 MS 매체 페트리 접시에 균등하게 150 살균 씨, 수술 테이프로 각 플레이트를 밀봉 - ~ 100 뿌리다.
- 격려하고 발아를 동기화 4 D - 거꾸로 2 4 ° C에서 접시를 저장합니다. 이전 씨는 4 ° C에서 (주까지) 이상 유지해야 할 수 있습니다.
- 식물 조직 배양 챔버에 접시를 전송하고 거꾸로 업을 둡니다.긴 일주기에서 8 D의 식물 성장 (16 시간 100 μmol · m - 2 ·의 - 1 등, 8 시간의 어두운) 20 ° C에서.
- 식물이 흐름 후드, 8 라 오래 스트레스 치료의 경우, 부드럽게 스트레스를 포함하는 액체 MS 매체의 멸균 플라스크에 넣고, 에탄올 멸균 장갑을 끼고 손을 긁어에 의해, 한천 매체로 전송 (예 : , 200 mM의 만니톨). 한천 매체를 통해 운반하지 마십시오. 멸균 호일로 플라스크 입을 덮고 식물 부드러운 진탕 (~ 100 RPM)를 오비탈 진탕 기에서 추가로 2 일 동안 단계 1.8에서와 동일한 조건 하에서 성장을 허용한다.
2. 시험 관내 전사에 의해 전구체 단백질을 만들기 / 번역
주 :이 프로토콜은 I 템플릿 / D 프레 같은 전구체 (pPsaD)를 소단위 애기 광계의 사용을 가정하지만, 다른 방법과 호환 가능하다.
- pBluescript 계 II SK 벡터 (또는 상류 T7 프로모터와 다른 유사한 벡터) (13)의 다중 클로닝 부위 (MCS)에 pPsaD의 암호화 서열 (CDS)를 복제. 하는 DNA 분리 키트를 사용하여 플라스미드 (통해 pBSK-pPsaD)을 정제하고 DNA 서열 분석에 의해 서열을 확인.
참고 :이 모든 단계는 표준 분자 복제 기술을 사용한다. - 260 nm에서 흡광도를 측정하도록 설정된 분광 광도계를 사용을 pBSK-pPsaD 플라스미드 DNA 농도를 측정. 10 NG / μL의 최종 농도로 플라스미드를 희석.
- 템플릿으로 희석 된 플라스미드를 사용하여 (35 사이클) 20 μL PCR을 실행합니다. 2 μL 10 × 중합 효소 버퍼, 2 μL 2 밀리미터의 dNTPs, 1 μL 5 mM의 M13 앞으로 프라이머 (5'-TGT AAA ACG ACG GCC AGT-3 '), 1 μL 5 mM의 M13 역방향 프라이머 (5 : 다음과 같이 반응 준비 '-CAG은 GAA ACA-3 ACC GCT ATG'), 1 μL은을 pBSK-pPsaD 플라스미드, 1 U Taq 중합 효소 및 증류수를 희석까지 총 반응 볼륨을 만들려면20 μL. 다음과 같이 표준 PCR 프로그램을 사용하여 95 ° C, 5 분; [95 ° C, 30 초 35주기; 56 ° C, 30 초; 72 ° C, 30 초) 72 ° C, 5 분.
- TAE 완충액 (트리스 - 염산, pH가 7.6, 20mM의 아세트산, 1 mM의 EDTA)에서 아가 로스 겔 cDNA에 올바른 증폭을 확인하고 해당 정량화 (/ V는 W) 1 %의 PCR 산물의 5 μL를 실행 표준 밴드의 상대 농도를 확인합니다. 상기 애플리케이션 -20 ° C에서 제품의 나머지 부분을 저장한다.
- 다음과 같이 PCR DNA와 호환 토끼 망상 적혈구 용 해물 계 무 세포 전사 / 번역 시스템을 이용하여 50 μL 반응을 준비한다 : 40 μL 망상 적혈구 용 해물을 전사 / 번역 시스템에서, 2.5 μL 방사성 [35 S] 메티오닌, 11 μCi를 / ㎖ (특정 활동> 1000 CI / mmol)을, 2.5 μL 멸균 증류수, 5 μL pPsaD PCR 제품 (100-800 NG).
주의 : 장갑, 실험실 의류 및 안전 한 유리를 착용SES는 방사성 물질을 취급 할 때. 모니터링 및 작업 표면 및 장비의 오염을 제거. 허가 된 폐기물 용기에 모든 방사성 폐기물 폐기하십시오. - 30 ° C의 물을 욕조에 90 분 동안 반응을 품어. 얼음 위에 시료를 넣어 반응을 정지.
- 오토 라디오 그래피, fluorography 또는 형광 촬상 다음 표준 소듐 도데 실 설페이트 폴리 아크릴 아미드 겔 전기 영동 (SDS-PAGE)의 검증을위한 시료로서 반응 (동일한 부피는 단계 5.7에 대한 입력 제어 역할을 할 수) 1 μL를 제거한다. 좋은 결과 pPsaD (~ 23 kDa의)의 분자량에 상응하는 별개의 강한 밴드의 관측에 의해 지시된다. 추가 응용 프로그램에 대한 -80 ° C에서 반응의 나머지를 저장합니다.
3. 엽록체 분리
- 다음 재고 솔루션을 준비합니다 :
- 0.6 M 솔비톨, 10 mM 염화 마그네슘 : 엽록체 분리 완충액 (CIB 2 배)를 준비(의 MgCl 2), 10 mM의 에틸렌 글리콜 디아민 테트라 아세트산 (EGTA), 10 mM의 에틸렌 디아민 테트라 아세트산 (EDTA), 20 mM의의 중탄산 나트륨 (NaHCO3), 40 mM의 4- (2- 히드 록시 에틸) 피페 라진 -1- 에탄 술폰산 (HEPES) ; KOH으로 pH 8.0으로 조정한다. 2 배 CIB 2 L 준비를 분취하고 장기 보관을 위해 -20 ℃에서 그들을 유지 또는 단기 저장을 위해 4 ℃에서. 증류수로 1; 1 배 CIB을하려면 배 CIB 1 희석 이는 엽록체 분리 실험 일에 신선하게 제조 할 수있다.
- HEPES-황산 4 -Sorbitol 완충액 (HMS, 1X) 준비는 50mM HEPES, 3 mM의 황산 마그네슘 (MgSO4로), 0.3 M 소르비톨; 수산화 나트륨 (NaOH)으로 pH를 8.0으로 조정한다. 버퍼 400 mL의 분취 량을 준비하고 장기 보관을 위해 -20 ℃에서 그들을 유지 또는 단기 저장을 위해 4 ℃에서.
- 추운 방에서 또는 얼음에서 다음 절차를 모두 실시한다. 일 전에 용액, 장치, 장비, 및 로터 모두 사전 냉각arting.
- 13 mL의 퍼콜, 13 mL의 2 배 CIB 버퍼 및 50 mL의 원심 분리기 튜브에 5 밀리그램 글루타티온을 혼합, 4 ° C에서 30 분 (브레이크 해제)에 대한 43,000 × g에서 혼합물을 원심 분리하여 연속 밀도 기울기를 준비합니다. 원심 분리 후, 그라디언트를 방해 방지하고 나중에 사용하기 위해 얼음에 그것을 유지하기 위해주의 튜브를 처리합니다.
- 1 L 비이커에 유전자형 / 조건에 따라 1 배 CIB의 100 mL로 전송합니다.
- 체로 팁에 의해 액체 매질에서 모종을 제거하고 다른 CIB 함유 비커에 전송할; 이어서, 신선한 CIB 100㎖로 교체하기 전에 잔류 액체 매질을 제거하는 CIB와 조직을 헹군다.
- 균질화를 들어, 50 mL의 비커에서 개최 신선한 CIB의 20 ㎖를 사용하여 라운드 균질화의 5 개의 연속 라운드, 각 샘플 당 100 mL의 1 배의 CIB의 총을 사용합니다.
- 균질의 첫 번째 라운드를 들면, 허용, 손으로 50 ㎖ 비이커로 식물 조직을 전송할이전 보유 버퍼는 손가락을 통해 배출합니다. 첫 라운드에서 조직의 대부분을 사용하려고하지만,이 버퍼에 몰입되어 있는지 확인; 이것이 가능하지 않다면, 두 번째 라운드의 나머지 미사용 조직을 소개한다.
- 조직에 조직 균질의 프로브를 놓고 1 개의 펄스와 균질화 - 2의 각. 부드러운 압착하여 250 mL의 원심 분리기 튜브에 여과 천의 두 층을 통해 균질를 필터링합니다. 여액을 유지하고, 50 mL의 비커에 다시 조직을 전송합니다.
- 균질화의 첫 번째 라운드에 사용되지 않은 나머지 조직을 추가, 50 mL의 비커에 두 번째 20 ㎖ CIB 나누어지는을 배치하고, 균질화 여과 단계를 반복합니다. 따라서, 반복 CIB의 100 ㎖ (즉, 5 ~ 20 mL를 분취), 그리고 결과 여과 액을 결합까지 사용 된 모든 때까지 3.5 및 3.6 단계를 반복합니다.
- 원심 분리기 4 ° C에서 5 분 (에 브레이크) 1,000 × g에서 풀링 된 균질하고, 부어상층 액을 즉시 펠렛을 방해하지 않도록주의하면서 원심 분리의 완료에 따라. 조심스럽게 얼음에 튜브를 교반하여 튜브에 남아있는 상등액 잔류 펠렛을 재현 탁. 피펫 또는 텍싱에 의해 적극적으로 재현 탁하지 마십시오.
- 부드럽게 수용 튜브의 벽을 통해 적용 할 파스퇴르 피펫을 사용하여 미리 제작 된 연속적인 밀도 구배의 정상에 균질 옮긴다. 그라데이션을 방해하지 마십시오. 4 ℃에서 10 분 (브레이크 해제)에 대한 7,800 × g에서 스윙 버킷 로터에서 원심 분리기.
하단 밴드가 그대로 엽록체를 포함하고 상위 대역 깨진 엽록체가 포함되어 두 개의 녹색 밴드는 원심 분리 후 그라디언트에서 볼 수 있습니다. - 피펫으로 상위 대역을 폐기하고 그라데이션 당 최대 8 ㎖를 유지하는 신선한 50 ㎖ 원심 분리 튜브에 파스퇴르 피펫으로 낮은 주파수 대역을 전송.
- t ~ 1X HMS 25 ㎖의 튜브에 완충액 추가 회 튜브 반전오 엽록체에서 퍼콜을 씻는다. 4 ° C에서 5 분 (에 브레이크) 1,000 × g에서 스윙 - 버킷 로터와 원심 분리기에 다시 튜브를 놓습니다.
- 상층 액을 붓고 조심스럽게 부드럽게 얼음에 튜브를 교반하여 튜브에 남아있는 잔류 HMS에서 엽록체 펠렛을 재현 탁. (펠렛의 크기와 제 4의 계산 기준) 필요한 경우 HMS 300 μL,하지만 너무 많은 샘플을 희석하지 않으려 고 - 추가 (100)를 추가합니다.
- 얼음에 엽록체를 유지합니다. 엽록체는, 다운 스트림 응용 프로그램에 사용하기 전에 각각의 시간을 재현 탁하기 위해 튜브를 흔들어. 항상 엽록체를 전송하는 (확대 기공)와 컷 피펫 팁을 사용합니다.
엽록체의 수율 및 Intactness 4. 분석
- 1.5 mL의 튜브에 495 μL 1 배의 HMS 버퍼에 고립 된 엽록체의 5 μL를 추가 한 다음 1 얻을 수있는 튜브 반전 부드럽게 혼합 : 100 희석.
- 놀이터혈구의 카운팅 챔버의 상부에 커버 글래스 CE. 천천히 피펫 ~ 40 - 커버 유리 및 카운팅 챔버 사이의 간극에 희석 엽록체 현탁액 60 μL. 10 배 또는 20 배 목적으로 위상 현미경을 사용하여, 그대로 엽록체는 둥글고 밝은 모양과 빛의 후광으로 둘러싸여있다.
주 : 현미경으로, 25 큰 사각형 카운팅 챔버의 중심에 각각 포함하는 16 개의 작은 사각형 1mm의 카운팅이 영역이있다. - 10 큰 사각형 엽록체의 수를 계산합니다. 너무 적거나 너무 많은 엽록체가 있으면, 적절하게 희석 계수 (상기 단계 4.1)을 조정하고, 절차를 반복하여 10 내지 30 대 면적당 엽록체의 수 평균한다.
- 다음 ㎖ (농도) 당 엽록체의 수를 계산한다 : N (단계 4.3에서 계산 된 대형 사각형 당 엽록체의 평균 수)가 큰 사각형 (25) (총 개수 ×) 100 (희석 인자) × 25 사각형 위 용적이 0.1 mm이기 때문에 3) 1 mL의 데이터를 표현하기 위해 104 (스케일링 팩터 ×.
- 단계 3.12에서 얻어진 엽록체 현탁액의 부피 농도를 곱하여 엽록체의 실제 수익률을 계산합니다. 일반적으로, 50 × 106 엽록체를 얻을 수있다.
5. 엽록체 단백질 가져 오기
- 다음 재고 솔루션을 준비합니다 :
- 10 배 HMS 버퍼 준비 : 500 mM의 HEPES, 30 mM의 황산, 3.0 M 소르비톨을; NaOH로 pH를 8.0으로 조정한다. 장기간 저장을 위해 -20 ℃에서의 버퍼, 분취하고, 저장소 50 ㎖를 준비하고 단기 저장을 위해 4 ℃에서.
- 1 배 HMS 완충 용액 50 mM의 EDTA : 수입 정지 버퍼를 준비합니다. -20 ° C에서 버퍼, 나누어지는 및 저장의 50 ㎖를 준비합니다.
- (w 60 mM 트리스 - 염산, pH가 6.8, 10 % (v / v) 글리세롤, 2 % : 배 단백질 로딩 완충액을 준비/ v)의 SDS, 0.005 % (w / v)의 브로 모 페놀 블루. 4 ℃에서 50 mL를 저장합니다. 그냥 사용하기 전에, 버퍼 900 μL에 1 M 1,4- 디티 오 트레이 톨 (DTT)의 100 μL를 추가합니다.
- 3 시간 점 시간 과정을 실행 3 관 수입 정지 버퍼의 130 μL 나누어지는을 포함하는 각을 준비하고 얼음을 둡니다. (유전자형 / 조건에 따라) 2 mL의 튜브에 450 μL 가져 오기 반응을 준비합니다. 사용 직전에 모든 성분을 해동.
- 하나 수입 반응에 통상적으로 μL 부피의 10 × 10 6 엽록체를 사용; 예컨대, 엽록소 농도는 2.5 × 108 / ㎖ 40 μL 엽록체 현탁액을 사용하는 경우. 세 번째 포인트는 3 × μL가 필요합니다 (즉, 우리의 예에서 120 μL).
- 다음 순서대로 얼음에 반응 성분을 혼합 : 증류수 (총 부피 600 μL를 만들기 위해), B μL 배 HMS 완충액 (여기서, B = [600-3 × A] / 10, 즉 48이 예에서) 12 μL1 M 글루 콘산 (칼륨 염), 6 μL 1 M NaHCO3을 6 μL의 20 % BSA, 30 μL를 100mM 아데노신 5'- 삼인산 마그네슘 염 (MgATP) 24 μL 250 mM의 메티오닌 (/ V W) (방사성 표지되지 ), 30 μL 단백질을 전구체. 즉시 가져 오기 반응을 시작하기 전에, 3 × 엽록체의 μL를 추가하고 부드럽게 튜브를 눌러 섞는다.
- 2 ·의 - 1 - 빛 100 μmol · m 아래 수조에서 25 ° C에서 반응 튜브를 품어. 때때로 엽록체를 재현 탁하기 위해 튜브를 가볍게.
- 시간 코스를 수행하기 위해, pPsaD 위해 ~ 12 분 (4, 8 및 12 분 시간 지점은 적합하도록 인 수입의 선형 범위 내에 필요한 시간 지점에서 상기 반응으로부터 130 μL 씩 인출 이 경우에). 선형 범위 기간은 다른 단백질 (14)에 따라 다를 수 있습니다. 따라서, t를 최적화하기 전에 각각의 프레를 테스트 제안그는 시간을 가리 킵니다.
- 즉시 인출시에, 빙냉 오기 정지 버퍼의 각 튜브에 130 μL 분취를 부드럽게 전달 튜브를 탭하여 혼합하고, 시간 과정이 완료 될 때까지 얼음 모든 튜브를 유지한다.
- 원심 분리기의 microfuge에서 12,000 × g에서 30 초 동안 모든 샘플은 피펫으로 상층 액을 버리고, 그리고에 resuspend 펠릿 텍싱 15 μL 배의 단백질 로딩 버퍼입니다.
- 모든 샘플 플러스 표준 SDS-PAGE 및 오토 라디오 그래피, fluorography 또는 형광 영상 (15)에 의해 pPsaD 입력 제어부 (단계 270에서, 각각의 가져 오기 반응에 첨가 양의 10 % pPsaD 당량을 함유)을 분석. 결과를 정량화하고 분석 할 이미지 분석 소프트웨어를 사용합니다. 수입 효율의 표시를 제공하기 위해, 다른 유전자형 가져온 단백질 량 / 각 상황 성숙한 밴드와 연관된 방사능을 측정함으로써 평가 될 수있다.
결과
3 시간 점을 예 엽록체 단백질 가져 오기 실험은 그림 1과 같다. PSAD는 ~ 23 kD의 (16)의 전구체 양식, 나는 기질에 노출 광계의 ~ 18 kD의 구성 요소입니다. 그 정상 수준 WT에 상대적인 SP1 돌연변이에서 증가되므로 PSAD는 돌연변이 3 년 수입 효율의 변화를 제시 스트레스 조건 하에서, 여기서 시험 관내 단백질 가져 분석으로 선정 하였다. SP1의 단백질 - 3 SP1 돌연변이는 엽록체 단백질 수입 기계의 중요한 조정기의 결함을 수행합니다. 정상적인 조건 하에서 성장 식물로부터 분리 엽록체 들어 SP1 및 WT 사이 PSAD 수입에서 명백한 차이는 없었다 (데이타는 도시되지 않음) 3. 그러나, 여기에 설명 된 방법을 사용하여 삼투에서 분리 된 엽록체에 psad는 가져 오기를 평가하기스트레스 식물, 명확한 차이가 감지되었습니다. 우리는 두 유전자형 시간 의존적으로 성숙한 단백질 형태의 축적이 관찰 된 반면, 수입 비율은 이전 결과 (3)와 일치한다 SP1 엽록체 (도 1)보다 WT 엽록체 유의하게 낮았다 계시 스트레스 조건 하에서 PSAD의 엽록체 수입을 규제에서 SP1 단백질의 중요한 역할.
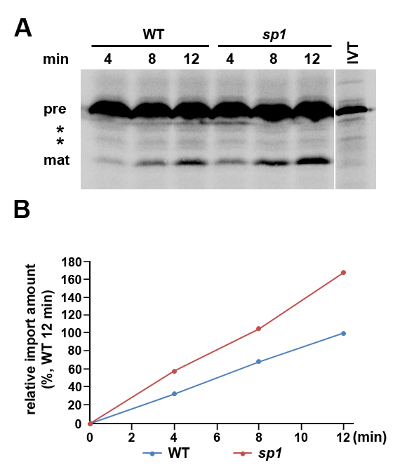
그림 1. 단백질 가져 오기 분석은 스트레스 조건 하에서 성장 엽록체가 10 일짜리 WT (골-0)에서 분리되었다. 삼투압 스트레스 조건에서 자란 식물에서 분리 된 엽록체와 SP1 돌연변이 애기 장대 식물을 사용하여 전도 (200 mM의 만니톨) 2 일합니다. (A) 단백질 가져 오기를 수행 하였다 [35 S] -methionine 표지 pPsaD 및 SDS-PAGE 및 형광 이미징에 의한 분석하기 전에 4, 8, 12 분 동안 진행하는 것을 허용했다. 병행하여, 시험관 내에서 상기 pPsaD 10 % 입력 제어 번역 단백질 (IVT)을 분석 하였다. 가능성이 잘 리거나 proteolyzed 번역 제품에 해당하는 두 개의 밴드가 사이에있는 동안 자신의 강도가 시간 코스 (*) 동안 변경되지 않았기 때문에 (사전) 성숙 전구체는 (매트) pPsaD의 형태는 표시됩니다. 스트레스 조건 하에서 성장 WT SP1 및 식물 엽록체로 수입 비율을 비교하는 (B)는 A의 수입 성숙 단백질에 대응하는 각 밴드의 강도를 정량 하였다. 모든 데이터는 12 분 후 WT 식물의 엽록체에서 수입 된 단백질의 양을 백분율로 표현된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리는 최근 엽록체 단백질 가져 오기가 적극적으로 엽록체 기능과 식물의 생존 3 중요하다 스트레스에 의해 조절 될 수 있음을 보여 주었다. 이 연구에서, 이러한 규제를 모니터링, 우리는 스트레스 조건 하에서 성장 식물 반입 용량 평가를 가능하게하기 위해 우리의 엽록체 단리 관내 가져 분석 절차에서 수정. 결과는 엽록체 단백질의 수입 규제에 SP1을위한 중요한 역할을 지적했다.
기존의 생체 외 수입 분석은 표준 MS 한천 배지 6,17,18에서 자란 식물을 사용합니다. 여기에 설명 된 SP1 변이체의 경우에, 종래 분석법은 WT 3 단백질 수입 상대적 차이를 보여주지 않았다. 단백질 오기가 여기에 설명 된 방법 (도 1)를 이용하여 스트레스 조건 하에서 평가한다 그러나 단백질 수입을 조절하는 SP1의 역할은 명백하게 드러난다. 그것은 해요 동안바깥 직접 (방법은 각각 액체 문화와 한천 배지에서 자란 식물을 사용하는 등) 기존의 분석에서 얻은 결과와 스트레스 조건 분석에서 수입 데이터를 비교 할 수없는 경우, 스트레스 아닌 스트레스 조건 사이의 비교가 가능 제공된다 식물 모두 또는 스트레스없이 같은 액체 배양 배지에서 배양된다.
한천 배지에 스트레스 치료와 비교할 때, 액체 배양은 시험관 가져 분석에 필요한 설비의 다수의 치료에 더 편리하다. 또한, 단기 스트레스 치료에 특히 중요하다 모든 식물의 스트레스의 균일 한 적용을 용이하게한다. 여기에 제시된 방법은 만니톨 처리를 사용하여 삼투압 스트레스 연구에 적용했지만, 쉽게 다른 응력 다양한 적응 될 수있다; 예를 들어, 단기 염 스트레스 및 산화 스트레스, 해당하는 스트레스의 b 구려전자 마찬가지로 액체 MS 매체를 통해 적용했다. 응력 다른 형태를 위해, 우리는 응력의 정도가 제 최적화 제안; 지나치게 가혹한 치료는 고립 된 세포 소기관의 수율 및 / 또는 수입 능력에 부정적 영향을 미칠 수 있습니다.
아래에 설명 된대로 하나, 특별한주의를 기울여야하는 프로토콜 내에서 몇 가지 중요한 단계가 있습니다.
제조업체에 따라 - (/ V 승, 0.9 % 0.6)를 MS 매체에 대한 최적의 한천 농도는 다를 수 있습니다. 따라서, 경험적 실험을 시작하기 전에 한천 농도를 최적화하는 것을 권장한다. 매체는이 수확 단계 (단계 1.9)에서 조직에 스틱 너무 부드러운 안, 어느 쪽도 그렇게 열심히 식물 뿌리의 발달을 억제하는 것이 없어야합니다. 슈 크로스 농도는 사용되는 식물에 따라 조정될 수있다. (/ V 승) 자당 식물이 잘 성장하는 데 도움이 될 수 있습니다 3 % - 특히 아픈 돌연변이로 작업 할 때, MS 매체는이 보충. 경우 앱스트레스 치료 누워, 상기 액체 매질 (예,> 14 일)까지 매우 오래 식물 전송 좋지 않다. 이전 식물의 뿌리 선진 더 쉽게 양도 중에 손상되기 때문이다.
맥아를 기반으로하는, 토끼 망상에 기반한 : 전사 / 번역 시스템과 관련하여,이 주요 시스템이있다. 이 키트는 선형화 된 플라스미드, unlinearized 플라스미드 또는 PCR 제품 등 다양한 템플릿을 사용할 수있다. 키트는 또한 T3, T7 및 SP6 프로모터에 대한 구체적인이다. 우리가 여기에서 추천하는 키트는 PCR 제품 및 T7 프로모터와 함께 사용에만 적합합니다. 그러나 알 수없는 원인으로,이 시스템을 만든 일부 방사성 표지 preproteins 가져 오기 분석에서 효율적으로 작동하지 않을 수 있습니다; 이러한 경우에, 하나는 맥아 추출물 시스템 또는 플라스미드 템플릿 의미 망상 적혈구 용 해물 시스템 시도 고려할 수있다. 하나는 전사 / 번역 재구성의 결과를 개선시킬 수있다제조자의 지침서에 따라 반응 조건을 수정하여 동작.
그것은 이른 아침에 엽록체 분리를 시작하는 것이 중요하다 (또는 초기 성장 챔버의 광 사이클에서) 그대로 소기관의 분리를 방해 할 수있는 광합성에 엽록체 내부에 전분의 축적을 피하기 위해서이다. 엽록체 분리 과정은 불필요한 지연없이 빠르게 수행되어야하고, 절연 엽록체 항상 저온 유지되어야한다. 이 점차 좋지 않아 자신의 생존 능력을 잃게됩니다 엽록체를 격리 관찰을 완화하는 것입니다. 새로 해동 CIB 또는 HMS 버퍼를 사용하는 경우, 균일 한 용액을 얻기 위해 사용하기 전에 잘 버퍼를 혼합해야합니다. 식물 재료의 균질화를위한 최적 조건을 경험적으로 설정되었고, 다른 조직의 균질화가 사용되는 경우 변할 수있다.
다른 식물의 유전자형은 simila 포함 된 경우R 엽록소 농도는 엽록소 정량화 가져 분석을 수행하기 전에 샘플을 정상화하는 다른 방법으로 사용될 수있다. 엽록소가 80 %에 고립 된 엽록체의 샘플의 추출 다음 분광 광도계 결정될 수있다 (v / v)의 수성 아세톤 (19, 20). 식물의 수입 비율이 (예를 들어, 백화 표현형을 가진 돌연변이)를 비교하는 서로 다른 엽록소 내용을 보여주는 경우, 가져 오기 분석에서 엽록체 샘플을 정상화 계산 엽록체 번호를 사용합니다. 철저하게 단계 3.11에서 엽록체를 재현 탁하는 것이 특히 중요하다. 부족 부유 가져 오기 반응에 올바른로드를 방해합니다 때문에 어려운 정확하게 숫자를 계산하는 것 엽록체의 집계를두고있다. 심한 응집 현미경으로 볼 경우 aggregat까지 얼음 엽록체 샘플을 계속 진탕 (예, 10 엽록체는 접합>과 합산)ES는 제거됩니다. 이 버퍼의 작은 볼륨에서 엽록체를 재현 탁하는 것이 더 쉽습니다.
단백질 가져 오기 반응 (5 절)이 때문에 방사성 특성 적절한 예방 조치로 수행해야 함을 인식하는 것이 중요하다. 필요한주의 사항은 다음과 같습니다 모니터링 및 작업 표면 및 장비의 오염을 제거하고, 허가 된 폐기물 용기에 모든 방사성 폐기물의 처분, 일회용 장갑, 실험실 의류 및 안전 안경을 착용. 또한 올바른 삼투압 가져 오기 반응시 엽록체의 intactness을 유지하기위한 중요한 명심하고, 이것은 주로 HMS 버퍼에 의해 유지된다. 배 HMS 점성이기 때문에, 제 RT까지 예열 한 후 완전히 혼합하고 정확한 양의 측정을 위해 절단 피펫 팁을 사용하여 적용한다. 임포트 반응에서, 차가운 메티오닌 무관 chloropl으로 자유 방사성 표지 메티오닌의 결합을 억제하는 추가배양 단계 동안 organellar 번역 통해 AST 단백질, BSA는 프로테아제에 대한 기질로서 작용하여 단백질 분해를 최소화하기 위해 사용된다.
공개
Authors have nothing to disclose.
감사의 말
이 작품은 생명 공학 및 생물 과학 연구 협의회에서 PJ에 부여에 의해 지원되었다 (BBSRC, 심판을 부여 BB / K018442 / 1.).
자료
| Name | Company | Catalog Number | Comments |
| Murashige and Skoog basal salt | Melford | M0221 | |
| phytoagar | Melford | P1003 | |
| 2-(N-morpholino) ethane sulfonic acid (MES) | Melford | B2002 | |
| triton X-100 | Fisher | BPE151-500 | |
| surgical tape (e.g., Micropore, 3M) | 3M | 1530-1 | |
| filter paper | Fisher | FB59023 | |
| Percoll | Fisher | 10607095 | |
| ethylene glycol tetraacetic acid (EGTA) | Sigma | E4378 | |
| ethylenediaminetetraacetic acid (EDTA) | Fisher | D/0700/53 | |
| 4-(2-hydroxyethyl)piperazine-1-ethanesulfonic acid (HEPES) | Melford | B2001 | |
| filtration cloth (Miracloth) | Calbiochem | 475855 | |
| 50 mL centrifuge tube | Fisher | CFT-595-040M | |
| 250 mL centrifuge bottle | Fisher | CFT-891-V | |
| Polytron (e.g., Kinematica PT10-35) | Fisher | 11010070 | |
| Polytron probe (e.g., Kinematica PTA20S) | Fisher | 11030083 | |
| centrifuge (e.g., Beckman Coulter Avanti JXN-26, for 50 and 250 mL tubes) | Beckman Coulter | B34182 | |
| fixed-angle rotor for 250 mL bottles (e.g., JLA-16.250) | Beckman Coulter | 363930 | |
| fixed-angle rotor for 50 mL tubes (e.g., JA-25.50) | Beckman Coulter | 363058 | |
| swinging-bucket rotor for 50 mL tubes (e.g., JS-13.1) | Beckman Coulter | 346963 | |
| radiolabeled [35S] methionine | Perkin Elmer | NEG072002MC | |
| rabbit reticulocyte lysate based cell-free translation system (TNT T7 Quick kit for PCR DNA) | Promega | L5540 | |
| phase-contrast microscope (e.g., Nikon Eclipse 80i) | Nikon | unavailable | |
| haemocytometer (Improved Neubauer BS748 chamber) | Hawksley Technology | AC1000 | 0.1 mm depth, 1/400 mm2 |
| cover glasses | VWR | 16004-094 | 22 mm × 22 mm, thickness 0.13-0.17 mm |
| 1.5 mL microfuge tubes | Sarstedt | 72.690.001 | |
| 2 mL microfuge tubes | Starlab | S1620-2700 | |
| microfuge (e.g., Eppendorf 5415D) | Eppendorf | unavailable | |
| Nanodrop 2000 spectrophotometer or similar | Thermo Fisher | SPR-700-310L | |
| gluconic acid (potassium salt) | Fisher | 22932-2500 | |
| bovine serum albumin (BSA) | Sigma | A7906 | |
| MgATP | Sigma | A9187 | |
| methionine | Sigma | M6039 | |
| bromophenol blue | Fisher | B/P620/44 | |
| glycerol | Fisher | G/0650/17 | |
| SDS | Fisher | S/5200/53 | |
| Tris Base | Melford | B2005 | |
| dithiothreitol (DTT) | Melford | MB1015 | |
| image analysis software (e.g., Aida Image Analyzer) | Raytest | unavailable |
참고문헌
- Jarvis, P., Lòpez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nat. Rev. Mol. Cell Biol. 14 (12), 787-802 (2013).
- Saibo, N. J., Lourenco, T., Oliveira, M. M. Transcription factors and regulation of photosynthetic and related metabolism under environmental stresses. Ann. Bot. 103 (4), 609-623 (2009).
- Ling, Q., Jarvis, P. Regulation of chloroplast protein import by the ubiquitin E3 ligase SP1 is important for stress tolerance in plants. Curr Biol. 25 (19), 2527-2534 (2015).
- Chua, N. H., Schmidt, G. W. In vitro synthesis, transport, and assembly of ribulose 1,5-bisphosphate carboxylase subunits. Basic Life Sci. 11, 325-347 (1978).
- Highfield, P. E., Ellis, R. J. Synthesis and transport of the small subunit of chloroplast ribulose bisphosphate carboxylase. Nature. 271, 420-424 (1978).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Lett. 529 (2-3), 215-220 (2002).
- Froehlich, J. Studying Arabidopsis envelope protein localization and topology using thermolysin and trypsin proteases. Methods Mol Biol. 774, 351-367 (2011).
- Flores-Pérez, &. #. 2. 1. 8. ;., Jarvis, P. Isolation and suborganellar fractionation of Arabidopsis chloroplasts. Methods Mol. Biol. 1511, 45-60 (2017).
- Kubis, S., et al. The Arabidopsis ppi1 mutant is specifically defective in the expression chloroplast import, and accumulation of photosynthetic proteins. Plant Cell. 15 (8), 1859-1871 (2003).
- Kubis, S., et al. Functional specialization amongst the Arabidopsis Toc159 family of chloroplast protein import receptors. Plant Cell. 16 (8), 2059-2077 (2003).
- Aronsson, H., et al. Nucleotide binding and dimerization at the chloroplast pre-protein import receptor, atToc33, are not essential in vivo but do increase import efficiency. Plant J. 63 (2), 297-311 (2010).
- Huang, W., Ling, Q., Bédard, J., Lilley, K., Jarvis, P. In vivo analyses of the roles of essential Omp85-related proteins in the chloroplast outer envelope membrane. Plant Physiol. 157 (1), 147-159 (2011).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory Manual. Second edn. 1, (1989).
- Aronsson, H., et al. Monogalactosyldiacylglycerol deficiency in Arabidopsis thaliana affects pigment composition in the prolamellar body and impairs thylakoid membrane energization and photoprotection in leaves. Plant Physiol. 148, 580-592 (2008).
- Aronsson, H., Jarvis, R. P. Rapid isolation of Arabidopsis chloroplasts and their use for in vitro protein import assays. Methods Mol. Biol. 774, 281-305 (2011).
- Haldrup, A., Lunde, C., Scheller, H. V. Arabidopsis thaliana plants lacking the PSI-D subunit of photosystem I suffer severe photoinhibition, have unstable photosystem I complexes, and altered redox homeostasis in the chloroplast stroma. J. Biol. Chem. 278 (35), 33276-33283 (2003).
- Kubis, S. E., Lilley, K. S., Jarvis, P. Isolation and preparation of chloroplasts from Arabidopsis thaliana plants. Methods Mol. Biol. 425, 171-186 (2008).
- Chen, X., Smith, M. D., Fitzpatrick, L., Schnell, D. J. In vivo analysis of the role of atTic20 in protein import into chloroplasts. Plant Cell. 14, 641-654 (2002).
- Miras, S., et al. Non-canonical transit peptide for import into the chloroplast. J. Biol. Chem. 277 (49), 47770-47778 (2002).
- Nada, A., Soll, J. Inner envelope protein 32 is imported into chloroplasts by a novel pathway. J. Cell Sci. 117 (17), 3975-3982 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유