需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
无透镜视频显微术在黏附细胞培养动态定量分析中的研究
摘要
无透镜的视频显微镜使我们能够在孵化器内直接监测细胞培养。在这里, 我们描述了用于获取和分析2.7 天长时间获取培养的 HeLa 细胞的完整协议, 导致一个数据集 2.2 x 106测量单个细胞形态学和10584细胞周期轨道。
摘要
在这里, 我们表明, 无透镜的视频显微镜, 使我们能够同时捕获数以千计的细胞的动力学, 直接在孵化器内, 并有可能监测和量化的单个细胞沿几个细胞周期。我们描述了用于监视和量化 HeLa 细胞培养2.7 天的完整协议。首先, 用无透镜的视频显微镜进行细胞培养, 然后在四步过程中分析数据: 多波长全息重建、细胞跟踪、细胞分割和细胞分裂检测算法.因此, 我们表明, 有可能收集具有超过1万个细胞周期轨道和超过 2 x 106细胞形态学测量的数据集。
引言
在几个细胞周期内监测培养的哺乳动物细胞, 准确测量细胞大小和细胞干质量是一项具有挑战性的任务。几个无标签的光学技术能够执行此任务1,2: 移相干涉测量3, 数字全息显微镜 (DHM)4,5,6,7, quadriwave 横向剪切干涉测量8,9和定量相断层扫描10,11。这些方法使人们对哺乳动物细胞周期的认识有了许多新的见解。然而他们很少加上自动细胞追踪算法, 并且他们的吞吐量仍然是有限的, 当测量细胞质量轨道1 (N < 20 分别在3,4,5,6). 因此, 需要用一种新的光学方法来测量大统计量 (N > 1000) 的细胞质量轨迹。
在本文中, 我们展示了无透镜视频显微镜的能力, 同时在孵化室内直接图像数以千计的细胞, 然后量化单个细胞指标沿数以千计的单个细胞周期轨道。无透镜显微镜是一种定量的相位成像技术, 它允许在一个非常大的视野 (通常数十毫米2, 这里29.4 毫米2)12,13 中获取密被包装细胞的相位图像. ,14,15。在单个单元格级别确定了几个度量值,例如、单元格区域、单元格的干质量、单元格粗细、单元格主轴长度和单元格长宽比12、15、每个图像。然后, 通过应用单元跟踪算法, 可以将这些功能绘制为每个单元格, 作为实验时间14、15的函数。此外, 通过检测细胞内的细胞分裂的发生, 有可能提取其他重要信息, 如初始细胞干质量 (刚刚细胞分裂), 最终细胞干质量 (刚刚细胞分裂) 和细胞周期持续时间,即, 两个连续的分区15之间的间隔。所有这些测量都可以计算出非常好的统计数据 (N > 1000), 因为大的视野通常允许分析200到1万细胞在一个单一的无透镜获取。
为了解释这种基于无透镜视频显微镜的方法, 我们描述了2.7 天内对 HeLa 细胞培养进行监测和量化的协议。数据分析是基于多波长全息重建、细胞跟踪、细胞分割和细胞分裂算法的四步过程。这里表明, 空间分辨率和相对较快的帧速率 (每10分钟一次采集) 获得与此无透镜视频显微镜设置兼容标准的细胞跟踪算法。对这个数据集的完整分析结果是在整个细胞周期内测量10584个细胞轨道。
总之, 无透镜视频显微镜是一个强大的工具, 自动监测数以千计的未标记, 不同步, 和未修改的细胞, 每个实验;在多个单元周期中跟踪每个单元格。因此, 我们的测量提供了几个细胞参数的平均值, 但更重要的是, 细胞间的变异超过了大量的细胞。
研究方案
1. 细胞培养监测采集
- 在 DMEM + 谷氨酰胺 (例如, GlutaMAX) 中生长 HeLa 细胞, 辅以 10% (v/v) 热灭活胎小牛血清和1% 青霉素和链霉素。
- 涂层6井玻璃底部培养板与纤维连接蛋白 (25 µg/毫升) 为 1 h。然后每个井种子 2 x 104单元格。
- 在购置期间, 每3天更换一次培养基。
- 对于延时采集, 使用视频无透镜显微镜 (商用)。
注: 这是基于无透镜的计算成像技术, 如欧兹坎et . 所述。16 , 它被修改为在孵化器中以37摄氏度12、15的控制温度执行连续监视。它具有一个互补的金属氧化物半导体 (CMOS) 图像传感器, 像素间距为1.67 µm, 成像面积为 6.4 x 4.6 毫米2。多波长照明由一个多芯片组件发光二极管 (led) 装置提供, 它提供红色、绿色和蓝色照明。波长分别为636、521和 452 nm, 其光谱带宽分别为25、45和 25 nm。红绿蓝 (RGB) 发光二极管位于150µm 针孔的上方, 距离细胞约5厘米。测量接近 LED 的光功率低至10µW 在每个波长和照明时间仅一秒每承购。因此, 在无透镜的视镜下观察细胞培养时, 不会出现光毒性问题。 - 将单元格区域性容器与 CMOS 传感器 (图 1) 联系在一起。在底部使用带有玻璃盖玻片的容器, 这对无透镜采集的质量很重要。还可以使用塑料容器, 但由于这些容器的光学质量较差, 无透镜采集将被降级。
- 使用采集软件 (商用) 控制视频无透镜显微镜, 既可实现定时采集, 又可进行全息重建。用户在软件界面中需要输入的参数包括帧速率、实验持续时间和细胞培养类型, 即黏附细胞或漂浮细胞。
- 设置采集软件的输入参数。每10分钟将帧速率设置为一次获取, 并将单元格区域性类型设置为 "粘附"。
注意: 每10分钟一次获取帧速率是一个很好的折衷, 因为它确保了可靠的单元跟踪, 而结果数据集的大小仍然是合理的。最快的帧速率可实现与这种无透镜显微镜设置是每5分钟一次获得。进一步增加帧率导致 CMOS 传感器过度加热, 这会影响细胞在培养中的生存能力。 - 启动延时采集, 全息重建算法 (商用) 将自动处理无透镜采集, 获得细胞培养的相位图像。全息重建算法是基于多波长相位检索算法17 , 并提供一个 RGB 重建相图像的范围内的每一个单一的单元格 (π, + π) 在一个大视野的29.4 毫米2。无透镜在线全息术的原理是在 z=0 上用平面波 (在正常化后的振幅 1) 来照亮一个稀薄的样本, 并在 CMOS 传感器上检测随后的衍射强度图像在短距离 z = z, 通常为1毫米后,示例.在我们的设置中, 光照按顺序切换到3波长 (λ1= 0.450 µm, λ2= 0.540 µm, λ3= 0.647 µm) 来测量同一样本的三衍射模式。
2. 细胞培养数据分析
- 对于单元跟踪, 使用 Trackmate 算法, 一个开源斐济插件, 用于自动跟踪单个粒子18。首先, 将全部的时间推移捕获加载到斐济 (加载图像序列命令)。由于数据集的大小很大, 通常 400 RGB 帧为 29.7 Mb, 因此以8位格式加载它们会更快。接下来, Trackmate 斐济插件引导用户通过细胞跟踪算法的几个阶段, 即单元检测阶段、单元跟踪阶段以及用于单元检测和计算轨道的几个滤镜。在每个阶段, 配置算法并立即显示结果, 以便在必要时可以轻松地来回导航以重新调整设置。Trackmate 接口的各种菜单显示在图 2中, 其中的实际设置用于 HeLa 单元实验。
- 将采集软件的输入参数设置为如下 (请参见图 2)。将估计的 blob 直径设置为15像素, 探测器阈值为 0.25, 链接最大距离为15像素, 间隙闭合最大距离为15像素, 轨道中的点数为3.5。
注意: 这些设置明显不同于一个实验, 特别是与单元格大小对应的 "估计 blob 直径" (这里给出的像素为1.67 µm)。同样的评论也适用于 "链接最大距离", 它解释了在两个连续帧 (这里给出的像素为1.67 µm) 的最大距离。它的最佳值取决于细胞的运动, 也依赖于细胞密度。 - 在单元格跟踪过程的末尾, 以三个文本文件 ("分析" 按钮) 的形式生成结果, 请参见图 2)。最有用的文件, 名为 "轨道统计" 中的 "点", 由一个表列出所有检测到的单元格, 它们各自 (x、y) 位置在获取、帧号和跟踪编号中。根据这些数据, 使用专用算法执行单元格分割和检测单元划分 (请参阅辅助代码文件)。另外两个文件被命名为 "跟踪统计信息" 和 "跟踪统计信息" 中的 "链接", 包括处理轨道的所有结果,例如跟踪工期、检测到的间隙数、跟踪初始帧等。
- 使用单元格分割算法 (见补充码文件), 自动提取几个描述细胞形态学从重建阶段图像的指标。这些指标是细胞表面积, 细胞主轴长度 (l), 细胞小轴长度 (l) 和细胞长宽比 (l/升)。从无透镜显微镜中恢复的相位与前述15所讨论的试样层的密度和厚度成正比。
- 除了细胞的形态学特征外, 从重建阶段13,19,20提取定量细胞干质量 (CDM) 测量结果
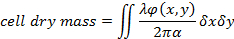 情商 (1)
情商 (1)
其中φ (x, y) 是重构的相移19, λ波长和α = 1.8 x 10-4 m3/千克与折射率变化有关的特定折射率1, 19。 - 用估计细胞折射率与培养基的差异来评估细胞厚度。20给出了单元格厚度h(x、y) 和测量的相移之间的关系:
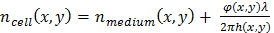 情商 (2.1)
情商 (2.1) 情商 (2.2)
情商 (2.2)
使用Δn(x,y) = n单元格(x,y)- n中 (x,y), 单元格和区域性媒体之间的折射率差。在下面, 假定Δn = 0.025的常量值, 这是从在 HeLa 细胞核 (n = 1.35511) 和磷酸盐缓冲盐水 (PBS) 培养基 (n = 1.33) 中测量的折射率估计出来的。虽然细胞厚度值只是指示性的, 因为它是基于一个假设, 它的相对变化是有意义的, 可以利用来检测分裂细胞。 - 使用专用算法 (请参阅辅助代码文件) 检测细胞分裂的发生, 然后提取与检测到的细胞分裂相关联的单元轨道, 以检测细胞分裂, 测量厚度大于8µm 的单元格。首先确定, 然后检查一个新的细胞是否在空间和时间紧密地出现。这样, 细胞分裂的检测依赖于两个健壮的标准。可替代的和更精细的细胞分裂检测方法可以应用到 lensfree 时间推移获取21,22,23。
结果
对于全息重建过程, 光场由标量字段a 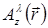 描述 (其中是从样本到距离z的平面上的a的复数值, 以及侧面位置和波长λ).
描述 (其中是从样本到距离z的平面上的a的复数值, 以及侧面位置和波长λ). 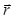 光传播是由惠更斯-菲涅尔理论建模的, 它提供了一个传递者内核.
光传播是由惠更斯-菲涅尔理论建模的, 它提供了一个传递者内核. 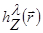 因此, 探测器平面?...
因此, 探测器平面?...
讨论
在本文中, 我们表明, 无透镜的视频显微镜可以在孵化器内使用, 以捕获数以千计的细胞的动力学。为了描述整个方法, 我们解释了如何用标准的细胞跟踪算法来分析2.7 天的 HeLa 细胞在培养中的时间推移获取。结果是一个具有 2.2 x 106单元格测量和10584个单元周期轨道的数据集。这项收购是对 Hela 细胞的一种文化进行的, 细胞间距离相对较大 (细胞密度 < 500 细胞/毫米2), 细胞形态学可?...
披露声明
作者没有什么可透露的。
致谢
作者没有什么可承认的。
材料
| Name | Company | Catalog Number | Comments |
| Cytonote lens-free video microscope | Iprasense | ||
| Horus acquisition software | Iprasense | ||
| 6-well glass bottom culture plates | MatTek corporation | Part No: P06G-0-14-F | |
| DMEM + GlutaMAX medium | Gibco | ||
| heat-inactivated fetal calf serum | Eurobio | ||
| penicillin and streptomycin | Gibco | ||
| Fibronectin | Sigma Aldrich | ||
| Matlab, image processing toolbox | Mathworks |
参考文献
- Zangle, T. A., Teitell, M. A. Live-cell mass profiling: an emerging approach in quantitative biophysics. Nat Methods. 11 (12), 1221-1228 (2014).
- Popescu, G., Park, K., Mir, M., Bashir, R. New technologies for measuring single cell mass. Lab Chip. 14 (4), 646-652 (2014).
- Reed, J., et al. Rapid, massively parallel single-cell drug response measurements via live cell interferometry. Biophys J. 101 (5), 1025-1031 (2011).
- Mir, M., et al. Optical measurement of cycle-dependent cell growth. Proc Natl Acad Sci. USA. 108 (32), 13124-13129 (2011).
- Girshovitz, P., Shaked, N. T. Generalized cell morphological parameters based on interferometric phase microscopy and their application to cell life cycle characterization. Biomed Opt Express. 3 (8), 1757-1773 (2012).
- Kemper, B., Bauwens, A., Vollmer, A., Ketelhut, S., Langehanenberg, P. Label-free quantitative cell division monitoring of endothelial cells by digital holographic microscopy. J Biomed Opt. 15 (3), (2010).
- Mir, M., Bergamaschi, A., Katzenellenbogen, B. S., Popescu, G. Highly sensitive quantitative imaging for monitoring single cancer cell growth kinetics and drug response. PLoS One. 9 (2), 1-8 (2014).
- Bon, P., Savatier, J., Merlin, M., Wattellier, B., Monneret, S. Optical detection and measurement of living cell morphometric features with single-shot quantitative phase microscopy. J Biomed Opt. 17 (7), (2012).
- Aknoun, S., et al. Living cell dry mass measurement usinq quantitative phase imaging with quadriwave lateral shearing interferometry: an accuracy and sensitivity discussion. J Biomed Opt. 20 (1), 1-4 (2015).
- Cotte, Y., et al. Marker-free phase nanoscopy. Nature Photonics. 7 (2), 113-117 (2013).
- Choi, W., et al. Tomographic phase microscopy. Nat Methods. 4 (9), 717-719 (2007).
- Kesavan, S. V., et al. High-throughput monitoring of major cell functions by means of lensfree video microscopy. Sci Rep. 4, 1-11 (2014).
- Zheng, G., Lee, S. A., Antebi, Y., Elowitz, M. B., Yang, C. The ePetri dish, an on-chip cell imaging platform based on subpixel perspective sweeping microscopy (SPSM). Proc Natl Acad Sci USA. 108 (41), 16889-16894 (2011).
- Pushkarsky, I., et al. Automated single-cell motility analysis on a chip using lensfree microscopy. Sci Rep. 4, 4717 (2014).
- Allier, C., et al. Imaging of dense cell cultures by multiwavelength lens-free video microscopy. Cytom Part A. 91 (5), 1-10 (2017).
- Su, T. -. W., Seo, S., Erlinger, A., Ozcan, A. High-throughput lensfree imaging and characterization of a heterogeneous cell solution on a chip. Biotechnol Bioeng. 102 (3), 856-868 (2009).
- Delacroix, R., et al. Cerebrospinal fluid lens-free microscopy: a new tool for the laboratory diagnosis of meningitis. Sci Rep. 7, 39893 (2017).
- Tinevez, J. -. Y., et al. TrackMate: an open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2016).
- Popescu, G. Optical imaging of cell mass and growth dynamics. Am J Physiol Physiol. 295 (2), 538-544 (2008).
- Liu, P. Y., et al. Cell refractive index for cell biology and disease diagnosis: past, present and future. Lab Chip. 16, 634-644 (2016).
- Rapoport, D. H., Becker, T., Mamlouk, A. M., Schicktanz, S., Kruse, C. A novel validation algorithm allows for automated cell tracking and the extraction of biologically meaningful parameters. PLoS One. 6 (11), e27315 (2011).
- Al-Kofahi, O., et al. Automated cell lineage construction: A rapid method to analyze clonal development established with murine neural progenitor cells. Cell Cycle. 5 (3), 327-335 (2006).
- Meijering, E., Dzyubachyk, O., Smal, I., van Cappellen, W. A. Tracking in cell and developmental biology. Semin Cell Dev Biol. 20 (8), 894-902 (2009).
- Posakony, J. W., England, J. M., Attardi, G. Mitochondrial growth and division during the cell cycle in HeLa cells. J Cell Biol. 74 (2), 468-491 (1977).
- Zocchi, E., et al. Expression of CD38 Increases Intracellular Calcium Concentration and Reduces Doubling Time in HeLa and 3T3 Cells. J Biol Chem. 273 (14), 8017-8024 (1979).
- Reitzer, L. J., Wice, B. M., Kennell, D. Evidence that glutamine, not sugar, is the major energy source for cultured HeLa cells. J Biol Chem. 254 (8), 2669-2676 (1979).
- Benedetti, A. D. E., Joshi-barve, S., Rinker-Schaeffer, C., Rhoads, R. E. Expression of Antisense RNA against Initiation Factor eIF-4E mRNA in HeLa Cells Results in Lengthened Cell Division Times, Diminished Translation Rates, and Reduced Levels of Both eIF-4E and the p220 Component of eIF-4F. Mol Cell Biol. 11 (11), 5435-5445 (1991).
- Kumei, Y., Nakajima, T., Sato, A., Kamata, N., Enomoto, S. Reduction of G1 phase duration and enhancement of c-myc gene expression in HeLa cells at hypergravity. J Cell Sci. 93 (2), 221-226 (1989).
- Ginzberg, M. B., Kafri, R., Kirschner, M. On being the right (cell) size. Science. 348 (6236), 1245075 (2015).
- Mathieu, E., et al. Time-lapse lens-free imaging of cell migration in diverse physical microenvironments. Lab Chip. 16 (17), 3304-3316 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。