Method Article
豚鼠耳蜗植入术
摘要
该协议的目的是提供一个动物模型的人工耳蜗植入, 这可以用来解决众多的研究问题。潜在的应用包括评估药物干预或电刺激对听力阈值或电极阻抗的有益影响。
摘要
人工耳蜗是一种高效的装置, 可以恢复听力严重受损的患者的听觉。由于语音感知结果的改善, 候选标准在过去几十年中得到了扩展。这包括有大量残留听觉的患者, 从同一耳的电声刺激中获益, 这使得耳蜗植入过程中的听力保存成为一个重要的问题。电极阻抗和相关的能量消耗问题是另一个重要的研究领域, 因为这一领域的进展可以为完全植入性听觉假肢铺平道路。要有系统地解决这些问题, 充分的动物模型是必不可少的。因此, 本议定书的目的是提供一种人工耳蜗植入动物模型, 可用于解决各种研究问题。由于它的大鼓膜泡, 它允许容易的手术进入内耳, 以及它的听觉范围, 这是相对类似的听觉范围的人, 豚鼠是一个常用的物种在听觉研究。豚鼠耳蜗植入是通过耳后的方法进行的。通过 bullostomy, cochleostomy 被钻孔, 耳蜗植入电极插入 scala 索。该电极可用于电刺激、电极阻抗的测定以及听觉神经复合动作电位的测量。除了这些应用, 耳蜗植入电极也可以作为药物传递设备, 如果一个局部交付药物制剂的细胞或内耳的液体是有意的。
引言
全世界有5亿多人患有听力丧失。1的听力障碍与更高的抑郁率、较低的自尊和自我价值感的降低有关, 这些都导致了生活质量的降低。2虽然助听器是恢复听觉功能的适当方法, 在中度听力减退的情况下, 最有效的治疗方式为患者的深刻听力损失是耳蜗植入 (CI)。由于语音知觉方面的优秀结果, 人工耳蜗植入的候选标准现在也包括在低频区域有大量残留听觉的患者, 但不受益于助听器。3由于这些患者可以在植入耳中使用联合电声刺激, 听力保存已成为 CI 外科医生的一个重要问题。在人工耳蜗植入过程中, 电极阵列插入到耳蜗的 scala 索中, 电刺激听觉神经。4电极插入损伤对残余听觉和诱发纤维化有风险, 增加电极阻抗和植入物的电池消耗。因此, 研究药物干预的模型可以减少由于电极插入引起的听力损失和纤维化。
豚鼠是一种适合和方便的动物模型为 CIs, 因为更容易和更可再生的手术进入内耳与沙鼠, 大鼠或小鼠。5,6,7,8此外, 这一物种的听觉范围相对于人类听觉来说是比较相似的。9种更大的物种, 如猫或猴子, 被用来解决与独联体有关的具体研究问题, 对于大多数 CI 研究来说, 由于伦理和财务方面的考虑, 并不代表一个合理的选择。10,11
总之, 豚鼠是一个可靠和相对成本效益高的模型, 以评估药理干预的作用, 在设置耳蜗植入。
研究方案
所有动物实验由地方动物福利委员会和奥地利联邦部批准了科学、研究和经济。
1. 准备手术所需的设备和设置
- 定位手术显微镜, 钻孔, 加热板和脉冲脉搏, 以方便和有效地处理在手术期间。根据制造商手册检查设备的功能。确保加热盘设置在38摄氏度, 以保护动物在手术中不受低温的侵害。
- 戴上帽子和面具。
- 进行手术手消毒。用肥皂精心洗手。干手, 然后使用酒精洗手液消毒手。手干后戴上手套。
- 准备消毒的手术器械和人工耳蜗植入所需的设备。请参阅本议定书中用于豚鼠 CI 植入手术器械和设备的材料表。
- 当复合动作电位 (CAP) 的测量是有意的, 准备一个约3.5 厘米长的聚四氟乙烯绝缘金丝, 小心地去除两端的绝缘部分使用微钳 (约3毫米从一端和5毫米从另一端)。准备第二块金线 (大约2.5 厘米) 与绝缘末端大约5毫米. 将准备好的电线放入酒精或消毒剂中。
2. 麻醉、药物和动物制剂
- 称量动物。
注意: 动物使用的是女性邓肯-哈特利白化豚鼠。使用的动物的重量, 是大约4-6 星期老, 范围从300到 400 g。 - 根据动物的体重准备手术所需的麻醉剂和药物。准备0.72 毫升的麻醉剂混合物, 包括0.06 毫升氯胺酮 (100 毫克/毫升), 0.18 毫升 medetomidine (1 毫克/毫升), 0.12 毫升咪达唑仑 (5 毫克/毫升) 和0.36 毫升芬太尼 (50 µg/毫升) 手术的400克豚鼠。见表 1的麻醉剂的重量为基础剂量。
- 用27克针将氯胺酮、medetomidine、咪唑安定和芬太尼的混合物注射到动物颈部的脂肪垫上。见表 1 , 以重量为基础的剂量的麻醉剂。把笼子盖住, 在安静的地方把动物留在10分钟, 然后再继续。
- 润滑动物的眼睛, 让他们在整个过程中润滑。剃掉动物的头, 把注意力集中在耳后区域, 以允许足够的外科手术进入泡。
- 将动物放置在发热板上, 并确保该动物与加热板不直接接触以防止热烧伤。将脉冲脉搏探针放在动物的脚上。然后用一个小喉镜仔细地打开动物的嘴巴, 用吸盘把整个口腔从食物中清理干净。
- 用喉镜把动物的嘴巴打开。小心地将胃管插入到动物的食道中, 慢慢地将其推向胃的方向, 直到感觉到阻力。
- 监测动物的 O2-饱和度, 确保胃管不在气管内。如果在 O2饱和度下降, 并在动物完全氧合后再试, 请取出胃管。
- 用23克针将生理盐水、5% 葡萄糖和恩诺沙星的混合物注入动物颈部的脂肪垫中。
- 用酒精洗手液消毒手。戴上新的干净的手套。
- 用聚维酮碘和70% 乙醇交替磨砂制备外科手术场, 覆盖动物。使用自粘窗帘或毛巾夹, 以确保只有手术领域保持发现在过程中。
- 皮下注射0.1 毫升2% 利多卡因溶液到计划切口区域足够的局部麻醉和位置的动物侧身。
- 重新剂量的动物与¼的初始剂量的麻醉混合物每30分钟后, 第一次注射, 以保持足够的麻醉。
3. 人工耳蜗植入术
- 使用手术刀在耳廓后执行大约2-3 厘米皮肤切口3-5 毫米。在必要时使用双极性烧灼, 以减少出血。
注: 麻醉深度应在第一次切口前缺乏踏板提取证实。这项试验应每15-20 分钟重复一次, 以监测整个过程中的麻醉深度。 - 在使用15手术刀或手术剪刀 palpating 听觉泡后, 小心地切开耳后区的肌肉。
注: 触及听觉泡为突出的肌肉。 - 用 raspatory 或棉花芽轻轻地推开泡的肌肉。使用牵引器来暴露切口的全长, 并有不受阻碍地进入泡。
- 使用15手术刀的尖端钻一个洞到泡。仔细旋转手术刀, 直到骨头穿孔, 以便检查中耳结构。
- 扩大 bullostomy 的需要, 以确保耳蜗和圆形窗口利基的基础转向可以充分发挥可视化。将动物的头部定位在弯曲的位置, 以便进入这些结构。用一小块压缩 bullostomy 的面积来防止血液和胞外液在中耳内流动。
注意: 头部的屈折位置可能会阻碍动物的呼吸道。因此, 需要经常检查动物的氧饱和度。 - 把动物放在俯卧的位置。通过执行矩形切口和去除皮肤来暴露动物的顶点。用手术刀解剖骨膜, 从任何其他组织或血液中清除骨。
- 当盖帽测量意欲时, 完成 3.5 cm 聚四氟乙烯绝缘的金导线的准备通过形成一个小钩与微型钳在导线的末端, 已经绝缘了3毫米。
- 当盖帽测量意欲时, 指南末端的金线, 已经被绝缘了5毫米, 被皮下到顶点通过一个 18 G 外周静脉导管使用一个微型钳。另一只手用另一个微钳将导线的钩端仔细地引导到中耳。
- 当盖帽测量意欲时, 活用动物的头通过 bullostomy 想象圆的窗口适当位置的区域。使用另一只手钩金线的骨突出的圆形窗口利基使用微钳。
- 在金丝上保持温和的张力, 并将其固定到 bullostomy 的颅骨边缘, 用 10-15 µL 的组织胶水, 使用1毫升注射器, 用27克针。避免将胶水移入中耳。看图 1为一张圆的窗口区域的一个术中图片与金子导线原位。
- 当帽测量是有意的, 连接绝缘端的黄金线的设备用于测量听觉电位和执行基线上限测量。见 Honeder 等, 2016, 详细描述的上限测量例行执行在我们的实验室。12
- 把动物放在俯卧的位置。钻2孔1毫米前的 lambda 缝合使用1毫米毛刺, 而不造成损坏的硬脑膜。植入2不锈钢螺丝2mm 入头骨。
注: 螺钉用作电极连接器的固定点。根据接头尺寸调整螺钉之间的距离。 - 使用18克外周静脉导管引导电极从连接器到泡在组织层尽可能接近头骨。
- 根据制造商手册, 将牙科水泥粉与用于牙科水泥粉的液体混合使用刮刀。
- 用刮刀将 0.5-0.7 毫升的半流体牙科水泥放在螺钉之间。将电极的接头放置在螺钉之间。
- 保持连接器的位置, 直到牙科水泥硬化。确保螺钉被水泥包裹, 以使接头稳定固定。
- 把动物放在侧面。小心地钻 cochleostomy 1 毫米从圆窗口利基使用0.5 毫米金刚石毛刺在自转率5000回合每分钟。
- 小心地将电极插入到 scala 索的深度4毫米。取出电极并重复插入。见图 2用于豚鼠耳蜗植入电极。
- 使用直针, 用一小块肌肉封住 cochleostomy 区域。用1毫升注射器, 用27克针将电极固定在 bullostomy 的颅骨边缘, 用10µL 的组织胶水。
- 准备3.14 中提到的牙科水泥。用刮刀仔细关闭 bullostomy 约0.3 毫升的牙科水泥。用5-0 可吸收缝线关闭耳后切口。
- 把动物变成俯卧的位置。
- 当盖帽测量意欲时, 用组织钳抓住在动物的顶点的长方形切口的后缘。用剪刀与另一只手做一个皮下隧道约2厘米长在动物的颈部。
- 当 CAP 测量的目的, 植入2.5 厘米金线皮下到动物的颈部使用镊子。将较短的绝缘端焊接到动物顶点上的连接器的指定销上。
- 当盖帽测量意欲时, 焊料圆的窗口小生境电极 (金导线) 到连接器的适当的别针在动物的顶点。
- 在连接器顶部涂上更多的牙科水泥, 以充分覆盖绝缘销和电极。
- 当 CAP 测量是有意的, 根据研究协议执行术后测量。
4. 术后护理
- 应用 atipamezole 和马西尼皮下手术和测量, 以对抗麻醉。
- 应用生理生理盐水作为液体替代物, 以支持动物从手术中恢复。
- 将动物置于加热灯下, 直到它完全从麻醉中恢复, 并开始在笼子内移动。
- 通过将加热灯放在大约50厘米的动物上防止热疗或烧伤。确保动物的体温始终介于37.5 摄氏度和39摄氏度之间。
- 检查动物的前庭损伤的症状, 如眼球震颤, 盘旋或滚动。13,14
- 在术后两天内, 应用丁丙诺啡止痛, 每天二次镇痛。
注: 在第一次应用丁丙诺啡术后, 请确保该动物已完全恢复, 并有稳定的呼吸。这种药物的应用, 而动物仍然在麻醉下可能导致呼吸道抑郁症。 - 在手术后的头3天内, 对动物进行称重, 以检测在这段时间内可能会造成的体重减轻。
注: 在手术后的头3天内, 体重损失约为 10%, 应该被认为是常见的。这种减肥是暂时的, 将在几天内恢复。
结果
通常外科创伤愈合快速和没有复杂化在豚鼠模型和联络为术后电生理测量保持容易地容易接近在动物的顶点 (图 3)。图 4显示了具有代表性的动物的前和术后点击帽测量。电极插入导致16分贝 (分贝) 的阈值移位 (图 4A和4B)。图 4C说明了同一动物的前后频率特异性帽阈值。在低频中, CAP 阈值几乎没有变化, 而在高频区域, 大约25到30分贝的阈值转移是从8赫开始的。
电极插入会引起内耳外伤。除了急性手术外伤外, 异物对电极的反应对耳蜗植入的性能有负面影响。图 5展示了耳蜗在 CI 插入和不同组织学程序后的表现。在图 5中, 在 scala 索中正确定位的电极被留在原位, 而在图 5B中, 电极在组织学检查前被除去。在图 5中, 几乎没有异物反应可见, 而在图 5B中, scala 索的大片区域充满了纤维化组织。图 5C描述了由 CI 电极插入引起的骨螺旋板骨折, 这也导致了该动物螺旋神经节细胞的丢失。这种骨折可以解释一些动物的阈值变化高于预期。
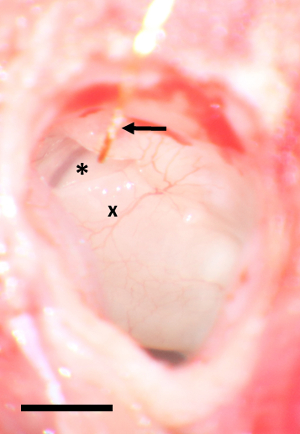
图 1: 带金线的圆窗区域.一个星号标记圆形窗口, x 是耳蜗的基本转弯。金线被箭头标记。缩放栏 2 mm请单击此处查看此图的较大版本.

图 2: 豚鼠耳蜗植入电极.两个触点的电极插入4毫米。电极的直径从尖端的0.3 毫米锥形到0.5 毫米. 线表示0.5 毫米.请点击这里查看这个数字的大版本。
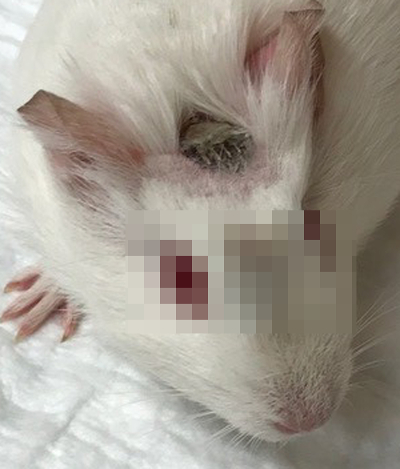
图 3: 豚鼠耳蜗植入大约两周后.该 CI 电极原位和接触的电生理测量是容易接近的在动物的顶点。请单击此处查看此图的较大版本.

图 4: 代表性上限阈值 (A)术前单击有代表性动物的 CAP 阈值。(B)对同一动物的术后点击上限阈值, 显示16分贝的阈值移位。线表示 10 dB。(C)预先和术后频率特定的上限阈值。虽然低频几乎不变, 但25-30 分贝的阈值移位可以在8到32赫的频率范围内观察到。请单击此处查看此图的较大版本.
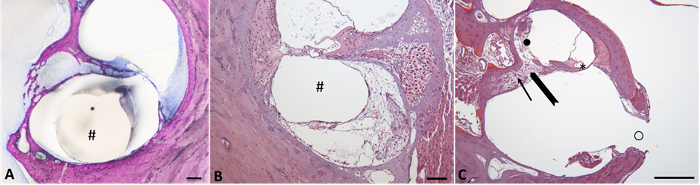
图 5: 电位电极插入的潜在局部后果。(a)豚鼠耳蜗基底转的显微图像与 CI 电极原位 (#) 和只有极小的异物反应。采用树脂嵌入和姬姆萨染色后的研磨抛光技术进行组织学分析。15比例条100µm (B)耳蜗上基底转的鼓膜的显微图像, 其可见组织反应在去除 CI 电极 (#) 后离开运河。比例条100µm (C)低基底转耳蜗骨折骨螺旋板 (粗箭) 和相邻组织反应: (i) 螺旋神经节细胞 (箭头) 在罗森塔尔运河 (ii) 纤维化和 osteoneogenesis 前庭导管 (), 和 (三) 对 Corti 器官的损失 (*)。用相邻 osteoneogenesis 插入 CI (0) 的钻孔孔。比例条500µm. 图5B 和5C 染有苏木精 (蓝) & 血红 (红色)。请单击此处查看此图的较大版本.
讨论
该协议描述了如何在豚鼠模型中进行人工耳蜗植入。该协议可用于评估不同的干预措施对其影响的残余听力和异物反应的 CI 电极。为了使实验具有较高的重现性和准确性, 应采取一些预防措施。
所有豚鼠的基线听力阈值应在术前使用,例如听觉脑干反应测量。一些商业上可用的豚鼠表现出相关的听力损失, 因此不应包括在实验队列中。根据手术和协议的长短, 这种评估可以在手术前或人工耳蜗植入前几天进行, 给动物足够的时间从麻醉中恢复。
在一个自发呼吸的动物全身麻醉下进行手术时, 速度是很重要的。因此, 在手术前细致的准备是必不可少的, 这也是麻醉方案的选择。使用氯胺酮, medetomidine, 咪唑安定和芬太尼结合局部麻醉, 导致了足够的麻醉和镇痛, 而同时, 动物继续自发呼吸。与经常被描述的使用氯胺酮和甲苯噻嗪, 这种方案导致更好的镇痛和减少围手术期的发病率和死亡率。重要的是要有所有的仪器和药物 (包括麻醉剂的助推剂), 在把动物睡觉之前, 可以随时提供。
由于动物的位置变化在手术期间 (从容易的位置改变到 sideward 位置和后面), 有一个风险为胃内容的期望在肺。因此, 该协议还包括胃管的应用, 这是一个快速和简便的方法, 以保护动物免受吸入和减少围手术期死亡率。
为了保持不育在重新定位, 动物被触摸的地方需要被无菌窗帘覆盖, 需要更换手套或重新定位需要由另一个人不育。
O2-饱和监测也是最重要的在手术期间。对海角和圆形窗位进行可视化所需的头部定位可能会导致呼吸道阻塞, 在确定足够早的时间时, 可以很容易地处理。
通常动物在手术过程中会丢失大量体液 (如血液、多余的细胞液、尿液)。因此, 本文介绍的液体置换协议是一种耐受性好的方法, 可以稳定动物的血流动力学, 支持快速恢复麻醉。
为了避免在执行 audiometrical 测量时出现错误, 建议在每次手术期间将连接器的同一针连接到特定电极。
这种方法的一个局限性是术后听力阈值的变化相对较高, 这往往与外科医生的知觉不太相关。尽管结果的这种变异性与残听人的 CI 接受者的情况相似, 但不完全理解变量结果的原因是什么。16,17,18一般来说, 随着时间的推移和外科医生的经验, 变异会减少。在插入电极时, 避免过度的作用力是很重要的, 这可以通过缓慢的插入速度来实现。由于仔细插入 CI 电极会导致听力损失非常有限, 所提出的协议描述了电极的重复插入, 从而导致更高和更可预测的听力损失。这听力损失在高频率区域是最明显的, 在16和32赫之间。由于 intracochlear 创伤取决于插入深度, 耳蜗的形态学和方法 (cochleostomy 与圆形窗口插入) 需要考虑。在豚鼠模型中, 通过圆窗膜插入 CI 电极, 通常在人工听觉保护耳蜗植入中进行。19由于圆窗膜是隐藏在豚鼠和电极插入通过圆窗膜产生不利的插入角度, 钻探 cochleostomy 导致更可预测的听力阈值转移。这项议定书建议使用手术刀, 而不是演习, 以打开鼓膜泡, 因为这导致减少噪音暴露的耳朵被植入。对内耳异物反应的组织学评价, 头发细胞和螺旋神经节细胞的数量, 以及骨螺旋板和电极易位率等结构的创伤应进行在所有植入的耳朵, 因为这些结果有助于更好地理解的功能结果测量。12,20
披露声明
克里斯托弗 Arnoldner 和克 Honeder 是澳大利亚医学-奥地利研究补助金的持有者。本出版物中使用的电极是由奥地利医学院提供的。其余的作者没有什么可透露的。
致谢
作者想感谢桑德拉 Peiritsch 对动物的照顾和诺娜莉皮特的医学写作。奥地利科学基金 (FWF 赠款 P 24260-B19) 和澳大利亚医学-奥地利的财政支助得到了感激的承认。
材料
| Name | Company | Catalog Number | Comments |
| Scale | |||
| Oxygen insufflator | |||
| Shaver | |||
| Sucker | |||
| Povidone Iodine Solution | |||
| Alcohol | |||
| Laryngoscope | |||
| Stomach tube | Fr 06, Lg 80 cm | ||
| Surgical binocular microscope | |||
| Drill | |||
| 0.5 mm diamond burr | |||
| 1 mm diamond burr | |||
| Heating plate | |||
| Pulse oximeter | |||
| Tissue glue | |||
| Dental cement powder | |||
| Fluid for dental cement powder | |||
| Bipolar cautery | |||
| Gauze compress | |||
| Cotton bud | |||
| Cement mixing bowl | |||
| Teflon insulated gold wire | 99.99 % gold, diameter: 0.125 mm, isolation: 0,016 mm, PTFE (Polytetrafluoroethylen) | ||
| Scalpel with blade No. 10 | |||
| Scalpel with blade No. 15 | |||
| Scissors | |||
| Mosquito forceps | |||
| Dressing forceps | |||
| Tissue forceps | |||
| Delicate dressing forceps 2X | |||
| Micro forceps | |||
| Screw driver | |||
| Stainless steel screws | diameter: 1 mm | ||
| Retractor | |||
| Needle probe | |||
| Spatula | |||
| Needle holder | |||
| 5-0 absorbable sutures | |||
| Needle 23G | |||
| Needle 27G | |||
| Medetomidine 1 mg/mL | 0.36 mg/kg | ||
| Midazolam g mg/mL | 1.2 mg/kg | ||
| Fentanyl 50 µg/mL | 0.036 mg/kg | ||
| Ketamine 100 mg/mL | 12 mg/kg | ||
| Lidocaine (local anesthesia) | 4 mg/kg | ||
| Atipamezole 5 mg/mL | 1 mg/kg | ||
| Flumazenil 0.1 mg/mL | 0.1 mg/kg | ||
| Enrofloxacin 100 mg/mL | 7 mg/kg | ||
| Buprenorphin 0.3 mg/mL | 0.05 mg/kg | ||
| Physiological Saline (at body temperature) | 12.5 mL/Kg (pre-surgery) | ||
| Glucose 5 % (preoperative, at body temperature) | 12.5 mL/Kg | ||
| Physiological Saline (at body temperature) | 25 mL/kg (post-surgery) |
参考文献
- Stevens, G., et al. Global and regional hearing impairment prevalence: an analysis of 42 studies in 29 countries. Eur J Public Health. 23 (1), 146-152 (2013).
- Ciorba, A., Bianchini, C., Pelucchi, S., Pastore, A. The impact of hearing loss on the quality of life of elderly adults. Clin Interv Aging. 7, 159-163 (2012).
- Arnoldner, C., et al. Electric acoustic stimulation in patients with postlingual severe high-frequency hearing loss: clinical experience. Adv Otorhinolaryngol. 67, 116-124 (2010).
- Kral, A., O'Donoghue, G. M. Profound deafness in childhood. N Engl J Med. 363 (15), 1438-1450 (2010).
- DeMason, C., et al. Electrophysiological properties of cochlear implantation in the gerbil using a flexible array. Ear Hear. 33 (4), 534-542 (2012).
- Eshraghi, A. A., et al. Pattern of hearing loss in a rat model of cochlear implantation trauma. Otol Neurotol. 26 (3), discussion 447 442-447 (2005).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hear Res. 312, 81-90 (2014).
- Wysocki, J. Topographical anatomy of the guinea pig temporal bone. Hear Res. 199 (1-2), 103-110 (2005).
- Heffner, H. E., Heffner, R. S. Hearing ranges of laboratory animals. J Am Assoc Lab Anim Sci. 46 (1), 20-22 (2007).
- Van Beek-King, J. M., Bhatti, P. T., Blake, D., Crawford, J., McKinnon, B. J. Silicone-coated thin film array cochlear implantation in a feline model. Otol Neurotol. 35 (1), 45-49 (2014).
- Marx, M., et al. Cochlear implantation feasibility in rhesus macaque monkey: anatomic and radiologic results. Otol Neurotol. 34 (7), 76-81 (2013).
- Honeder, C., et al. Effects of sustained release dexamethasone hydrogels in hearing preservation cochlear implantation. Hear Res. , (2016).
- Ris, L., Capron, B., de Waele, C., Vidal, P. P., Godaux, E. Dissociations between behavioural recovery and restoration of vestibular activity in the unilabyrinthectomized guinea-pig. J Physiol. 500, (Pt 2) 509-522 (1997).
- Jin, Z., Mannstrom, P., Skjonsberg, A., Jarlebark, L., Ulfendahl, M. Auditory function and cochlear morphology in the German waltzing guinea pig. Hear Res. 219 (1-2), 74-84 (2006).
- Honeder, C., et al. Effects of intraoperatively applied glucocorticoid hydrogels on residual hearing and foreign body reaction in a guinea pig model of cochlear implantation. Acta Otolaryngol. 135 (4), 313-319 (2015).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Eshraghi, A. A., et al. Clinical, surgical, and electrical factors impacting residual hearing in cochlear implant surgery. Acta Otolaryngol. 137 (4), 384-388 (2017).
- Reiss, L. A., et al. Morphological correlates of hearing loss after cochlear implantation and electro-acoustic stimulation in a hearing-impaired Guinea pig model. Hear Res. 327, 163-174 (2015).
- Chang, M. Y., et al. The Effect of Systemic Steroid on Hearing Preservation After Cochlear Implantation via Round Window Approach: A Guinea Pig Model. Otol Neurotol. 38 (7), 962-969 (2017).
- Eshraghi, A. A., Yang, N. W., Balkany, T. J. Comparative study of cochlear damage with three perimodiolar electrode designs. Laryngoscope. 113 (3), 415-419 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。