Method Article
Implantation cochléaire chez le cobaye
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le but du présent protocole est de fournir un modèle animal d’implantation cochléaire, qui peut être utilisé pour traiter une multitude de questions de recherche. Les applications potentielles incluent l’évaluation des interventions pharmaceutiques ou stimulation électrique pour des effets bénéfiques sur les seuils d’audition ou d’impédance de l’électrode.
Résumé
Les implants cochléaires sont des dispositifs très efficaces qui peuvent rétablir l’audition chez les sujets atteints de déficience auditive profonde. En raison de résultats de perception améliorée des discours, les critères de candidature ont été élargies au cours des dernières décennies. Ceci inclut les patients avec audition résiduelle importante qui profitent de la stimulation électrique et acoustique de la même oreille, ce qui rend préservation d’audience pendant l’implantation cochléaire une question importante. Impédance de l’électrode et la question connexe de la consommation énergétique est un autre domaine de recherche principaux, comme progrès dans ce domaine pourraient ouvrir la voie pour les prothèses auditives totalement implantables. Pour résoudre ces problèmes de manière systématique, des modèles animaux adéquats sont essentiels. Par conséquent, le but du présent protocole est de fournir un modèle animal d’implantation cochléaire, qui peut être utilisé pour traiter diverses questions de recherche. En raison de sa grande bulla tympanique, qui permet un accès chirurgical facile à l’oreille interne, ainsi que sa gamme d’audience qui est relativement similaire à la portée de l’homme, le cochon d’Inde est une espèce couramment utilisée dans la recherche sonore. L’implantation cochléaire chez le cobaye est réalisée via une approche rétroauriculaires. Par le biais de le bullostomy un cochleostomy est foré et l’électrode de l’implant cochléaire est inséré dans le tympan de la scala. Cette électrode peut alors servir pour la stimulation électrique, détermination des impédances de l’électrode et la mesure des potentiels d’action composés du nerf auditif. En plus de ces applications, électrodes de l’implant cochléaire peuvent également servir comme dispositifs si une livraison topique d’agents pharmaceutiques aux cellules ou des liquides de l’oreille interne sont destinés.
Introduction
Plus de 500 millions de personnes dans le monde souffrent d’une perte auditive. 1 altération auditive a été associée à un taux plus élevé de dépression, l’estime de soi plus faible et plus bas sentiments d’estime de soi, qui tous conduisent à la qualité de vie réduite. 2 tandis que les prothèses auditives sont une façon adéquate pour restaurer la fonction sensorielle en cas de perte d’audition modérée, la modalité de traitement plus efficace pour les patients souffrant de déficience auditive profonde est l’implant cochléaire (IC). En raison des excellents résultats en ce qui concerne la perception de la parole, critères de candidature pour une implantation cochléaire maintenant également incluent les patientss ayant résiduelle importante audience dans la région de basse fréquence, mais ne bénéficient pas d’aides auditives. 3 étant donné que ces patients peuvent utilisation combinée de la stimulation électrique et acoustique dans l’oreille implantée, préservation de l’audition est devenue un enjeu majeur pour les chirurgiens de la CI. Pendant l’implantation cochléaire, un tableau de l’électrode est inséré dans le tympan de la scala de la cochlée, où elle stimule électriquement le nerf auditif. 4 le traumatisme d’insertion électrode présente un risque pour l’audition résiduelle et induit une fibrose, ce qui augmente l’impédance de l’électrode et de la consommation de la batterie de l’implant. Ainsi, les modèles pour l’étude des interventions pharmaceutiques qui peuvent réduire la perte d’audition et de la fibrose causée par l’insertion de l’électrode sont essentiels.
Le cobaye est un modèle animal adapté et pratique pour le CIs, en raison de la plus facile et plus accès chirurgical reproductible à l’oreille interne par rapport aux gerbilles, rats ou des souris. 5 , 6 , 7 , 8 en outre, à la portée de cette espèce est relativement comparable à l’oreille humaine. 9 grandes espèces comme les chats ou les singes, qui ont servi à l’adresse des questions de recherche spécifiques associées à CIs, ne représentent pas un choix raisonnable pour la plupart des études CI en raison de considérations éthiques et finances. 10 , 11
En résumé, le cobaye est un modèle fiable et relativement efficaces pour évaluer les effets des interventions pharmacologiques dans le cadre de l’implantation cochléaire.
Protocole
Toutes les expériences animales ont été approuvées par le Comité local de bien-être animal et le ministère fédéral autrichien des sciences, recherche et économie.
1. préparer le matériel et la configuration requise pour la chirurgie
- Positionner le microscope chirurgical, la foret, la plaque chauffante et pulse oxymètre pour permettre facile et efficace de manipulation pendant la chirurgie. Vérifiez le bon fonctionnement des dispositifs basés sur le manuel du constructeur. Assurez-vous que la plaque chauffante est fixée à 38 ° C afin de protéger l’animal d’hypothermie au cours de la chirurgie.
- Mettre sur une cagoule et un masque.
- Effectuer la désinfection chirurgicale main. Se laver les mains soigneusement avec du savon. Séchez-vous les mains et ensuite utilisez un désinfectant alcoolique pour désinfecter les mains. Mettez des gants en après que les mains soient sèches.
- Préparer les instruments chirurgicaux stérilisés et l’équipement requis pour l’implantation cochléaire. Voir la Table des matières pour les instruments chirurgicaux et l’équipement utilisé pour l’implantation de CI de cobaye dans le présent protocole.
- Lorsque des mesures de potentiel d’action composé (PAC) doivent servir, préparer un morceau d’environ 3,5 cm de long de fil d’or isolé téflon en enlevant soigneusement certaines parties de l’isolation des deux extrémités à l’aide d’une pince micro (environ 3 mm d’un bout et 5 mm de l’autre extrémité). Préparer un deuxième morceau de fil d’or (environ 2,5 cm) avec les extrémités non isolées d’environ 5 mm. Place les fils disposés dans l’alcool ou un désinfectant.
2. anesthésie, médicaments et préparation animaux
- Peser l’animal.
NOTE : Les animaux utilisés est femelles cochons d’Inde albinos Dunkin-Hartley. Le poids des animaux utilisés, qui sont environ de 4 à 6 semaines, varie de 300 à 400 g. - Préparer les anesthésiques et les médicaments nécessaires pour la chirurgie basée sur le poids de l’animal. Préparation de 0,72 mL du mélange anesthésique, consistant en la kétamine 0,06 mL (100 mg/mL), 0,18 mL médétomidine (1 mg/mL), 0,12 mL de midazolam (5 mg/mL) et 0,36 mL de fentanyl (50 µg/mL) pour une intervention chirurgicale sur un cobaye de 400 g. Voir le tableau 1 pour les doses basées sur le poids des anesthésiques.
- Injecter le mélange de kétamine, médétomidine, midazolam et de fentanyl par voie sous-cutanée à la grosse garniture dans le cou de l’animal à l’aide d’une aiguille de 27 G. Voir le tableau 1 pour poids basé doses des anesthésiques. Couvrez la cage et laisser l’animal dans un endroit calme pendant 10 min avant de procéder.
- Lubrifier les yeux de l’animal et gardez-les lubrifié pendant toute la procédure. Se raser la tête de l’animal, en se concentrant sur la région de rétroauriculaires afin de permettre un accès chirurgical suffit à la bulle tympanique.
- Placez l’animal sur la plaque chauffante en position couchée et assurez-vous que l’animal n’est pas en contact direct avec la plaque chauffante pour éviter les brûlures thermiques. Placez la sonde oxymètre de pouls sur un pied de l’animal. Ensuite, ouvrez délicatement la bouche de l’animal avec un laryngoscope petit et nettoyer que toute la cavité buccale des aliments incombe à l’aide d’une ventouse.
- Gardez la bouche de l’animal a ouvert avec le laryngoscope. Insérez avec précaution une sonde gastrique dans le œsophage de l’animal et le pousser lentement dans le sens de l’estomac jusqu'à sente une résistance.
- Surveiller l’O2-saturation de l’animal pour s’assurer que la sonde gastrique n’est pas dans la trachée. Retirez la sonde gastrique s’il y a une diminution de la saturation2 O et essayez à nouveau après que l’animal est complètement oxygéné.
- Injecter un mélange de sérum physiologique, 5 % de glucose et enrofloxacine dans le coussin de graisse dans le cou de l’animal à l’aide d’une aiguille de 23 G.
- Utiliser un désinfectant alcoolique pour désinfecter les mains à nouveau. Enfilez des gants propres nouvelles.
- Préparer le champ chirurgical avec une alternance de scrubs de povidone iode et 70 % d’éthanol et couvrir l’animal. Utilisation autocollantes opaques ou serviette pinces pour s’assurer que seul le champ chirurgical reste découvert au cours de la procédure.
- Par voie sous-cutanée, injecter 0,1 mL de solution de lidocaïne 2 % dans la zone de l’incision prévue pour l’anesthésie locale suffisante et placez l’animal sur le côté.
- Re-doser l’animal avec un quart de la dose initiale du mélange anesthésique toutes les 30 minutes après la première injection de maintenir une anesthésie suffisante.
3. cochléaire Implantation
- Effectuer une environ 2-3 cm incision de la peau 3-5 mm postérieure à la pinna à l’aide d’un scalpel. Utilisez une cautérisation bipolaire lorsque cela est nécessaire pour minimiser les saignements.
Remarque : Profondeur anesthésique doit être confirmé par l’absence de pédale retrait avant la première incision. Ce test doit être répété chaque 15-20 minutes pour contrôler la profondeur anesthésique tout au long de la procédure. - Découpez soigneusement les muscles dans la région de rétroauriculaires après avoir palpé la bulla auditif à l’aide d’un scalpel 15 ou les ciseaux chirurgicaux.
NOTE : Palper la bulla auditif comme une proéminence sous les muscles. - Disséquer les muscles de la bulle tympanique en poussant doucement de côté en utilisant un raspatory ou un coton-tige. Utiliser un enrouleur pour exposer toute la longueur de l’incision et ont librement accès à la bulle tympanique.
- Utilisez la pointe d’un scalpel 15 pour percer un trou dans la bulle tympanique. Avec précaution, faites tourner le scalpel jusqu'à ce que l’os sont perforée pour permettre l’inspection des structures de l’oreille moyenne.
- Agrandir la bullostomy selon les besoins pour s’assurer que le tour basal de la cochlée et le créneau de la fenêtre ronde peut être visualisé correctement. Positionner la tête de l’animal en position fléchie afin d’accéder à ces structures. Recouvrir la surface de la bullostomy avec un petit morceau d’une compresse pour empêcher le sang et le liquide extracellulaire d’exécuter l’oreille moyenne.
Remarque : La position fléchie du chef peut obstruer les voies respiratoires de l’animal. Par conséquent, la saturation en oxygène de l’animal doit être vérifié fréquemment. - Placez l’animal en position couchée. Exposer le sommet de l’animal en effectuant une incision rectangulaire et en enlevant la peau. Disséquer le périoste et nettoyer l’os de n’importe quel autre type de tissu ou de sang à l’aide d’un scalpel.
- Lorsque les mesures de la PAC doivent servir, terminer la préparation du fil or 3,5 cm teflon isolés en formant un petit crochet avec une micro pince à l’extrémité du fil, qui a été isolé de 3 mm.
- Quand les mesures de la PAC sont destinées, guider l’extrémité du fil or, qui a été non isolée de 5 mm, par voie sous-cutanée au sommet grâce à un cathéter veineux périphérique à l’aide d’une pince micro en 18 G. Utiliser une autre pince micro avec l’autre main pour guider l’extrémité recourbée du fil soigneusement en à l’oreille moyenne.
- Quand les mesures de la PAC sont destinées, infléchir la tête de l’animal afin de visualiser la zone de la niche de la fenêtre ronde par le biais de la bullostomy. Utilisez l’autre main pour accrocher le fil d’or à la protubérance osseuse de la niche de la fenêtre ronde en utilisant une pince micro.
- Maintenir la légère tension sur le fil d’or et fixez-le au bord crânial de la bullostomy avec 10-15 µL de colle tissu à l’aide d’une seringue de 1 mL avec une aiguille de 27 G. Éviter le déplacement de la colle dans l’oreille moyenne. Voir la Figure 1 pour une image peropératoire de la zone de fenêtre ronde avec le fil d’or sur place.
- Quand les mesures de la PAC sont destinées, connectez l’extrémité non isolée du fil or pour l’équipement utilisé pour mesurer des potentiels auditifs et d’effectuer des mesures de base CAP. Voir des Honeder et coll., 2016, pour obtenir une description détaillée des mesures CAP régulièrement effectués dans notre laboratoire. 12
- Placez l’animal en position couchée. Percer 2 trous de 1 mm avant la suture lambda à l’aide d’une bavure de 1 mm sans causer de dommages à la dure-mère. Implanter des 2 vis inox 2mm dans le crâne.
Remarque : Les vis servent de points de fixation pour le connecteur de l’électrode. Adapter la distance entre les vis en ce qui concerne la taille du connecteur. - Utilisez un cathéter veineux périphérique 18 G pour guider l’électrode du connecteur vers la bulle tympanique dans une couche de tissu au plus près le crâne que possible.
- Mélanger la poudre de ciment dentaire avec le fluide pour la poudre de ciment dentaire à l’aide d’une spatule selon le manuel du constructeur.
- Placer 0,5 - 0,7 mL de ciment dentaire semi-fluide entre les vis à l’aide d’une spatule. Positionner le connecteur de l’électrode entre les vis.
- Maintenir le connecteur en position jusqu'à ce que le ciment dentaire est durci. Assurez-vous que les vis sont entourées par le ciment pour permettre une fixation stable du connecteur.
- Placez l’animal sur le côté. Percer avec précaution le cochleostomy 1 mm de la niche de la fenêtre ronde avec une bavure de diamant de 0,5 mm à une vitesse de rotation de 5000 tours / minute.
- Introduire doucement l’électrode aux scala de timbales jusqu'à une profondeur de 4 mm. Retirer l’électrode et répétez l’insertion. Voir la Figure 2 de l’électrode utilisée pour l’implantation cochléaire de cobaye.
- En utilisant une aiguille droite, sceller la zone de cochleostomy avec un petit morceau de muscle. Fixer l’électrode au bord crânial de la bullostomy avec 10 µL de colle tissu à l’aide d’une seringue de 1 mL avec une aiguille de 27 G.
- Préparer le ciment dentaire, tel que mentionné dans 3.14. Refermer soigneusement le bullostomy avec environ 0,3 mL de ciment dentaire à l’aide d’une spatule. Refermer l’incision de rétroauriculaires à l’aide de sutures résorbables 5-0.
- Mettre l’animal en position couchée.
- Lorsque les mesures de la PAC doivent servir, saisir le bord postérieur de l’incision rectangulaire au sommet de l’animal à l’aide d’une pince de tissu. Utilisez des ciseaux avec l’autre main pour faire un tunnel sous cutané d’environ 2 cm de long dans le cou de l’animal.
- Quand les mesures de la PAC sont destinées, l’implant le fil d’or de 2,5 cm par voie sous-cutanée dans le cou de l’animal à l’aide d’une pince. Souder le bout court non isolé sur la broche désigné du connecteur sur le sommet de l’animal.
- Quand les mesures de la PAC sont destinées, souder à l’électrode de niche de la fenêtre ronde (fil d’or) sur la goupille appropriée du connecteur sur le sommet de l’animal.
- Appliquer un montant supplémentaire de ciment dentaire sur le dessus du connecteur pour couvrir entièrement les goupilles isolées et l’électrode.
- Quand les mesures de la PAC sont destinées, effectuer des mesures postopératoires selon le protocole de recherche.
4. postopératoire soins
- Appliquer Atipamézole et flumazénil par voie sous-cutanée après la chirurgie et les mesures afin de s’opposer à l’anesthésie.
- Appliquer une solution saline physiologique comme fluide substitution pour soutenir la reprise de l’animal de la chirurgie.
- Mettre l’animal sous une lampe chauffante jusqu'à ce qu’il a pleinement récupéré de l’anesthésie et commence à bouger dans la cage.
- Éviter l’hyperthermie ou brûler en plaçant la lampe chauffante environ 50 cm de l’animal. Assurez-vous que la température du corps de l’animal est toujours entre 37,5 ° C et 39 ° C.
- Vérifier l’animal pour les symptômes d’une lésion vestibulaire comme nystagmus, encerclant ou renversement. 13 , 14
- Appliquer la buprénorphine pour l’analgésie deux fois par jour pour deux plusieurs jours après la chirurgie.
Remarque : Avant la première application de buprénorphine post-opératoire s’assurer que l’animal a complètement récupéré et a la respiration stable. Application de ce médicament alors que l’animal est encore sous anesthésie peut entraîner une dépression respiratoire. - Peser l’animal au cours de la première 3 jours après la chirurgie pour détecter la perte de poids possible comme marqueur de détresse pendant ce temps.
NOTE : Perte de poids d’environ 10 % au cours de la première chirurgie après 3 jours peut être prévue et devrait être considéré comme commune. Cette perte de poids est temporaire et va récupérer en quelques jours.
Résultats
Habituellement les plaies chirurgicales guérissent rapidement et sans complications dans le modèle de cochon d’Inde et les contacts pour des mesures électrophysiologiques postopératoires restent facilement accessibles au sommet de l’animal (Figure 3). La figure 4 montre la mesure pré- et postopératoire clic-CAP d’un animal représentatif. Insertion des électrodes a provoqué un déplacement de seuil de 16 décibels (dB) (Figures 4 a et 4 b). Figure 4 C illustre les seuils de CAP de fréquence spécifiques préalables et postopératoires de l’animal même. Seuils de CAP sont presque inchangés dans les basses fréquences, alors qu’un déplacement de seuil d’environ 25 à 30 dB est atteint dans la région de haute fréquence, à partir de 8 kHz.
Insertion des électrodes peut causer un traumatisme de l’oreille interne. Outre le traumatisme chirurgical aigu, la réaction de corps étranger à l’électrode un impact négatif sur performances de l’implant cochléaire. La figure 5 illustre le limaçon des cobayes après insertion de CI et de différentes procédures histologiques. Figure 5A l’électrode, qui se positionne correctement dans le tympan de la scala, a été laissé sur place, tandis que dans la Figure 5B l’électrode a été supprimé avant histologique préopératoire. Dans la Figure 5A presque aucune réaction à corps étranger n’est visible, alors que dans la Figure 5B une vaste zone de la scala tympanique est rempli de tissu fibreux. Figure 5 C représente la fracture de la lame spirale osseuse due à l’insertion des électrodes CI, qui a également provoqué une perte de cellules de ganglion spiral chez cet animal. Ces fractures peuvent expliquer plus haut que les déplacements de seuil attendu chez certains animaux.
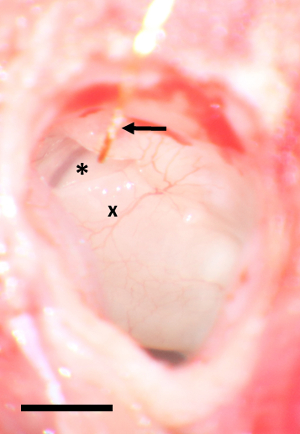
Figure 1 : Tour de zone de la fenêtre avec fil d’or in situ. L’astérisque marque la fenêtre ronde, un x tournez le basal de la cochlée. Le fil d’or est marqué par une flèche. L’échelle bar 2 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Électrode implant cochléaire cobaye. L’électrode avec deux contacts est inséré pour 4 mm. Le diamètre de l’électrode est conique de 0,3 mm à la pointe de 0,5 mm. lignes indiquent 0,5 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
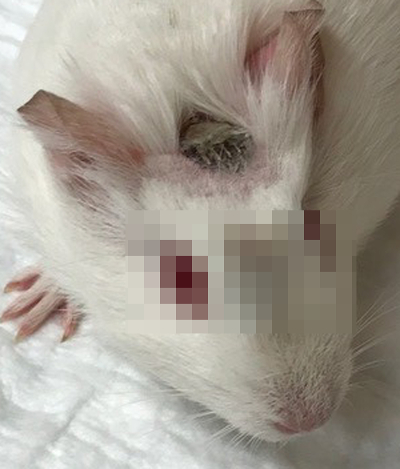
Figure 3 : Cochon d’Inde environ deux semaines après l’implantation cochléaire. L’électrode de CI est sur place et les contacts pour des mesures électrophysiologiques sont facilement accessibles au sommet de l’animal. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Seuils représentant CAP (A) Seuil de CAP cliquez préopératoire d’un animal représentatif. (B) Postoperative cliquez sur seuil de CAP de l’animal même, présentant un déplacement de seuil de 16 dB. Les lignes indiquent 10 dB. (C) , seuils de CAP fréquence spécifique pré- et postopératoires. Alors que les basses fréquences sont presque inchangés, un déplacement de seuil de 25-30 dB peut être observé dans la gamme de fréquences de 8 à 32 kHz. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
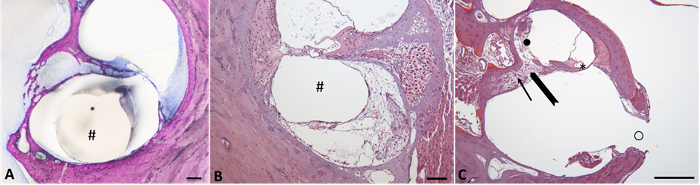
Figure 5 : Conséquences locales d’insertion des électrodes CI. (A) micrographie de tour basal d’une cochlée de cobaye avec l’électrode CI in situ (#) et seulement la réaction minime corps étrangers. L’analyse histologique a été réalisée en utilisant un meulage et polissage technique après l’incorporation de la résine et la coloration de Giemsa. 15 échelle 100 µm micrographie (B) de la gaine tympanique de l’empeigne basale arrêter la cochlée avec réponse tissulaire visible, laissant un canal après le retrait de l’électrode de CI (#). Échelle 100 µm (C) inférieur tour basal de la cochlée avec lame spirale osseuse fracturée (flèche "BOLD") et la réponse des tissus adjacents : (i) la perte de cellules de ganglion spiral (flèche) dans canal (ii) la fibrose de Rosenthal et osteoneogenesis dans les conduits vestibulaires (●) et ( III) perte de l’organe de Corti (*). Trous de forage pour l’insertion de CI (○) avec osteoneogenesis adjacents. Échelle de 500 µm. les chiffres 5 b et 5c ont été colorés avec l’hématoxyline (bleu) & éosine (rouges). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le protocole présenté explique comment effectuer une implantation cochléaire dans le modèle de cochon d’Inde. Ce protocole peut être utilisé pour évaluer les différentes interventions pour leurs effets sur l’audition résiduelle et la réaction à corps étranger à l’électrode de CI. Plusieurs précautions doivent être prises pour obtenir une reproductibilité élevée et la précision des expériences.
Seuils d’audition de référence de tous les cochons d’Inde doivent être mesurées avant l’opération en utilisant par exemple des réponses auditif du tronc cérébral. Certains des porcs Guinée commercialement disponibles présentent une déficience auditive pertinents et ne devraient donc pas figurer dans la cohorte expérimentale. Selon la durée de la chirurgie et le protocole, que cette évaluation peut être faite soit immédiatement avant la chirurgie ou quelques jours avant l’implantation cochléaire, donnant l’animal suffisamment de temps pour récupérer de l’anesthésie.
Lors de l’exécution chirurgie sous anesthésie générale dans un spontanément respiration animale, la vitesse est importante. Une préparation minutieuse avant l’intervention chirurgicale est donc essentielle, comme c’est le choix du protocole anesthésique. L’utilisation de la kétamine, médétomidine, midazolam et fentanyl en combinaison avec des résultats d’anesthésie locale en une anesthésie suffisante et l’analgésie, tandis que dans le même temps, l’animal continue à respirer spontanément. Par rapport à l’usage souvent décrits de kétamine et de xylazine, ce régime entraîne mieux analgésie et péri-opératoire réduit la morbidité et la mortalité. Il est important d’avoir tous les instruments et les médicaments (y compris une dose de rappel des anesthésiques) facilement disponibles avant de mettre l’animal à dormir.
En raison des changements de position des animaux au cours de la chirurgie (changeant de position couchée à la position latéralement et verso), il y a un risque d’aspiration de l’estomac contenu dans les poumons. Pour cette raison, le protocole prévoit aussi l’application d’une sonde gastrique, qui est un moyen rapide et facile pour protéger l’animal à l’aspiration et réduire la mortalité péri-opératoire.
Afin de maintenir la stérilité pendant le repositionnement, les zones où l’animal est touché il fallait être couverts par des tentures stériles, gants doivent être changés par la suite, ou re-positionnement doit être fait par un autre individu qui n’est pas stérile.
O2-surveillance de la saturation est également primordial pendant la chirurgie. Le positionnement de la tête requis pour la visualisation du promontoire et niche de la fenêtre ronde peut provoquer une obstruction des voies aériennes, qui peuvent être facilement manipulé quand identifié assez tôt.
Les animaux perdent généralement une grande quantité de liquides organiques (par exemple le sang, liquide extra-cellulaire, urine) pendant la chirurgie. Par conséquent, le protocole de substitution fluide introduit dans ce manuscrit représente une méthode bien tolérée pour stabiliser l’hémodynamique des animaux et prend en charge leur récupération rapide de l’anesthésie.
Pour éviter des erreurs lors de l’exécution des mesures d’audiometrical, il est recommandé de fixer la même broche du connecteur à une électrode spécifique pendant chaque intervention chirurgicale.
Une des limites de cette méthode est la variabilité relativement élevée dans quarts de seuil d’audition postopératoire, qui souvent ne concordent pas bien avec la perception du chirurgien. Même si cette variabilité des résultats ressemble à la situation humaine CI receveurs avec audition résiduelle, on ne comprend pas bien quelles sont les causes des résultats variables. 16 , 17 , 18 en général, la variabilité diminue avec le temps et l’expérience du chirurgien. Il est important d’éviter les efforts excessifs lors de l’insertion de l’électrode, ce qui peut être atteint par une vitesse lente d’insertion. Parce que l’insertion minutieuse d’une électrode de CI peut entraîner seulement une perte auditive très limitée, le protocole présenté décrit une insertion répétée de l’électrode, ce qui provoque une plus grande et la perte d’audition plus prévisible. Cette perte auditive est plus prononcée dans la région de haute fréquence, entre 16 et 32 kHz. Le traumatisme INTRACOCHLAIRE dépend de la profondeur d’insertion, la morphologie de la cochlée et l’approche (cochleostomy contre l’insertion de la fenêtre ronde) doivent être prises en compte. Insertion de l’électrode de CI à travers la membrane de la fenêtre ronde, généralement pratiquée en implantation cochléaire de l’audition humaine préservation, a également été utilisée dans le modèle de cochon d’Inde. 19 parce que la membrane de la fenêtre ronde est cachée dans le cobaye et l’insertion des électrodes à travers les résultats de membrane de fenêtre ronde dans un angle défavorable d’insertion, un cochleostomy de forage mène à plus prévisibles quarts de seuil d’audition. Ce protocole propose d’utiliser un scalpel au lieu d’une perceuse pour l’ouverture de la bulla tympanique, car cela se traduit par une exposition au bruit réduit de l’oreille à implanter. Une évaluation histologique de l’oreille interne sur la réaction de corps étranger à l’électrode, la quantité de cellules ciliées et des cellules de ganglion spiral ainsi traumatisme aux structures comme la lame osseuse spirale et taux de translocation électrode doivent être effectuées dans l’ensemble implanté à oreilles, car ces résultats contribuer à faire mieux comprendre les résultats fonctionnels mesurés. 12 , 20
Déclarations de divulgation
Christoph Arnoldner et Clemens Honeder sont les titulaires d’une subvention de recherche de l’Autriche de MED-EL. Les électrodes utilisées dans la présente publication ont été fournis par l’Autriche de MED-EL. Les autres auteurs n’ont rien à divulguer.
Remerciements
Les auteurs veulent remercier Sandra Peiritsch pour le soin des animaux et des Noelani Peet pour rédaction médicale. Le soutien financier par le Fonds scientifique autrichienne (FWF grant P 24260-B19) et MED-EL Autriche tient à reconnaître.
matériels
| Name | Company | Catalog Number | Comments |
| Scale | |||
| Oxygen insufflator | |||
| Shaver | |||
| Sucker | |||
| Povidone Iodine Solution | |||
| Alcohol | |||
| Laryngoscope | |||
| Stomach tube | Fr 06, Lg 80 cm | ||
| Surgical binocular microscope | |||
| Drill | |||
| 0.5 mm diamond burr | |||
| 1 mm diamond burr | |||
| Heating plate | |||
| Pulse oximeter | |||
| Tissue glue | |||
| Dental cement powder | |||
| Fluid for dental cement powder | |||
| Bipolar cautery | |||
| Gauze compress | |||
| Cotton bud | |||
| Cement mixing bowl | |||
| Teflon insulated gold wire | 99.99 % gold, diameter: 0.125 mm, isolation: 0,016 mm, PTFE (Polytetrafluoroethylen) | ||
| Scalpel with blade No. 10 | |||
| Scalpel with blade No. 15 | |||
| Scissors | |||
| Mosquito forceps | |||
| Dressing forceps | |||
| Tissue forceps | |||
| Delicate dressing forceps 2X | |||
| Micro forceps | |||
| Screw driver | |||
| Stainless steel screws | diameter: 1 mm | ||
| Retractor | |||
| Needle probe | |||
| Spatula | |||
| Needle holder | |||
| 5-0 absorbable sutures | |||
| Needle 23G | |||
| Needle 27G | |||
| Medetomidine 1 mg/mL | 0.36 mg/kg | ||
| Midazolam g mg/mL | 1.2 mg/kg | ||
| Fentanyl 50 µg/mL | 0.036 mg/kg | ||
| Ketamine 100 mg/mL | 12 mg/kg | ||
| Lidocaine (local anesthesia) | 4 mg/kg | ||
| Atipamezole 5 mg/mL | 1 mg/kg | ||
| Flumazenil 0.1 mg/mL | 0.1 mg/kg | ||
| Enrofloxacin 100 mg/mL | 7 mg/kg | ||
| Buprenorphin 0.3 mg/mL | 0.05 mg/kg | ||
| Physiological Saline (at body temperature) | 12.5 mL/Kg (pre-surgery) | ||
| Glucose 5 % (preoperative, at body temperature) | 12.5 mL/Kg | ||
| Physiological Saline (at body temperature) | 25 mL/kg (post-surgery) |
Références
- Stevens, G., et al. Global and regional hearing impairment prevalence: an analysis of 42 studies in 29 countries. Eur J Public Health. 23 (1), 146-152 (2013).
- Ciorba, A., Bianchini, C., Pelucchi, S., Pastore, A. The impact of hearing loss on the quality of life of elderly adults. Clin Interv Aging. 7, 159-163 (2012).
- Arnoldner, C., et al. Electric acoustic stimulation in patients with postlingual severe high-frequency hearing loss: clinical experience. Adv Otorhinolaryngol. 67, 116-124 (2010).
- Kral, A., O'Donoghue, G. M. Profound deafness in childhood. N Engl J Med. 363 (15), 1438-1450 (2010).
- DeMason, C., et al. Electrophysiological properties of cochlear implantation in the gerbil using a flexible array. Ear Hear. 33 (4), 534-542 (2012).
- Eshraghi, A. A., et al. Pattern of hearing loss in a rat model of cochlear implantation trauma. Otol Neurotol. 26 (3), discussion 447 442-447 (2005).
- Mistry, N., Nolan, L. S., Saeed, S. R., Forge, A., Taylor, R. R. Cochlear implantation in the mouse via the round window: effects of array insertion. Hear Res. 312, 81-90 (2014).
- Wysocki, J. Topographical anatomy of the guinea pig temporal bone. Hear Res. 199 (1-2), 103-110 (2005).
- Heffner, H. E., Heffner, R. S. Hearing ranges of laboratory animals. J Am Assoc Lab Anim Sci. 46 (1), 20-22 (2007).
- Van Beek-King, J. M., Bhatti, P. T., Blake, D., Crawford, J., McKinnon, B. J. Silicone-coated thin film array cochlear implantation in a feline model. Otol Neurotol. 35 (1), 45-49 (2014).
- Marx, M., et al. Cochlear implantation feasibility in rhesus macaque monkey: anatomic and radiologic results. Otol Neurotol. 34 (7), 76-81 (2013).
- Honeder, C., et al. Effects of sustained release dexamethasone hydrogels in hearing preservation cochlear implantation. Hear Res. , (2016).
- Ris, L., Capron, B., de Waele, C., Vidal, P. P., Godaux, E. Dissociations between behavioural recovery and restoration of vestibular activity in the unilabyrinthectomized guinea-pig. J Physiol. 500, (Pt 2) 509-522 (1997).
- Jin, Z., Mannstrom, P., Skjonsberg, A., Jarlebark, L., Ulfendahl, M. Auditory function and cochlear morphology in the German waltzing guinea pig. Hear Res. 219 (1-2), 74-84 (2006).
- Honeder, C., et al. Effects of intraoperatively applied glucocorticoid hydrogels on residual hearing and foreign body reaction in a guinea pig model of cochlear implantation. Acta Otolaryngol. 135 (4), 313-319 (2015).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Eshraghi, A. A., et al. Clinical, surgical, and electrical factors impacting residual hearing in cochlear implant surgery. Acta Otolaryngol. 137 (4), 384-388 (2017).
- Reiss, L. A., et al. Morphological correlates of hearing loss after cochlear implantation and electro-acoustic stimulation in a hearing-impaired Guinea pig model. Hear Res. 327, 163-174 (2015).
- Chang, M. Y., et al. The Effect of Systemic Steroid on Hearing Preservation After Cochlear Implantation via Round Window Approach: A Guinea Pig Model. Otol Neurotol. 38 (7), 962-969 (2017).
- Eshraghi, A. A., Yang, N. W., Balkany, T. J. Comparative study of cochlear damage with three perimodiolar electrode designs. Laryngoscope. 113 (3), 415-419 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon