需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
化学共轭法在戊型肝炎病毒纳米粒子表面功能化中的应用
摘要
我们已将戊型肝炎病毒的衣壳蛋白作为 theranostic 纳米微粒 (HEVNP) 进行了设计。HEVNP 自组装成一个稳定的 icosahedral 笼在黏膜分娩。在这里, 我们描述了 HEVNPs 的改变的肿瘤靶向性的变异表面暴露残留到半胱氨酸, 共轭合成配体, 具体绑定肿瘤细胞。
摘要
病毒样粒子 (VLPs) 被用作 nanocarriers, 用于显示异物抗原和/或在各种疾病的检测和治疗中提供小分子。该应用依赖于基因修饰、自组装和半胱氨酸共轭来实现重组 VLPs 的肿瘤靶向应用. 与单基因修饰相比, 国外多肽对 VLPs 的化学共轭提供了一种很大的优势, 因为它允许多种实体, 如合成肽或寡糖, 以调制和灵活的方式共轭到 VLPs 表面, 而不改变 vip 组装。
在这里, 我们演示如何使用 E 型肝炎病毒纳米粒子 (HEVNP), 一个模块化的 theranostic 胶囊, 作为一个多功能运送载体。HEVNPs 的功能包括组织靶向、影像学和治疗性分娩。在 HEVNP 的结构研究基础上, 选取了结构上独立的和表面暴露的残留物作为 maleimide 连接化学基团的共轭点, 通过硫醇选择性的联系来选择半胱氨酸置换。一种特殊的半胱氨酸修饰 HEVNP (胱氨酸取代天门冬在 573 aa (HEVNP-573C)) 被共轭到乳腺癌细胞特异配体, LXY30 和标记为近红外线 (近红外) 荧光染料 (Cy5.5), 呈现肿瘤靶向HEVNPs 作为有效的诊断胶囊 (LXY30-HEVNP Cy5.5)。类似的工程策略可以与其他大分子复合物与众所周知的原子结构, 以探索潜在的应用 theranostic 交付。
引言
在治疗和诊断分娩中纳米载体的发展, 被称为 nanotheranostics, 已经把大部分生物医学领域从广义治疗转移到目标传递1。靶向 nanotheranostic 交付将纳米载体 (纳米粒子) 与 theranostic 分子结合在一起, 稳定地直接 theranostic 分子到特定患病组织或生物化学途径2,3,4.纳米医学已经走到了目标交付的前列, 因为最佳尺寸的纳米粒子有能力稳定 theranostic 分子的循环, 有选择地靶向细胞表面分子呈现在患病的组织上。许多 nanotheranostic 平台仍然遭受被动细胞吸收, 前成熟退化, 毒性和与 theranostic 分子不充分的联系。VLPs 克服了目标交付中的许多障碍。它们被用作 nanocarriers 来显示外来的表位和/或提供小分子: 一种可以用来对抗许多疾病的方案1。该应用主要依赖于自组装的特性以及遗传修饰的方便性, 以满足给定 vip 的设计应用。与基因工程相比, 国外多肽对 vip 的化学共轭显示了一个重要的优势, 因为它允许多种实体, 如多肽或寡糖, 被共轭到 VLPs 的表面, 在调制和灵活的方式, 不改变贵宾大会。
HEVNPs, 来自重组的混合动力衣壳蛋白, 2nd开放阅读框架 (ORF2), 是非传染性的, 自组装衣壳能够细胞结合和进入。由于混合动力汽车进化为黏膜传输, 组装的衣壳蛋白是同样稳定的水解和酸性粘膜条件5。HEVNPs 形成一个空心, T = 1 icosahedral 衣壳, 由60个相同的单位组成,6,7 ORF2, 使其在储存和严酷的生理条件下高度稳定。由于缺乏任何病毒遗传元素, 通过昆虫细胞的杆状病毒表达系统实现了高效、高产的生产。由于其蛋白水解稳定性, 自组装 HEVNPs 提取和纯化的细胞上清, 大大减少必要的净化步骤。此外, HEVNPs 拥有一个表面暴露的凸出域 (P 域) 通过一个灵活的铰链连接到一个稳定的 icosahedral 基础。p 域在 icosahedral 基础上形成表面暴露的尖峰, 而柔性铰链使得在不损害基 icosahedral 结构的情况下可以显著地修改 P 域。与60个重复的单位, 单一站点特定的修改结果在60个对称站点的化学调制。最近, 我们提出了一个纳米平台使用 HEVNP, 可以化学共轭配体或小分子的 theranostic 应用。这是通过取代单一氨基酸与半胱氨酸的突出领域的混合动力-vip 作为一个反应地点与 maleimide 链接的肽或分子。基于以前对混合动力-vip 和研究良好的免疫表位8,9的结构分析, 以下五个 hev-vip 氨基酸以半胱氨酸取代为潜在候选者: Y485C、T489C、S533C、N573C 和 T586C (图 1)。通过透射电镜 (TEM) 观察 (图 2) 对昆虫细胞的表达和纯化后的 vip 形成进行了验证, 并在 maleimide 链接生物素后对暴露的半胱氨酸部位进行了分析。共轭 (图 2)。在五变种人中, HEVNP-573C 显示了 maleimide-生物素共轭 (图 2) 的最强信号, 并被用来作为乳腺癌细胞靶向4 (图 3) nanocarrier 的后续演示。
该协议描述了化学共轭方法, 通过表面半胱氨酸共轭将肿瘤靶向分子附着在 HEVNPs 上。我们详细的肿瘤靶向和检测分子结合的肿瘤传递与重组 HEVNPs 含有半胱氨酸在 N573 (HEVNP-573C)。我们专注于两步点击化学共轭过程, 以绑定乳腺癌肿瘤靶向肽, LXY3010到 HEVNPs 形成 LXY30-HEVNP (图 4)。随后, n-hydroxysuccimide (NHS)-Cy5.5 被共轭到单独的赖氨酸站点在 HEVNPs 建立 LXY30 HEVNP-Cy5.5 为荧光检测的在体外(图 5) 和在体内4.
研究方案
1. 昆虫细胞的 HEVNP 生产
注意: 所有以下步骤都应在单元格培养罩中执行。有关更详细的 HEVNP 生产过程11, 请参阅我们以前的出版物。
- 在昆虫细胞介质中培养 Sf9 细胞 (参见材料表), 以 50-75% 汇流在6井板上。
- 利用昆虫细胞转染试剂根据制造商的协议, 染 Bacmids 含有 HEVNP-573C ORF2 到 Sf99 细胞生产重组杆状病毒。根据细胞的生存能力, 在27摄氏度孵育转染细胞, 3-6 天。
- 在感染后 3-6 天收集上清液 (转染后的细胞因杆状病毒感染裂解) 为 P0 杆状病毒。
- 在25厘米2单层烧瓶中应用200µL P0 库存到 50-75% 汇合 Sf9 细胞之前, 移除培养基。每15分钟摇动烧瓶, 确保接种的全部覆盖。重复4次, 总共60分钟。
- 添加2毫升的昆虫细胞培养培养基到烧瓶, 并保持在27摄氏度 3-6 天, 取决于细胞的生存能力, 放大杆状病毒, 以更高的效价。
- 进行斑块化验以获得杆状病毒滴度阅读12。
- 培养悬浮的 Tn5 昆虫细胞 (材料表) 与100毫升昆虫细胞媒介在250毫升瓶并且在27°c 在150转到一个滴度 0.5 x 105 -1 x 106为接种。
- 添加杆状病毒在 5-10 到100毫升 Tn5 细胞在250毫升瓶中的多重感染 (语言)。接种后, 在27°c 以150转每分钟晃动 5-7 天。
- 一旦大多数细胞出现囊泡, 70-90% 的细胞在光学显微镜观察下死亡, 收集 Tn5 细胞并转移到33毫升 ultracentrifuge 管。将 ultracentrifuge 管放在摆动斗转子中, 平衡, 并将细胞碎片和重组杆状在 1万 x g 处旋转90分钟, 达到25摄氏度。
- 将含有释放 HEVNPs 的上清液保持在4摄氏度, 以进一步纯化。为进一步贮存杆状病毒上清, 添加蛋白酶抑制剂。
2. HEVNP 纯化
- 用氯化铯 (中海) 梯度分离 HEVNPs 颗粒和分离:
- 转移收集到的上清 (从步骤 1.10), 并添加 20% NP-40 到每个管, 使最终浓度 0.5% NP-40, 以溶解任何剩余的细胞膜。轻轻地混合吹打和孵化至少30分钟在25摄氏度。
- Ultracentrifuge HEVNPs 在 112400 x g 在摆动的桶式转子为2小时在4°c 从上清的 HEVNPs 颗粒下来。离心后丢弃上清, 在每管200µL 10 毫米的 MES 缓冲 pH 值 6.2 (O/N) 在4摄氏度的情况下, 轻轻地重新悬浮原油颗粒。运行 SDS 页 (步骤 3.1) 以确认 ORF2 在粗颗粒中存在 HEVNP, 作为 52 kDa 带。
- 在6.2 毫升 ultracentrifuge 管中混合1.96 克中海, 再悬浮的粗球团, 4 毫升0.01 米的 MES pH 5, 准备 38.5% (w/v) 中海梯度。平衡管和地方在摆动斗转子。Ultracentrifuge 在 14.7万 x g 16 小时在4摄氏度。
- 收集了中海梯度后的分数:
- 丢弃前500µL 分数, 这主要是轻量细胞膜碎片。收集500µL 分数, 从管的顶端开始, 并改变每个分数之间的提示。将每个分数放入编号/标记为1.5 毫升的管。
注: 由于中海中高浓度, HEVNP ORF2 的存在, 不能通过运行 SDS 页凝胶来检测。中海中的每一个分数可以被删除或稀释通过遵循中海清洁程序。另外, 中海梯度可由 10-40% 蔗糖梯度13取代, 以避免中海中残留。 - 把每一个分数转移到一个5毫升 ultracentrifuge 管和稀释中海中与4.5 毫升10毫米 MES, pH 值6.2。平衡管和地方在摆动斗转子。Ultracentrifuge 在 14.7万 x g 2 小时, 在4°c, 以球团下来的 HEVNPs。
- 放弃上清, 并轻轻地重新悬浮在100µL 10 毫米 MES pH 6.2 在每管 HEVNPs。覆盖管, 以避免蒸发和孵化4摄氏度的 O/N。
- 使用分光光度计记录 A280 读数和 A260/A280 nm 比值。确定 ORF2 的近似浓度为:
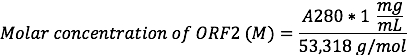
每个 ORF2 将包含1胱氨酸站点和1赖氨酸站点为化学共轭。
注: HEVNP ORF2 的摩尔消光系数为 60280, 相当于1.019 毫克/毫升 x A280。这是如此接近 1:1, HEVNPs 的浓度 (在镁/毫升) 可以接近的 A280, 因此, ORF2 的浓度由上述方程式。例如, A280 读数为1的 HEVNP 将有1毫克/毫升的浓度, 相当于18.8 µM ORF2。 - 准备一个 SDS 页面。使用每个分数的6µL 样本来确定含有 53.3 kDa HEVNP ORF2 蛋白的分数 (步骤 3.1)。HEVNPs 应该被发现在分数 3-5, 与密度为 ~ 1.25 克/毫升。
- 通过 TEM 观察, 确定 HEVNPs 的存在和纯度。准备或稀释 HEVNP 样品到 0.5-2.0 毫克/毫升的 TEM。HEVNPs 以透射电镜显示为空 icosahedral 蛋白, 直径约 27 nm (图 2)。一些蛋白质污染物可能留在分数, 并将在 TEM 下观察 (步骤 3.2)。
- 丢弃前500µL 分数, 这主要是轻量细胞膜碎片。收集500µL 分数, 从管的顶端开始, 并改变每个分数之间的提示。将每个分数放入编号/标记为1.5 毫升的管。
- 在透射电镜下存在杂质的情况下, 重复步骤 2.1.3 2.2.6, 以提高 HEVNPs 的纯度。
注: 通过中海梯度的额外净化可能导致 HEVNPs 的产量损失。另外, 中海梯度纯化可以用 10-40% 蔗糖梯度代替, 以避免中海中的残留13。
3. HEVNP 特征
- 准备 SDS 页4-12% 双三蛋白凝胶, 1.0 毫米, 17 井 (见材料表) 根据用户手册14:
- 添加2µL 4x 加载缓冲到6µL 蛋白质样品。将样品混合物在热块中孵育10分钟, 在100摄氏度变性蛋白质。将蛋白质样品装载到凝胶上。
- 通过将 DC 电源设置为10分钟, 然后 150 v 为45分钟, 运行 SDS 页面, 直到样品在凝胶底部的约1厘米处运行为止。
- 染色 SDS 页凝胶与考马斯蓝色 (0.25% (瓦特/v) 考马斯明亮的蓝色 R250, 30% (v/v) 甲醇, 10% (v/v) 乙酸), 1 h。
- 染色程序后, 去除考马斯蓝染色, 并应用去除染色缓冲器 (30% (v/v) 甲醇, 10% (v/v) 醋酸) 到蛋白质凝胶 > 12 小时室温。
- 在白光下记录下凝胶以确认在 52 kDa 带 HEVNP ORF2 的存在。
- 用 TEM 观察 HEVNPs。
- 将 HEVNP 样品准备或稀释为 0.5-2 毫克/毫升, 10 毫米 MES pH 6.2 用于 TEM 成像。
- 电离 40 mA 辉光放电的碳涂层网格在三十年代生产一个亲水性的碳表面。辉光放电设备在材料表中描述。
注: 在辉光放电处理后, 网格的亲水性碳表面只能持续30分钟。 - 按住镊子, 在网格中添加2µL 的 HEVNP 样品, 等待15三十年代, 并用滤纸涂抹。
- 立即用 ddH20 清洗网格, 然后用过滤纸涂抹。
- 立即在网格中加入2µL 2% 的醋酸铀, 等待十五年代, 然后用过滤纸涂抹。将样品栅格放在电子除湿干燥柜中, 使其干燥。
- 将网格转换成透射电镜和10-80k 放大图像。HEVNPs 出现在透射电镜作为空的 icosahedral 蛋白, 是27毫微米直径, 由于缺乏病毒 RNA。
4. HEVNPs 与生物素、肿瘤靶向配体、显影的化学共轭
- 执行一步共轭 HEVNPs 和 maleimide 链接生物素。
- 缓冲变化: 根据制造商的协议 (材料表), 将 HEVNPs 在迷你透析单元和透析中应用于室温下的0.01 米 PBS pH 值为1小时。将 HEVNPs 转移到1.5 毫升管, 用分光光度计测量 280 nm 的蛋白质浓度。
- 将 HEVNP 混合到1毫克/毫升, 相当于18.8 µM 的胱氨酸反应站点 (参见步骤2.2.4 中的详细信息), 在0.01 米 PBS, pH 为 7.4, 以相等的 maleimide-生物素 (100 µM), 使1:5 摩尔比;反应4摄氏度。根据制造商的协议 (材料表), 删除未绑定 maleimide-生物素与 40 K 截留分子量自旋脱盐塔工艺。
- 通过标准的减少 SDS 页面 (步骤 3.1) 分析样品。
- 使用标准程序, 用酶联的链亲和素制备一种化学发光印迹。通过 x 射线胶片捕获化学发光信号 (图 2)。
- 在混合动力核动力源上执行两步 LXY30 共轭到表面暴露的半胱氨酸 (图 5)。
- 缓冲交换: 应用 HEVNPs 在微型透析单位和透析对 0.01 M PBS pH 值7.4 在室温下为 1 h. 将 HEVNPs 转移到1.5 毫升管, 用分光光度计测定 280 nm 的蛋白质浓度。
- 添加650µM maleimide-叠氮化物和650µM alkyne-LXY3010在 0.01 M PBS pH 7.4 与200µM 丘索4和1毫米抗坏血酸形成 maleimide 链接的 LXY30 (Mal-LXY30) 在650µM. 孵育混合物在4°c 为 O/N。
- 混合 HEVNP 到1毫克/毫升, 相当于18.8 µM 的胱氨酸反应站点 (见细节在步骤 2.2.4), 约10% 卷 Mal-LXY30 (650 µM) 在0.01 米 PBS pH 7.4, 使一个1:3 摩尔比率;反应4摄氏度。
注: 由于 Mal-LXY30 浓度相对较高, 反应物的最终浓度 (如丘索4) 在混合后减少约10倍, 以避免其对 HEVNPs 的损害。另一个选项是无铜共轭方法15。 - 根据制造商的协议删除未绑定 maleimide-click-LXY30 与 40 K 截留分子量自旋脱盐塔 (请参阅材料表)。保持 LXY30-linked HEVNPs (LXY30-HEVNPs) 在4摄氏度。
- 执行一步共轭 LXY30-HEVNPs 和 Cy5.5 nhs 酯 (nhs-Cy5.5)
- 混合 LXY30-linked HEVNPs (LXY30-HEVNPs) 到1毫克/毫升, 这相当于胱氨酸反应站点的18.8 µM (参见步骤2.2.4 中的详细信息), 在0.01 米 PBS (100 Cy5.5) 的同等数量的 NHS-µM 的 pH 7.4, 使1:5 摩尔比率;反应4摄氏度。
- 根据制造商的协议, 删除未绑定 Cy5.5-NHS 与40K 截留分子量自旋脱盐塔程序 (请参阅材料表)。保持 LXY30, Cy5.5 链接 HEVNPs (LXY30 HEVNP Cy5.5) 在4摄氏度。
5. HEVNP 对 MDA-MB231 乳腺癌细胞的束缚和内化
- 种子 MDA-MB231 乳腺癌细胞成一个35毫米的玻璃底部菜肴 (5 x 104每碟) O/N 在哺乳动物细胞培养柜。
- 对于细胞结合实验, 请按照步骤 4.2-4.3 准备 LXY30-HEVNP Cy5.5。稀释 LXY30-HEVNP-Cy5.5 0.01 毫克/毫升, 相当于 HEVNP ORF2 的0.188 µM (指步骤 2.2.4), 250 µL 0-1% 的血清/DMEM。
- 在0.01 毫克/毫升 HEVNP Cy5.5 的情况下, 按步骤 4.3, 但与 NHS-Cy5.5 染料共轭, (HEV-Cy5.5), 准备阴性对照样品。稀释 HEVNP-Cy5.5 到0.01 毫克/毫升, 相当于 HEVNP ORF2 的0.188 µM (指步骤 2.2.4), 250 µL 10% 的血清补充 DMEM。
- 通过应用250µL 1 米 PBS 缓冲液, pH 值7.4 来清洗细胞。清洗后取出 PBS 缓冲器, 同时在细胞培养皿中保留一些缓冲液。
- 应用250µL 的 LXY30-HEVNP Cy5.5 在10% 的血清补充 DMEM 或 HEVNP Cy5.5 在10% 的血清补充 DMEM 的培养 MDA-MB231 乳腺癌细胞。用铝箔保护细胞培养皿。
- 将细胞培养皿保持在37摄氏度细胞培养柜内, 用于内部化1小时。
- 在冰上冲洗培养的细胞3次, 每洗5分钟, 250 µL 1 米 PBS, pH 7.4。
- 在1米 pbs 中固定4% 只粉煤灰中的细胞, ph 7.4 为20分钟, 然后用250µL 的1米 pbs, ph 7.4 清洗一次。
注意: 细胞现在已经准备好被共聚焦显微镜成像。代表性数据显示在图 5中。
结果
类似于 HEV-VLPs, 所有胱氨酸改性 HEVNPs 形成可溶性 icosahedral 衣壳, 并没有聚集在溶液中的生产或纯化。在单步 maleimide-生物素共轭之前和之后, 每个胱氨酸修改后的 HEVNPs 在负染色 EM (图 2) 中都与混合动力 VLPs 不区分。Maleimide-生物素共轭效率胱氨酸改性 HEVNPs 首次测试与西方印迹通过化学发光链亲和素结合。继 maleimide-生物素共轭后, 胱氨酸修饰 HEVNPs 显...
讨论
与耗时的基因工程程序, 这通常需要几个星期, 在这里我们演示简单的两步和一步化学共轭程序, 可以在3天内完成, 增加癌症靶向配体和/或荧光检测染料到胱氨酸/赖氨酸 HEVNPs 的部位。该技术可用于筛选候选池中的最佳配体目标, 从而在合理的成本和交付时间内利用可用的肽/小分子合成服务。
不同于传统的基因工程, 它只能将多肽插入到感兴趣的蛋白质中, 化学共轭可以将各种...
披露声明
作者声明他们没有竞争的兴趣。
致谢
提交人承认, 资助 RHC 由 NIH 赠款 # 的 AI095382, EB021230, CA198880, 国家粮食和农业研究所, 以及芬兰杰出的教授计划。
材料
| Name | Company | Catalog Number | Comments |
| MINI Dialysis Units, 10K MWCO | Thermo Fisher Scientific | 69572 | mini dialysis unit |
| High Five Cells | Thermo Fisher Scientific | B85502 | Tn5 cells |
| SF9 Cells | Thermo Fisher Scientific | 11496015 | Sf9 cells |
| Bac-to-Bac Baculovirus Expression System | Thermo Fisher Scientific | A11101, A11100 | Baculovirus expression system |
| Bac-to-Bac Baculovirus Expression System | Life Technologies | 10359-016, 10360-014, 10584-027, 10712-024 | Bacmid |
| ESF921 Insect Cell Media | Expression Systems LLC | 96-001-01 | insect cell media |
| Cy5.5 NHS ester, 5mg | Lumiprobe Corp | 27020 | Cy5.5 NHS ester |
| Zeba Spin Desalting Columns, 40K MWCO, 0.5 mL | Thermo Scientific | 87766 | spin desalting column |
| MES Hydrate | Sigma-Aldrich Chemical Co | M8250-250G | MES |
| Ultra-Clear Centrifuge Thinwall Ultra-Centrifuge Tubes | Beckman Coulter, Inc | Depends on Rotor | ultracentrifuge tube |
| NuPage 4-12% Bis-Tris Protein Gels | Thermo Fisher Scientific | NPO321BOX | SDS protein gel |
| Cellfectin II Reagent | Thermo Fisher Scientific | 10362100 | transfection reagent |
| EMS Glow Discharger | Electron Microscopy Science | glow discharger |
参考文献
- Ludwig, C., Wagner, R. Virus-like particles-universal molecular toolboxes. Curr Opin Biotechnol. 18 (6), 537-545 (2007).
- Galaway, F. A., Stockley, P. G. MS2 viruslike particles: a robust, semisynthetic targeted drug delivery platform. Mol Pharm. 10 (1), 59-68 (2013).
- Ma, Y., Nolte, R. J., Cornelissen, J. J. Virus-based nanocarriers for drug delivery. Adv Drug Deliv Rev. 64 (9), 811-825 (2012).
- Chen, C. C., et al. Chemically activatable viral capsid functionalized for cancer targeting. Nanomedicine (Lond). 11 (4), 377-390 (2016).
- Jariyapong, P., et al. Chimeric hepatitis E virus-like particle as a carrier for oral-delivery. Vaccine. 31 (2), 417-424 (2013).
- Xing, L., et al. Recombinant hepatitis E capsid protein self-assembles into a dual-domain T = 1 particle presenting native virus epitopes. Virology. 265 (1), 35-45 (1999).
- Li, T. C., et al. Essential elements of the capsid protein for self-assembly into empty virus-like particles of hepatitis E virus. J Virol. 79 (20), 12999-13006 (2005).
- Xing, L., et al. Structure of hepatitis E virion-sized particle reveals an RNA-dependent viral assembly pathway. J Biol Chem. 285 (43), 33175-33183 (2010).
- Xing, L., et al. Spatial configuration of hepatitis E virus antigenic domain. J Virol. 85 (2), 1117-1124 (2011).
- Xiao, W., et al. Discovery and characterization of a high-affinity and high-specificity peptide ligand LXY30 for in vivo targeting of α3 integrin-expressing human tumors. EJNMMI research. 6 (1), (2016).
- Li, T. C., et al. Expression and self-assembly of empty virus-like particles of hepatitis E virus. J Virol. 71 (10), 7207-7213 (1997).
- Peyret, H. A protocol for the gentle purification of virus-like particles produced in plants. J Virol Methods. 225, 59-63 (2015).
- Technologies, N. b. L. . Vol. MAN0007891 1-2. , (2013).
- Baskin, J. M., et al. Copper-free click chemistry for dynamic in vivo imaging. Proc Natl Acad Sci U S A. 104 (43), 16793-16797 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。