需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
电容式传感器监测林木茎含水量的标定及应用
摘要
生物量的水力容量是植被水资源预算的重要组成部分, 是抵御短期和长期干旱胁迫的缓冲。在这里, 我们提出了一个校准和使用土壤湿度电容传感器的协议来监测大树茎中的含水量。
摘要
通过土壤-植物-大气连续体的水运输和贮存是陆地水循环的关键, 已成为主要的研究重点领域。生物量电容在避免水力损伤蒸腾过程中起着不可或缺的作用。然而, 大型树的水力电容动态变化的高时间分辨率测量是罕见的。在这里, 我们提出了校准和使用电容传感器的程序, 通常用于监测土壤含水量, 以测量田间树木的体积含水量。频域反射式观测对所研究介质的密度敏感。因此, 有必要进行 species-specific 校准, 从传感器报告的介电介电常数值转换为体积水含量。校准是对收获的分支或干切到干燥或 "的部分进行的, 以产生完整的水含量, 用于生成与传感器观测结果的最佳回归。传感器入到校准段或安装在树后前孔的公差适合使用预制模板 , 以确保正确的钻头对准。特别注意确保传感器的齿尖与周围的介质保持良好的接触, 同时使其不受外力的插入。通过所提出的方法观察的体积水含量动态与使用热耗散技术和环境强迫数据记录的 sap 流量测量相一致。生物质水含量数据可用于观察水分胁迫、干旱响应和恢复的发生, 并有可能应用于新的植物水平流体力学模型的标定和评价, 以及对遥感水分产品的地下成分。
引言
植物材料中储存的水分对植物处理短期和长期水分胁迫的能力起着不可或缺的作用1,2。植物在细胞内和胞外 (例如,木质部容器) 中储存水分, 其中包括2、3、4。这水被显示贡献在10和50% 之间昼夜发生了水2,5,6,7,8。因此, 植物的水力电容是陆地水量平衡的关键组成部分, 可以作为水分胁迫、干旱响应和恢复的指标1, 是纠正观测时间滞后所必需的关键因素。蒸腾和 sap 流9,10,11。植被水分实时监测也可用于农业应用, 以帮助限制果园和作物灌溉, 以提高浇水效率12,13。然而, 测量的连续,原位茎-水含量的木本物种7,14,15,16,17,18, 19相对于 sap 流量测量20是罕见的。在这里, 我们概述了校准电容传感器的程序, 以监测在树的茎内的体积水含量5,21。
水动力行为和用水调控由植被是土壤-植物-大气连续统一体的一个缺一不可的组分22,23 , 因此是重要的控制之间的水分和碳通量生物圈和大气24,25。茎含水量的动态变化受生物和非生化因素的影响。干贮水的损耗和补给受环境条件的短期和长期趋势的影响, 特别是蒸气压亏缺和土壤含水量1,26。木材的物理性质27 (如、密度、容器结构) 和紧急水力策略25 (如、iso 或 anisohydric 气孔调节) 决定了植物贮存和使用水的能力19,26,28, 并可通过种类广泛变化29,30。以往的研究显示了不同的电容在热带的作用16,27,31,32,33和温带5,7 ,21物种, 并在两个被子植物1,2,34和裸子植物6,11,17,19。
提高对生物量水含量的认识, 将有助于了解植被的水资源获取策略, 并使用1,2, 以及物种对降水制度的预测变化的脆弱性35 ,36。进一步了解植物水的使用策略将有助于预测未来气候情况下的人口变化模式37,38。通过模型数据融合技术39, 使用此方法获得的茎含水量数据可用于通知和测试可伸缩的植物级流体力学模型40,41, 42,43,44 , 以改善气孔电导率的计算, 从而模拟蒸腾和光合碳的摄取。这些先进的流体力学模型可以提供一个显著的减少不确定性和误差时, 纳入较大的地面和地球系统模型25,45,46, 47,48。
用于监测或计算干水含量的方法包括树取心33,49, 电子 dendrometers2,15,50, 电阻51, 伽玛辐射衰减52, 氘示踪器19, sap 流量传感器32,33,53, 阀杆 psychrometers49,振幅11和时间4,12,13域反射 (TDR)。最近的努力已经测试了传统上用于测量土壤容积水含量的电容传感器的可行性5,18,21,27。频域反射 (FRD) 式电容传感器是低成本的, 使用相对较少的能量进行连续测量, 使它们成为在现场场景中进行高分辨率测量的有吸引力的工具。罗斯福在 tdr 式传感器上的自动化方便了连续的 sun 每小时数据集的收集, 并消除了需要大量电缆长度13的 tdr 测量所固有的许多挑战。使用原位电容传感器消除了重复取心或分枝收获的需要, 并可提高硬木品种的精确度。木本树种, 主要从细胞外空间, 如木质部血管, 或具有高木材或树皮弹性模量的弹性, 通常不是很好的候选的流行的 dendrometer 测量技术, 由于低弹性杆扩展2. 电容传感器估计介电介电常数, 可直接转换为体积含水量。但是, 电容测量对传感器周围介质的密度很敏感。因此, 我们主张 species-specific 校准, 将传感器的输出转换为体积木水含量5,21。
我们提出了一个 species-specific 校准的协议, 将电容传感器输出转换为木材的体积含水量。还提供了成熟树中电容传感器现场安装的说明, 并讨论了该方法的优点、缺点和假设。这些技术的目的是监测树干, 最大的树蓄水水库8的容积水含量, 但可以很容易地扩展到整个树与安装额外的传感器沿分支机构。动态植物含水量的测定将促进植被流体力学、生物、地表模拟等领域的发展。
研究方案
1. 选择用于检测的树
- 选择要测量的树。理想情况下, 选择健康的树木, 一般圆的茎横断面, 和直径之间的1-2 倍的长度, 或边材深度大于长度的传感器 (〜5厘米的具体电容传感器在这里演示)。用树芯测量边材的深度, 或对多种树种, 通过速方程计算边材深度, 将边材面积与茎直径29,54, 用标准直径胶带测量。
注意: 但是, 某些类型的电容传感器可以在不影响测量精度的情况下, 按照步骤1.2 的适当长度进行裁剪。只有带有刚性测量齿的电容传感器不包含布线, 才能进行裁剪或切割。对于已修剪的传感器, 需要单独校准。因此, 在校准过程之前, 选择树并确定适当的齿长。 - 根据树的直径和边材深度确定传感器齿叉的长度。
注: 电容传感器将湿度信息集成在传感器齿尖的长度上, l. 因此, 假定它们提供的集成观测是在直径介于l和2L 之间时的整个词干的代表。.树皮和韧皮部不会影响测量, 因为它们是在安装之前从测量区域中删除 (见4.2 节)。- 修剪在L大于阀杆直径的位置的传感器 (请参见步骤 1.3), 使其不穿透茎的另一侧。
- 将边材和心材的组合信号与传感器的直径大于 2l的树进行测量, 但边材深度小于l。
注: 由于这两种组织类型的含水量不同, 如果假定观察是整个茎的代表, 这可能会引起偏倚。在这种情况下, 或当用户只对边材水的波动感兴趣时, 传感器的齿尖必须修剪到边材深度, 这样观察才会代表边材 (活性木质部) 的含水量波动。当边材深度大于L时, 观测只表示边材, 但不需要修剪传感器。
- 如有必要 (如在步骤1.2.1 和1.2.2 中确定), 请剪切传感器以适合指定的应用程序。要切断传感器齿尖, 将传感器固定在工作台上, 并在穿戴适当的保护设备时, 使用装有钢切盘的动力旋转工具, 将每一个时间段精确地切割到相同的长度。
2. 收集和准备所有感兴趣物种的木材样本, 以产生特定物种的校准
- 收集树干, 幼茎, 或大枝至少6厘米直径从感兴趣的种类。更大的直径是首选, 以最大限度的木材包围的数量传感器和最接近的树干密度的现场测量。去除所有附属的树枝或叶子, 以及任何地衣或松散的材料。
注: 请参阅讨论部分, 以进一步讨论因分支和茎密度差异而产生的不确定性。 - 将茎段分成25或更多的圆柱形截面, 长度为15厘米。
- 标记每个段并记录每个线段的平均直径和长度。将线段的体积近似为圆柱体的体积。
- 将该段分成两组, 用于不同的补液和干燥。将大约1/3 的段放在水浴中水化, 而其他2/3 的段在干燥的烤箱中在60° c 处脱水。将两段分开, 以便立即测量: 最好是从茎的长度中间, 一个从一端。
注: 通常情况下, 干燥60° c 后将完全干涸2周后, 完全水化后〜3天。从烤箱/水浴中取出各个部分, 测量每日或两次间隔 (参见步骤 3.7)。为了产生跨越最大范围的可能的体积水含量的测量梯度。
3. 在传感器输出与容积含水量之间建立校准关系
- 按照制造商提供的说明, 将电容传感器连接到数据记录设备, 并将计算机用于 real-time 传感器读数可视化。设置数据收集到三十年代的时间间隔。
- 使用预制钻孔模板固定到位, 保持对准, 钻头比电容传感器的齿尖直径略小 (3.57 mm 用于本实验的传感器), 钻两个垂直套三孔第二套位于约150°左右的木段, 与垂直分离的几厘米, 以确保没有潜在的重叠之间的孔。在第一组测量中, 使用2.4 步中预留的木材段。
- 在测量时, 称量段并将重量记录到最接近的0.01 克。用塑料包盖两端的部分, 以防止额外的干燥。
- 在称重后, 立即用乙醇拭子清洗电容传感器的齿尖, 并将其完全插入阀杆段, 这样就不会有任何部分的钢齿尖可见。等待输出屏幕上的测量读数稳定 (通常为2或3分钟)。记录温度、电导率和介电常数 (εb) 的传感器输出, 每年三十年代为5分钟, 并计算10测量的平均值。
- 轻轻地将传感器从段中取出, 用酒精拭子清洗尖齿, 然后等待输出读数返回零。在第二组预孔中, 重复步骤3.3 向前的测量过程。
- 从两端取出塑料, 将茎段放在烘箱中。允许它完全枯萎 (一般2周, 或直到重量稳定了几天)。
- 对所有段重复步骤3.3 到3.7。从干燥烘箱中取出部分, 并在干燥前几天内更频繁地测量 (每天两次), 这是由于初始水分流失率高于过去几天 (每日)。在称量和测量之前, 用纸巾从水浴中去除的部分表面的干燥多余的水。
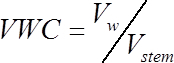 (1)
(1)其中Vw 是水的体积 (cm3), v词干是在步骤1.2 中计算的词干段 (cm3) 的音量。
- 计算测量时每段水的体积, 如:
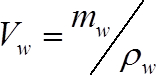 (2)
(2)
其中mw 是在测量时的阀杆段 (g) 中的质量水, 而ρw 是水的密度 (1 克 cm-3) - 计算测量时每段水的质量为:
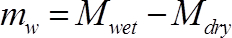 (3)
(3)
其中, M湿是测量时词干段的质量 (g), 而m干是该段 (g) 的最终权重。
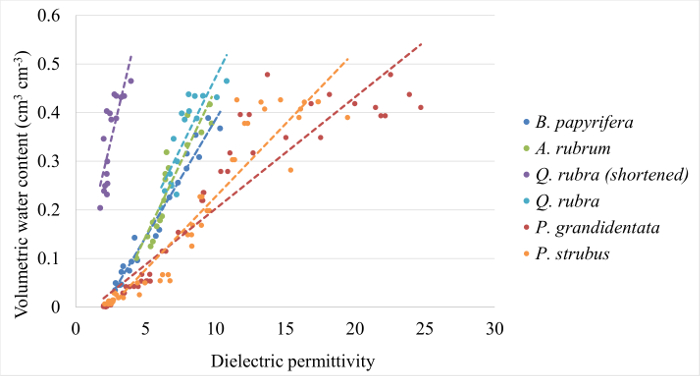
图 1: 示例校准曲线.为栓皮栎、宏虫、桦树、杨 grandidentata和松松生成的校准曲线, 在本协议的1和2部分之后。在表 1中提供了每个公式和确定系数。请单击此处查看此图的较大版本.
| m | b | R2 | |
| B. paprifera | 0.048 | -0.098 | 0.967 |
| 虫 | 0.067 | -0.158 | 0.853 |
| Q. 杨梅(缩短) | 0.120 | 0.041 | 0.636 |
| Q. 杨梅 | 0.058 | -0.109 | 0.718 |
| P. grandidentata | 0.023 | -0.028 | 0.887 |
| P. 松 | 0.030 | -0.072 | 0.900 |
表 1: 用于转换的校准公式εbto VWC用于五种温带树种.系数 "和" b "是在标准形式的线性等式中提出的: VWC = m * εb+ b。
4. 在树上安装电容传感器进行现场测量
- 在传感器安装之前, 记录每个传感器位置的阀杆直径和地面高度。通常, 要监视主干中的VWC , 请在地面上方放置一个传感器 ~ 0.5 米, 然后在第一个主要分支拆分 (7.5 米以上位于地面上,图 2) 下放置第二个探测器。
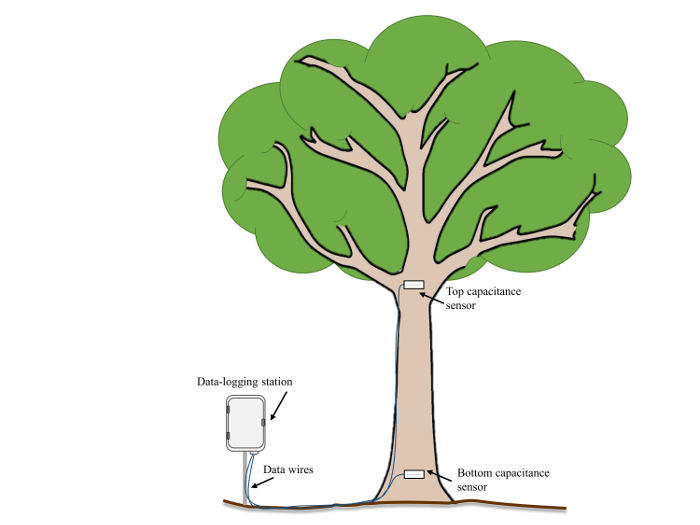
图 2: 示例字段实验设置.在与数据记录站相邻的成熟树中的传感器位置和方向示意图。请单击此处查看此图的较大版本.
- 将树皮移至形成层, 并创建一个平坦的表面, 传感器将使用绘图刀片安装。确保此表面宽且平整, 使传感器在安装时与树的表面齐平, 这样就不会露出尖叉的任何部分。除去树皮和形成层, 以确保测量只包括木质部的含水量, 同时排除树皮或韧皮部中的含水量。
- 钻尖孔。使用钻头的直径稍微小一些, 较软的木材, 而使用更接近的真正大小的尖叉硬木材 (3.57 毫米, 在本议定书中使用)。对于高质量的测量, 确保传感器的齿尖与木材有良好的接触。由于不需要定期移除传感器, 就像校准过程中的情况一样, 此处使用的钻头略小一点, 可用于校准。
- 用酒精拭子擦拭传感器的齿尖, 去除污垢或皮肤油, 并将传感器插入预孔。如果传感器在插入时遇到太多阻力, 请轻轻地将其向后重新, 并将其稍稍放大。确保所有三齿都被完全插入, 传感器的主体与树干齐平。
- 用硅基密封胶将传感器密封在树干上, 以防止茎流进入洞中, 避免害虫侵扰。
- 用反射绝缘盖住传感器, 避免外部加热。
- 按照制造商的要求, 将所有传感器连接到 12 V 电源和兼容的数据记录器。对部署在该字段中的传感器使用5分钟的数据收集间隔, 但使用更长的间隔来节省电源限制的站点中的电源,例如, 太阳能/电池操作的站点。
5. 使用校准曲线处理原始数据到干水贮存
- 使用在步骤2.9 中生成的校准曲线的公式, 将传感器输出转换为VWC以进行所有观测。VWC通常表示为 cm3 /cm3或百分比。因此, VWC的百分比将介于0和100% 之间。
- 通过假定阀杆直径随高度线性变化, 将两个测量高度 (例如, 图 2: 0.5 m 和 7.5 m) 中的总感兴趣量 (cm3) 集成在一起。
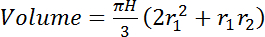 (4)
(4)其中, H是传感器之间的高度差 (垂直距离) (例如在图 2: 700 cm) 和r1 和r2 是底部和顶部传感器位置处的阀杆 (cm) 的半径,分别.
对于那些传感器仅提供边材含水量估计的树 (见传感器长度测定, 1.2 节) 使用 eq. 5:
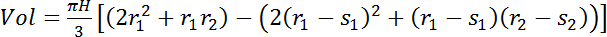 (5)
(5)其中, s1 和s2 分别是底部和顶部传感器位置的边材深度 (cm)。
结果
在本节中, 我们将介绍五种常见的东部森林树种的校准数据, 然后详细分析三宏虫个体在2016生长期的田间测量。为宏虫, 桦树, 松, 杨树 grandidentata,和栎林 (图 1) 生成了校准曲线。曲线的斜率与P. grandidentata和虫(表 1) 的差异高达 97.7%, 这表明需要执行 species-specific 校准以获得精确的VWC测量。在地面上?...
讨论
通过电容传感器观测到的茎水含量的季节性和日变化趋势与并行 sap 流量和环境强制测量 (图 3, 图 4, 图 5) 的走势一致。当蒸腾速度超过通过木本组织的补给速率时, 当土壤水分限制了根水的可用性时, 昼夜水库的茎贮储层就枯竭了5。这内部电容提供了一个有价值的缓冲液的水力限制气孔...
披露声明
史蒂芬 r 加里蒂是一个米组 Inc. 的雇员, 生产 GS3 加固土壤水分传感器在本文中使用。
致谢
这项研究的经费由美国能源部科学办公室、生物和环境研究办公室、陆地生态系统科学方案奖 No. 提供。DE-SC0007041, Ameriflux 管理计划在通量核心站点协议 No. 7096915 通过劳伦斯伯克利国家实验室和国家科学基础水文科学授予1521238。在这一材料中提出的任何意见、发现、结论或建议都是作者的观点, 不一定反映供资机构的意见。
材料
| Name | Company | Catalog Number | Comments |
| Ruggedized Soil Moisture Sensor | METER Group Inc. | GS-3 | Capacitance sensors |
| 1/8" drill bit | Any | N/A | |
| 9/64" drill bit | Any | N/A | |
| Drying oven | Any | N/A | |
| Chainsaw | Any | N/A | |
| Electric drill | Any | N/A | |
| Bucket for water bath | Any | N/A | |
| Alcohol swabs | Any | N/A | |
| Draw knife | Any | N/A | |
| Data logger | Any | N/A | |
| Silicon sealant | Any | N/A |
参考文献
- Matheny, A. M., et al. Contrasting strategies of hydraulic control in two codominant temperate tree species. Ecohydrol. 10 (3), e1815 (2017).
- Kocher, P., Horna, V., Leuschner, C. Stem water storage in five coexisting temperate broad-leaved tree species: significance, temporal dynamics and dependence on tree functional traits. Tree Physiol. 33 (8), 817-832 (2013).
- Holbrook, N. M., Gartner, B. L. Chapter 7. Plant stems: physiology and functional morphology. , 151-174 (1995).
- Wullschleger, S. D., Hanson, P. J., Todd, D. E. Measuring stem water content in four deciduous hardwoods with a time-domain reflectometer. Tree Physiol. 16 (10), 809-815 (1996).
- Matheny, A. M., et al. Observations of stem water storage in trees of opposing hydraulic strategies. Ecosphere. 6 (9), 165 (2015).
- Waring, R. H., Running, S. W. Sapwood water storage: its contribution to transpiration and effect upon water conductance through the stems of old-growth Douglas-fir. Plant Cell Environ. 1 (2), 131-140 (1978).
- Cermak, J., Kucera, J., Bauerle, W. L., Phillips, N., Hinckley, T. M. Tree water storage and its diurnal dynamics related to sap flow and changes in stem volume in old-growth Douglas-fir trees. Tree Physiol. 27 (2), 181-198 (2007).
- Betsch, P., et al. Drought effects on water relations in beech: The contribution of exchangeable water reservoirs. Agric. For. Meteorol. 151 (5), 531-543 (2011).
- Schäfer, K. V. R., Oren, R., Tenhunen, J. D. The effect of tree height on crown level stomatal conductance. Plant Cell Environ. 23 (4), 365-375 (2000).
- Burgess, S. S. O., Dawson, T. E. Using branch and basal trunk sap flow measurements to estimate whole-plant water capacitance: a caution. Plant Soil. 305 (1-2), 5-13 (2008).
- Kumagai, T., Aoki, S., Otsuki, K., Utsumi, Y. Impact of stem water storage on diurnal estimates of whole-tree transpiration and canopy conductance from sap flow measurements in Japanese cedar and Japanese cypress trees. Hydrol. Process. 23 (16), 2335-2344 (2009).
- Nadler, A., Raveh, E., Yermiyahu, U., Green, S. Stress induced water content variations in mango stem by time domain reflectometry. Soil Sci. Soc. Am. J. 70 (2), 510-520 (2006).
- Nadler, A., Raveh, E., Yermiyahu, U., Green, S. R. Evaluation of TDR use to monitor water content in stem of lemon trees and soil and their response to water stress. Soil Sci. Soc. Am. J. 67 (2), 437-448 (2003).
- Hernandez-Santana, V., Martinez-Fernandez, J. TDR measurement of stem and soil water content in two Mediterranean oak species. Hydrolog Sci J. 53 (4), 921-931 (2008).
- Cocozza, C., et al. Simultaneous measurements of stem radius variation and sap flux density reveal synchronisation of water storage and transpiration dynamics in olive trees. Ecohydrol. 8 (1), 33-45 (2015).
- Andrade, J. L., et al. Regulation of water flux through trunks, branches, and leaves in trees of a lowland tropical forest. Oecologia. 115 (4), 463-471 (1998).
- Domec, J. C., Gartner, B. L. Cavitation and water storage capacity in bole xylem segments of mature and young Douglas-fir trees. Trees-Struct. Funct. 15 (4), 204-214 (2001).
- Holbrook, N. M., Burns, M. J., Sinclair, T. R. Frequency and time-domain dielectric measurements of stem water-content in the arborescent palm, Sabal palmetto. J. Exp. Bot. 43 (246), 111-119 (1992).
- Meinzer, F. C., et al. Dynamics of water transport and storage in conifers studied with deuterium and heat tracing techniques. Plant Cell Environ. 29 (1), 105-114 (2006).
- Poyatos, R., et al. SAPFLUXNET: towards a global database of sap flow measurements. Tree Physiol. 36 (12), 1449-1455 (2016).
- Hao, G. Y., Wheeler, J. K., Holbrook, N. M., Goldstein, G. Investigating xylem embolism formation, refilling and water storage in tree trunks using frequency domain reflectometry. J. Exp. Bot. 64 (8), 2321-2332 (2013).
- Bonan, G. B., Williams, M., Fisher, R. A., Oleson, K. W. Modeling stomatal conductance in the earth system: linking leaf water-use efficiency and water transport along the soil-plant-atmosphere continuum. Geosci. Model Dev. 7 (5), 2193-2222 (2014).
- Brantley, S. L., et al. Reviews and syntheses: on the roles trees play in building and plumbing the critical zone. Biogeosciences Discuss. 2017, 1-41 (2017).
- Bonan, G. B. Forests and climate change: Forcings, feedbacks, and the climate benefits of forests. Science. 320 (5882), 1444-1449 (2008).
- Matheny, A. M., Mirfenderesgi, G., Bohrer, G. Trait-based representation of hydrological functional properties of plants in weather and ecosystem models. Plant Diversity. 39 (1), 1-12 (2017).
- Chapotin, S. M., Razanameharizaka, J. H., Holbrook, N. M. Water relations of baobab trees (Adansonia spp.L.) during the rainy season: does stem water buffer daily water deficits. Plant Cell Environ. 29 (6), 1021-1032 (2006).
- Oliva Carrasco, L., et al. Water storage dynamics in the main stem of subtropical tree species differing in wood density, growth rate and life history traits. Tree Physiol. 35 (4), 354-365 (2015).
- Wullschleger, S. D., Meinzer, F. C., Vertessy, R. A. A review of whole-plant water use studies in trees. Tree Physiol. 18 (8-9), 499-512 (1998).
- Matheny, A. M., et al. Species-specific transpiration responses to intermediate disturbance in a northern hardwood forest. J. Geophys. Res. 119 (12), 2292-2311 (2014).
- Ford, C. R., Hubbard, R. M., Vose, J. M. Quantifying structural and physiological controls on variation in canopy transpiration among planted pine and hardwood species in the southern Appalachians. Ecohydrol. 4 (2), 183-195 (2011).
- Holbrook, N. M., Sinclair, T. R. Water-Balance in the arborescent palm, Sabal palmetto. II. Transpiration and stem water storage. Plant Cell Environ. 15 (4), 401-409 (1992).
- Goldstein, G., et al. Stem water storage and diurnal patterns of water use in tropical forest canopy trees. Plant Cell Environ. 21 (4), 397-406 (1998).
- Borchert, R. Soil and stem water storage determine phenology and distribution of tropical dry forest trees. Ecology. 75 (5), 1437-1449 (1994).
- Hernandez-Santana, V., Martinez-Fernandez, J., Moran, C. Estimation of tree water stress from stem and soil water monitoring with time-domain reflectometry in two small forested basins in Spain. Hydrol. Process. 22 (14), 2493-2501 (2008).
- . . Climate change 2013: the physical science basis contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change. , 1535 (2013).
- Konings, A. G., Williams, A. P., Gentine, P. Sensitivity of grassland productivity to aridity controlled by stomatal and xylem regulation. Nat. Geosci. , (2017).
- Fei, S., et al. Divergence of species responses to climate change. Science Advances. 3 (5), (2017).
- Fisher, R. A., et al. Vegetation demographics in Earthsystem models: a review of progress and priorities. Glob. Change Biol. , (2017).
- Dietze, M. C., Lebauer, D. S., Kooper, R. O. B. On improving the communication between models and data. Plant Cell Environ. 36 (9), 1575-1585 (2013).
- Bohrer, G., et al. Finite element tree crown hydrodynamics model (FETCH) using porous media flow within branching elements: A new representation of tree hydrodynamics. Water Resour. Res. 41 (11), (2005).
- Mirfenderesgi, G., et al. Tree level hydrodynamic approach for resolving aboveground water storage and stomatal conductance and modeling the effects of tree hydraulic strategy. J. Geophys. Res. 121 (7), 1792-1813 (2016).
- Gentine, P., Guérin, M., Uriarte, M., McDowell, N. G., Pockman, W. T. An allometry-based model of the survival strategies of hydraulic failure and carbon starvation. Ecohydrol. 9 (3), 529-546 (2015).
- Huang, C. -. W., et al. The effect of plant water storage on water fluxes within the coupled soil-plant system. New Phytol. 213 (3), 1093-1106 (2017).
- Bittner, S., et al. Functional-structural water flow model reveals differences between diffuse- and ring-porous tree species. Agric. For. Meteorol. 158, 80-89 (2012).
- Matheny, A. M., et al. Characterizing the diurnal patterns of errors in the prediction of evapotranspiration by several land-surface models: an NACP analysis. J. Geophys. Res. 119 (7), 1458-1473 (2014).
- Matthes, J. H., Goring, S., Williams, J. W., Dietze, M. C. Benchmarking historical CMIP5 plant functional types across the Upper Midwest and Northeastern United States. J. Geophys. Res. 121 (2), 523-535 (2016).
- Musavi, T., et al. The imprint of plants on ecosystem functioning: A data-driven approach. Int. J. Appl. Earth Obs. Geoinf. 43, 119-131 (2015).
- Wullschleger, S. D., et al. Plant functional types in Earth system models: past experiences and future directions for application of dynamic vegetation models in high-latitude ecosystems. Ann. Bot. 114 (1), 1-16 (2014).
- Scholz, F. G., et al. Biophysical properties and functional significance of stem water storage tissues in Neotropical savanna trees. Plant Cell Environ. 30 (2), 236-248 (2007).
- Scholz, F. G., et al. Temporal dynamics of stem expansion and contraction in savanna trees: withdrawal and recharge of stored water. Tree Physiol. 28 (3), 469-480 (2008).
- Borchert, R. Electric resistance as a measure of tree water status during seasonal drought in a tropical dry forest in Costa Rica. Tree Physiol. 14 (3), 299-312 (1994).
- Edwards, W. R. N., Jarvis, P. G. A method for measuring radial differences in water content of intact tree stems by attenuation of gamma radiation. Plant Cell Environ. 6 (3), 255-260 (1983).
- Phillips, N. G., Scholz, F. G., Bucci, S. J., Goldstein, G., Meinzer, F. C. Using branch and basal trunk sap flow measurements to estimate whole-plant water capacitance: comment on Burgess and Dawson (2008). Plant Soil. 315 (1-2), 315-324 (2009).
- Bovard, B. D., Curtis, P. S., Vogel, C. S., Su, H. -. B., Schmid, H. P. Environmental controls on sap flow in a northern hardwood forest. Tree Physiol. 25, 31-38 (2005).
- Granier, A. Evaluation of transiration in a Douglas-Fir stand by means of sap flow measurements. Tree Physiol. 3 (4), 309-319 (1987).
- Brodribb, T. J., Holbrook, N. M. Stomatal closure during leaf dehydration, correlation with other leaf physiological traits. Plant Physiol. 132 (4), 2166-2173 (2003).
- Brodribb, T. J., Holbrook, N. M. Stomatal protection against hydraulic failure: a comparison of coexisting ferns and angiosperms. New Phytol. 162 (3), 663-670 (2004).
- Taneda, H., Sperry, J. S. A case-study of water transport in co-occurring ring- versus diffuse-porous trees: contrasts in water-status, conducting capacity, cavitation and vessel refilling. Tree Physiol. 28 (11), 1641-1651 (2008).
- Schuldt, B., Leuschner, C., Brock, N., Horna, V. Changes in wood density, wood anatomy and hydraulic properties of the xylem along the root-to-shoot flow path in tropical rainforest trees. Tree Physiol. 33 (2), 161-174 (2013).
- Sarmiento, C., et al. Within-individual variation of trunk and branch xylem density in tropical trees. Am. J. Bot. 98 (1), 140-149 (2011).
- Barij, N., Cermak, J., Stokes, A. Azimuthal variations in xylem structure and water relations in cork oak (Quercus suber). Iawa J. 32 (1), 25-40 (2011).
- Domec, J. C., Pruyn, M. L., Gartner, B. L. Axial and radial profiles in conductivities, water storage and native embolism in trunks of young and old-growth ponderosa pine trees. Plant Cell Environ. 28 (9), 1103-1113 (2005).
- Ewers, B. E., Oren, R. Analyses of assumptions and errors in the calculation of stomatal conductance from sap flux measurements. Tree Physiol. 20 (9), 579-589 (2000).
- Fan, Z. X., Cao, K. F., Becker, P. Axial and radial variations in xylem anatomy of angiosperm and conifer trees in Yunnan, China. Iawa J. 30 (1), 1-13 (2009).
- James, S. A., Clearwater, M. J., Meinzer, F. C., Goldstein, G. Heat dissipation sensors of variable length for the measurement of sap flow in trees with deep sapwood. Tree Physiol. 22 (4), 277-283 (2002).
- James, S. A., et al. Axial and radial water transport and internal water storage in tropical forest canopy trees. Oecologia. 134 (1), 37-45 (2003).
- Fromm, J. H., et al. Xylem water content and wood density in spruce and oak trees detected by high-resolution computed tomography. Plant Physiol. 127 (2), 416-425 (2001).
- Steppe, K., De Pauw, D. J. W., Doody, T. M., Teskey, R. O. A comparison of sap flux density using thermal dissipation, heat pulse velocity and heat field deformation methods. Agric. For. Meteorol. 150 (7-8), 1046-1056 (2010).
- Vergeynst, L. L., Vandegehuchte, M. W., McGuire, M. A., Teskey, R. O., Steppe, K. Changes in stem water content influence sap flux density measurements with thermal dissipation probes. Trees. 28 (3), 949-955 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。