Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L’étalonnage et l’utilisation de Capacitance capteurs pour surveiller la teneur en eau tige dans les arbres
Dans cet article
Résumé
La capacité hydraulique de la biomasse est une composante clé du bilan hydrique de la végétation, qui sert à amortir les contraintes à court et à long terme de la sécheresse. Nous présentons ici un protocole pour l’étalonnage et l’utilisation de l’humidité du sol capteurs capacitance pour surveiller la teneur en eau dans les tiges des grands arbres.
Résumé
Transport de l’eau et de stockage dans le continuum sol-plante-atmosphère est cruciale pour le cycle de l’eau terrestre et est devenu une zone de mise au point de grands travaux de recherche. Capacité de la biomasse joue un rôle essentiel dans la prévention des déficiences hydrauliques à la transpiration. Toutefois, les mesures de haute résolution temporelle des variations dynamiques de la capacité hydraulique des grands arbres sont rares. Nous présentons ici les procédures d’étalonnage et d’utiliser des capteurs de capacitance, généralement utilisée pour contrôler la teneur en eau du sol, afin de mesurer la teneur en eau volumétrique dans les arbres sur le terrain. Fréquence domain reflectometry style observations sont sensibles à la densité des médias à l’étude. Par conséquent, il est nécessaire effectuer l’étalonnage spécifique à l’espèce pour convertir les valeurs déclarées capteur de permittivité diélectrique en teneur en eau volumétrique. Calibrage est effectué sur une branche récolté ou les souches coupées en segments qui sont séchés ou réhydratées pour produire une gamme complète de teneurs en eau utilisé pour générer une régression ajustée avec les observations de la sonde. Capteurs insérés dans les segments de calibration ou installées dans les arbres après pré-perçage des trous à une tolérance ajusté en utilisant un modèle fabriqué pour assurer un alignement correct perceuse. Une attention particulière est veiller à ce que dents de capteur établir un bon contact avec les médias environnants, tout en leur permettant d’être inséré sans force excessive. L’eau volumétrique contenue dynamique observée par la méthodologie présentée aligner avec sap les mesures de débit enregistrés à l’aide de techniques de dissipation thermique et des données environnementales de forçages. Données de contenu de l’eau la biomasse peuvent être utilisées pour observer l’apparition de stress hydrique, de la sécheresse intervention et de rétablissement, et a le potentiel pour être appliquée à l’étalonnage et l’évaluation de nouveaux modèles de niveau hydrodynamique, ainsi qu’à la partition à distance senti produits de l’humidité en composants aériens et souterrains.
Introduction
L’eau stockée dans le matériel végétal joue un rôle essentiel dans la capacité des plantes à faire face à court et à long terme l’eau stress1,2. Plantes stockent l’eau dans les racines, tiges, et les feuilles à la fois intracellulaire et extracellulaire (p. ex., les vaisseaux du xylème) espaces 2,3,4. Cette eau a démontré de contribuer entre 10 et 50 % de l’eau pendant le jour était2,5,6,7,8. Par conséquent, plante capacité hydraulique est un élément clé de l’équilibre de l’eau terrestre, peut être utilisée comme un indicateur de stress hydrique, la réponse de la sécheresse et récupération1et est un facteur critique nécessaire pour corriger les décalages observés entre transpiration et sap débit9,10,11. Surveillance en temps réel de la teneur en eau la végétation également utilisable dans des applications agricoles afin de contraindre le verger et d’irrigation des cultures afin d’augmenter l’arrosage efficacité12,13. Toutefois, les mesures de continu, tige-l’eau in situ des espèces ligneuses7,14,15,16,17,18, 19 sont rares par rapport aux flux de sève mesures20. Ici, nous décrivons une procédure pour l’étalonnage des capteurs de la capacité de contrôler la teneur en eau volumétrique dans les tiges d’arbres5,21.
Des comportements hydrodynamiques et règlement d’utilisation de l’eau de végétation sont une partie intégrante du continuum sol-plante-atmosphère22,23 et sont donc des contrôles importants pour le flux de l’eau et du carbone entre les la biosphère et l’atmosphère de24,25. La dynamique de la teneur en eau de tige est influencée par des facteurs biotiques et abiotiques. Appauvrissement de la couche et recharge d’eau stockée à la tige sont affectés par les tendances à court et à long terme dans des conditions environnementales, en particulier, le déficit de pression de vapeur et eau contenu1,26du sol. Les propriétés physiques des bois27 (p. ex., densité, structure de navire) et la stratégie hydraulique émergente25 (par exemple, iso - ou anisohydric règlement stomatique) déterminent la capacité de la plante pour stocker et utiliser de l’eau 19 , 26 , 28et peut varier considérablement par espèces29,30. Des études antérieures ont démontré les différents rôles de capacitance tropicale16,27,31,32,33 et tempérées5,7 ,21 espèces et les deux angiospermes1,2,34 et gymnospermes6,11,17,19.
Améliorer la connaissance de la teneur en eau de la biomasse améliorera la compréhension des stratégies de la végétation pour l’acquisition de l’eau et utiliser1,2, ainsi que la vulnérabilité des espèces aux changements prévus dans les régimes de précipitations35 ,,36. Comprendre davantage de consommation d’eau plante stratégies aidera à prévoir les changements démographiques sous climats futurs scénarios37,38. Par le biais de techniques de fusion de données du modèle39, teneur en eau tige données obtenues à l’aide de cette méthode peuvent être utilisées pour informer et tester évolutive, niveau hydrodynamique modèles40,41, 42,43,44 afin d’améliorer le calcul de la conductance stomatique et, partant, des simulations de transpiration et assimilation photosynthétique du carbone. Ces modèles hydrodynamiques avancés peuvent prévoir une réduction significative dans l’incertitude et l’erreur une fois incorporé plus grandes terres émergées et terre systèmes modèles25,45,46, 47,48.
Méthodes utilisées pour surveiller ou calculer la teneur en eau tige incluent arbre carottage33,49, dendromètres électronique2,15,50, résistance électrique 51, gamma rayonnement atténuation52, deutérium traceurs19réseaux de sève flux capteurs32,33,53, psychromètres49, la tige et amplitude11 et temps4,12,13 réflectométrie (TDR). Les efforts récents ont testé la viabilité des capteurs de capacité qui ont traditionnellement été utilisées pour mesurer le sol eau volumétrique contenu5,18,21,27. Réflectométrie de domaine de fréquence (FRD)-style capacitance capteurs sont de faible coût et utilisent des quantités relativement faibles de l’énergie pour les mesures en continu, ce qui les rend un outil attrayant pour les mesures haute résolution temporelle dans les scénarios de champ. La facilité d’automatisation des FDR sur capteurs TDR-style facilite la collecte des ensembles de données de sun-horaire continus et élimine un grand nombre des défis inhérents à la mesure de TDR nécessitant d’importantes longueurs de câble13. L’utilisation de capteurs de capacitance in situ élimine le besoin de carottage répétitif ou de la direction générale de la récolte et peut prévoir des meilleure précision des essences feuillues.Les espèces ligneuses qui retirent l’eau principalement des espaces extracellulaires, telles que les vaisseaux du xylème, ou ont des modules hauts de bois ou d’écorce d’élasticité, ne sont généralement pas de bons candidats pour les techniques de mesure de verniers populaire en raison de la faible tige élastique expansion 2. capteurs de capacitance estiment permittivité diélectrique, qui peut être directement convertie en teneur en eau volumétrique. Toutefois, les mesures de capacité sont sensibles à la densité des médias autour du capteur. C’est pourquoi, nous préconisons pour les étalonnages spécifiques à l’espèce qui convertissent la sortie des capteurs volumétriques bois-eau contenu5,21.
Nous présentons un protocole pour un étalonnage spécifique à l’espèce convertir la sortie capacité du capteur à teneur en eau volumétrique du bois. Instructions pour l’installation de capteurs de capacitance en arbres matures sur le terrain et une analyse des forces, des faiblesses et des hypothèses de la méthode sont également fournis. Ces techniques visent à contrôler la teneur en eau volumétrique dans le coffre, le plus grand arbre eau stockage réservoir8, mais peuvent être facilement étendues à l’arbre tout entier avec l’installation de capteurs supplémentaires le long des branches. Mesures de teneur en eau plante dynamique fera progresser les domaines de l’hydrodynamique de la végétation, biométéorologie et modélisation de la surface terrestre.
Protocole
1. choisir un arbre pour l’Instrumentation
- Sélectionner les arbres pour la mesure. Idéalement, sélectionnez les arbres qui sont en bonne santés avec une coupe transversale de tige généralement rond et un diamètre entre 1 - 2 fois la longueur de la tige, ou aubier épaisseur supérieure à la longueur des dents capteur (~ 5 cm pour les capteurs spécifiques capacitance démontré ici). Mesurez la profondeur de l’aubier à l’aide de carottes, ou pour de nombreuses espèces, calculer la profondeur de l’aubier par des équations allométriques reliant la surface de l’aubier pour tige diamètre 29,54, tel que mesuré par une bande de diamètre standard.
Remarque : Cependant, certains types de capteurs à capacité peuvent être en mesure d’être coupé pour une durée appropriée après étape 1.2 sans affecter la précision des mesures. Capteurs de capacitance seul à dents de mesure rigide qui ne contiennent pas de câblage peuvent être élaguées ou coupées. Étalonnage séparé est nécessaire pour capteurs parés. Par conséquent, sélectionnez l’arborescence et déterminer la longueur de tige appropriée avant la procédure d’étalonnage. - Déterminer la durée appropriée des dents capteur basé sur le diamètre de l’arbre et de la profondeur de l’aubier.
NOTE : Capteurs de Capacitance intègrent l’information de l’humidité sur toute la longueur des dents capteur, L. il est donc supposé que l’observation intégrée qu’ils fournissent est représentatif de la tige, le diamètre se situe entre L et 2 L de . L’écorce et le phloème n’affectera pas la mesure comme ils sont retirés de la zone de mesure avant l’installation (voir section 4.2).- Taillez les capteurs pour les arbres, où L est supérieur au diamètre de la tige, (voir étape 1.3) tel que les dents ne pénètrent pas par le biais de l’autre côté de la tige.
- Mesurer le signal combiné de l’aubier et le duramen avec le capteur d’arbres où le diamètre est supérieur à 2L, mais la profondeur de l’aubier est inférieure à L.
Remarque : Comme la teneur en eau diffère dans ces types de deux tissus, il peut-être entraîner un biais si l'on suppose que l’observation est représentatif de la tige entière. Dans ce cas, ou lorsque l’utilisateur est seulement intéressé par les fluctuations de l’eau aubier, le capteur dents doivent être coupés à la profondeur de l’aubier, tels que les observations représentera les fluctuations de contenu de l’eau de l’aubier (xylème actif) seulement. Lorsque la profondeur de l’aubier est plus grande que L, observations représentent seulement l’aubier, mais le capteur ne doit pas être coupé.
- Si nécessaire (tel que déterminé dans les étapes 1.2.1 et 1.2.2), coupe le capteur pour l’application spécifiée. Pour couper les pointes de sonde, fixer le capteur en toute sécurité sur un établi et, si vous portez un équipement de protection, utilisez un outil rotatif électrique équipé d’un disque à tronçonner acier pour couper chaque dent à exactement la même longueur.
2. récolter et préparer des échantillons de bois de toutes les espèces d’intérêt pour générer un étalonnage spécifique à l’espèce
- Recueillir un tronc, tige juvénile ou grosse branche au moins 6 cm de diamètre de l’espèce d’intérêt. Grands diamètres sont privilégiées afin de maximiser la quantité de bois enserrant le capteur et rapprochent plus étroitement la densité du tronc pour les mesures sur le terrain. Enlever les branches attachées toutes les feuilles et lichen ou un matériau meuble.
Remarque : Reportez-vous à la section Discussion pour poursuivre la discussion de l’incertitude en raison des différences dans la branche et la densité des tiges. - Segmenter la tige en sections de 25 ou plus cylindriques d’environ 15 cm de longueur.
- Identifier chaque segment et enregistrer le diamètre moyen et la longueur de chacun. Approximative de volume les résultats des secteurs comme le volume d’un cylindre.
- Les segments se divisent en deux groupes pour réhydratation différentielle et le séchage. Utilisez environ 1/3 des segments dans un bain d’eau pour se réhydrater et les autres 2/3 des segments dans une étuve à 60 ° C, mettre en attente. Séparez les deux segments pour mesure immédiate : de préférence celle du milieu de la longueur de la tige et celui de fin.
Remarque : En général, segments de séchage à 60 ° C seront entièrement desséchés après environ 2 semaines et complètement réhydratés après environ 3 jours. Supprimer les segments individuels du four/bain-marie et mesurer les intervalles quotidiennes ou biquotidienne (voir étape 3.7). Afin de produire un gradient de mesures couvrant la plus grande gamme de teneur en eau volumétrique possible.
3. créer une relation de calibrage entre la sortie du capteur et eau volumétrique contenu
- Connecter un capteur de capacité sur un périphérique d’enregistrement de données, suivant les instructions fournies par le fabricant et à un ordinateur pour la visualisation de l’affichage de capteur en temps réel. Définissez l’intervalle de temps pour la collecte de données à 30 s.
- À l’aide d’un gabarit de perçage premade solidement maintenu en place pour maintenir l’alignement et un foret légèrement inférieur au diamètre des dents de la sonde de capacité (3,57 mm pour le capteur utilisé dans cette expérience), percez deux séries verticales de trois trous avec les deuxième série située à environ 150 ° loin autour du segment de bois avec une séparation verticale de quelques centimètres pour s’assurer qu’il n’y a aucune possibilité de chevauchement entre les trous. Utilisez les segments bois mis de côté à l’étape 2.4 pour la première série de mesures.
- Peser le segment et noter le poids à 0,01 g près, au moment de la mesure. Cap aux extrémités des segments d’une pellicule de plastique pour empêcher le séchage supplémentaire.
- Immédiatement après la pesée, nettoyer les dents de la sonde de capacité avec un tampon imbibé d’alcool et insérez-le dans le segment de la tige complètement, telle qu’aucune partie des dents en acier n’est visible. Attendez que la mesure de la lecture à l’écran de sortie pour stabiliser (2 ou 3 min, généralement). Enregistrer les sorties de capteur de température, la conductivité électrique et la permittivité diélectrique (εb) toutes les 30 s pour calculer la moyenne des 10 mesures et de 5 min.
- Délicatement enlever le capteur du segment, nettoyer les dents avec un tampon imbibé d’alcool et attendez que les lectures de sortie remettre à zéro. Répétez la procédure de mesure de l’étape 3.3 à partir de la deuxième série de trous percés au préalable.
- Retirez le plastique à chaque extrémité et placer le segment de la tige dans l’étuve. Permettez-lui de dessécher complètement (généralement 2 semaines, ou jusqu'à ce que le poids s’est stabilisé pendant plusieurs jours).
- Répétez les étapes de 3,3 à 3,7 pour tous les segments. Supprimer les segments de l’étuve et mesurer plus souvent (deux fois par jour) dans les premiers jours de séchage, en raison du taux plus élevé de perte d’humidité initial qu’au cours des derniers jours (par jour). Sécher les surplus d’eau de la surface des segments retiré du bain d’eau à l’aide d’un essuie-tout avant la pesée et de mesure.
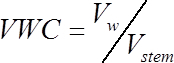 (1)
(1)Où Vw représente le volume d’eau (cm3) et Vde la tige est le volume de la tige de segment (cm3) calculé à l’étape 1.2.
- Calculer le volume d’eau dans chaque segment au moment de la mesure comme :
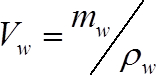 (2)
(2)
Où mw est l’eau de masse dans le segment de la tige (g) au moment de la mesure et ρw est la masse volumique de l’eau (1 g cm-3) - Calculer la masse d’eau dans chaque segment au moment de la mesure comme :
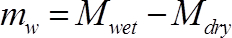 (3)
(3)
Où Mhumide est la masse du segment tige au moment de la mesure (g), et Msec est le poids final du segment (g).
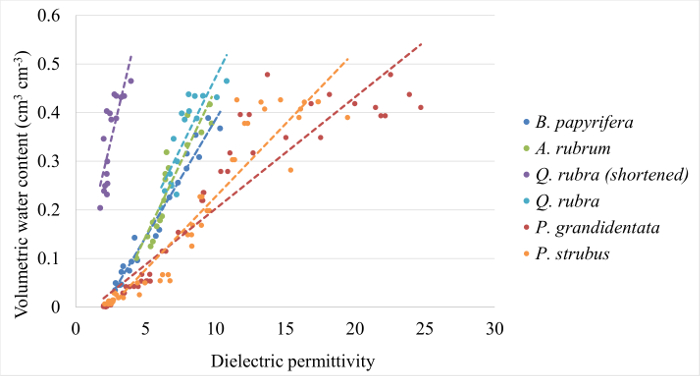
Figure 1 : courbes d’étalonnage exemple. Courbes d’étalonnage obtenues pour Quercus rubra, Acer rubrum, Betula papyrifera, Populus grandidentataet Pinus strobus suivant les parties 1 et 2 du présent protocole. Équations et les coefficients de détermination sont fournis pour chacun dans le tableau 1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| m | b | R2 | |
| Paprifera b. | 0,048 | -0.098 | 0,967 |
| A. rubrum | 0,067 | -0.158 | 0,853 |
| Q. rubra (raccourci) | 0,120 | 0,041 | 0,636 |
| Q. rubra | 0,058 | -0.109 | 0,718 |
| P. grandidentata | 0,023 | -0.028 | 0,887 |
| P. strobus | 0,030 | -0.072 | 0,900 |
Tableau 1 : équations de Calibration pour la conversion de Ε b à VWC pour cinq essences tempérées. Les coefficients ai ' et « b » est présenté pour une équation linéaire sous la forme standard : VWC = m * εb+ b.
4. installation de capteurs de capacité dans les arbres pour mesures sur le terrain
- Avant l’installation du capteur, noter le diamètre de la tige et la hauteur au-dessus de la surface du sol pour chaque emplacement du capteur. En général, pour surveiller la CAV dans le coffre, placer un capteur ~0.5 m au-dessus de la surface du sol et placer une seconde juste en dessous de la première division de ramification importante (~7.5 m au-dessus du sol, Figure 2).
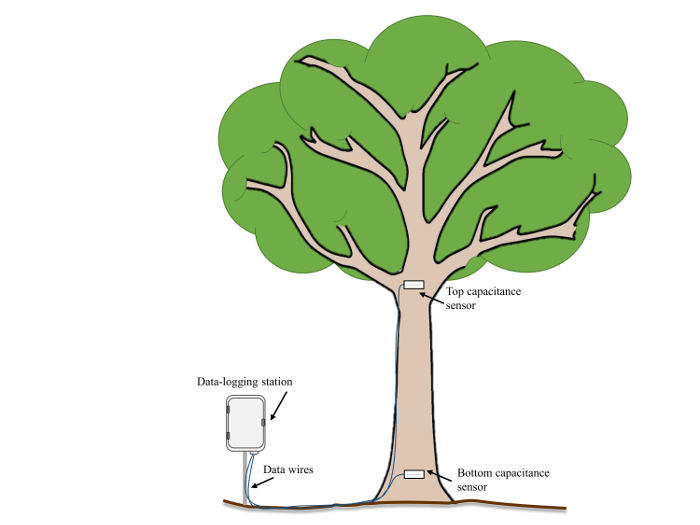
Figure 2 : montage exemple domaine. Un schéma de l’emplacement des capteurs et l’orientation dans un arbre mature adjacente à une station d’enregistrement de données. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Enlever l’écorce jusqu'à le cambium et créer une surface plane où le capteur sera installé à l’aide d’une lame de tirage au sort. Veiller à ce que cette surface est grande et suffisamment plat pour que le capteur trouve contre la surface de l’arbre quand il est monté de manière qu’aucune partie des dents n’est exposée. Enlever l’écorce et le cambium pour s’assurer que les mesures comprennent uniquement l’eau contenu dans le xylème, tout en excluant l’eau contenue dans l’écorce ou phloème.
- Percer les trous pour les dents. Utilisez un foret légèrement inférieur au diamètre des dents pour bois doux, tout en utilisant un peu plus près à la taille réelle des dents pour bois plus dur (3,57 mm tel qu’utilisé dans le présent protocole). Pour les mesures de haute qualité, faire en sorte que les dents de capteur établissent un bon contact avec le bois. Puisqu’il y aura pas besoin d’enlever la sonde régulièrement, comme ce fut le cas au cours de la procédure d’étalonnage, on peut servir un foret légèrement plus petit que celle utilisée pour l’étalonnage.
- Nettoyer les dents de la sonde avec un tampon imbibé d’alcool pour enlever toute saleté ou la peau des huiles et insérer le capteur dans les trous préalablement percés. Si le capteur répond à trop forte résistance lors de l’insertion, doucement il sortir et re-percer les trous pour les élargir un peu. S’assurer que tous les trois andouillers sont bien insérés et le corps du capteur est assis contre le tronc d’arbre.
- Utiliser un scellant à base de silicone pour sceller le capteur contre le tronc d’arbre pour aider les garder à flot d’entrer dans les trous et pour prévenir les infestations de ravageurs.
- Couvrir le capteur avec isolant réfléchissant pour éviter un échauffement externe.
- Suivant le fabricant, connectez tous les capteurs à une source de courant de 12 V et un enregistreur de données compatible. Intervalles de collecte de données utilisation de 5 min pour capteurs déploiement sur le terrain, mais utilisation des intervalles plus longs pour économiser l’électricité dans les sites où le pouvoir est limiter, par exemple, solaire/batterie exploité sites.
5. traiter les données brutes pour stockage de tige-l’eau à l’aide de la courbe d’étalonnage
- À l’aide de l’équation de la courbe d’étalonnage générée à l’étape 2,9, convertir la sortie du capteur en CAV pour toutes les observations. VWC est généralement exprimée en cm 3/cm3 ou en pourcentage. Le pour cent VWC variera donc entre 0 et 100 %.
- Intégrer le volume total d’intérêt (cm3) entre les hauteurs de deux mesures (par exemple, dans la Figure 2: 0,5 m et 7,5 m) en supposant que les changements de diamètre de tige linéairement avec la hauteur.
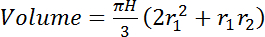 (4)
(4)où H est la différence de hauteur (distance verticale) entre les capteurs (par exemple, dans la Figure 2: 700 cm) et r1 et r2 sont les rayons de la tige (cm) au fond et emplacements des capteurs haut de la page, respectivement.
Pour les arbres où les capteurs fournissent une estimation seulement de l’eau de l’aubier, le contenu (voir Détermination de longueur de capteur, section 1.2) utiliser EQ. 5 :
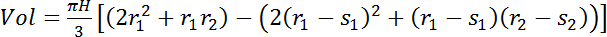 (5)
(5)où s1 et s2 sont les profondeurs de l’aubier (cm) aux emplacements des capteurs bas et en haut, respectivement.
Résultats
Dans cette section, nous présentons des données d’étalonnage pour cinq espèces d’arbres forestiers est commune, suivies d’une analyse détaillée des mesures sur le terrain de stockage de tige-eau chez trois individus Acer rubrum pendant la saison de croissance de 2016. Courbes d’étalonnage ont été générés pour Acer rubrum, Betula papyrifera, Pinus strobus, Populus grandidentata et Quercus rubra (Figure 1). Pentes ...
Discussion
Tendances saisonnières et diurnes tige de teneur en eau observée par l’intermédiaire de capteurs s’aligner sur les tendances dans le flux de sève simultanées de capacitance et environnemental obligeant les mensurations (Figure 3, Figure 4, , Figure 5). Réservoirs de stockage de l’eau de tige sont épuisées pendant le jour quand le rythme de transpiration dépasse le taux de recharge à...
Déclarations de divulgation
Steven R. Garrity est un employé de compteur Group Inc. qui produit la sonde d’humidité du sol Ruggedized GS3 utilisés dans cet Article.
Remerciements
Cette étude a été financée par le U.S. Department of Energy Office of Science, Office of Biological and Environmental Research, écosystème terrestre Sciences programme prix no DE-SC0007041, programme de gestion Ameriflux sous Flux Core Site accord n° 7096915 par le Lawrence Berkeley National Laboratory et les sciences hydrologiques de National Science Foundation grant 1521238. Les avis, les conclusions et les conclusions ou les recommandations exprimées dans ce matériel sont celles des auteurs et ne reflètent pas nécessairement les vues des organismes subventionnaires.
matériels
| Name | Company | Catalog Number | Comments |
| Ruggedized Soil Moisture Sensor | METER Group Inc. | GS-3 | Capacitance sensors |
| 1/8" drill bit | Any | N/A | |
| 9/64" drill bit | Any | N/A | |
| Drying oven | Any | N/A | |
| Chainsaw | Any | N/A | |
| Electric drill | Any | N/A | |
| Bucket for water bath | Any | N/A | |
| Alcohol swabs | Any | N/A | |
| Draw knife | Any | N/A | |
| Data logger | Any | N/A | |
| Silicon sealant | Any | N/A |
Références
- Matheny, A. M., et al. Contrasting strategies of hydraulic control in two codominant temperate tree species. Ecohydrol. 10 (3), e1815 (2017).
- Kocher, P., Horna, V., Leuschner, C. Stem water storage in five coexisting temperate broad-leaved tree species: significance, temporal dynamics and dependence on tree functional traits. Tree Physiol. 33 (8), 817-832 (2013).
- Holbrook, N. M., Gartner, B. L. Chapter 7. Plant stems: physiology and functional morphology. , 151-174 (1995).
- Wullschleger, S. D., Hanson, P. J., Todd, D. E. Measuring stem water content in four deciduous hardwoods with a time-domain reflectometer. Tree Physiol. 16 (10), 809-815 (1996).
- Matheny, A. M., et al. Observations of stem water storage in trees of opposing hydraulic strategies. Ecosphere. 6 (9), 165 (2015).
- Waring, R. H., Running, S. W. Sapwood water storage: its contribution to transpiration and effect upon water conductance through the stems of old-growth Douglas-fir. Plant Cell Environ. 1 (2), 131-140 (1978).
- Cermak, J., Kucera, J., Bauerle, W. L., Phillips, N., Hinckley, T. M. Tree water storage and its diurnal dynamics related to sap flow and changes in stem volume in old-growth Douglas-fir trees. Tree Physiol. 27 (2), 181-198 (2007).
- Betsch, P., et al. Drought effects on water relations in beech: The contribution of exchangeable water reservoirs. Agric. For. Meteorol. 151 (5), 531-543 (2011).
- Schäfer, K. V. R., Oren, R., Tenhunen, J. D. The effect of tree height on crown level stomatal conductance. Plant Cell Environ. 23 (4), 365-375 (2000).
- Burgess, S. S. O., Dawson, T. E. Using branch and basal trunk sap flow measurements to estimate whole-plant water capacitance: a caution. Plant Soil. 305 (1-2), 5-13 (2008).
- Kumagai, T., Aoki, S., Otsuki, K., Utsumi, Y. Impact of stem water storage on diurnal estimates of whole-tree transpiration and canopy conductance from sap flow measurements in Japanese cedar and Japanese cypress trees. Hydrol. Process. 23 (16), 2335-2344 (2009).
- Nadler, A., Raveh, E., Yermiyahu, U., Green, S. Stress induced water content variations in mango stem by time domain reflectometry. Soil Sci. Soc. Am. J. 70 (2), 510-520 (2006).
- Nadler, A., Raveh, E., Yermiyahu, U., Green, S. R. Evaluation of TDR use to monitor water content in stem of lemon trees and soil and their response to water stress. Soil Sci. Soc. Am. J. 67 (2), 437-448 (2003).
- Hernandez-Santana, V., Martinez-Fernandez, J. TDR measurement of stem and soil water content in two Mediterranean oak species. Hydrolog Sci J. 53 (4), 921-931 (2008).
- Cocozza, C., et al. Simultaneous measurements of stem radius variation and sap flux density reveal synchronisation of water storage and transpiration dynamics in olive trees. Ecohydrol. 8 (1), 33-45 (2015).
- Andrade, J. L., et al. Regulation of water flux through trunks, branches, and leaves in trees of a lowland tropical forest. Oecologia. 115 (4), 463-471 (1998).
- Domec, J. C., Gartner, B. L. Cavitation and water storage capacity in bole xylem segments of mature and young Douglas-fir trees. Trees-Struct. Funct. 15 (4), 204-214 (2001).
- Holbrook, N. M., Burns, M. J., Sinclair, T. R. Frequency and time-domain dielectric measurements of stem water-content in the arborescent palm, Sabal palmetto. J. Exp. Bot. 43 (246), 111-119 (1992).
- Meinzer, F. C., et al. Dynamics of water transport and storage in conifers studied with deuterium and heat tracing techniques. Plant Cell Environ. 29 (1), 105-114 (2006).
- Poyatos, R., et al. SAPFLUXNET: towards a global database of sap flow measurements. Tree Physiol. 36 (12), 1449-1455 (2016).
- Hao, G. Y., Wheeler, J. K., Holbrook, N. M., Goldstein, G. Investigating xylem embolism formation, refilling and water storage in tree trunks using frequency domain reflectometry. J. Exp. Bot. 64 (8), 2321-2332 (2013).
- Bonan, G. B., Williams, M., Fisher, R. A., Oleson, K. W. Modeling stomatal conductance in the earth system: linking leaf water-use efficiency and water transport along the soil-plant-atmosphere continuum. Geosci. Model Dev. 7 (5), 2193-2222 (2014).
- Brantley, S. L., et al. Reviews and syntheses: on the roles trees play in building and plumbing the critical zone. Biogeosciences Discuss. 2017, 1-41 (2017).
- Bonan, G. B. Forests and climate change: Forcings, feedbacks, and the climate benefits of forests. Science. 320 (5882), 1444-1449 (2008).
- Matheny, A. M., Mirfenderesgi, G., Bohrer, G. Trait-based representation of hydrological functional properties of plants in weather and ecosystem models. Plant Diversity. 39 (1), 1-12 (2017).
- Chapotin, S. M., Razanameharizaka, J. H., Holbrook, N. M. Water relations of baobab trees (Adansonia spp.L.) during the rainy season: does stem water buffer daily water deficits. Plant Cell Environ. 29 (6), 1021-1032 (2006).
- Oliva Carrasco, L., et al. Water storage dynamics in the main stem of subtropical tree species differing in wood density, growth rate and life history traits. Tree Physiol. 35 (4), 354-365 (2015).
- Wullschleger, S. D., Meinzer, F. C., Vertessy, R. A. A review of whole-plant water use studies in trees. Tree Physiol. 18 (8-9), 499-512 (1998).
- Matheny, A. M., et al. Species-specific transpiration responses to intermediate disturbance in a northern hardwood forest. J. Geophys. Res. 119 (12), 2292-2311 (2014).
- Ford, C. R., Hubbard, R. M., Vose, J. M. Quantifying structural and physiological controls on variation in canopy transpiration among planted pine and hardwood species in the southern Appalachians. Ecohydrol. 4 (2), 183-195 (2011).
- Holbrook, N. M., Sinclair, T. R. Water-Balance in the arborescent palm, Sabal palmetto. II. Transpiration and stem water storage. Plant Cell Environ. 15 (4), 401-409 (1992).
- Goldstein, G., et al. Stem water storage and diurnal patterns of water use in tropical forest canopy trees. Plant Cell Environ. 21 (4), 397-406 (1998).
- Borchert, R. Soil and stem water storage determine phenology and distribution of tropical dry forest trees. Ecology. 75 (5), 1437-1449 (1994).
- Hernandez-Santana, V., Martinez-Fernandez, J., Moran, C. Estimation of tree water stress from stem and soil water monitoring with time-domain reflectometry in two small forested basins in Spain. Hydrol. Process. 22 (14), 2493-2501 (2008).
- . . Climate change 2013: the physical science basis contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change. , 1535 (2013).
- Konings, A. G., Williams, A. P., Gentine, P. Sensitivity of grassland productivity to aridity controlled by stomatal and xylem regulation. Nat. Geosci. , (2017).
- Fei, S., et al. Divergence of species responses to climate change. Science Advances. 3 (5), (2017).
- Fisher, R. A., et al. Vegetation demographics in Earthsystem models: a review of progress and priorities. Glob. Change Biol. , (2017).
- Dietze, M. C., Lebauer, D. S., Kooper, R. O. B. On improving the communication between models and data. Plant Cell Environ. 36 (9), 1575-1585 (2013).
- Bohrer, G., et al. Finite element tree crown hydrodynamics model (FETCH) using porous media flow within branching elements: A new representation of tree hydrodynamics. Water Resour. Res. 41 (11), (2005).
- Mirfenderesgi, G., et al. Tree level hydrodynamic approach for resolving aboveground water storage and stomatal conductance and modeling the effects of tree hydraulic strategy. J. Geophys. Res. 121 (7), 1792-1813 (2016).
- Gentine, P., Guérin, M., Uriarte, M., McDowell, N. G., Pockman, W. T. An allometry-based model of the survival strategies of hydraulic failure and carbon starvation. Ecohydrol. 9 (3), 529-546 (2015).
- Huang, C. -. W., et al. The effect of plant water storage on water fluxes within the coupled soil-plant system. New Phytol. 213 (3), 1093-1106 (2017).
- Bittner, S., et al. Functional-structural water flow model reveals differences between diffuse- and ring-porous tree species. Agric. For. Meteorol. 158, 80-89 (2012).
- Matheny, A. M., et al. Characterizing the diurnal patterns of errors in the prediction of evapotranspiration by several land-surface models: an NACP analysis. J. Geophys. Res. 119 (7), 1458-1473 (2014).
- Matthes, J. H., Goring, S., Williams, J. W., Dietze, M. C. Benchmarking historical CMIP5 plant functional types across the Upper Midwest and Northeastern United States. J. Geophys. Res. 121 (2), 523-535 (2016).
- Musavi, T., et al. The imprint of plants on ecosystem functioning: A data-driven approach. Int. J. Appl. Earth Obs. Geoinf. 43, 119-131 (2015).
- Wullschleger, S. D., et al. Plant functional types in Earth system models: past experiences and future directions for application of dynamic vegetation models in high-latitude ecosystems. Ann. Bot. 114 (1), 1-16 (2014).
- Scholz, F. G., et al. Biophysical properties and functional significance of stem water storage tissues in Neotropical savanna trees. Plant Cell Environ. 30 (2), 236-248 (2007).
- Scholz, F. G., et al. Temporal dynamics of stem expansion and contraction in savanna trees: withdrawal and recharge of stored water. Tree Physiol. 28 (3), 469-480 (2008).
- Borchert, R. Electric resistance as a measure of tree water status during seasonal drought in a tropical dry forest in Costa Rica. Tree Physiol. 14 (3), 299-312 (1994).
- Edwards, W. R. N., Jarvis, P. G. A method for measuring radial differences in water content of intact tree stems by attenuation of gamma radiation. Plant Cell Environ. 6 (3), 255-260 (1983).
- Phillips, N. G., Scholz, F. G., Bucci, S. J., Goldstein, G., Meinzer, F. C. Using branch and basal trunk sap flow measurements to estimate whole-plant water capacitance: comment on Burgess and Dawson (2008). Plant Soil. 315 (1-2), 315-324 (2009).
- Bovard, B. D., Curtis, P. S., Vogel, C. S., Su, H. -. B., Schmid, H. P. Environmental controls on sap flow in a northern hardwood forest. Tree Physiol. 25, 31-38 (2005).
- Granier, A. Evaluation of transiration in a Douglas-Fir stand by means of sap flow measurements. Tree Physiol. 3 (4), 309-319 (1987).
- Brodribb, T. J., Holbrook, N. M. Stomatal closure during leaf dehydration, correlation with other leaf physiological traits. Plant Physiol. 132 (4), 2166-2173 (2003).
- Brodribb, T. J., Holbrook, N. M. Stomatal protection against hydraulic failure: a comparison of coexisting ferns and angiosperms. New Phytol. 162 (3), 663-670 (2004).
- Taneda, H., Sperry, J. S. A case-study of water transport in co-occurring ring- versus diffuse-porous trees: contrasts in water-status, conducting capacity, cavitation and vessel refilling. Tree Physiol. 28 (11), 1641-1651 (2008).
- Schuldt, B., Leuschner, C., Brock, N., Horna, V. Changes in wood density, wood anatomy and hydraulic properties of the xylem along the root-to-shoot flow path in tropical rainforest trees. Tree Physiol. 33 (2), 161-174 (2013).
- Sarmiento, C., et al. Within-individual variation of trunk and branch xylem density in tropical trees. Am. J. Bot. 98 (1), 140-149 (2011).
- Barij, N., Cermak, J., Stokes, A. Azimuthal variations in xylem structure and water relations in cork oak (Quercus suber). Iawa J. 32 (1), 25-40 (2011).
- Domec, J. C., Pruyn, M. L., Gartner, B. L. Axial and radial profiles in conductivities, water storage and native embolism in trunks of young and old-growth ponderosa pine trees. Plant Cell Environ. 28 (9), 1103-1113 (2005).
- Ewers, B. E., Oren, R. Analyses of assumptions and errors in the calculation of stomatal conductance from sap flux measurements. Tree Physiol. 20 (9), 579-589 (2000).
- Fan, Z. X., Cao, K. F., Becker, P. Axial and radial variations in xylem anatomy of angiosperm and conifer trees in Yunnan, China. Iawa J. 30 (1), 1-13 (2009).
- James, S. A., Clearwater, M. J., Meinzer, F. C., Goldstein, G. Heat dissipation sensors of variable length for the measurement of sap flow in trees with deep sapwood. Tree Physiol. 22 (4), 277-283 (2002).
- James, S. A., et al. Axial and radial water transport and internal water storage in tropical forest canopy trees. Oecologia. 134 (1), 37-45 (2003).
- Fromm, J. H., et al. Xylem water content and wood density in spruce and oak trees detected by high-resolution computed tomography. Plant Physiol. 127 (2), 416-425 (2001).
- Steppe, K., De Pauw, D. J. W., Doody, T. M., Teskey, R. O. A comparison of sap flux density using thermal dissipation, heat pulse velocity and heat field deformation methods. Agric. For. Meteorol. 150 (7-8), 1046-1056 (2010).
- Vergeynst, L. L., Vandegehuchte, M. W., McGuire, M. A., Teskey, R. O., Steppe, K. Changes in stem water content influence sap flux density measurements with thermal dissipation probes. Trees. 28 (3), 949-955 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon