Method Article
采用自动结晶耦合原位动态光散射的不同尺寸生长蛋白晶体
摘要
在这里, 我们提出了一个控制生产蛋白质纳米微晶的协议。该过程使用一个自动化设备, 允许控制操作的几个结晶参数。蛋白质结晶是通过控制和自动添加结晶溶液进行的, 同时监测和研究结晶液中颗粒的半径分布。
摘要
该自动结晶装置是一项专利技术1特别开发的监测蛋白质结晶实验, 目的是精确地调整成核和晶体生长达到预期大小的蛋白质晶体。控制结晶是基于原位动态光散射样本调查, 而水滴的所有视觉变化都是通过与 CCD 相机耦合的显微镜进行在线监测的, 从而使整个结晶过程中蛋白质滴的研究。在整个实验中使用原位dl 测量, 可以精确地确定过渡到新阶段的高饱和蛋白质溶液--晶体细胞核的形成。通过确定蛋白质的成核阶段, 可以从大蛋白晶体中优化结晶到蛋白质纳米微晶的生产。实验协议显示了一种基于精确自动化步骤的交互式结晶方法, 如沉淀加、诱导高过饱和的水蒸发和减缓诱导的均质成核的样品稀释和反转相位转换。
引言
近年来, 蛋白质微晶和纳米晶体的生长引起了蛋白质结晶学群落的关注, 特别是连续飞秒晶体学 (SFX) 的不断发展。由于新的 X 射线辐射源的辉煌, 并根据迄今取得的成功成果, 蛋白质微晶和纳米晶体的生产已成为高度相关性, 对制备这种晶体悬浮液提出了很高的要求。2,3. 由于在自由电子激光器 (XFELs) 上收集数据所需的晶体尺寸小, 而且实验 beamtime 的可用性有限, 因此在数据收集之前进行样本描述是必不可少的。最常见的技术, 以表征蛋白质微或纳米晶悬浮直到现在的电子显微镜和 X 射线粉末衍射。
到目前为止, 一些方法已经适应了从普通的结晶方法, 目的是生产大量的蛋白质晶体与尺寸的小千分尺范围。该批处理方法用于快速混合高浓缩蛋白和沉淀溶液, 从而迫使样品溶液到高度过饱和的阶段, 其中纳米可能偏爱4。其他方法包括粉碎大的蛋白质晶体形成一个水晶浆, 这可以作为纳米晶悬浮用于数据收集5。然而, 结果有时可能导致衍射质量下降, 因为退化的晶体有较低的内部秩序。基于自由界面扩散的纳米也是一个可用的替代品, 蛋白质溶液被添加到一个高度集中的沉淀溶液3中。然而, 在所有的技术中, 最有效的方法似乎是间歇结晶和更创新的操纵技术, 采用气-扩散方法在静坐下降6。
一般而言, 对于蛋白质的结晶, 必须越过能量屏障来支撑成核--晶体形成的第一个热力学步骤。为了将蛋白质溶液从热力学上稳定态转移到过饱和, 最后诱导相变, 需要对与蛋白质溶液相关的一些变量进行修正。这些变量通常是蛋白质溶液的浓度, 环境变化 (例如,温度, 湿度), 溶剂特性 (如pH 值, 离子强度), 浓度和缓冲性能等.7 ,8可更改的样本参数的概览通常用相图表示, 允许不同的呈现方式, 如溶解度图、成核相图, 甚至更详细描述三维或更复杂的图表可以考虑8,9,10。最吸引人的相图类型通常是二维的, 其中主变量是蛋白质浓度作为另一个参数的函数, 而其余参数保持恒定6,11。一旦形成一个或几个原子核, 较大的晶体就可以通过从大体积溶液中摄入额外的蛋白质来生长。当针对微晶和纳米晶体的生产, 这种传统的结晶方法是不可行的, 由于少数的晶体存在于溶液中。纳米晶悬浮物通常必须丰富的晶体实体, 因此结晶途径必须重新调整, 这样, 有一个最大的核事件在样品中存在。因此, 这需要调查一些新的, 直到现在尚未开发的蛋白质的核途径, 这还没有完全理解12,13。根据前面提到的相图基本原理, 经典理论已经扩展到一个新的假设, 即成核被描述为两步机制: 首先, 向更高蛋白质浓度的过渡发生 (致密液体阶段) 和第二, 从稠密的阶段过渡到一个更高的内部顺序 (水晶原子核与格子建筑学)14,15,16。蛋白质结晶对许多因素都很敏感, 因此当结晶配方被重新调整以产生不同大小的晶体时, 食谱就不能总是依赖以前的知识。需要为每个单独的蛋白质目标建立新的洞察力: 缓冲成分的调节, 样品的纯度和稳定性, 蛋白质溶解度的精确知识等。
动态光散射今天是一个成熟的方法来分析和优化蛋白质结晶过程, 由于广泛的颗粒范围, 可以调查: 从单体蛋白纳米晶和小纳米微晶。该方法利用溶液中的粒子进行布朗运动, 并且该运动的平均速度由粒子大小、热能和介质的粘度和粒子的几何形状决定。首先, 液体介质由相干光源照明, 使用激光。粒子散射的光形成了干涉模式。由于粒子处于永久性运动中, 干扰模式也会永久改变。当在某一方向寻找时, 强度波动可以被观察到。这些波动现在显示了由布朗运动引起的粒子运动。从实测的强度波动计算出自相关函数 (ACF)。对 ACF 的分析将给出粒子的速度分布 (更精确的扩散系数), 并利用斯托克斯-爱因斯坦方程, 转化为粒子半径分布17。与 dl 功能和工作原理相关的其他信息可在各种出版物和书籍18,19中找到。
在这里, 我们应用和描述一个独特的自动结晶装置, XtalController900, 升级版本的 XtalController 技术6, 精确地开发用于监测交互式蛋白质结晶实验。该技术为核事件的实时识别和跟踪提供了很高的潜力, 允许通过结晶相图进行精确的机动。这种特殊的结晶过程的目的是优化蛋白质结晶, 以获得高质量的蛋白质微晶和纳米晶, 适用于使用微聚焦同步辐射 x 射线源, 电子衍射, 或SFX.
研究方案
注: 在整个协议中, 用于添加水的微剂量系统将被称为 Pump0, 而用于添加沉淀的微剂量系统将被称为 Pump1。本实验的结果将进一步讨论, 并称为 THM2_micro-crystals。
1. 参数和解决方案设置
- 用0.2 µm 无菌注射器过滤器, 过滤16毫升的钠酒石酸溶液 (1.2 米) 和16毫升蒸馏水。
注: 酒石酸钠溶液代表结晶实验的沉淀溶液。 - 用5毫升的过滤溶液填充沉淀和水瓶。
注: 瓶的最大容量为5毫升。 - 将瓶子装在实验室的泵架上。
- 将 "软件" 窗口中的实验参数设置为以下值: 温度为20摄氏度, 相对湿度为 20, 溶剂为水。
注:图 2显示了显示窗口, 用户可以在其中插入每个参数 (如温度、相对湿度和溶剂) 的正确值。软件窗口还显示一些附加参数, 如添加剂。这对于在沉淀溶液中存在添加剂的实验是非常重要的。 - 打开实验室的前门, 取出盖玻片托架。
- 在托架上放置一个干净和渗的盖玻片, 并将其放回设备中。
注: 盖玻片的尺寸为2.2 厘米。 - 关闭实验室以确保步骤1.4 中的环境条件。
注意: 协议可以在这里暂停。
2. 微剂量系统调整
- 使用 图 3中的主泵特性打开 Pump0, 然后创建一个水流。
注: 水流轨迹是根据一些可调整的水泵特性而创建的。图 3显示了该实验应使用的主要泵特性和最佳值。 - 手动操作指定的调整螺钉, 调整水流瞄准盖玻片中心的位置。关掉Pump0。
- 打开 Pump1 并创建以前在步骤2.1 中所做的液体流。将 Pump1 的流位置调整为 Pump0 固定位置。关掉Pump1。
- 用新的和清洁的盖玻片代替所用的结晶实验。
注: 软湿巾通常建议清洗新的盖玻片从残余灰尘, 之前被用于结晶实验。
3. 在实验室设置奇异果甜蛋白下降
- 使用软件包创建新的实验文件。在实验文件中输入以下信息: 蛋白质 (奇异果甜蛋白Thaumatococcus daniellii), 蛋白质浓度 (14 毫克/毫升), 沉淀 (酒石酸) 和沉淀浓度 (1.2 米)。
注: 此信息将用于在结晶实验过程中沉淀和蛋白质浓度的自动计算。 - 加载新的实验文件以激活步骤3.1 中的所有信息。
- 使用 Pump0 添加小水滴, 标记蛋白质滴的位置。
注: 目的是创建一个小水滴, 将作为一个里程碑, 其中蛋白质样本将放置。 - 按下按钮 , 将天平所给的重量设置为零。
注意: 这将消除盖玻片的重量和在步骤3.3 中创建的小水地标添加的额外重量。 - 打开实验室顶盖和吸管8µL 奇异果甜蛋白溶液在水上地标。
- 按照下一命令注册新的奇异果甜蛋白。
- 按下按钮新的下拉属性的初始条件从实验文件。
- 按下按钮常数, 以补偿水滴的自然蒸发。
- 如果 Pump0 的目标是蛋白质下降, 请检查 CCD 摄像机。调整 Pump0 的位置, 如果水流是瞄准在下落外面。
注: 从这一刻起, 蛋白质滴将保持在一个恒定的重量, 通过自动水添加补偿自然水蒸发从蛋白质滴。利用显示窗口实时监测蛋白质液滴的重量, 以及温度和相对湿度等参数。这个实验可以在这里暂停。
4.原位dl 测量
- 打开 dl 激光器, 用调整螺钉手动将激光束放在蛋白质滴下。
- 输入以下 dl 参数: 测量持续时间 (六十年代), 两次测量 (十年代) 和测量次数 (300) 之间的等待间隔。
注: 前30项测量将作为蛋白质稳定性检查的参考指标。其余的测量将作为一个完整的研究的蛋白质滴在总长度的结晶过程。 - 按下按钮开始启动 dl 测量。选择一个 dl 图形表示法检查样品的质量。
注: 样品应显示高度的单分散性, 没有任何骨料在溶液中。dl 结果可以显示和读取为: 半径分布, 半径直方图, 半径绘制, 测量总结, 或作为一个概述的计数率强度。
5. 样品蒸发步骤
- 使用表 1中显示的数据, 在计划表中输入蒸发步骤的条件。
注: 在第二行 "浓度/百分比" 列中引入的符号表示水从蛋白质滴中流失, 而值 "25" 则表示水滴体积将减少25%。这意味着液滴的蛋白质浓度将增加25%。 - 按下按钮自动化激活样品蒸发步骤。当样品蒸发步骤完成后, 按下按钮停止。
- 激活按钮常量, 以保持下降常数后停止样品蒸发。
6. 沉淀加法步骤
- 使用表 2中提供的数据, 在图 4所示的计划表中输入沉淀加法步骤的条件。
注: 表的第一行表示校准步骤, 在此期间, 软件根据必须添加到蛋白质液滴的沉淀量计算蛋白质滴的自然蒸发速率。该软件推断该值, 自动调整 Pump0 的拍摄频率, 以自动补偿下一沉淀加法步骤的水蒸发。 - 通过按下按钮自动化激活沉淀添加步骤。
注意: 添加沉淀是一个自动化的过程, 跟随从时间表表的输入。
7. 随着时间的推移, 跟踪结晶液滴的演变过程
- 使用 CCD 相机检查奇异果甜蛋白晶体的外观。
- 使用 dl 图形表示法检查粒度分布。
- 使用显示窗口检查重量和实验参数的变化。
注: 当酒石酸钠溶液在蛋白质滴下达到0.74 米浓度时, 液滴会在奇异果甜蛋白微晶体中丰富, 如图 7所示。
8. 结晶液滴的回收
- 用石蜡油涂上干净的标准 Terasaki 板。
- 在盘子里加3毫升石蜡油。
- 用不同角度轻轻移动板材, 将石蜡油分散在板井上, 使油覆盖所有的72口井。
- 把漂浮在盘子上的油倒出来, 除去多余的石蜡油。
- 按按钮停止完成结晶实验。小心取出含有结晶液滴的样品载体。
- 使用吸管, 在 Terasaki 板的水井中放置2µL 整除数的结晶降。
注: 通过用显微镜或其它与标准 Terasaki 板配合使用的 dl 技术, 通过在油中回收板中的结晶液, 可以定期检查样品的稳定性和晶体生长情况。
结果
在结晶实验过程中, 由 dl 测量得到的结果表明, 流体动力学粒子半径的详细演化导致了两个主粒子分布分数的变化, 随着时间的推移发展。在实验的第一部分, 样品慢慢蒸发, 以达到更高的蛋白质浓度。如图 5B所示, 蛋白质滴被浓缩从14毫克/毫升到19.5 毫克/毫升。在此期间, 根据图 5A中的半径分布模式, 蛋白质在溶液中显示出单体行为, 其粒径约为 2.5 nm。随着样品的进一步蒸发, 单体蛋白在溶液中保持稳定, 没有任何变性或样品聚集的迹象。
在样品蒸发后立即开始添加沉淀溶液, 在半径分布模式和平衡曲线上加亮灰色, 以更好地可视化 (图 5)。根据样品重量得出的计算结果, 突出的粒子分数归因于晶体成核的初始化, 导致半径大小约为 200-400 nm。这种现象 (称为成核) 是在蛋白质液滴的0.6 米的沉淀浓度开始的, 在大约66分钟的时间内, 从实验的启动和大约23分钟的起始沉淀除了。随着沉淀浓度的增加, 半径分布在溶液中呈现出广泛的颗粒分布。随着原子核形态的增加, 初始晶体实体的体积增大, 达到半径分布在 800-1300 nm 之间。可以得出结论, 在这个阶段, 晶体细胞核继续生长, 蛋白质的分数逐渐变得越来越差, 因为蛋白质分子是由纳米微晶。随着蛋白质滴沉淀浓度的逐渐增加, 纳米微晶的形成在75分钟后很容易识别, 当半径分布持续发展到500和1500毫微米之间时。半径分布的演变也证实了 CCD 照相机图像, 蛋白质纳米微晶是可看见的在沉淀集中 0.7 M 在解答 (图 7)。随着沉淀的增加和结晶降保持恒定, 半径分布显示了1000和 3000 nm 之间的一个主要阶段, 而成核事件的分数随着时间的推移而减少。此时, 结晶降完全饱和纳米微晶, 溶液中不存在进一步的成核事件。
利用天平给出的反馈数据作为实验输入, 绘制了结晶相图, 对奇异果甜蛋白结晶过程进行了全面的认识。在图 6中, 实验相图显示了三个独立结晶实验, 奇异果甜蛋白danielli纳米微晶的生产被标记为 THM_2 微晶体 (协议)。另外两个标记为 THM_1 宏观晶体和 THM_3 宏观晶体的结晶实验被用作输入数据, 以便对相图中不同区域 (例如, 溶解度或亚稳态区域)进行正确的映射。由于这些实验的协议遵循不同的结晶途径, 核化区域的识别变得更容易, 因此更准确。对于每一个实验, 结晶路径被强调的数量, 以强调不同的方法和结晶步骤的数量, 用于特定的结果, 而灰色箭头代表最终蛋白质的估计浓度当晶体生长时, 吸收蛋白质分子从溶液中形成定义良好的稳定蛋白晶体。
图 6所示的三奇异果甜蛋白实验显示了进入成核区域时的不同条件, 从而得出了不同的最终结晶结果, 从相图下的图片可以看出。在 THM1 和 THM3 的情况下, 蛋白质溶液通过成核阶段并重新进入亚稳态区域, 直到晶体形成。因此, 实验导致大, 明确定义的形状晶体被母液包围。然而, 对于在协议部分中提出的实验, THM2_micro-crystals, 结晶路径遵循特定的方法。在前一节中, 我们提到了一个样品给纳米微晶, 蛋白质溶液必须位于深的核阶段, 使成核事件可以形成的最大速率。在 THM2_micro-crystals 的情况下, 蛋白质与沉淀浓度的比值被调整成这样一种方式, 即样品不仅进入成核区域, 而且随着沉淀进一步添加到蛋白质溶液中, 并且条件不移动到相图中的另一个区域, 但在成核区域内保持高度过饱和状态。因此, 当蛋白质滴立即饱和与小晶体实体时, 溶液的熵会急剧减少。
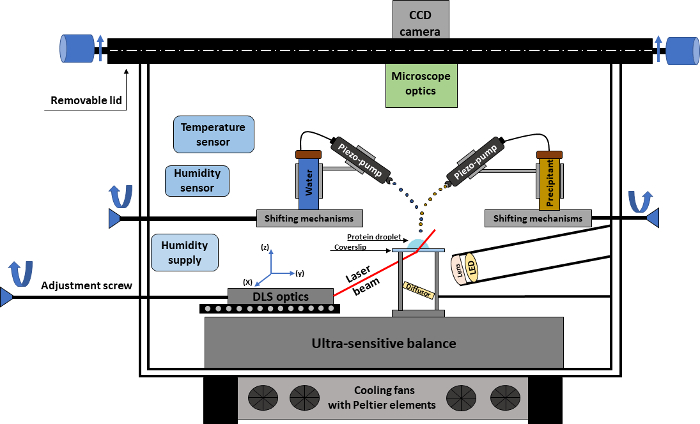
图1。结晶实验的示意图表示法.该图显示了结晶实验室的概况以及进行自动化结晶实验所需的所有技术部件。请单击此处查看此图的较大版本.
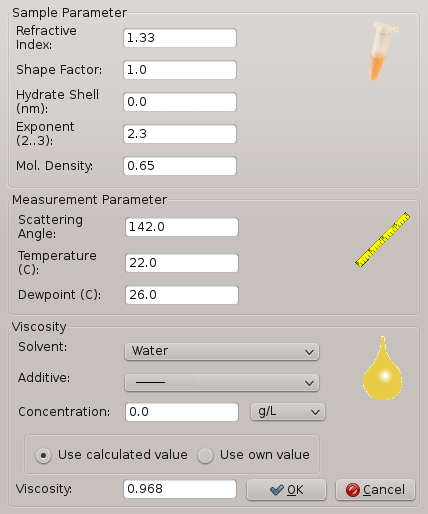
图 2: 与结晶实验相关的 dl 和样本参数的软件窗口.参数包括温度、相对湿度、粘度等。
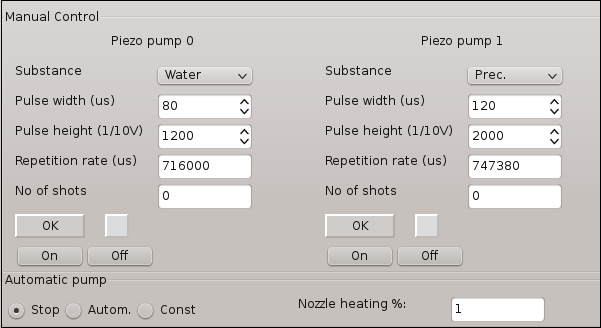
图 3: 在结晶实验中所涉及的微剂量系统的软件控制窗口.这些功能允许对生成水滴或溶液流的特定参数进行调整。
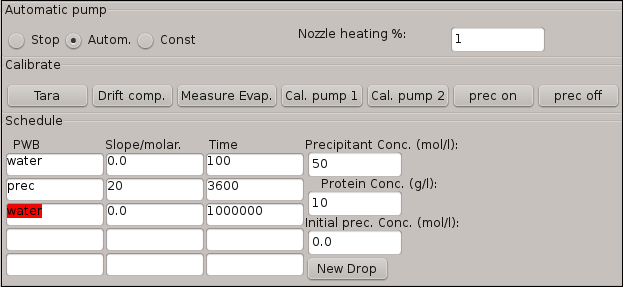
图 4: 用于描述实验所涉及的结晶步骤的时间表表的软件窗口.在这个窗口中也集成了结晶液滴的初始条件。
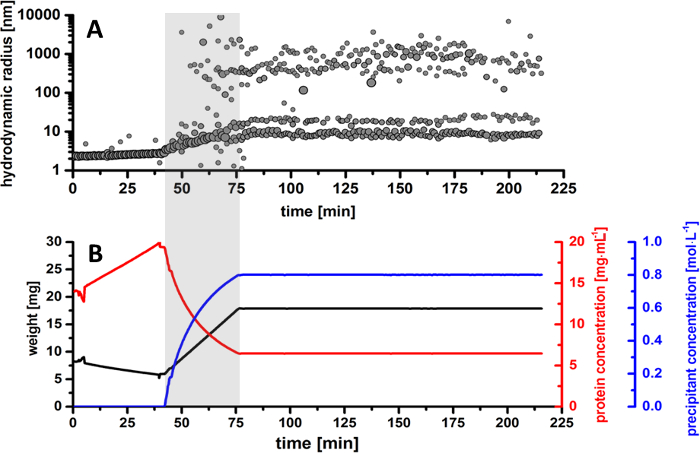
图5。奇异果甜蛋白daniellii纳米微晶生产概况.(A) 整个结晶过程中蛋白质滴粒大小的半径分布。(B) 监测试验参数概览。地块代表蛋白质滴 (黑色曲线) 的重量的演变与计算的蛋白质浓度 (红色曲线) 和沉淀浓度 (蓝色曲线) 一起。请单击此处查看此图的较大版本.
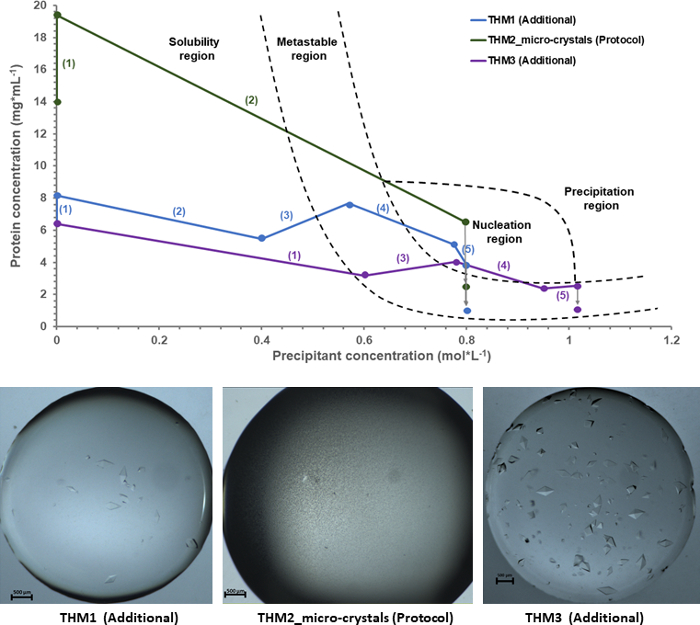
图 6: 奇异果甜蛋白danielli的实验结晶相图以及由此产生的结果.所有的地块都是根据天平提供的反馈信息从实验数据中提取出来的。在括号之间可见的每个实验的数字表示顺序和在结晶协议过程中采取的步骤的数量。请单击此处查看此图的较大版本.

图 7: THM2_Micro-crystals (协议) 的记录照片, 显示大量的纳米微晶饱和的溶液.该图片是在4小时 (240 分钟) 后, 设置在实验室中的蛋白质滴结晶。请单击此处查看此图的较大版本.

图 8: THM_1 宏观晶体的记录照片, 显示一些大的奇异果甜蛋白晶体在溶液中稳定.图片被采取了20小时, 在设置了蛋白质滴在实验室为结晶。请单击此处查看此图的较大版本.

图 9: 在溶液中显示各种尺寸的奇异果甜蛋白晶体的 THM_3 宏观晶体的记录照片.图片被采取了20小时, 在设置了蛋白质滴在实验室为结晶。请单击此处查看此图的较大版本.
| 物质 | 浓度/百分比 | 时间 (s) |
| 水 | 0 | 100 |
| 水 | -25 | 2100 |
| 水 | 0 | 2100 |
表 1: 奇异果甜蛋白纳米微晶生产中样品蒸发步骤的自动时间表输入。
| 物质 | 浓度/百分比 | 时间 (s) |
| 水 | 0 | 100 |
| prec | 0。8 | 1800 |
| 水 | 0 | 18000 |
表 2: 奇异果甜蛋白生产中沉淀添加步骤的自动时间表输入纳米微晶.
讨论
该结晶装置设计用于监测和操作的关键参数在结晶实验的基础上, 改进的气-扩散方法。这项技术允许监测和评分在所有阶段的蛋白质结晶实验, 使用户有精确的知识和控制的蛋白质溶液在整个结晶相图, 基于原位dl 分析样品悬浮。
该结晶器包括与 CCD 摄像机连接的实验室 (图 1), 它允许对结晶液滴进行实时监测。该相机适用于配备不同放大透镜的显微镜, 提供了大约2.5 µm 的最大空间分辨率。实验室的核心是一个超灵敏天平, 用于跟踪样本重量随时间推移的演化。结晶过程对应于一个静坐滴蒸气扩散实验, 蛋白质下落放置在渗盖玻片上, 放置在天平上。根据液滴的重量变化, 这是由沉淀添加, 水/添加剂添加, 或样品蒸发, 天平给出了一个精确的输入算法立即计算蛋白质和沉淀浓度随着时间的推移.此外, 还对温度和相对湿度等重要结晶参数进行了精确的监测和控制。
为了进行结晶实验, 该装置配备两个微剂量系统 (无接触压电泵), 工作在一个 picoliter 的规模沉淀和水添加。通过使用这种少量的物质, 在蛋白质滴内的浓度梯度和对流现象被最小化。压电泵的主要作用是增加沉淀或水, 后者例如被作为补偿为蛋白质滴的自然蒸发。微剂量系统有一组特征, 可以决定添加某种物质。这些特性包括: 添加物质的重复率、每秒添加的水滴数、物质流轨迹的宽度和高度等。此外, 泵的位置可以手动调整, 使用户有一个精确的位置添加物质到蛋白质滴。
通过原位dl 数据实现了结晶降的独特反馈控制操作, 可以在整个实验过程中显示蛋白质寡聚状态的可能变化。该技术允许不断地评估粒度分布随着时间的推移, 从而揭示未知的蛋白质相关机制。dl 光学设备在战略上被放置在盖玻片区域之下, 允许探测器和激光束通过盖玻片和进一步通过蛋白质滴在原位方式;因此, 只有雾滴中的变化才会从 dl 路径中记录下来。为了便于处理, 该设备有两个开口: 一个前门为最佳定位的盖玻片和一个顶盖, 可以删除, 使用户可以调整的射击位置的微剂量系统, 以及设置与准确性一个新的蛋白质 droplet 在盖玻片上。
采用上述装置的交互式结晶方法是一种可靠的蛋白质晶体生产技术。虽然目前有许多结晶方法可供选择, 但内部关于结晶机理的信息并不容易实现。一般而言, 应用传统的结晶方法只允许在结晶相图中对溶液进行有限的控制, 只有在实验开始后才可能改变其航向。在进行结晶实验的同时, 应用这种自动结晶技术与原位dl 结合, 在相图中获得了大量关于过渡的知识。一般情况下, 在相图中, 产生无定形沉淀的区域和均匀成核的诱导是相互接近的。因此, 通过根据粒子分布的实时信息来操作结晶液滴过程, 可以通过逐步调整结晶条件向成核, 避免蛋白质沉淀, 并晶体形成。
目前, 许多结晶条件包括聚乙二醇 (PEG) 衍生物广泛存在的沉淀溶液。这种化合物通常具有高粘度, 可以吹打或配药困难。在本例研究中, 用于沉淀配药的微剂量系统应用非常薄的毛细血管, 使增加的 picolitre 增量成为可能。因此, 在使用高粘性物质方面存在一些局限性。在一系列过去的实验中, 该系统使用以下 PEG 衍生物得到了积极的结果: PEG200 50%, PEG3000 20%, PEG6000 10%, PEG800010%。虽然到目前为止只有上述的解决方案被测试, 微剂量系统包含一个特殊的加热机制, 可以使用, 以减少溶液的粘度。另一个因素是盐溶液, 必须考虑时, 作为蛋白质沉淀。在使用高浓度盐的情况下, 少量能在微剂量系统的喷嘴上结晶, 导致微泵在沉淀添加时的表面堵塞;即使在实验室中存在非常高的相对湿度。为了克服这个问题, 实验需要被搁置, 这样喷嘴中的盐才能被除去。这可能需要特殊处理, 并且可能在沉淀添加阶段产生错误。
根据在进行这种自动结晶实验时可以获得的宝贵信息, 这项技术也可以推广到研究蛋白质结晶物理化学方面。其成核和晶体生长反应速率是基于温度、粒径生长、蛋白质和沉淀等实验所描述的时间依赖性信息, 可以推导和计算的动力学现象。浓度。
披露声明
我们特此声明, 作者阿恩迈尔, 卡斯滕迪克斯和基督徒 Betzel 是公司的股东晶概念 GmbH, XtalController900 技术的生产商。
致谢
作者从欧洲联盟的地平线2020研究和创新计划的资助, 在玛丽玛丽·斯卡洛多斯卡·居里-居里缩写 "X 探针" 赠款协议637295号和支持通过 BMBF 赠款05K16GUA 和 "汉堡中心为超快成像-原子尺度上的物质结构、动力学和控制 "德意志 Forschungsgemeinschaft (DFG) 卓越的集群"。
材料
| Name | Company | Catalog Number | Comments |
| Thaumatin from Thaumatococcus daniellii | Sigma-Aldrich | 1002365940 | Protein for protocol |
| Bis-Tris 14880 | Sigma-Aldrich | 2302377 | Buffer for protein solution |
| di-Sodium tartrate dihydrate | AppliChem | A0451,0500 | Precipitant for protein solution |
| Silliconized coverslips | Heinz Herenz Medizinalbedarf GmbH | 1051203 | Coverslips for crystallization |
| Syringe filter | Starstedt | 831826001 | Filter pore 0.2 µm |
| Syringe | Omnifix | 4617207V | Luer Lock Solo 20 mL |
| Paraffin oil | Sigma-Aldrich | 2323842 | Oil for coating the plate |
| Standard Terakasi plate | Sigma-Aldrich | M5812270EA | Plate for recovering the crystallization droplet |
| Soft wipes | KIMTECH Science | ||
| XtalController900 | Xtal-Concepts GmbH | XTC900 | Crystallization device |
参考文献
- . . Patent "Vorrichtung und Verfahren zur Kontrolle der Kristallisation". , (2010).
- Chapman, H. M., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcuselongatus as a model system. Philos. Trans. R. Soc. Lond. B Biol. Sci. 369 (1647), 20130316 (2014).
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (2052-2525), 246-255 (2015).
- Stevenson, H. P., et al. Use of transmission electron microscopy to identify nanocrystals of challenging protein targets. Proc. Natl. Acad. Sci. U.S.A. 111 (23), 8470-8475 (2014).
- Meyer, A., et al. Single-drop optimization of protein crystallization. Acta. Crystallogr. Sect. F. Biol. Cryst. Commun. 68 (Pt 8), 994-998 (2012).
- Ferré-D'Amaré, A. R. . Crystallization of Biological Macromolecules. 5 (7), 847-848 (1999).
- Asherie, N. Protein crystallization and phase diagrams. Methods. 34 (3), 266-272 (2004).
- Sauter, C., Lorber, B., Kern, D., Cavarelli, J., Moras, D., Giege, R. Crystallogenesis studies on yeast aspartyl-tRNAsynthetase: use of phase diagram to improve crystal quality. Acta. Cystallogr. D. Biol. Crystallogr. 55 (Pt 1), 149-156 (1999).
- Ewing, F., Forsythe, E., Pusey, M. Orthorhombic lysozyme solubility. Acta. Crystallogr. D. Biol. Crystallogr. 50 (Pt 4), 424-428 (1994).
- Saridakis, E. E. G., Steward, P. D. S., Lloyd, L. F., Blow, D. M. Phase diagram and dilution experiments in the crystallization of carboxypeptidase G2. Acta. Crystallogr. D. Biol. Crystallogr. 50 (Pt 3), 293-297 (1994).
- McPherson, A., Cudney, B. Optimization of crystallization conditions for biological macromolecules. Acta. Crystallogr. F. Struct. Biol. Commun. 70 (Pt 11), 1445-1467 (2014).
- Sleutel, M., Van Driessche, A. E. S. Role of clusters in nanoclassical nucleation and growth of protein crystals. Proc. Natl. Acad. Sci. USA. 111 (5), 546-553 (2014).
- Schubert, R., Meyer, A., Baitan, D., Dierks, K., Perbandt, M., Betzel, C. Real-time observation of protein dense liquid cluster evolution during nucleation in protein crystallization. Cryst. Growth Des. 17 (3), 954-958 (2017).
- Vekilov, P. G. The two-step mechanism of nucleation of crystals in solution. Nanoscale. 2 (11), 2346-2357 (2010).
- Vekilov, P. G. Dense liquid precursor for the nucleation of ordered solid phases from solution. Crystal Growth & Design. 4 (4), 671-685 (2004).
- Dierks, K., Meyer, A., Einspahr, H., Betzel, C. Dynamic light scattering in protein crystallization droplets: adaptations for analysis and optimization of crystallization processes. Cryst. Growth Des. 8 (5), 1628-1634 (2008).
- Schubert, R., et al. Reliably distinguishing protein nanocrystals from amorphous precipitate by means of depolarized dynamic light scattering. J. Appl. Cryst. 48, 1476-1484 (2015).
- Brown, W. . Dynamic light scattering: the method and some applications. , 978 (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。