Method Article
Crescimento de cristais de proteína com dimensões distintas usando automatizado cristalização juntamente com In Situ Difusão dinâmica da luz
Neste Artigo
Resumo
Aqui nós apresentamos um protocolo para a produção controlada de microcristais de proteína. O processo usa um dispositivo automatizado permitindo manipulação controlada de vários parâmetros de cristalização. A cristalização de proteínas é realizada pela adição de automatizado e controlada de soluções de cristalização ao monitoramento e investigar a distribuição de raio de partículas em gota a cristalização.
Resumo
O dispositivo automatizado cristalização é uma técnica patenteada1 especialmente desenvolvido para monitorar experimentos de cristalização de proteínas com o objetivo de manobrar precisamente a nucleação e crescimento de cristais no sentido desejados tamanhos de cristais de proteína. A cristalização controlada baseia-se na investigação de amostra com em situ espalhamento dinâmico de luz (DLS), enquanto todas as alterações visuais da gota são monitoradas on-line com a ajuda de um microscópio acoplado a uma câmera CCD, permitindo assim uma completa investigação sobre as gotículas de proteína durante todas as fases de cristalização. O uso de em situ DLS as medições ao longo de todo o experimento permite uma identificação precisa da solução da proteína altamente supersaturada em transição para uma nova fase – a formação de núcleos de cristal. Identificando a fase de nucleação de proteína, a cristalização pode ser otimizada de cristais de proteína grande para a produção de proteína microcristais. O protocolo experimental mostra uma cristalização interativa abordagem baseada em etapas automatizadas precisas, tais como adição precipitant, a evaporação da água para induzir supersaturação elevada, e diluição de amostra para abrandar induzido nucleação homogênea ou transições de fase de inversão.
Introdução
Nos últimos anos, o crescimento da proteína micro e nanocristais capturou a atenção da comunidade de cristalografia de proteínas, especialmente com o desenvolvimento contínuo de cristalografia de femtossegundo Serial (SFX). Devido o brilho dos raios x romance radiação fontes e baseia os bons resultados obtidos até o momento, a produção de proteína microe nanocristais tornou-se de alta relevância, posando uma alta demanda na preparação de tais suspensões de cristalinas 2 , 3. devido ao cristal pequeno tamanho-alcance necessário para coleta de dados em lasers de elétron livre (XFELs) e a disponibilidade limitada de beamtime experimental, caracterização da amostra antes da coleta de dados é essencial. As técnicas mais comuns para caracterizar suspensões de micro - ou nanocrystal de proteína são até agora a microscopia eletrônica e difração de raios x.
Até agora, várias abordagens foram adaptadas de métodos comuns de cristalização com o objetivo de produzir quantidades em massa de cristais de proteína com dimensões na faixa de micrômetro pequeno. O método de lote é usado para a mistura rápida de alta proteína concentrada e soluções precipitantes, obrigando a solução da amostra para uma fase altamente supersaturada onde nanocrystallization pode ser favorecido4. Outros métodos incluem o esmagamento de cristais de proteína grande para formar uma pasta de cristal, que pode servir como suspensões nanocristalina deve ser usado para dados de coleção5. No entanto, os resultados às vezes podem resultar em qualidade de diminuição da difração, como cristais deteriorados tem baixa ordem interna. Nanocrystallization baseado na difusão de interface livre também é uma alternativa disponível, onde a solução de proteína é adicionada em pequenas quantidades a uma solução altamente concentrada precipitantes3. No entanto, entre todas as técnicas, os métodos mais eficazes parecem ser a cristalização de lote e mais inovadoras técnicas manipulativas, usando métodos de difusão de vapor em sentado gotas6.
Em geral, para a cristalização de uma proteína, uma barreira de energia deve ser atravessada para oferecer suporte a nucleação - o primeiro passo termodinâmico na formação de cristais. Para mover a solução da proteína de um estado termodinamicamente estável a supersaturação e finalmente para induzir uma fase de transição, algumas variáveis relacionadas à solução da proteína precisam ser modificado. Essas variáveis são, geralmente, a concentração da solução da proteína, mudanças ambientais (ex., temperatura, umidade), características de solventes (por exemplo, pH, força iônica), concentração e buffer Propriedades, etc.7 ,8 , uma visão geral dos parâmetros de amostra que pode ser mudada normalmente é representada por meio de diagramas de fases, que permitem diferentes modos de apresentação, tais como diagramas de solubilidade, diagramas de fase de nucleação ou ainda mais detalhada descrições onde diagramas tridimensionais ou mais complexos podem entram em consideração8,9,10. Os tipos mais atraentes de diagramas de fase são geralmente bidimensionais, onde a principal variável é a concentração de proteína em função de um outro parâmetro, enquanto os restantes parâmetros são mantidos constante6,11. Uma vez que um ou alguns núcleos são formados, cristais maiores podem crescer tomando proteínas adicionais da solução em massa. Quando apontando para produção de micro e nanocrystal, uma abordagem convencional de cristalização não é viável mais, devido ao pequeno número de Cristais presentes na solução. Nanocristalina suspensões geralmente tem que ser rico em entidades cristalinas, assim, que o caminho de cristalização tem de ser reajustado, tal que existe uma maxima de eventos de nucleação presentes na amostra. Em consequência, isto requer a investigação de alguns novos, até vias de nucleação agora inexplorado para proteínas, que também ainda não são totalmente compreendidos12,13. Baseia-se nos fundamentos de diagrama de fase mencionados anteriormente, a teoria clássica foi estendida para uma nova hipótese, onde nucleação é descrita como um mecanismo em duas fases: na primeira, uma transição para uma maior concentração de proteína ocorre (líquido denso fase) e a segunda, uma transição de uma fase densa-rico para uma maior ordem interna (núcleos de cristal com arquitetura de retículo)14,15,16. Cristalização de proteínas é sensível a muitos fatores, e, portanto, quando receitas de cristalização são reajustadas para resultar em cristais de tamanhos diferentes, as receitas não podem sempre depender de conhecimentos prévios. Novas perspectivas devem ser estabelecidas para cada destino de proteínas individuais: ajuste de composição do tampão, a pureza e a estabilidade do conhecimento preciso, amostra do solubility de proteína, etc.
Difusão dinâmica da luz é hoje um método bem estabelecido para análise e otimização de processos de cristalização de proteínas, devido a uma ampla gama de tamanho de partículas que podem ser investigados: das proteínas monoméricas de nanocristais e microcristais pequeno. O método explora que partículas em solução sofrem movimento browniano e que a velocidade média deste movimento é determinada pelo tamanho da partícula, sua energia térmica e pela viscosidade do meio e a geometria das partículas. No começo, o meio líquido é iluminado por uma fonte de luz coerente com o uso de um laser. A luz espalhada por partículas está formando um padrão de interferência. Porque as partículas estão em permanente movimento o padrão de interferência também altera permanentemente. Quando olhando em uma determinada direção, flutuações de intensidade podem ser observadas. Estas flutuações são agora mostrando o movimento de partículas causado pelo movimento browniano. Partir as flutuações de intensidade medido é calculada uma função de autocorrelação (ACF). Uma análise do ACF dará uma medida para a distribuição de velocidade (mais precisamente, o coeficiente de difusão) de partículas e usando a equação de Einstein-Stokes, é convertido em um raio de partículas distribuição17. Informações adicionais relacionadas com a funcionalidade DLS e princípio de funcionamento podem ser encontradas em diversas publicações e livros18,19.
Aqui nós aplicamos e descrever um dispositivo exclusivo cristalização automatizada, o XtalController900, uma versão atualizada do XtalController tecnologia6, precisamente desenvolvido para monitorar experimentos de cristalização de proteínas interativo. Esta técnica mostra um alto potencial para identificação e monitoramento de eventos de nucleação em tempo real, permitindo uma precisa manobrar através do diagrama de fase de cristalização. O objectivo deste procedimento de cristalização particular é otimizar a cristalização de proteínas para obter micro de proteína de alta qualidade - e nanocristais que são adequados para aplicações utilizando fontes de raio-x de foco micro síncrotron, difração de elétrons, ou SFX.
Protocolo
Nota: Em todo o protocolo inteiro, o sistema de microdosagem utilizado para adição de água será referido como Pump0 enquanto o sistema de microdosagem utilizado para adição de dessensibilizador será chamado Pump1. Os resultados desta experiência serão ainda mais discutidos e conhecidos como THM2_micro-cristais.
1. parâmetros e configuração da solução
- Filtro 16 mL de solução de tartarato-at (1.2 M) e 16 mL de água destilada, usando um filtro de seringa estéril de 0,2 µm.
Nota: A solução de tartarato-at representa a solução precipitant para o experimento de cristalização. - Encha o dessensibilizador e garrafas de água com 5 mL das soluções filtradas.
Nota: As garrafas têm uma capacidade máxima de 5 mL. - Monte as garrafas nos suportes da bomba da câmara experimental.
- Definir os parâmetros experimentais na janela do software para os seguintes valores: temperatura de 20 ° C, umidade relativa, em 20 e solvente como água.
Nota: A Figura 2 mostra a janela de exibição onde o usuário pode inserir os valores corretos para cada parâmetro como temperatura, umidade relativa e solvente. A janela do software mostra também alguns parâmetros adicionais, tais como aditivos. Isso é importante só para experiências onde aditivos estão presentes na solução precipitant. - Abra a porta da frente da câmara experimental e remover o portador da lamela.
- Coloque uma lamínula limpa e siliconizada sobre a transportadora e colocá-lo de volta no dispositivo.
Nota: A lamela tem um tamanho de 2,2 cm. - Feche a câmara experimental para assegurar as condições ambientais da etapa 1.4.
Nota: O protocolo pode ser pausado aqui.
2. ajuste de sistemas microdosagem
- Interruptor ON Pump0 usando as principais características de bomba na Figura 3 e criar um fluxo de água.
Nota: A trajetória do fluxo de água é criada com base em algumas características da bomba que podem ser ajustadas. A Figura 3 mostra as características principais da bomba e os valores ideais que devem ser usados para este experimento. - Ajuste o fluxo de água com o objetivo de posição em direção ao centro da lamela acionando manualmente seu parafuso de ajuste designado. Interruptor fora Pump0.
- Interruptor ON Pump1 e criar uma corrente de líquido como anteriormente feita no passo 2.1. Ajuste a posição do fluxo de Pump1 no sentido da posição fixada para Pump0. Interruptor fora Pump1.
- Substitua a lamela usada por uma nova e limpa para o experimento de cristalização.
Nota: Toalhetes suaves são geralmente recomendados para limpeza nova lamela do pó residual, antes de serem utilizados no experimento de cristalização.
3. definindo uma gota de Taumatina na câmara Experimental
- Crie um novo arquivo experimental usando o pacote de software. Insira as seguintes informações no arquivo experimental: proteína (Taumatina de Thaumatococcus daniellii), concentração de proteínas (14 mg/mL), dessensibilizador (at-tartarato) e concentração precipitant (1.2 M).
Nota: Esta informação servirá para cálculos automáticos de concentração dessensibilizador e proteína durante o experimento de cristalização. - Carrega o novo arquivo de experimento para ativar todas as informações do passo 3.1.
- Marque a posição da gotículas de proteína, adicionando uma gota de água pequeno usando Pump0.
Nota: O objectivo é criar uma gota de água pequeno que irá servir como um marco em que a amostra de proteína será colocada. - Pressione o botão Tare para definir o peso dado pela micro-balança para zero.
Nota: Isto irá remover o peso da lamela e o peso extra adicionado pelo Marco de água pequeno criado na etapa 3.3. - Abra a tampa superior da câmara experimental e pipetar 8 µ l de solução de Taumatina sobre o marco de água.
- Registre a nova queda de Taumatina, seguindo os próximos comandos.
- Pressione o botão nova queda para as condições iniciais de atributo do arquivo experimental.
- Pressione o botão Const para compensar a evaporação natural da água da gota.
- Verifique com a câmera do CCD se Pump0 está apostado no drop-proteína. Reajuste a posição do Pump0 se o fluxo de água é com o objetivo fora da gota.
Nota: A partir deste momento em diante, as gotículas de proteína permanecerá em um peso constante, por adição de água automatizado que compensa a evaporação da água natural das gotículas de proteína. O peso da gota de proteína, bem como outros parâmetros tais como temperatura e umidade relativa do ar pode ser monitorado em tempo real usando a janela de exibição. O experimento pode ser pausado aqui.
4. in Situ DLS medições
- Interruptor sobre as DLS do laser e coloque o feixe de laser no drop-proteína manualmente usando os parafusos de ajuste.
- Insira os seguintes parâmetros DLS: duração de medição (60 s), tempo de espera entre duas medições (10 s) e o número de medições (300).
Nota: As primeiras 30 medições servirá como referência as medições para verificação de estabilidade da proteína. O resto das medições vai servir como uma investigação completa de gotículas de proteína durante o comprimento total do processo de cristalização. - Pressione o botão Iniciar para iniciar as medições de DLS. Verifica a qualidade da amostra, selecionando uma das representações gráficas DLS.
Nota: A amostra deve mostrar um alto grau de mono-dispersity, sem qualquer agregados na solução. Os resultados DLS podem ser mostrados e ler como: distribuição de raio, histograma de raio, trama do raio, medições resumidas, ou como uma visão geral sobre a intensidade de taxa de contagem.
5. amostra evaporação passo
- Insira as condições para a etapa de evaporação na tabela de programação usando os dados mostrados na tabela 1.
Nota: O sinal "-" introduzida na coluna "Molaridade/percentagem" na segunda linha representa uma perda de água das gotículas de proteína, enquanto o valor "25" significa que o volume da gota sofrerá uma redução de 25%. Isto significa que a concentração de proteína de gota aumentará 25%. - Ative a etapa de evaporação de amostra, pressionando o botão Autom. Pressione o botão parar quando tiver terminado a etapa de evaporação de amostra.
- Ative o botão Const para manter a queda constante depois de parar a evaporação da amostra.
6. precipitantes adição passo
- Insira as condições para a etapa de adição precipitantes na tabela de programação mostrada na Figura 4 , usando os dados fornecidos na tabela 2.
Nota: A primeira linha da tabela representa uma etapa de calibração, durante o qual o software calcula a taxa de evaporação natural da gotículas de proteína com base na quantidade de dessensibilizador que tem de ser adicionado para a gota de proteína. O software extrapola esse valor e automaticamente ajusta a frequência de disparo para Pump0 para compensar automaticamente a evaporação de água para a próxima etapa de adição precipitantes. - Ative a etapa de adição precipitantes pressionando o botão Autom.
Nota: A adição de dessensibilizador é um processo automatizado, após a entrada da tabela de agendamento.
7. acompanhamento da evolução da gota a cristalização ao longo do tempo
- Verifique a aparência dos cristais Taumatina usando a câmera do CCD.
- Verificar a distribuição de tamanho de partícula usando as representações gráficas de DLS.
- Verificar a evolução do peso e parâmetros experimentais usando a janela de exibição.
Nota: Quando a solução de tartarato-at atinge uma concentração de 0,74 M no drop-proteína, a gota torna-se rica em microcristais de Taumatina como visto na Figura 7.
8. recuperação de cristalização da gota
- Casaco um prato limpo padrão de Terasaki com óleo de parafina.
- Adicione 3 mL de óleo de parafina à placa.
- Disperse o óleo de parafina sobre os poços da placa movendo suavemente a placa em ângulos diferentes para que o óleo cobre todos os 72 poços da placa.
- Retire o excesso de óleo de parafina, deitando fora o óleo que flutua sobre a placa.
- Pressione o botão parar para terminar o experimento de cristalização. Retire cuidadosamente o transportador de amostra contendo o droplet de cristalização.
- Com o uso de uma pipeta, coloca um volume de 2 alíquotas µ l da gota cristalização dos poços da placa de Terasaki.
Nota: Recuperando a gota de cristalização em uma placa com óleo, a amostra pode ser periodicamente verificada de estabilidade e crescimento de cristal com o uso de um microscópio ou outras técnicas DLS que trabalham com as placas Terasaki.
Resultados
Os resultados obtidos através de medições de DLS durante o experimento de cristalização mostram uma evolução detalhada dos raios de partículas hidrodinâmica, resultando em duas fracções de distribuição principal partícula, que se desenvolvem ao longo do tempo. Na primeira parte do experimento, a amostra foi lentamente evaporou-se, a fim de alcançar uma maior concentração de proteína. Como mostrado na Figura 5B, a redução de proteína foi concentrada de 14 mg/mL para 19,5 mg/mL. Durante este tempo, de acordo com o padrão de distribuição do raio na Figura 5A, a proteína mostra um comportamento monomérico em solução com uma constante de granulometria de aproximadamente 2,5 nm. Como a amostra está sendo mais evaporada, a proteína monomérica permanece estável em solução, sem sinais de desnaturação ou agregação de amostra.
A adição de solução precipitant para a queda de proteína é imediatamente iniciada após evaporação da amostra e destaque com cinza nas distribuição padrão e equilíbrio curvas de raio para melhor visualização (Figura 5). Com base em cálculos derivados o peso de amostra, a fração de partículas realçado é atribuída a iniciação de nucleação de cristal, resultando em um tamanho de raio de aproximadamente 200-400 nm. Este fenômeno (conhecido como nucleação) é iniciado em uma concentração precipitant de 0,6 M na gotículas de proteína, em um período de tempo de cerca de 66 min desde o início do experimento e aproximadamente 23 min em relação ao início do dessensibilizador Além disso. Como a concentração do precipitantes aumenta, a distribuição de raio mostra uma ampla distribuição de partículas em solução. Como formar mais núcleos, a inicial cristalina entidades estão crescendo em tamanho, alcançando uma distribuição de raio entre 800-1.300 nm. Pode concluir-se que, nesta fase, os núcleos de cristal continuam a crescer, e a fração proteica é tornando-se gradualmente mais pobre como as moléculas de proteína são tomadas por microcristais. Como a concentração precipitant no drop-proteína aumenta lentamente, a formação de microcristais é identificada facilmente depois de 75 min, quando a distribuição de raio continua a desenvolver-se entre 500 e 1.500 nm. A evolução da distribuição do raio é também confirmada por imagens da câmera CCD, onde microcristais de proteína são visíveis em uma concentração precipitant de 0,7 M em solução (Figura 7). Como a adição de precipitant está terminada e a queda de cristalização é mantida constante, a distribuição de raio mostra uma fase predominante entre 1.000 e 3.000 nm, enquanto a fração dos eventos de nucleação diminui ao longo do tempo. Neste momento, a queda de cristalização está totalmente saturada com microcristais e não há mais eventos de nucleação estão presentes na solução.
Um diagrama de fase de cristalização usando como entrada experimental os dados de feedback dados pela micro-balança, foi desenhado para uma compreensão abrangente do processo de cristalização de Taumatina. Na Figura 6, o diagrama de fase experimental mostra três experimentos de cristalização independente, onde a produção de Taumatina T. danielli microcristais é rotulada como Microcristais de THM_2 (protocolo). Dois experimentos de cristalização adicional rotulado THM_1 Macrocristais e THM_3 Macrocristais têm sido usados como dados de entrada a fim de ter um mapeamento correto das diferentes áreas no diagrama de fases (EG., solubilidade ou região metaestável). Já que os protocolos para estas experiências seguem caminhos diferentes de cristalização, a identificação da região de nucleação torna-se mais fácil e, portanto, mais precisos. Para cada experimento, o caminho de cristalização é realçado pelos números de ordem para enfatizar as diferentes abordagens e o número de etapas de cristalização que foram usados para um resultado específico, enquanto as setas cinzas representam uma estimativa da proteína final concentração quando moléculas de proteína de entrada do cristal crescimento da solução na formação de bem definida estável de cristais de proteína.
Os três experimentos de Taumatina apresentados na Figura 6 mostram diferentes condições ao entrar na região de nucleação, e resultados de cristalização final diferente, portanto, como podem ser vistos pelas fotos abaixo o diagrama de fase. No caso de THM1 e THM3, a solução da proteína passa a fase de nucleação e re-entra a região metaestável, onde repousa até formar cristais. Consequentemente, as experiências levam a grandes e bem definidas em forma de cristais rodeados por licor de mãe. No entanto, para o experimento apresentado na seção de protocolo, THM2_micro-cristais, o caminho de cristalização segue uma abordagem particular. Em uma seção anterior mencionamos que para uma amostra dar microcristais, solução da proteína tem de estar localizado na fase de nucleação, para que os eventos de nucleação podem dar forma a uma taxa máxima. No caso de THM2_micro-cristais, a proporção de proteína a concentração precipitant foi ajustada de tal forma que a amostra entra não só a região de nucleação, mas como um dessensibilizador adicional é adicionado à solução da proteína, e as condições não se move para outra região no diagrama de fase, mas permanecem em um estado altamente supersaturado dentro da região de nucleação. Como resultado, a entropia da solução diminui drasticamente à medida que as gotículas de proteína imediatamente se torna saturada com pequenas entidades cristalinas.
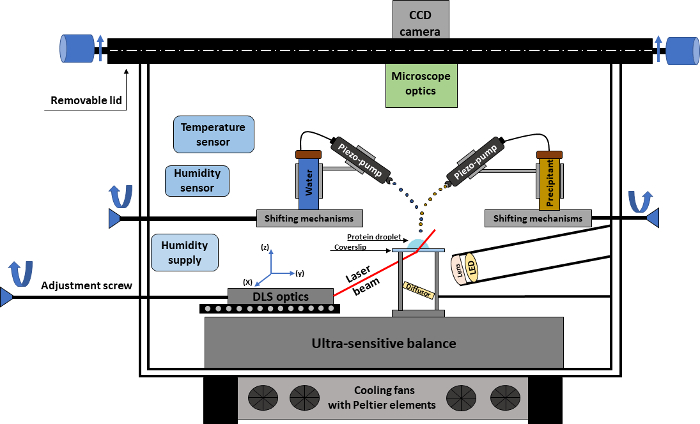
Figura 1. Representação esquemática da experiência cristalização. O desenho mostra uma visão geral da câmara experimental de cristalização com todas as peças técnicas necessárias para a realização de um experimento de cristalização automatizada. Clique aqui para ver uma versão maior desta figura.
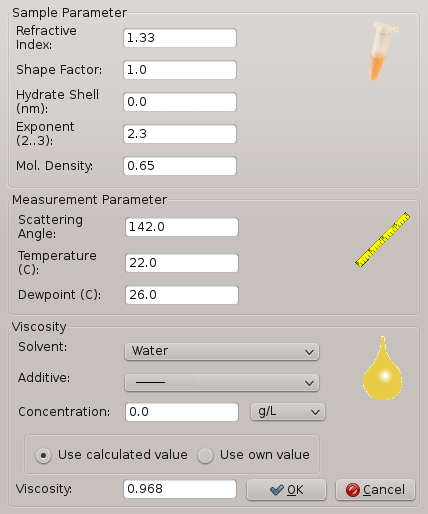
Figura 2: janela de Software para DLS e parâmetros de amostra que são relevantes para um experimento de cristalização. Parâmetros incluem a temperatura, umidade relativa, viscosidade, etc.
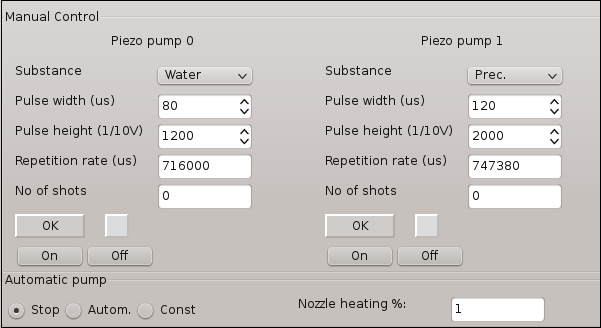
Figura 3: janela de controle de Software para os sistemas de microdosagem envolvidos no experimento cristalização. As características permitem o ajuste de parâmetros específicos para a geração de gotículas ou fluxo de solução.
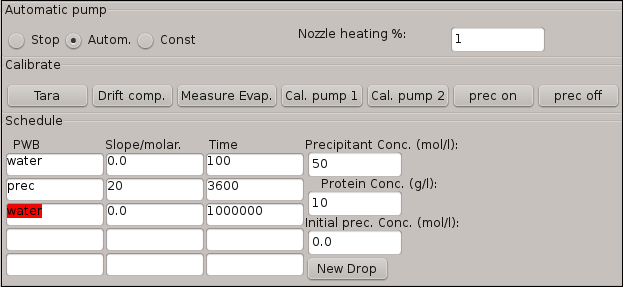
Figura 4: janela de Software para a tabela de agendamento, descrevendo as etapas de cristalização envolvidas no experimento. As condições iniciais da gota a cristalização também são integradas nessa janela.
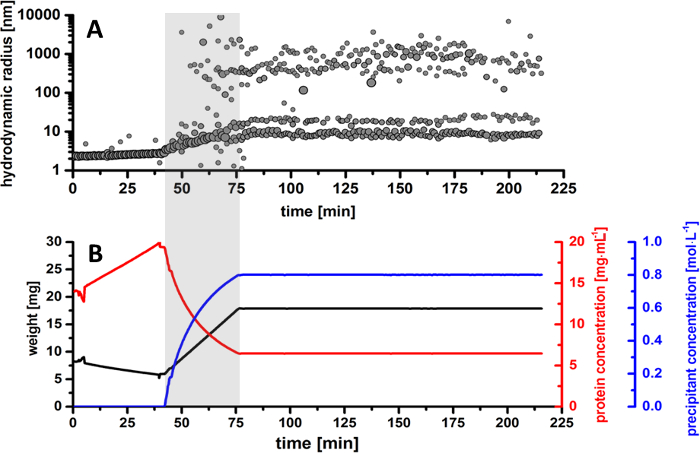
Figura 5. Visão geral de Taumatina daniellii T. produção de microcristais. (A) distribuição de raio do tamanho de partícula no drop-proteína durante o processo de cristalização inteira. (B) monitoradas visão geral dos parâmetros experimentais. As parcelas representam a evolução ao longo do tempo para o peso da gota a proteína (curva preta) juntamente com a concentração de proteína calculada (curva vermelha) e a concentração precipitant (curva azul). Clique aqui para ver uma versão maior desta figura.
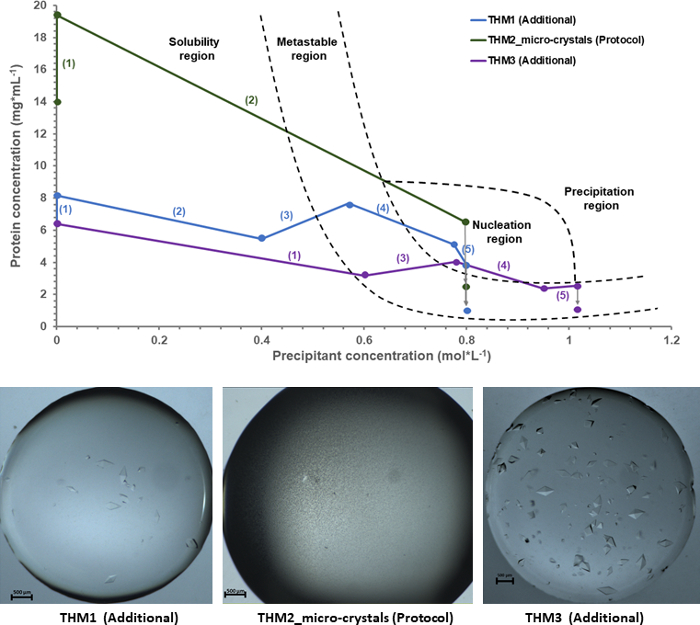
Figura 6: diagrama de fase Experimental cristalização por Taumatina danielli T. juntamente com os resultados resultantes. Todos os lotes são derivados de dados experimentais, baseados na informação do gabarito dada pela micro-balança. Os números atribuídos a cada experimento que são visíveis entre colchetes representam a ordem e o número de passos dados durante um protocolo de cristalização. Clique aqui para ver uma versão maior desta figura.

Figura 7: fotografia gravada para THM2_Micro-cristais (protocolo) mostrando um número abundante de microcristais saturado em solução. A foto foi tirada às 4h (240 min) depois de definir as gotículas de proteína na câmara experimental para cristalização. Clique aqui para ver uma versão maior desta figura.

Figura 8: fotografia gravada para THM_1 Macrocristais mostrando alguns cristais de grande Taumatina estável em solução. A foto foi tirada 20 h após a configuração da gota de proteína na câmara experimental para cristalização. Clique aqui para ver uma versão maior desta figura.

Figura 9: foto gravada para THM_3 Macrocristais mostrando vários tamanhos de Taumatina cristais na solução. A foto foi tirada 20 h após a configuração da gota de proteína na câmara experimental para cristalização. Clique aqui para ver uma versão maior desta figura.
| Substância | Molaridade/percentagem | Tempo (s) |
| água | 0 | 100 |
| água | -25 | 2100 |
| água | 0 | 2100 |
Tabela 1: Entrada de calendário automatizado para a evaporação da amostra passo na produção de microcristais de Taumatina.
| Substância | Molaridade/percentagem | Tempo (s) |
| água | 0 | 100 |
| prec | 0.8 | 1800 |
| água | 0 | 18000 |
Tabela 2: entrada de calendário automatizado para a adição de precipitant passo na produção de Taumatina microcristais.
Discussão
O dispositivo de cristalização é projetado para monitorar e manipular os parâmetros cruciais durante um experimento de cristalização, com base em um método modificado de difusão de vapor. Esta técnica permite monitoramento e marcando um experimento de cristalização de proteínas em todas as fases, permitindo que o usuário tenha conhecimento preciso e controle da solução da proteína durante todo o diagrama de fase de cristalização, com base em in situ análise DLS de suspensão da amostra.
O dispositivo de cristalização é composto por uma câmara experimental (Figura 1), conectada a uma câmera CCD que permite o monitoramento em tempo real da gota de cristalização. A câmara é adaptada a um microscópio equipado com lentes de ampliação diferentes, proporcionando uma resolução espacial máxima de aproximadamente 2,5 µm. O núcleo da câmara experimental é uma micro-balança ultra-sensível para acompanhar a evolução do peso da amostra ao longo do tempo. O processo de cristalização corresponde a um experimento de sessão soltar vapor-difusão, onde a queda de proteína é colocada sobre uma lamela siliconizada, que é colocada sobre a micro-balança. Com base nas alterações de peso da gota, que são causadas por adição precipitant, adição de água/aditivo ou evaporação da amostra, a micro-balança dá uma entrada precisa de um algoritmo para o cálculo imediato da concentração de proteína e dessensibilizador ao longo do tempo . Além disso, os parâmetros importantes de cristalização, tais como temperatura e umidade relativa são precisamente monitorados e controlados.
Para executar um experimento de cristalização, o dispositivo é equipado com dois sistemas de microdosagem (contato livre bombas piezoelétricas) que trabalham em uma escala de picoliter para adição dessensibilizador e água. Trabalhando com essas pequenas quantidades de substância, os gradientes de concentração e o fenômeno de convecção dentro da gota de proteína são minimizados. O principal papel das bombas piezoelétricos é a adição de água, este último, por exemplo, sendo usado como compensação pela evaporação natural das gotículas de proteína ou dessensibilizador. Os sistemas de microdosagem têm um conjunto de recursos, que pode ditar a adição de uma substância. Tais características incluem: a taxa de repetência para a adição de uma substância, o número de gotas adicionado por segundo, a largura e a altura da trajetória de fluxo de substância, etc. Além disso, a posição das bombas pode ser manualmente ajustada, permitindo que o usuário tenha uma posição precisa para adição de substâncias na gotículas de proteína.
A manipulação de exclusivo gabarito controlado da gota cristalização é conseguida em situ DLS dados, que podem mostrar as possíveis alterações no estado de proteínas oligoméricas ao longo de todo o procedimento experimental. A técnica permite a avaliação constante da distribuição granulométrica ao longo do tempo, revelando mecanismos desconhecidos relacionados com proteína. O equipamento de ótica DLS é colocado estrategicamente abaixo da área de lamela, permitindo que o feixe de laser e detector passar através da lamela e ainda mais através da gota de proteína de forma em situ ; Portanto, apenas alterações dentro da gota são constituídas a partir do caminho DLS. Para permitir fácil manuseio, o dispositivo tem duas aberturas: uma porta para um posicionamento ideal da lamela e uma tampa superior, que pode ser removida, para que o usuário pode ajustar a posição de tiro dos sistemas microdosagem, bem como definir com precisão uma nova proteína dro PLET na lamela.
O método de cristalização interativos usando o dispositivo acima mencionado é uma técnica confiável para a produção de tamanho controlado de cristais de proteína. Embora muitos métodos de cristalização estão atualmente disponíveis, informações sobre a cristalização mecanismo em si não é facilmente alcançável. Em geral, aplicação de métodos convencionais de cristalização permite apenas controle limitado de uma solução no diagrama de fases de cristalização, com apenas algumas possibilidades de mudar seu curso, depois que um experimento foi iniciado. Ao executar uma cristalização experimentar e aplicando tal uma tecnologia automatizada de cristalização juntamente com em situ DLS, uma grande quantidade de conhecimento é adquirida sobre transições no diagrama de fase. Em geral, as regiões, resultando em precipitado amorfo e a indução de nucleação homogênea estão próximos uns dos outros no diagrama de fase. Portanto, manipulando-se o curso de uma gotícula de cristalização, com base em informações em tempo real sobre a distribuição de partículas, é possível evitar a precipitação de uma proteína, gradualmente, ajustando as condições de cristalização para nucleação e formação de cristais.
Hoje em dia, muitas condições de cristalização incluem soluções precipitantes onde derivados de polietileno glicol (PEG) estão amplamente presentes. Tais compostos geralmente têm uma alta viscosidade que pode possuir dificuldades para pipetagem ou dispensação. O presente estudo de caso, os sistemas de microdosagem que são utilizados para a distribuição precipitantes aplicam capilares muito finos que possibilitam a adição dos incrementos de picolitre. Como consequência, há algumas limitações no trabalho com substâncias altamente viscosas. Dentro de uma série de experiências passadas, o sistema tem dado resultados positivos usando os seguintes derivados PEG: PEG200 50%, PEG3000 20%, PEG6000 10%, PEG800010%. Embora até agora somente as soluções acima mencionadas foram testadas, os sistemas de microdosagem contêm um mecanismo especial de aquecimento que pode ser usado para diminuir a viscosidade de uma solução. Outro fator é a soluções de sal que devem ser considerados quando usado como precipitantes de proteínas. Quando se trabalha com sais altamente concentrados, uma pequena quantidade pode cristalizar no bocal do sistema de microdosagem, causando bloqueio superficial da microdosagem bomba durante adição precipitant; mesmo quando muito alta humidade relativa está presente na câmara experimental. Para superar esse problema, o experimento precisa ser colocado em espera para que o sal do bocal pode ser removido. Isto pode exigir um tratamento especial e pode produzir erros na fase de adição precipitantes.
Com base nas informações valiosas que podem ser alcançadas quando realizando tais experimentos de cristalização automatizada, esta técnica também pode ser estendida para estudos investigando os aspectos físico-química de cristalização de proteínas. As taxas de reação de crescimento de nucleação e cristal são fenómenos cinéticos, que podem ser derivados e calculados com base na dependência do tempo informação retratada de um experimento como temperatura, crescimento de tamanho de partícula e proteína e precipitantes concentração.
Divulgações
Nós declaramos que os autores Arne Meyer, Karsten Dierks e Christian Betzel são acionistas da empresa Xtal-conceitos GmbH, produtor da tecnologia XtalController900.
Agradecimentos
Os autores reconhecem o financiamento do União Europeia Horizonte 2020 programa de pesquisa e inovação sob o Marie Sklodowska-Curie Acronym "X-sonda" Grant acordo n. º 637295 e suporte via BMBF concessão 05K16GUA e o "The Hamburgo centro para Ultrafast Imagem latente-estrutura, dinâmica e controle da matéria na escala atômica"cluster de excelência da Deutsche Forschungsgemeinschaft (DFG).
Materiais
| Name | Company | Catalog Number | Comments |
| Thaumatin from Thaumatococcus daniellii | Sigma-Aldrich | 1002365940 | Protein for protocol |
| Bis-Tris 14880 | Sigma-Aldrich | 2302377 | Buffer for protein solution |
| di-Sodium tartrate dihydrate | AppliChem | A0451,0500 | Precipitant for protein solution |
| Silliconized coverslips | Heinz Herenz Medizinalbedarf GmbH | 1051203 | Coverslips for crystallization |
| Syringe filter | Starstedt | 831826001 | Filter pore 0.2 µm |
| Syringe | Omnifix | 4617207V | Luer Lock Solo 20 mL |
| Paraffin oil | Sigma-Aldrich | 2323842 | Oil for coating the plate |
| Standard Terakasi plate | Sigma-Aldrich | M5812270EA | Plate for recovering the crystallization droplet |
| Soft wipes | KIMTECH Science | ||
| XtalController900 | Xtal-Concepts GmbH | XTC900 | Crystallization device |
Referências
- Xtal Concepts GmbH, Germany . Patent "Vorrichtung und Verfahren zur Kontrolle der Kristallisation". , EP 2 588 649 (11754824.8) and US 9,284,659 B2 (2010).
- Chapman, H. M., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcuselongatus as a model system. Philos. Trans. R. Soc. Lond. B Biol. Sci. 369 (1647), 20130316(2014).
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (2052-2525), 246-255 (2015).
- Stevenson, H. P., et al. Use of transmission electron microscopy to identify nanocrystals of challenging protein targets. Proc. Natl. Acad. Sci. U.S.A. 111 (23), 8470-8475 (2014).
- Meyer, A., et al. Single-drop optimization of protein crystallization. Acta. Crystallogr. Sect. F. Biol. Cryst. Commun. 68 (Pt 8), 994-998 (2012).
- Ferré-D'Amaré, A. R. Crystallization of Biological Macromolecules. 5 (7), Cold Spring Harbor Laboratory Press. 847-848 (1999).
- Asherie, N. Protein crystallization and phase diagrams. Methods. 34 (3), 266-272 (2004).
- Sauter, C., Lorber, B., Kern, D., Cavarelli, J., Moras, D., Giege, R. Crystallogenesis studies on yeast aspartyl-tRNAsynthetase: use of phase diagram to improve crystal quality. Acta. Cystallogr. D. Biol. Crystallogr. 55 (Pt 1), 149-156 (1999).
- Ewing, F., Forsythe, E., Pusey, M. Orthorhombic lysozyme solubility. Acta. Crystallogr. D. Biol. Crystallogr. 50 (Pt 4), 424-428 (1994).
- Saridakis, E. E. G., Steward, P. D. S., Lloyd, L. F., Blow, D. M. Phase diagram and dilution experiments in the crystallization of carboxypeptidase G2. Acta. Crystallogr. D. Biol. Crystallogr. 50 (Pt 3), 293-297 (1994).
- McPherson, A., Cudney, B. Optimization of crystallization conditions for biological macromolecules. Acta. Crystallogr. F. Struct. Biol. Commun. 70 (Pt 11), 1445-1467 (2014).
- Sleutel, M., Van Driessche, A. E. S. Role of clusters in nanoclassical nucleation and growth of protein crystals. Proc. Natl. Acad. Sci. USA. 111 (5), 546-553 (2014).
- Schubert, R., Meyer, A., Baitan, D., Dierks, K., Perbandt, M., Betzel, C. Real-time observation of protein dense liquid cluster evolution during nucleation in protein crystallization. Cryst. Growth Des. 17 (3), 954-958 (2017).
- Vekilov, P. G. The two-step mechanism of nucleation of crystals in solution. Nanoscale. 2 (11), 2346-2357 (2010).
- Vekilov, P. G. Dense liquid precursor for the nucleation of ordered solid phases from solution. Crystal Growth & Design. 4 (4), 671-685 (2004).
- Dierks, K., Meyer, A., Einspahr, H., Betzel, C. Dynamic light scattering in protein crystallization droplets: adaptations for analysis and optimization of crystallization processes. Cryst. Growth Des. 8 (5), 1628-1634 (2008).
- Schubert, R., et al. Reliably distinguishing protein nanocrystals from amorphous precipitate by means of depolarized dynamic light scattering. J. Appl. Cryst. 48, 1476-1484 (2015).
- Brown, W. Dynamic light scattering: the method and some applications. , Clarendon Press: Oxford. ISBN-13: 978-0198539421 978(1993).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados