Method Article
タンパク質結晶の成長を使用して異なる寸法自動結晶化その場の動的光散乱と相まって
要約
タンパク質の結晶化制御用プロトコルをご紹介します。プロセスは、いくつかの結晶化パラメーターの制御操作をできるように自動化されたデバイスを使用します。タンパク質の結晶化が行われてアウト監視および結晶化液滴の粒子径分布を調査しながら結晶化ソリューションの制御と自動添加による。
要約
自動結晶化装置は、特に核生成と所望のサイズに向かって蛋白質結晶の結晶成長を正確に操縦する目的でのタンパク質結晶化実験の監視のために開発特許取得済み技術1です。液滴のすべての視覚変更ができフル CCD カメラに結合された顕微鏡の助けを借りて、オンラインで監視しながら制御された結晶化がサンプル調査をその場で動的光散乱 (DL) に基づきます結晶化のすべての段階の間に蛋白質の液滴の調査。その場でDL 測定実験全体を通じて新しい相-結晶核の形成に移行高過飽和タンパク質溶液の正確な同定を使用します。タンパク質核形成の段階を識別することによって蛋白質微結晶の生産に、大規模なタンパク質結晶から結晶化を最適化できます。実験的プロトコルを示し、インタラクティブな結晶化誘発高過飽和の水分蒸発、沈殿等正確な自動手順に基づく減速のサンプル希釈による均一核生成や相転移を逆転させます。
概要
最後の数年間、蛋白質マイクロとナノ結晶の成長は、シリアル フェムト秒結晶構造解析 (特撮) の連続的な開発、特にタンパク質結晶構造解析コミュニティの注目を集めています。新規 x 線の輝きのため放射線源し、これまでのところ、得られた成功の結果に基づいて蛋白質マイクロ生産と関連性が高い、そのような結晶懸濁液の準備の需要が高いポーズ ナノ結晶となっています。2,3。 自由電子レーザー (Xfel) でのデータ収集、実験課題の限られた供給のために必要な、小さな結晶・ サイズの範囲のためのデータ収集の前にサンプルの評価は不可欠です。タンパク質マイクロやナノ結晶懸濁液の特性に最も一般的な手法は、今電子顕微鏡と x 線粉末回折までです。
これまでのところ、いくつかのアプローチは、小さなマイクロ メートルの範囲内の寸法によるタンパク質結晶のバルク量を生成する目的で一般的な結晶化方法から適応されています。バッチは、高速混合高濃縮タンパク質の沈殿のソリューションは、このように高過飽和相ナノ結晶化が支持された4をする可能性がありますに試料溶液を強制的に用いられます。他の方法は、データ コレクション5に使用するナノ結晶懸濁液として役立つことができる結晶スラリーを形成する大規模なタンパク質結晶を粉砕など。ただし、成果もあります減少回折品質劣化した結晶が内部下位。自由界面拡散に基づくナノ結晶化はまた利用できる代わりに、タンパク質溶液が高い沈殿溶液3に少量の追加は。ただし、すべての技術の中で最も効率的な方法は表示バッチ晶析と滴6に座っての蒸気拡散法を使用してより多くの革新的な整体技術。
一般に、蛋白質の結晶化のエネルギー障壁は核生成 - 結晶形成の最初の熱力学的ステップをサポートする越える必要があります。熱力学的に不安定状態からタンパク質溶液を過飽和に移動するため、最後に相転移を誘発するタンパク質溶液に関連するいくつかの変数を変更する必要します。このような変数は、通常、環境の変化、蛋白質溶液の濃度 (e.g、温度、湿度)、溶媒の特性 (例えば、pH、イオン強度)、濃度およびバッファー プロパティ、等7。 ,8変更できるサンプル パラメーターの概要は通常溶解度図、核相図、またはさらに詳細など、プレゼンテーションの別のモードを許可する相図によって表される三次元またはより複雑な図が考察8,9,10に来ることができる場所の説明を。最も魅力的な種類の相図は、残りのパラメーターが定数6,11を維持しながら、主要な変数が別のパラメーターの関数として蛋白質の集中通常二次元。1 つまたは少数の核が形成されると、一度大きな結晶は一括ソリューションから付加的な蛋白質をとることによって育てることができます。マイクロ ・ ナノ微粒子の生産を目指し、時このような従来の結晶化のアプローチは、ソリューションに存在する結晶の数が少ないためもう不可能です。ナノ結晶懸濁液は通常結晶化経路は、そのサンプルに存在する核生成イベントのマキシマ手直しが持っていますこのように結晶エンティティで金持ちになるあります。その結果、蛋白質はまたまだない完全理解12,13今未踏の核生成経路まで新しい、いくつかの調査が必要です。前述相図の基礎をもとに、古典的な理論に拡張されている新しい仮説核が二段階機構として記載されている: 最初より高い蛋白質の集中への移行が行われる (密な液体相) と第二に、密度の高い豊富な段階からより高い内部順序 (結晶核格子アーキテクチャ)14,15,16への移行。タンパク質の結晶は、多くの要因に敏感、従って結晶化のレシピは、異なるサイズの結晶が発生する再調整されるとき、レシピことはできません常に頼る以前の知識。新しい洞察力を個々 の蛋白質ターゲットごとに確立する必要: バッファー組成、純度、タンパク質の溶解度等のサンプルでは、正確な知識の安定性の調整。
動的光散乱法が今日確立法調査することができる粒子の幅広いサイズ範囲のための蛋白質結晶化プロセスの解析と最適化: ナノ結晶と小さな微結晶に単量体蛋白質から。メソッドは、溶液中の粒子がブラウン運動を受けるし、媒体とパーティクル ジオメトリの粘度、粒子サイズ、熱エネルギーによって、この運動の平均速度が決定されることを悪用します。最初は、液体培地はレーザーを用いるコヒーレント光源に照らされました。粒子からの散乱光は干渉縞を形成します。粒子は、恒久的な運動で、干渉パターンはまた、永続的に変更します。一定の方向に見て、強度の変動が観察できます。これらの変動は今の量子ブラウン運動による粒子の動きを示しています。強度変動から自己相関関数 (ACF) が計算されます。ACF の分析は粒子のストークス アインシュタイン方程式を用いた速度分布 (より正確には拡散係数) の測定を与える、粒子半径分布17に変換されます。様々 な出版物や書籍18,19DL 機能と動作原理に関連する追加情報を見つけることが。
ここで適用し、ユニークな自動結晶化装置、XtalController900、XtalController 技術6、正確にインタラクティブなタンパク質結晶化実験の監視のために開発のアップグレードされたバージョンをについて説明します。この手法は、識別と核生成イベントをリアルタイムでの追跡、結晶相図によって正確な操縦できるように潜在的な高を示しています。この特定の結晶化手順の目的は、高品質タンパク質マイクロとナノ結晶シンクロトロンのマイクロ フォーカス x 線源、電子線回折を利用するアプリケーションに適した取得する蛋白質の結晶化を最適化するために、特撮。
プロトコル
注: プロトコル全体を通して水の添加用マイクロ投与量のシステム、とい Pump0 Pump1 に呼び出される鉛塩法の追加に使用されるマイクロ投与システム間。この実験の結果は、さらに議論・ THM2_micro 結晶と呼ばれるされます。
1. パラメーターとソリューションのセットアップ
- 16 mL Na 酒石酸溶液 (1.2 M) と 16 mL の蒸留水 0.2 μ m の滅菌注射器フィルターを使用してフィルター処理します。
注: Na 酒石酸ソリューションは、結晶成長実験の沈殿のソリューションを表します。 - フィルター選択されたソリューション 5 mL で鉛塩法と水のボトルを埋めます。
注: ボトル 5 mL の最大容量があります。 - 実験室のポンプ ホルダーにボトルをマウントします。
- 次の値にソフトウェアのウィンドウで実験的パラメーターを設定: 温度 20 ° C、相対湿度 20、および溶媒を水で。
注:図 2は、ユーザーが温度、相対湿度、溶剤など各パラメーターに適切な値を挿入することができます表示ウィンドウを示しています。ソフトウェアのウィンドウは、添加物なども、いくつかの追加のパラメーターを示しています。これこそが重要な実験のため添加物が沈殿のソリューションに存在します。 - 実験室の玄関のドアを開け、coverslip キャリアを取り外します。
- キャリアのクリーンとシリル coverslip を置き、デバイスにそれを配置します。
注: coverslip 2.2 cm のサイズがあります。 - 1.4 の手順で環境条件を確保するための実験室を閉じます。
注: プロトコルはここで一時停止することができます。
2. マイクロ計量装置の調整
- Pump0 を切り替える使用特性を図 3にポンプし、水の流れを作成します。
注: 水ストリーム軌道が調整することができますいくつかのポンプ特性に基づいて作成されます。図 3は、主ポンプ特性とこの実験のために使用する最適な値を示しています。 - その指定された調整ネジを手動で操作することにより、カバーガラスの中心に向かって位置を目指して水の流れを調整します。Pump0オフを切り替えます。
- Pump1 を切り替え、前述手順 2.1 で行う液体ストリームを作成します。Pump0 の固定位置に向かって Pump1 のストリームの位置を調整します。Pump1オフを切り替えます。
- 新しい使用される coverslip に置き換えるし、きれいに結晶化実験の 1 つ。
注: ソフト ワイプは通常結晶化実験で使用されている前に、残留の塵から新しい coverslip のクリーニングの推薦されます。
3. 実験室でタウマチン ドロップの設定
- ソフトウェア パッケージを使用して新しい実験ファイルを作成します。実験ファイルに次の情報を入力します: 蛋白質 ( Thaumatococcus danielliiからタウマチン)、蛋白濃度 (14 mg/mL)、鉛塩法 (Na 酒石酸塩)、および沈殿濃度 (1.2 M)。
注: この情報は結晶化実験中に鉛塩法とタンパク質濃度の自動計算になります。 - ステップ 3.1 からすべての情報を有効にする新しい実験ファイルをロードします。
- Pump0 を使用して小さな水ドロップを追加することによって蛋白質液滴の位置をマークします。
注: 目的蛋白質のサンプルの配置をランドマークとなる小さな水滴を作成することです。 - 風袋ゼロに対し、天秤で重量を設定するボタンを押します。
注: これは、カバーガラスの重量と 3.3 のステップで作成した小さな水ランドマークによって追加された余分な重量が削除されます。 - 実験室の上蓋を開くし、水ランドマーク タウマチン液 8 μ L をピペットします。
- 新しいタウマチン ドロップを登録するには、次の命令に従います。
- 実験ファイルから初期条件の属性に新しいドロップのボタンを押します。
- Const液滴からの水の自然蒸発を補うためにボタンを押します。
- タンパク質のドロップで Pump0 を目指して場合 CCD カメラでチェックしてください。水の流れがドロップの外を目指している場合は、Pump0 の位置を調整してください。
注: この瞬間からタンパク質液滴に残ります、一定重量タンパク質液滴からの自然な水分蒸発を補償する自動水添加による。温度や湿度などの他のパラメーターと同様に、タンパク質液滴の重量は、表示ウィンドウを使用してリアルタイムで監視できます。実験はここで一時停止することができます。
4. DLその場測定
- 電源スイッチにDL レーザーし、手動で調整ネジを使用して蛋白質のドロップでレーザ光を配置します。
- 次の DL パラメーターを入力: 測定期間 (60 s)、2 つの測定の間の待機時間 (10 s)、および測定 (300) の数。
注: 最初 30 測定蛋白質安定性チェックのための参照の測定として役立ちます。測定値の残りの部分は、タンパク質液滴の結晶化過程の全体の長さ中の完全な調査となります。 - DLS の測定を開始するに開始ボタンを押します。サンプルの品質をチェックするには、DL のグラフィック表現のいずれかを選択します。
注: サンプルはモノ-カオリン、ソリューション内の任意の集計なしの高度を表示する必要があります。DLS 結果を示すし、として読むことができます: 半径分布半径ヒストグラム、半径プロット、概要、または概略的なカウント数の強度の測定。
5. サンプル蒸発ステップ
- 表 1に示されているデータを使用して集計表の蒸発のステップのための条件を入力します。
注: 記号「-」列で導入された 2 行目の「モル/率」を表し、水の損失蛋白質液滴から値が「25」を意味する, 液滴体積が 25% の削減に苦しむこと。これは、液滴のタンパク質濃度が 25% 増加することを意味します。 - Automボタンを押すことによってサンプルの蒸発のステップをアクティブにします。サンプルの蒸発のステップが完了したら、停止ボタンを押します。
- ボタン サンプルの蒸発を停止した後、ドロップを保つにはConstをアクティブにします。
6. 沈殿の追加手順
- 図 4 の表 2で提供されるデータを使用してのようにスケジュール表に沈殿追加手順のための条件を入力します。
注: テーブルの最初の行は、中にソフトウェア計算蛋白質液滴に追加する、鉛塩法の量に基づくタンパク質液滴の自然蒸発速度校正手順を表します。ソフトウェアは、この値を推定し、自動的に次に沈殿添加水の蒸発を補うために Pump0 の撮影頻度を自動的に調整します。 - Automボタンを押すことによって沈殿の追加ステップをアクティブにします。
注: 鉛塩法の添加はスケジュール表から入力、以下、自動化されたプロセスです。
7. 時間をかけて結晶化液滴の進化を追跡
- CCD カメラを用いたタウマチン結晶の外観を確認します。
- DLS のグラフィック表現を使用して粒度分布を確認してください。
- 表示ウィンドウを使用して、重量と実験的パラメーターの進化を確認してください。
注: Na 酒石酸ソリューション タンパク質ドロップで 0.74 M の濃度に達すると、液滴が図 7に見られるように、タウマチンの微結晶の豊かなります。
8. 結晶化液滴の回復
- パラフィン オイルできれいな標準テラサキ プレートをコートします。
- プレートにパラフィン オイル 3 mL を追加します。
- プレートの井戸で油カバー プレートのすべての 72 の井戸は、別の角度で優しくプレートの移動によってパラフィン油を分散します。
- パラフィン油の過剰を削除するには、プレートに浮かぶ油を注ぐします。
- 結晶化実験を終わらせるに停止ボタンを押します。結晶化液滴を含むサンプル キャリアを慎重に取り出してください。
- ピペットの使用, テラサキ プレートの井戸に結晶化ドロップの 2 μ 因数のボリュームを配置します。
注: オイルにおける平板結晶化液滴を回復することによってサンプル定期的にチェックできます安定性と結晶を使って顕微鏡または標準テラサキ プレートで動作する他の DLS 技術のため。
結果
結晶化実験中に DLS 測定によって得られた結果は、時間をかけて開発、2 つの主な粒子分布分数生じる流体粒子の半径の詳細な進化を表示します。実験の最初の部分で、サンプルはだったより高い蛋白質の集中を達成するために、ゆっくりと蒸発。図 5 bのように、タンパク質のドロップだった 14 mg/mL 19.5 mg/mL に濃縮。この時間の間に図 5 aの半径分布パターンに従ってタンパク質単量体の行動を示す溶液で一定の粒径は約 2.5 nm。サンプルがさらに蒸発されて、単量体蛋白質ソリューション、変性またはサンプル集計の兆候なしで安定したままです。
タンパク質ドロップする沈殿溶液添加はすぐにサンプルの蒸発後に開始より良い可視化 (図 5) の半径分布パターンとバランス曲線で灰色で強調表示されます。サンプル重量から派生した計算に基づいて、強調表示された粒子画分は約 200-400 nm の半径サイズの結晶核生成の開始に起因します。(核形成として知られている) この現象、タンパク質液滴の 0.6 M の沈殿の濃度で実験と鉛塩法の開始への点で約 23 分の開始から約 66 分の期間で開始します。さらに。沈殿の増加の濃度としては、半径方向分布は、ソリューションで粒子の広範な分布を示しています。多くの核を形成する結晶の初期、エンティティが 800 1,300 nm 間の半径分布に達するサイズに成長しています。この段階では、結晶核が成長し続けるし、タンパク質画分は、タンパク質分子が撮影アップ微結晶によって貧しい徐々 にいえます。タンパク質のドロップで沈殿の濃度を徐々 に上げと半径方向分布は 500 から 1500 nm の間成長し続けるときに 75 分後微結晶の形成は簡単に識別されます。半径方向分布の進化蛋白質微結晶が沈殿 0.7 M 濃度で目に見えるソリューション (図 7) に、CCD カメラの画像でも確認されました。沈殿の追加が完了し、結晶化ドロップは一定に保たれる、半径方向分布は 1,000 〜 3,000 nm の, 時間の経過とともに核生成イベントの割合が減少する一方の間優勢な段階を示しています。この瞬間、微結晶の結晶化ドロップは完全飽和し、さらに核生成イベントがソリューションに存在しません。
天秤によって与えられるフィードバック データを実験的入力として使用して、結晶相図はタウマチンの結晶化過程の総合的理解のために描いた。図 6実験的相図は、タウマチンT. danielli微結晶の生産が THM_2 微結晶 (プロトコル) としてラベル付けされて 3 つの独立した結晶化実験を示しています。相図にさまざまな領域の適切なマッピングを持つために入力データをラベル付き THM_1 マクロ結晶と THM_3 マクロ結晶として使用されている 2 つの追加の結晶化実験 (e.g。、溶解または準安定領域)。以来、これらの実験のプロトコルは、異なる結晶化経路をたどる、容易さ、およびそれ故により正確な核形成領域の同定となります。さまざまなアプローチを強調する順序数と灰色の矢印を表す最終的な蛋白質の推定中特定の結果に使用する結晶化手順の数によって各実験のため結晶化パスが強調表示されます。濃度の適切に定義された層の溶液から結晶成長吸収蛋白質分子タンパク質結晶を安定したとき。
核形成領域を入力するとき、図 6に示した 3 つのタウマチン実験表示条件が異なるとそれが異なるため最終的な結晶化結果を相図下の写真から見ることができます。THM1 と THM3 の場合蛋白質溶液は核相を通過し、再結晶が形成されるまでかかって、準安定領域に入る。その結果、実験は、大規模な明確に定義された形をした結晶を母液に囲まれてに します。ただし、プロトコルのセクション、THM2_micro 結晶で示した実験結晶化パスの特定の方法に従います。前のセクションで述べた微結晶を与えるためのサンプル、蛋白質の解決があること核形成の段階では、深部に位置する核生成イベントを最大速度で形成することができます。THM2_micro 結晶の場合蛋白変性濃度比が調整されたそのような方法でサンプルだけでなく核形成領域に入ることが共沈剤をタンパク質溶液に追加されさらに、条件に移動しないでください核形成領域内の高過飽和状態の相図の別の領域に残ります。その結果、ソリューションのエントロピーはタンパク質液滴が結晶に小さなエンティティですぐに飽和状態になりますと大幅に減少します。
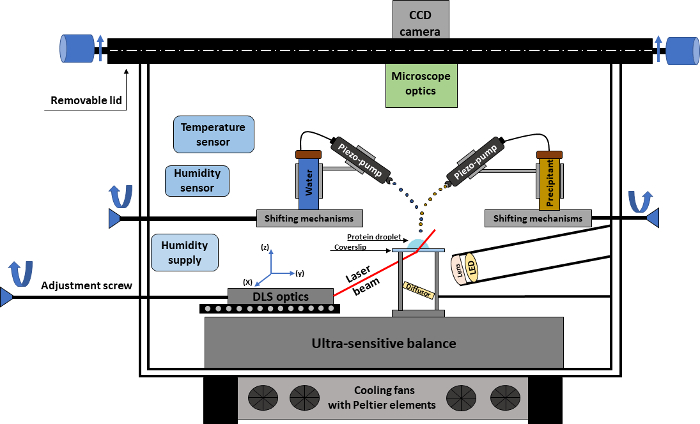
図 1。結晶化実験の概略図。図面は、自動結晶化実験を行なうために必要なすべての技術的な部分と結晶化の実験室の概要を示します。この図の拡大版を表示するのにはここをクリックしてください。
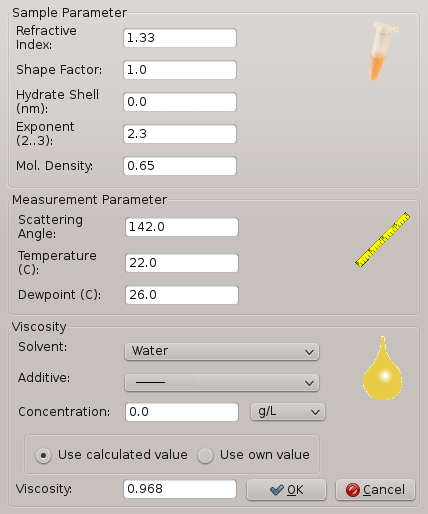
図 2: ソフトウェアの DL の] ウィンドウおよび結晶化実験に関連するサンプル パラメーター 。パラメーターには、温度、相対湿度、粘度などが含まれます。
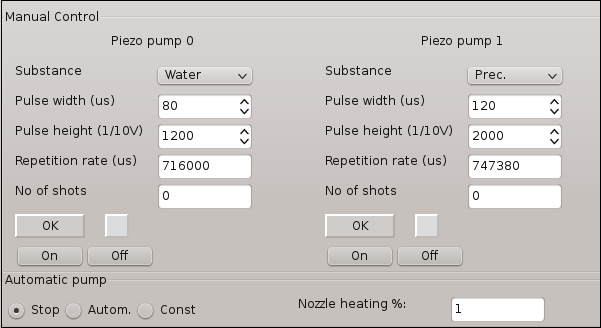
図 3: 結晶化実験に関与するマイクロ投与システムのソフトウェア コントロール ウィンドウ。機能は、水滴やソリューション ストリームの生成のための特定のパラメーターの調整を許可します。
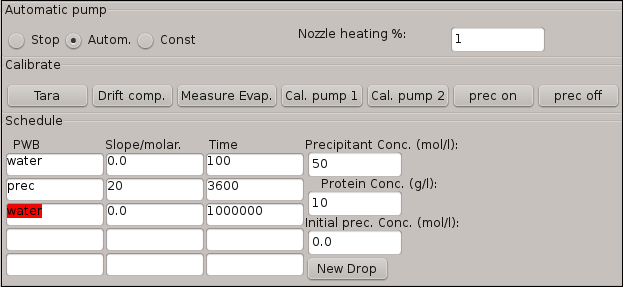
図 4: 実験で結晶化手順を説明したスケジュール表のソフトウェア ウィンドウ。結晶粒の最初の条件は、このウィンドウに統合されています。
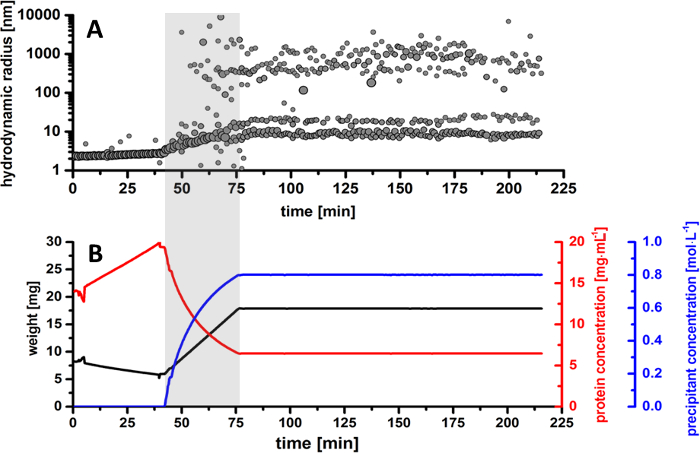
図 5。タウマチンソーマトコッカスダニエリ微結晶生産の概要。(A) 全体の結晶化プロセス中にタンパク質のドロップで粒径の半径分布。(B) 実験的パラメーターの監視概要。プロットは、計算蛋白質濃度 (赤いカーブ) と変性濃度 (青の曲線) とタンパク質液滴 (黒い曲線) の重量のための時間をかけて進化を表しています。この図の拡大版を表示するのにはここをクリックしてください。
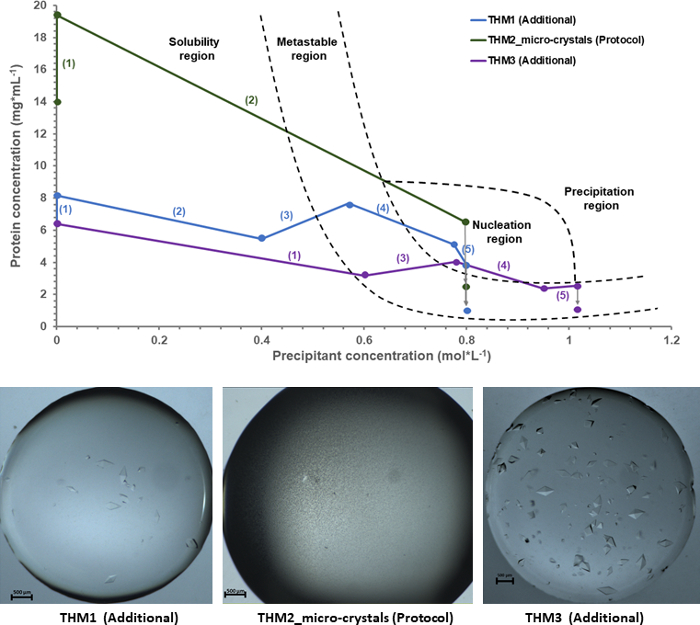
図 6: タウマチンT. danielli一緒に生じる結果の実験的結晶相図。すべてのプロットは、天秤によって与えられるフィードバック情報に基づく実験データから派生しました。各実験に起因する括弧の間に表示されている番号は、順序と結晶化プロトコルで使われるステップの数を表しています。この図の拡大版を表示するのにはここをクリックしてください。

図 7: THM2_Micro 結晶 (プロトコル) ソリューションで飽和する微結晶の豊富な数を示す記録写真。画像は、結晶化の実験室の蛋白質液滴を設定した後 4 時間 (240 分) で撮影されました。この図の拡大版を表示するのにはここをクリックしてください。

図 8: ソリューションで安定しているいくつかの大きなタウマチン結晶を示す THM_1 マクロ結晶における記録写真。結晶化の実験室の蛋白質液滴を設定した後は、20 h が撮影されました。この図の拡大版を表示するのにはここをクリックしてください。

図 9: THM_3 マクロ-結晶溶液タウマチン結晶の様々 なサイズを示すための記録写真です。結晶化の実験室の蛋白質液滴を設定した後は、20 h が撮影されました。この図の拡大版を表示するのにはここをクリックしてください。
| 物質 | モル/割合 | 時間 (秒) |
| 水 | 0 | 100 |
| 水 | -25 | 2100 |
| 水 | 0 | 2100 |
表 1: サンプルの蒸発の自動スケジュール入力はタウマチン微結晶の生産のステップです。
| 物質 | モル/割合 | 時間 (秒) |
| 水 | 0 | 100 |
| プレック | 0.8 | 1800 |
| 水 | 0 | 18000 |
表 2: 沈殿の付加のための自動化されたスケジュール入力ステップ タウマチンの生産で微結晶します。
ディスカッション
結晶化デバイスは、監視し、変更された蒸気拡散法に基づく結晶化実験中の重要なパラメーターを操作する設計されています。このテクニックにより、監視およびスコアの正確な知識と結晶相図を通して蛋白質の解決の制御を持っているユーザーを有効にするすべての段階でのタンパク質結晶成長実験に基づいてその場でDL 解析サンプルの停止。
結晶化デバイスには、結晶粒のリアルタイム監視ができる CCD カメラに接続して実験室 (図 1) が装備されています。カメラは、最大約 2.5 μ m の空間分解能を提供する倍率の異なるレンズを搭載した顕微鏡に合わせられます。実験室のコアは、時間をかけてサンプル重量の進化を追跡するための超高感度天秤です。結晶化の手順は、天秤になっているシリコーン coverslip の蛋白質のドロップを配置する場所に座ってドロップ蒸気拡散実験に対応します。沈殿追加、水/添加剤の添加、またはサンプルの蒸発によって引き起こされる、液滴の体重の変化に基づいて、天秤鉛塩法とタンパク質濃度の経年の即時の計算のアルゴリズムへの正確な入力を与える.さらに、温度、相対湿度など重要な結晶化パラメーターは正確に監視、制御します。
結晶化実験を実行するためにデバイスに鉛塩法と水添加の picoliter スケールで働く 2 つのマイクロ投与システム (お問い合わせ無料圧電ポンプ) が備わっています。このような微量物質と協力して、濃度勾配およびタンパク質液滴内で対流現象が最小します。圧電ポンプの主な役割は、鉛塩法や水、たとえばタンパク質液滴の自然蒸発のための補償として使用されている後者の追加です。マイクロ計量装置物質の追加を指示することができますの機能のセットがあります。このような機能が含まれます: 液滴の数を 1 秒、幅など、物質ストリーム軌道の高さ追加、物質を追加する繰り返し。また、ポンプの位置手動で調整できます、タンパク質液滴への物質の添加の正確な位置を持っているユーザーを有効にします。
その場でDLS データ、実験プロシージャ全体でタンパク質のオリゴマーの状態に可能な変更を示すことができる結晶化ドロップのユニークなフィードバック制御を用いた操作を実現します。テクニックには、粒度分布、時間をかけてこのように未知タンパク質関連メカニズムを明らかの一定の評価ができます。DLS 光学機器は、coverslip を通過し、その場で方法で蛋白質液滴をさらに検出器とレーザーのビームをできるように coverslip 領域の下に戦略的に配置、したがって、DL パスから液滴内の変更だけが記録されます。簡単に処理できるように、デバイスに 2 つの開口部がある: ユーザーがマイクロ計量装置の撮影位置を調整できるように、coverslip ・削除できる上蓋の最適な位置決めと同様、設定精度を持つ新しい蛋白質 dro の正面玄関上、plet。
前述のデバイスを使用してインタラクティブな結晶化法は、タンパク質の結晶サイズ制御生産のため信頼性の高い手法です。結晶化の多くの方法は、現在利用できるが、結晶化に関する内部情報機構自体は簡単に達成可能であります。一般に、従来手法を適用すると、結晶相図、実験が開始されたら、そのコースを変更するいくつかの可能性だけでソリューションのだけ限られた制御をできます。結晶中実験し、相図における遷移に関する知識を得られるその場でDL、素晴らしいと相まってこのようなの自動結晶化技術を適用します。一般に、非晶質沈殿物と同質な核形成の誘導結果領域は、相図の互いの近くにあります。したがって、その粒子分布に関するリアルタイムな情報に基づく結晶化液滴のコースを操作することによって徐々 に核に向かって結晶化条件を調整することによって、蛋白質の沈殿物を避けるために不可能だと結晶形成。
今日では、多くの結晶化条件にはポリエチレング リコール (PEG) 誘導体が広く存在している沈殿のソリューションが含まれます。このような化合物は通常、ピペッティングや調剤のための困難を持っていることが高い粘性を持ちます。本事例研究で沈殿の調剤に使用されるマイクロ計量装置は picolitre 単位の追加を可能にする非常に細い毛細血管を適用します。その結果、粘性の高い物質の使用にいくつかの制限があります。過去の実験の一連のシステムは、次の PEG 誘導体を使用して肯定的な結果を与えている: PEG200 PEG3000 50%、20%、PEG6000 10%、PEG800010%。前述のソリューションのみを調べたところ、マイクロ投与システムにはソリューションの粘度を減少させるために使用できる特別な加熱機構が含まれて。別の要因は、タンパク質沈殿として使用する場合に考慮されなければならない塩のソリューションです。沈殿の追加; マイクロ-充填ポンプの表面的なブロッキングの原因微小量システムのノズルで少量が結晶化高濃度塩類を使用する場合相対湿度が非常に高い場合でも、実験室で提示します。この問題を克服するために実験をノズルから塩を削除することができますので、保留する必要があります。これは特別な処理を必要とする可能性があり、沈殿追加段階でエラーを生成可能性があります。
このような自動結晶化実験を行う際に達成することができます貴重な情報に基づき、この手法は結晶の物理化学の側面を調査研究するよう拡張することも。核形成と結晶成長の反応速度が派生し、沈殿と温度、粒子サイズ、および蛋白質の成長など実験から示されている時間依存情報に基づいて計算することができます運動現象濃度。
開示事項
ここアルネ マイヤー、カルステン ダークスベントリー、キリスト教の Betzel、著者が Xtal 概念 gmbh 社は、XtalController900 技術の生産の会社の株主であることを宣言します。
謝辞
著者は欧州連合のホライゾン 2020年研究所とマリー ・ マリアスクウォドフスカ キュリー頭字語「X プローブ」契約番号 637295 とサポートを介して BMBF グラント 05K16GUA や、"、ハンブルク中心部の超高速の下で革新プログラムからの資金を認めるイメージング-構造、ダイナミクス、原子スケールでの物質のコントロール"卓越したクラスターのドイツ研究振興協会 (DFG)。
資料
| Name | Company | Catalog Number | Comments |
| Thaumatin from Thaumatococcus daniellii | Sigma-Aldrich | 1002365940 | Protein for protocol |
| Bis-Tris 14880 | Sigma-Aldrich | 2302377 | Buffer for protein solution |
| di-Sodium tartrate dihydrate | AppliChem | A0451,0500 | Precipitant for protein solution |
| Silliconized coverslips | Heinz Herenz Medizinalbedarf GmbH | 1051203 | Coverslips for crystallization |
| Syringe filter | Starstedt | 831826001 | Filter pore 0.2 µm |
| Syringe | Omnifix | 4617207V | Luer Lock Solo 20 mL |
| Paraffin oil | Sigma-Aldrich | 2323842 | Oil for coating the plate |
| Standard Terakasi plate | Sigma-Aldrich | M5812270EA | Plate for recovering the crystallization droplet |
| Soft wipes | KIMTECH Science | ||
| XtalController900 | Xtal-Concepts GmbH | XTC900 | Crystallization device |
参考文献
- . . Patent "Vorrichtung und Verfahren zur Kontrolle der Kristallisation". , (2010).
- Chapman, H. M., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcuselongatus as a model system. Philos. Trans. R. Soc. Lond. B Biol. Sci. 369 (1647), 20130316 (2014).
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (2052-2525), 246-255 (2015).
- Stevenson, H. P., et al. Use of transmission electron microscopy to identify nanocrystals of challenging protein targets. Proc. Natl. Acad. Sci. U.S.A. 111 (23), 8470-8475 (2014).
- Meyer, A., et al. Single-drop optimization of protein crystallization. Acta. Crystallogr. Sect. F. Biol. Cryst. Commun. 68 (Pt 8), 994-998 (2012).
- Ferré-D'Amaré, A. R. . Crystallization of Biological Macromolecules. 5 (7), 847-848 (1999).
- Asherie, N. Protein crystallization and phase diagrams. Methods. 34 (3), 266-272 (2004).
- Sauter, C., Lorber, B., Kern, D., Cavarelli, J., Moras, D., Giege, R. Crystallogenesis studies on yeast aspartyl-tRNAsynthetase: use of phase diagram to improve crystal quality. Acta. Cystallogr. D. Biol. Crystallogr. 55 (Pt 1), 149-156 (1999).
- Ewing, F., Forsythe, E., Pusey, M. Orthorhombic lysozyme solubility. Acta. Crystallogr. D. Biol. Crystallogr. 50 (Pt 4), 424-428 (1994).
- Saridakis, E. E. G., Steward, P. D. S., Lloyd, L. F., Blow, D. M. Phase diagram and dilution experiments in the crystallization of carboxypeptidase G2. Acta. Crystallogr. D. Biol. Crystallogr. 50 (Pt 3), 293-297 (1994).
- McPherson, A., Cudney, B. Optimization of crystallization conditions for biological macromolecules. Acta. Crystallogr. F. Struct. Biol. Commun. 70 (Pt 11), 1445-1467 (2014).
- Sleutel, M., Van Driessche, A. E. S. Role of clusters in nanoclassical nucleation and growth of protein crystals. Proc. Natl. Acad. Sci. USA. 111 (5), 546-553 (2014).
- Schubert, R., Meyer, A., Baitan, D., Dierks, K., Perbandt, M., Betzel, C. Real-time observation of protein dense liquid cluster evolution during nucleation in protein crystallization. Cryst. Growth Des. 17 (3), 954-958 (2017).
- Vekilov, P. G. The two-step mechanism of nucleation of crystals in solution. Nanoscale. 2 (11), 2346-2357 (2010).
- Vekilov, P. G. Dense liquid precursor for the nucleation of ordered solid phases from solution. Crystal Growth & Design. 4 (4), 671-685 (2004).
- Dierks, K., Meyer, A., Einspahr, H., Betzel, C. Dynamic light scattering in protein crystallization droplets: adaptations for analysis and optimization of crystallization processes. Cryst. Growth Des. 8 (5), 1628-1634 (2008).
- Schubert, R., et al. Reliably distinguishing protein nanocrystals from amorphous precipitate by means of depolarized dynamic light scattering. J. Appl. Cryst. 48, 1476-1484 (2015).
- Brown, W. . Dynamic light scattering: the method and some applications. , 978 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved