Method Article
用于疾病建模的人三维肺组织培养 (3D-LTCs) 的生成
* 这些作者具有相同的贡献
摘要
在这里, 我们提出了一个方案, 用于制备富含琼脂的人精确切肺切片从切除的患者组织, 适合产生三维肺组织培养, 以模拟人类肺部疾病的生物和生物医学研究。
摘要
人类基于组织的疾病模型的存在限制了人类疾病新发现的翻译。精确切割肺切片 (pcls) 用作三维肺组织培养物 (3d-ltc), 是一种优雅且具有高度生物相关性的三维细胞培养模型, 由于其复杂性、生物力学性和分子性, 与原位组织非常相似组成。组织切片在各种动物模型中得到了广泛的应用。从人类 pcls 中提取的3D-LTCs 可用于分析对新型药物的反应, 这可能有助于更好地了解药物在人体组织中的机制和功能效应。从经过肺叶切除术的肺组织标本中制备 pcls, 增加了病变和口腔组织的可及性。在这里, 我们描述了一个详细的方案, 以生成人类 pcls 从手术切除的软弹性患者肺组织。琼脂糖被引入到直肠的支气管肺泡空间中, 从而保持了肺结构, 增加了组织的刚度, 这对随后的切片至关重要。从组织块中制备了500μm 厚的切片, 并具有振动。从 pcls 中提取的活检冲孔可确保可比较的组织样本大小, 并进一步增加组织样本的数量。所产生的肺组织培养可应用于人类肺生物学的各种研究, 包括不同疾病的病理生理学和机制, 如在 (亚) 细胞水平上的最佳纤维化过程。3d-ltc体外模型的最大优点是它在三维组织结构、细胞类型多样性和肺解剖方面对原位人体肺的近距离表示, 以及从个别患者中评估组织的潜力。是相关的进一步发展新的策略的精密医学。
引言
慢性和急性肺病是全世界发病率和死亡率的主要原因1。对于慢性肺病患者, 如阻塞性肺病 (copd)2、重症哮喘3、肺癌4和弥漫性实质肺病5, 目前尚不具备治疗疗法。虽然对肺病动物模型的研究加深了对疾病病理机制的了解, 但也导致了潜在的新治疗目标7、8、9 的确定。与人类相比, 这些模型表现出相关的生物和生理差异10。为了克服小鼠与人体生物学以及解剖学之间的差异, 人体外三维肺组织培养 (3d-ltc) 系统被用于生物医学研究的各个领域。这些3d-ltc 培养系统是基于精确切割肺切片 (pcls)。通过在体内生成 pcls, 可以分析第三个空间维度, 从而可以调查整个肺泡和气道11中细胞的空间和功能关系, 以及间质、血管和间皮。值得注意的是, pcls 体外模型是多细胞的, 这意味着它们包含了原位肺的大多数功能细胞, 从而密切代表了细胞的原始生物环境, 从而克服了大多数2d 中有限的细胞细胞和细胞基质相互作用细胞培养的方法。到目前为止, 体内小鼠 pcls 被用来模拟肺部疾病, 如 copd12, 肺纤维化13, 肺癌 14,病毒感染15,16, 支气管肺发育不良17, 和哮喘18。然而, 在临床试验中调查的相当一部分人类肺病新药治疗并没有转化为临床, 因为它们缺乏疗效或安全性, 令人惊讶的是, 由于人类与人类之间尚未存在相当大的差异。小鼠生物学和疾病19,20,21。
几年来, 人类 pcls 主要用于评估化学品和药物的肺毒性。直到最近, 人类肺组织才被用于慢性阻塞性肺病22,23, 哮喘24和肺纤维化25, 以进行病理生理学和药理研究。通过使用切除的患者器官材料并生成其 pcls, 可以在一个复杂的三维组织环境22中重述主要疾病的特征 , 代表和维持器官的大部分本地细胞多样性。此外, 在各种实验设置中应用的病变组织被证明是模拟肝脏、肠道和肾脏的疾病样变化 26,27,28,29。
然而, 肺组织的处理仍然具有挑战性, 原因有几个。与固体组织不同的是, 本地肺实质体往往在没有通气的情况下塌陷, 并表现出较低的组织刚度。这些特性阻碍了组织的切片。因此, 气道和肺泡空间的填充与低熔点琼脂糖保留了本地肺结构, 并提供了所需的刚度, 精确切割切片的小鼠和人的肺 30.人类为研究目的捐赠的肺切除物本质上是解剖、遗传和生理上高度多样化的, 因此在进行实验25时往往表现出很高的患者间变异性。与整个肺叶或整个肺外植体不同的是, 通过胸外科切除的肺样本不一定遵循解剖段, 因此需要特殊的准备。在本文中, 我们提供了一个详细和优化的方案, 以产生人类 pcls 从切除的肺组织, 并随后种植和实验使用模型肺病。
研究方案
路德维希-马克西米利亚大学伦理委员会批准了人体组织的使用 [德国慕尼黑 (项目编号 455-12)]。肺疾病问题的 asklepios biobank 提供了无肿瘤的人肺切除术 (德国盖廷, 项目编号 333-10)。
请注意:人工 pcls 生产的所有过程 (图 1) 都是在无菌层流罩下完成的。
1. 仪器和材料的制备
-
准备所有材料, 以通货膨胀剂肺组织的膨胀, 如下所述。
- 制备培养基: dulbecco 的改良鹰培养基 f-12, 辅以 l-谷氨酰胺、hepes、10, 000 ie 青霉素、10, 000 ie 链霉素和 0.1% (vw) 胎儿牛血清。
请注意:在37°c 下使用介质。 - 准备一个用纸巾覆盖的无菌金属托盘。将无菌15厘米的细胞培养盘放在托盘上。
- 用15毫升培养基填充细胞培养皿。
- 在至少30毫升的培养基中溶解适量的低熔点琼脂糖, 制备3% 琼脂糖溶液。
- 用微波炉加热溶液, 直到沸腾。在水浴中将琼脂糖溶液冷却到42°c。将储存在水浴中的液体琼脂糖溶液保存在水浴中。
- 准备几个装有液体琼脂糖的50毫升锥形管。
- 制备培养基: dulbecco 的改良鹰培养基 f-12, 辅以 l-谷氨酰胺、hepes、10, 000 ie 青霉素、10, 000 ie 链霉素和 0.1% (vw) 胎儿牛血清。
2. 切除肺组织
- 在4°c 的 dmem f-12 培养基中立即储存新鲜的无肿瘤肺组织的叶切除切除术, 直至第3步。
- 在加工前不要超过4-8 的冷缺血时间。
3. 琼脂糖填充前的检测和选择已切除的组织
- 用推子将组织从培养基中提起。为了避免对组织造成任何损害, 特别是对胸膜的损害, 只在气道上用子处理组织。
- 根据表 1中定义的肺琼脂填充评分的标准对组织质量进行评分。
- 如果组织的质量得分高于或等于 72, 请继续执行步骤4。如果组织的质量低于 60, 不要继续进一步与琼脂糖填充。
请注意:如果组织评分在60到68之间, 琼脂填充和组织切片仍可能产生合理的结果, 并且必须为延长实验做出最终决定。然而, 不符合上述要求的肺组织大多在琼脂糖填充失败。
4. 琼脂糖填充物引起的肺组织膨胀
- 从存储介质中提起组织, 并从组织中排出多余的介质。将肺组织转移到1.1.2 制备的15厘米培养皿中。
- 用1.1.3 的低熔点琼脂糖填充一个30毫升的注射器。
- 通过取出闭塞器并将其连接到30毫升注射器来制备外周静脉导管
- 识别组织中通风组织完整部分的支气管 (直径 0.5-3 毫米) (参见图 2)。
- 将插管插入所选的支气管 (直径 0.5-3 毫米)。
- 轻轻地轻轻地推动插管轻轻向前, 尽量。
- 用钳子压迫插管周围的支气管壁, 理想的情况是同时夹紧任何相邻的肺动脉, 密封支气管周围的支气管。
- 用手术钳排除其他额外的气道, 以防止琼脂糖通过这些气道泄漏。
- 用培养皿中的钳子提起组织。
- 用注射器手动倒入琼脂糖的速度不超过 0.3 mL/s。由于气道和 (或肺不张) 的异质性, 琼脂糖充填速度可能在0.05 至 0.3 mls 之间变化。
-
如果在填充过程中观察到高阻力或从组织中泄漏琼脂糖, 请尝试从步骤4.4 不同的支气管的整个过程。执行故障排除, 如下所述。
请注意:琼脂糖填充的程度在很大程度上取决于导管在组织中的位置, 导管的深度渗透导致琼脂糖填充的小锥样区域 (*) 的肺组织 (图 2c)。- 在高电阻的情况下, 尝试定位导管可正确填充组织的大部分区域 (#) (图 2d)。
- 由于早期凝固琼脂糖的塞在近端支气管或其他气道障碍物 (箭头) 可以导致组织的不完全填充 (图 2e), 不强迫琼脂糖填充, 因为这可能会导致填充区域的缺陷, 但不在填充阻塞的组织部分。
- 如果从插管支气管中提取的呼吸树在切除过程中受损, 而琼脂糖填充导致液体琼脂糖不断泄漏 (图2f 中的箭头), 则将导管插入气道系统的外围部分, 以填充至少一个小部分的组织 (*) (图 2g)。此外, 用手术钳 (箭头) 密封损坏的外周气道 (图 2h)。
- 应用琼脂糖, 直到肺组织完全填充。不要过度充气组织, 因为这可能会对组织结构及其细胞造成不可逆转的损害。
- 夹紧立即用于填充物的支气管。夹紧前取下插管。
- 在4°c 的培养基中对培养培养基中的组织进行30分钟的培育, 以确保琼脂糖凝固。
- 如果切除的组织有多个支气管条目, 重复步骤4.2 至 4.13, 直到组织的所有部分充满琼脂糖。
- 将琼脂糖填充肺组织切片储存在4°c 冷介质中, 直至切片。
5. 精确切割肺切片
-
识别肺组织中牢固地填充琼脂糖的区域。当它们被用子轻轻压在细胞培养盘的底部时, 它们不会崩溃。
- 消费 1-1.5 厘米3块区域在5.1 描述, 而一边仍然应覆盖胸膜。
- 使用氰基丙烯酸酯胶, 将每个组织块与胸膜一侧连接振动体的支架。
请注意:胸膜稍有弹性, 因此会阻碍振动刀片的切割。放置在组织支架上, 胸膜不会干扰切割, 重要的是, 在氰基丙烯酸酯胶和组织的实质之间形成天然屏障, 使胶的扩散最小。 - 用振动器切片肺组织具有以下设置: 厚度: 500μm, 频率: 100 hz, 刀的振幅: 1.2 mm, 刀片的前进速度 3-12μm, 这取决于组织的刚度。如果切片切割不当, 或者组织块本身开始振动, 则降低刀片的突出速度。
- 用钳子将切片从振动的托盘中抬起, 轻轻地将其转移到一个充满培养基的12孔板的井中。最后, 在标准细胞培养条件下, 在孵化器中孵育肺切片。
- 当组织块的2-3 毫米未切片时, 停止切片, 因为氰基丙烯酸酯胶可能会损害该区域的组织完整性。
6. pcls 冲床的产生
- 将肺切片从一口井转移到一个10厘米的空盘子。
- 将4毫米活检打孔器正交放置到 pcls 的上表面, 并开始顺时针和逆时针旋转移动打孔器。
- 将细胞培养基填充到96孔板的井中。用钳子提起组织冲孔, 并将冲孔转移到96孔板的井中。最后, 在1.1.1 制备的培养基中孵育肺冲入。在标准条件下的细胞培养孵化器中 (在37°c 条件下, 氧气含量为 21%, 二氧化碳含量为 5%, 湿度为 95%)。
7. 组织培养和样品采集
- 在标准的细胞培养条件下, 在孵化器中培养 pcls 并打一夜。
- 培养 pcls 和拳打脚踢在概述的情况下最多120小时后, 他们的一代, 以确保细胞的活力和功能。
- 为了收获蛋白质和 rna, 在磷酸盐缓冲盐水 (pbs) 中清洗 pcls 并打三次, 将它们转移到冷冻和液氮中的反应夹。
-
培养的 pcls 冲孔的培养基中上清液用于分析分泌的蛋白质。
- 为了进行组织学分析, 用 pbs 清洗 pcls 并打三次, 并在37°c 孵育 30分钟, 用4% 的甲醛修复。最后, 将 pcls 存储在4°c 的 pbs 中, 以便进一步进行下游染色。
结果
pcls 生成
pcls 的生成可分为四个基本步骤: 手术肺组织切除、琼脂糖填充、基于振动的 pcls 生成和 pcls 培养。切除的肺组织充满低熔点琼脂糖, 这增加了肺组织切片所需的刚度, 并保持了原生肺结构和结构。值得注意的是, pcls 的生成非常耗时, 因此通常隔夜储存在 dmem f-12 介质中的填充肺组织可以作为一个额外的步骤, pcls 生成是在第二天开始。根据以下实验设置, 生成的 pcls 可以在含有 0.1% (ww) 胎儿牛血清的标准细胞培养基中隔夜孵育, 然后再应用实验条件。在本协议 (图 1) 概述的培养条件下, 3D-LTCs 是可行的, 并表现出高达 120h 22的细胞功能 (如表面活性剂蛋白分泌), 并可能在进一步改进后进行优化。
琼脂糖灌装
对于琼脂糖填充组织, 将直径为1.3 毫米的外周静脉导管的插管插入切割组织表面的支气管中 (图 2a)。布朗奇通常位于肺动脉附近。虽然动脉有较薄的壁, 并倾向于崩溃, 支气管表现出良好的可见腔。根据组织的完整性, 导管可以通过几代呼吸树推进到肺的周围。穿透的支气管用推子密封在插管周围 (图 2b)。肺动脉可以同时用推子夹住。随后, 组织被抬起, 液体琼脂糖被轻轻地注入气道。
根据导管的位置, 大部分组织可以用液体琼脂糖填充 (图 2d)。或者, 环状的肺组织的部分, 反映肺的实质通风被穿透的支气管, 可能会充满琼脂糖 (图 2c)。在这两种情况下, 都可以观察到固体填充组织区域的特征模式: 第一, 组织的主要部分是在楔形中填充的 (图 2d), 其次是出现一个较小的突出圆形区域的完全填充组织区域 (图 2c)。如果部分气道由于琼脂糖凝块或其他原因而阻塞, 部分组织可能无法正确填充琼脂糖。因此, 只有部分组织可能适用于切片。在琼脂糖灌装过程中出现泄漏的情况下, 填充的呼吸树的部分可能会穿孔, 肺组织的填充几乎不可能, 然而, 可能的解决方法包括通过更外围支气管的灌装, 更深的插管进入远端气道 (图 2g), 或潜在夹紧泄漏区域 (图 2G)。
精密切肺切片
长度和宽度为 1-1. 5 厘米的组织块从完全充满凝固琼脂糖的组织区域切除 ( 图 3a-3b)。接下来, 单个组织块粘附在振动体的组织支架上 (图 3c)。生成了500μm 厚的 pcls, 而振动的组织块以3-12μms 的速度向前推进 (图 3d-3f)。最后, 将 pcls 淹没在含有0.1% 胎牛血清的细胞培养培养基中, 并在标准细胞培养条件下进行培养, 如步骤7所述。
48小时培养后人类3d-ltc 的实验读数
如图4a/4c 所示, alsafadi 等人25所述的具有代表性的免疫荧光染色如下图所示。纤维连接蛋白 (红色) 和细胞核 (dapi, 蓝色) 的免疫标记, 允许成像保存在人类3d-ltc 外体内的肺泡结构。用纤维化细胞因子鸡尾酒治疗人 pcls 拳 (包括转化生长因子β1、血小板衍生生长因子 ab、脂质磷酸和肿瘤坏死因子α) 48小时, 导致人的纤维样改变3D-LTCs。通过 qpcr, 在3d-ltc 起拳击机上观察到纤维相关细胞外基质成分1型和纤维连接蛋白基因的显著诱导 (图 4d)。此外, 在4例患者中, 有3例患者在接受3d-ltc 拳压后, 其间质标记 vimentin 的蛋白质水平升高 (图 4e)。
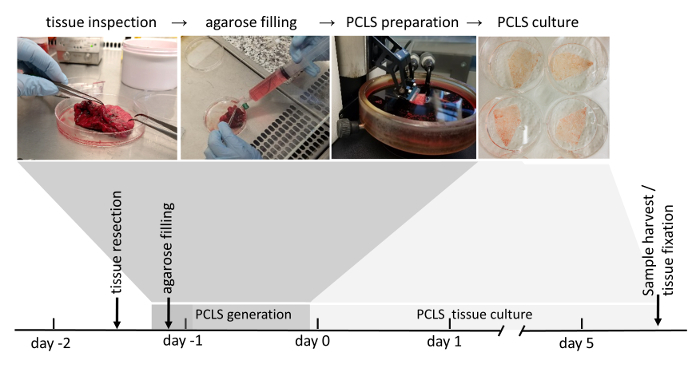
图 1: pcls 生成的工作流.肺切除的无肿瘤区域由于其组织完整性而被彻底检查。如果组织的评分适合进一步使用 (评分在材料和方法部分详细说明), 它下一步被填充液体琼脂糖。装满凝固琼脂糖的组织块随后被切割成一个振动体。在细胞培养培养基中, 3d-ltc 在生成后被培养到120小时。三维 lpc 的下游分析包括蛋白表达或 rna 表达、活组织荧光成像以及组织固定后的免疫荧光染色。请点击这里查看此图的较大版本.
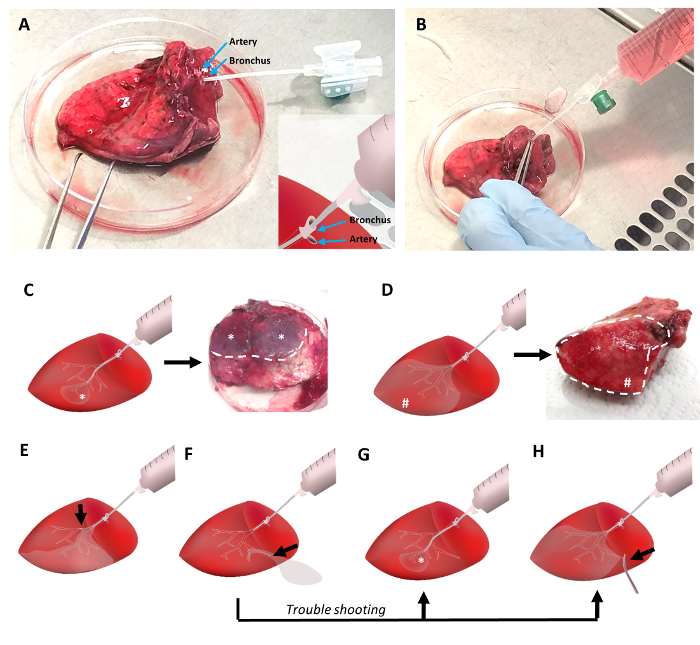
图 2: 用低熔点琼脂糖填充肺组织.肺组织用外周静脉导管插管, 该导管插入与肺动脉相邻的支气管 (图 2a)。使用钳子固定支气管中的插管, 并夹紧肺动脉, 以避免液体琼脂糖泄漏。在42°c 的液体琼脂糖用30毫升注射器倒入肺组织 (图 2b)。在填充过程中, 插管的远端定位将导致填充组织的小区域 (图 2c), 而近端定位将确保填充较大的组织体积 (图 2d)。气道的任何障碍都会减少可以填充的组织体积 (图 2e)。在琼脂糖泄漏的情况下, 远端插管定位和/或夹紧泄漏侧, 使琼脂糖填充肺组织适当(图 2f-2h)。请点击这里查看此图的较大版本.

图 3: 精密切肺切片.成功填充琼脂的肺组织被用来用手术刀切除一块组织块 (1 厘米 x1.5 厘米 x1 厘米) (图 3 a)。接下来, 切除的组织块粘附在组织支架上, 刻度条表示1厘米 (图 3b)。优选地, 组织与胸膜表面粘合在组织支架表面, 如图3c 所示。500微米厚的切片由振动片用蓝宝石刀在 10°-15°角相对于组织 (图 3E和3e)。切割过程的结果是 2-3厘米 3大完整的肺切片, 刻度杆 = 5 毫米 (图 3f)。此外, 通过使用活检打孔器, 可以产生直径为4毫米的小的可重复的打孔。请点击这里查看此图的较大版本.
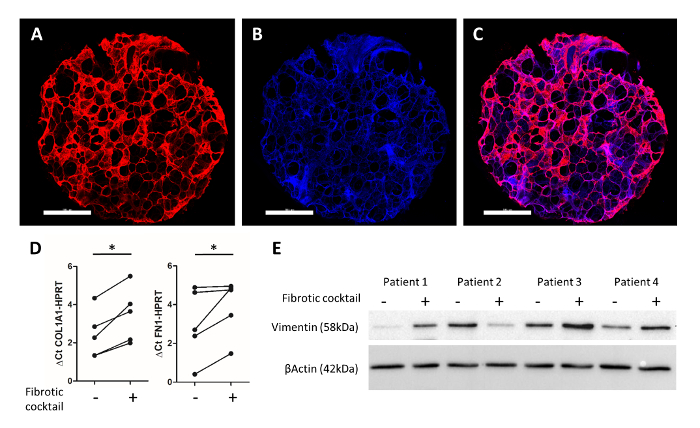
图 4: 培养48小时后人类3D-LTCs 的实验读数.对纤维连接蛋白 (红色) 和 dapi (蓝色) 进行了直径为4毫米的人3d-ltc 冲床免疫 ( 图 4a-4c)。刻度条 = 1, 000μm. 图4c显示了合并后的图像。定量 rt-pcr 对 pcls 的 rna 分析显示, 纤维化鸡尾酒25对 col1a1 和 fn1 基因表达有显著提高。图 4e显示了用纤维化鸡尾酒25治疗的 pcls 全蛋白裂解物的免疫印迹。对 vimentin 和β-actin 的探索显示, 在纤维化因素治疗后, 在1、3和4患者样本中, 间充质标记 (vimentin) 的蛋白表达增加。请点击这里查看此图的较大版本.
| 标准 | 点 |
| 组织样本具有完整的胸膜表面。 | 20 |
| 组织样本似乎宏观完整, 缺乏切口, 挤压, 破裂和扭曲。 | 20 |
| 组织样本中至少含有一个直径 & gt;1mm 的支气管。 | 20 |
| 组织样本中不含或只有少量的血液。 | 4个 |
| 组织标本完全保存在培养基中, 无肺不张明显的迹象。 | 4个 |
| 组织样本在过去四个小时内被切除。 | 4个 |
| 组织样本的最大直径大于5厘米。 | 4个 |
| 总分: |
表 1: 肺琼脂糖灌装得分.肺琼脂糖填充评分 (lafs) 与成功率的成功填充组织切除琼脂糖, 以其随后的振动为基础的 pcls 生产。分数总结了组织所达到的所有标准点。lafs 等于或等于72预测良好的琼脂糖填充性能, 分数低于60预测琼脂糖填充组织的可能性很大。
讨论
本手稿中描述的协议包括从人类肺组织切除物中生成 pcls, 方法是将其填充液体琼脂糖和随后的振动体切片。组织切片的生成之前被证明为一对夫妇的器官, 如肝脏和大脑, 而这些器官固有的刚度允许直接切片, 而无需对组织进行任何修改。值得注意的是, 肺组织的初始适当准备是产生 pcls 的最关键步骤。肺的琼脂糖填充是稳定其柔软和弹性的方法, 并确保均匀和可重复的 pcls 生成。切除的肺组织的大气道管 , 以提供进入小气道的通道 , 以及完整的肺实质。缺乏完整的胸膜, 这使得琼脂糖填充几乎不可能, 是肺组织大多不能用于肺切片的主要原因。前瞻性地, 一种原本设计用于在脱细胞支架上进行功能实验的合成胸膜有可能被用于成功地充填缺乏完整胸膜31的外植体。切除导致人类肺组织片与完整的胸膜是必不可少的产生组织块切片。切除的组织比接受肺移植的患者完全完整的裂片或全肺外植体更容易获得癌症切除引起的肿瘤无肿瘤组织。
通常, 有两个系统用于生产 pcls: krumdieck 组织切片器15和振动微瘤 (振动体)。组织切片器通过通过金属容器传递组织块生成切片, 金属血管在这个容器的末端以90°的速度切割 pcls。振动体通过在浸没在冷却介质浴中的固定组织块上水平移动振动刀产生 pcls, 与 krumdieck 切割机相比, 它对组织的剪切力较小。这导致培养前对组织的处理不那么苛刻。另一方面, 振动模切割是更多的时间和工作消耗。在我们手中, 振动体切片能够在一天内最多生产 100个 pcls 或 500个 pcls 冲孔, 足以用于大多数实验研究。pcls 可以通过各种方式进行培养: (a) 附着在跨井上, 从而产生空气液体界面 (ali) 系统, (b) 作为动态器官培养 (doc), 或 (c) 在标准细胞培养条件下淹没在细胞培养培养基中。pcls 的详细培养以前描述过22,23,25;然而, 它们在世界各地的各种实验室的使用之间的共同种植条件标准仍然缺失。特别是, 培养时间可能是关键的: 在小鼠 pcls 中, sftpc 阳性肺泡型2细胞在144小时后, 但不是在 120h22后, 就会丢失。此外, 在22小鼠和人类 pcls25中, 代谢活动似乎保持稳定, 时间为120小时。
pcls 的产生有几个技术限制: 直肠的数量和大小会随着时间的推移而波动;琼脂糖填充的效率取决于所获得组织中是否存在完整的胸膜, 决定了 pcls 生成的最终成功;所获得的 (患病) 肺组织内的病理改变所造成的组织破坏可能会干扰 pcls 的制备。气道阻塞和缺乏完整肺泡空间的纤维化组织阻碍琼脂糖充盈, 从而使纤维化组织切片成为一项艰巨的任务。在慢性阻塞性肺病或α-1-抗胰蛋白酶缺乏症等疾病中发现的肺气肿组织可能经不起琼脂糖填充的压力, 并将导致肺泡和建筑文物破裂。在这些情况下, 使用低琼脂糖浓度, 例如 1% ( w v), 可能有助于降低琼脂糖灌装过程中的压力和速度。总体而言, 组织的疾病状态会极大地限制组织在 pcls 生成中的使用。所有这些参数决定了可以从肺组织中产生的 pcls 的数量, 以及产生 pcls 所需的时间。pcls 的进一步限制是不同肺切片在大小或组织含量方面的不一致, 这就需要进一步的规范化实验步骤。为了克服这种情况, 可以产生同一切片类似区域的活检拳。此过程容易减少组织的变异性, 并作为一个额外的好处, 增加可用于实验的 pcls 样本的数量。
总之, 人类三维肺组织培养从琼脂糖填充 pcls 为研究肺生理和疾病提供了一个复杂的人类模型。该协议详细介绍了从切除的肺组织中制备 pcls 的方法及其培养, 并解决了琼脂糖填充人体肺切除的挑战以及如何克服这些挑战。
披露声明
所有作者都声明没有相互竞争的经济利益。
致谢
提交人感谢 marisa neumann 提供的专家技术援助。所有肺组织均由 cpc-m 生物档案提供。这项工作得到了德国肺研究中心 (dzl)、赫尔姆霍兹协会和 cpc 研究学校赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| Vibratome Hyrax V50 | Zeiss | - | |
| Hyrax CU 65 | Zeiss | - | |
| Vasofix Braunüle 18 G | B. Braun Melsungen AG | 4268130B | |
| 30 mL NORM-INJECT | Henke Sass Wolf | 4830001000 | |
| Guarded disposable scalpels, sterile | Swann-Morton | ||
| Loctite 406 | Henkel | LOCTITE 406 | |
| Synthetic Single Crystal Sapphire | Delaware Diamond Knives | - | |
| Dulbecco's Modified Eagle Medium F-12 Nutreient Mixture (Ham) + L-Glutamine + 15mM HEPES | Gibco | 31330-038 | |
| Penicillin Streptomycin | Gibco by Life Technologies | 15070-063 | |
| Special process fetal bovine serum (Sera Plus) | Pan Biotech | P30-3702 | |
| Disposable Biopsy Punch | pfm medical | 48401 | |
| 96 Well, Black/Clear, Tissue Culture Treated Plate, Flat Bottom with Lid, sterile | Falcon / Corning | 353219 | |
| Agarose, low geling temperature | Sigma | A9414-100G |
参考文献
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2095-2128 (2010).
- Rosenberg, S. R., Kalhan, R., Mannino, D. M. Epidemiology of Chronic Obstructive Pulmonary Disease: Prevalence, Morbidity, Mortality, and Risk Factors. Seminars in Respiratory and Critical Care Medicine Med. 36 (4), 457-469 (2015).
- Hekking, P. P., et al. The prevalence of severe refractory asthma. The Journal of Allergy and Clinical Immunology. 135 (4), 896-902 (2015).
- Woodard, G. A., Jones, K. D., Jablons, D. M. Lung Cancer Staging and Prognosis. Cancer Treatment and Research. 170, 47-75 (2016).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. American Journal of Respiratory and Critical Care Medicine. 183 (4), 431-440 (2011).
- Burgstaller, G., et al. The instructive extracellular matrix of the lung: basic composition and alterations in chronic lung disease. European Respiratory Journal. 50 (1), (2017).
- Degryse, A. L., Lawson, W. E. Progress toward improving animal models for idiopathic pulmonary fibrosis. The American Journal of the Medical Sciences. 341 (6), 444-449 (2011).
- Fricker, M., Deane, A., Hansbro, P. M. Animal models of chronic obstructive pulmonary disease. Expert Opinion on Drug Discovery. 9 (6), 629-645 (2014).
- Sagar, S., Akbarshahi, H., Uller, L. Translational value of animal models of asthma: Challenges and promises. European Journal of Pharmacology. 759, 272-277 (2015).
- Williamson, J. D., Sadofsky, L. R., Hart, S. P. The pathogenesis of bleomycin-induced lung injury in animals and its applicability to human idiopathic pulmonary fibrosis. Experimental Lung Research. 41 (2), 57-73 (2015).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of beta2-adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Skronska-Wasek, W., et al. Reduced Frizzled Receptor 4 Expression Prevents WNT/beta-Catenin-driven Alveolar Lung Repair in Chronic Obstructive Pulmonary Disease. American Journal of Respiratory and Critical Care Medicine. 196 (2), 172-185 (2017).
- Lehmann, M., et al. Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo. European Respiratory Journal. 50 (2), (2017).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Communication and Signaling. 12, 73 (2014).
- Ebsen, M., et al. Infection of murine precision cut lung slices (PCLS) with respiratory syncytial virus (RSV) and chlamydophila pneumoniae using the Krumdieck technique. Pathology - Research and Practice. 198 (11), 747-753 (2002).
- Kennedy, J. L., et al. Effects of rhinovirus 39 infection on airway hyperresponsiveness to carbachol in human airways precision cut lung slices. The Journal of Allergy and Clinical Immunology. 141 (5), 1887-1890 (2018).
- Royce, S. G., et al. Airway Remodeling and Hyperreactivity in a Model of Bronchopulmonary Dysplasia and Their Modulation by IL-1 Receptor Antagonist. American Journal of Respiratory Cell and Molecular Biology. 55 (6), 858-868 (2016).
- Donovan, C., et al. Rosiglitazone elicits in vitro relaxation in airways and precision cut lung slices from a mouse model of chronic allergic airways disease. American Journal of Physiology-Lung Cellular and Molecular Physiology. 309 (10), L1219-L1228 (2015).
- Zscheppang, K., et al. Human Pulmonary 3D Models For Translational Research. Biotechnology Journal. 13 (1), (2018).
- Fisher, R. L., et al. The use of human lung slices in toxicology. Human & Experimental Toxicology. 13 (7), 466-471 (1994).
- Wang, L., et al. Differences between Mice and Humans in Regulation and the Molecular Network of Collagen, Type III, Alpha-1 at the Gene Expression Level: Obstacles that Translational Research Must Overcome. International Journal of Molecular Sciences. 16 (7), 15031-15056 (2015).
- Uhl, F. E., et al. Preclinical validation and imaging of Wnt-induced repair in human 3D lung tissue cultures. European Respiratory Journal. 46 (4), 1150-1166 (2015).
- Switalla, S., et al. Natural innate cytokine response to immunomodulators and adjuvants in human precision-cut lung slices. Toxicology and Applied Pharmacology. 246 (3), 107-115 (2010).
- Banerjee, A., et al. Trichostatin A abrogates airway constriction, but not inflammation, in murine and human asthma models. American Journal of Respiratory Cell and Molecular Biology. 46 (2), 132-138 (2012).
- Alsafadi, H. N., et al. An ex vivo model to induce early fibrosis-like changes in human precision-cut lung slices. American Journal of Physiology-Lung Cellular and Molecular Physiology. 312 (6), L896-L902 (2017).
- Westra, I. M., Oosterhuis, D., Groothuis, G. M., Olinga, P. Precision-cut liver slices as a model for the early onset of liver fibrosis to test antifibrotic drugs. Toxicology and Applied Pharmacology. 274 (2), 328-338 (2014).
- Vatakuti, S., Schoonen, W. G., Elferink, M. L., Groothuis, G. M., Olinga, P. Acute toxicity of CCl4 but not of paracetamol induces a transcriptomic signature of fibrosis in precision-cut liver slices. Toxicology in Vitro. 29 (5), 1012-1020 (2015).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Disease Models & Mechanisms. 8 (10), 1227-1236 (2015).
- Li, M., de Graaf, I. A., Groothuis, G. M. Precision-cut intestinal slices: alternative model for drug transport, metabolism, and toxicology research. Expert Opinion on Drug Metabolism & Toxicology. 12 (2), 175-190 (2016).
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Wagner, D. E., et al. Design and Synthesis of an Artificial Pulmonary Pleura for High Throughput Studies in Acellular Human Lungs. Cellular and Molecular Bioengineering. 7 (2), 184-195 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。