Method Article
Génération de Cultures de tissus pulmonaires humains de 3D (3D-SFLC) pour la modélisation de la maladie
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole pour la préparation de tranches de poumon de coupe de précision humain rempli d’agarose de tissus réséqués du patient qui sont aptes à produire des cultures de tissus pulmonaires 3D aux maladies pulmonaires humaines modèle dans études biologiques et biomédicales.
Résumé
Traduction de nouvelles découvertes à la maladie humaine est limitée par la disponibilité des modèles axée sur les tissus humains de la maladie. Tranches de coupe de précision du poumon (CIP) utilisées comme cultures de tissus pulmonaires 3D (3D-SFLC) représentent un cadre élégant et modèle de culture cellulaire 3D biologiquement très pertinentes, qui ressemblent fortement à des tissus sur place en raison de leur complexité, biomécanique et moléculaires composition. Découpage de tissu est largement appliqué dans divers modèles animaux. 3D-SFLC dérivé PCLS humaine peut être utilisé pour analyser les réponses à nouveaux médicaments, qui pourraient encore aider à mieux comprendre les mécanismes et les effets fonctionnels de drogues dans les tissus humains. La préparation de PCLS d’échantillons de tissus réséqués chirurgicalement pulmonaires des patients, qui ont connu la lobectomie pulmonaire, augmente l’accessibilité des malades et les tissus péri-tumoral. Nous décrivons ici un protocole détaillé pour la génération de PCLS humaine de tissus réséqués chirurgicalement soft-élastique patients pulmonaires. Agarose a été introduit dans l’espace de broncho-alvéolaire de la resectates, donc préservant la structure des poumons et augmente la rigidité du tissu, qui est cruciale pour le tranchage ultérieur. tranches de 500 µm d’épaisseur ont été préparés depuis le bloc de tissu avec un vibratome. Poinçons de biopsie de PCLS assurer tissu comparable tailles d’échantillon et augmentent la quantité d’échantillons de tissus. Les cultures de tissus pulmonaires généré peut être appliqués à une variété d’études en biologie du poumon humain, y compris la physiopathologie et les mécanismes des différentes maladies, telles que les processus fibrotiques à ses niveaux cellulaire au (sous-). L’avantage plus élevé du modèle 3D-LTC ex vivo est sa représentation proche du poumon humain in situ en ce qui concerne l’architecture 3D tissus, diversité de type cellulaire et anatomie du poumon ainsi que le potentiel pour l’évaluation des tissus de patients individuels, qui est pertinent développer de nouvelles stratégies pour la médecine de précision.
Introduction
Maladies pulmonaires chroniques et aiguës sont une cause majeure de morbidité et mortalité dans le monde1. Pour les patients atteints de maladie pulmonaire chronique comme la maladie pulmonaire obstructive (BPCO)2, asthme sévère3, poumon cancer4 et diffus parenchymateuses pulmonaires maladies5, thérapies curatives ne sont actuellement pas disponibles. Bien que des études sur des modèles animaux de maladies pulmonaires ont approfondi la compréhension des maladies pathomécanismes6 et ont permis d’identifier de nouvelles cibles thérapeutiques potentielles7,8,9, ces modèles présentent des différences biologiques et physiologiques pertinentes par rapport aux hommes10. Pour surmonter ces divergences entre biologie murine et humaine, mais aussi, l’anatomie humaine ex vivo culture de tissu pulmonaire 3D (3D-LTC) systèmes sont utilisés dans divers domaines de la recherche biomédicale. Ces systèmes de culture 3D-LTC reposent sur des tranches de coupe de précision du poumon (CIP). La génération de PCLS ex vivo permet l’analyse de l’une troisième dimension spatiale, qui permet l’étude des relations spatiales et fonctionnelles des cellules en entier alvéoles et airways11, ainsi que de l’interstitium, système vasculaire et mésothélium. Notamment, PCLS ex vivo modèles sont multicellulaires, ce qui signifie qu’ils contiennent des cellules plus fonctionnelles des poumons in situs, traduisant ainsi étroitement l’environnement biologique indigène lipo et ainsi surmonter les cellules limitées et l’interaction cellule-matrice en 2D plus approches de la culture cellulaire. Jusqu'à présent, ex vivo PCLS murins ont été utilisées pour modéliser des maladies pulmonaires, comme la BPCO12, poumon fibrose13, de cancer du poumon14, infection virale15,16, de dysplasie bronchopulmonaire17, et 18de l’asthme. Toutefois, une proportion considérable de nouvelles pharmacothérapies dans les maladies pulmonaires humaines qui ont été étudiés dans les essais cliniques ne se traduisent pas à la clinique en raison de leur manque d’efficacité ou l’innocuité, assumingly raison de pourtant des différences considérables entre l’homme et murine biologie et maladie19,20,21.
Sur plusieurs années, PCLS humaines ont été utilisés dans une large mesure pour évaluer la toxicité pulmonaire de produits chimiques et de médicaments. Seulement récemment, tissus pulmonaires humains a été utilisée de patients atteints de MPOC22,23, asthme24et poumon fibrose25, pour poursuivre des études physiopathologiques et pharmacologiques. Par à l’aide de matériel organique patients réséqués et générant PCLS, on peut récapituler les caractéristiques principales de la maladie dans un complexe tissu 3D environnement22 représentant et le maintien de la diversité cellulaire native de l’orgue, la plupart. En outre, les tissus malades appliqué dans une variété de configurations expérimentales s’est avéré imiter la maladie comme changements dans le foie, intestin et les reins26,27,28,29.
Traitement du tissu pulmonaire reste cependant difficile pour plusieurs raisons. À la différence des tissus solides, parenchyme pulmonaire natif a tendance à s’effondrer sans ventilation et expositions plus faible rigidité des tissus. Ces propriétés font obstacle à la Coupe du tissu. Ainsi, remplissage des voies respiratoires et de l’espace alvéolaire avec bas point de fusion point d’agarose conserve la structure du poumon natif et fournit la rigidité nécessaire pour trancher le coupe de précision des poumons murins et humains30. Resectates du poumon humain donnés aux fins de la recherche sont par leur nature anatomique, génétiquement et physiologiquement très diversifiée, ce qui souvent présente une grande variabilité inter patiente lors de l’exécution d’expériences25. Contrairement à la lobe entier ou un poumon entier des explants, échantillons de poumon réséqués au moyen de la chirurgie thoracique ne font pas nécessairement suivre les segments anatomiques et requièrent donc une préparation spéciale. Dans cet article, nous fournissons un protocole détaillé et optimisé pour la génération d’humains PCLS de tissu réséqué pulmonaire et leur culture ultérieure et l’utilisation expérimentale des maladies pulmonaires modèle.
Protocole
L’utilisation de tissus humains a été approuvée par le Comité d’éthique de l’Université de Ludwig-Maximilien [Munich, Allemagne (numéro de projet 455-12)]. Résections pulmonaires exempt de tumeurs humaines ont été fournies par le Asklepios Biobank pour les maladies pulmonaires (numéro de projet de Gauting (Allemagne), 333-10).
Remarque : Toutes les procédures de production PCLS humaine (Figure 1) sont effectuées sous une hotte à flux laminaire stérile.
1. préparation des Instruments et matériaux
-
Préparer tout le matériel pour le gonflage des tissus pulmonaires avec agarose comme décrit ci-dessous.
- Préparer le milieu de culture : Eagle modifié (DMEM) F-12 de Dulbecco additionné de L-Glutamine, HEPES, pénicilline de IE 10 000, 10 000 IE streptomycine et 0,1 % (v/v) sérum de veau fœtal.
Remarque : Support est utilisé à 37 ° C. - Préparer un plateau stérile en métal recouvert de papier de soie. Placez une boîte de Petri stérile 15 cm cellulaire sur le plateau.
- Remplir le plat de culture cellulaire avec le 15 mL de milieu de culture.
- Préparer une solution à 3 % (p/v) d’agarose en dissolvant la quantité appropriée de bas point de fusion point d’agarose dans un minimum de 30 mL de milieu de culture.
- Chauffer la solution dans un four à micro-ondes jusqu'à ébullition. Refroidir la solution de gel d’agarose à 42 ° C dans un bain d’eau. Conserver la solution d’agarose liquide stockée dans l’eau du bain.
- Préparer plusieurs tubes coniques 50 mL, remplis de l’agarose liquide.
- Préparer le milieu de culture : Eagle modifié (DMEM) F-12 de Dulbecco additionné de L-Glutamine, HEPES, pénicilline de IE 10 000, 10 000 IE streptomycine et 0,1 % (v/v) sérum de veau fœtal.
2. les tissus pulmonaires réséqués
- Magasin frais tumeur poumon gratuit tissu de lobectomie resectates immédiatement après la résection dans un milieu DMEM F-12 à 4 ° C jusqu'à l’étape 3.
- Ne dépassez pas la durée d’ischémie froide de 4 à 8 heures avant de procéder.
3. inspection et sélection de tissu réséqué avant le remplissage de gel d’Agarose
- Soulevez le tissu du milieu avec des pincettes. Afin d’éviter d’endommager les tissus, en particulier à la plèvre, gérer le tissu avec des pincettes dans les voies respiratoires uniquement.
- Marquer la qualité des tissus par les critères de la partition de remplissage d’Agarose poumon définies au tableau 1.
- Passez à l’étape 4, si la qualité du tissu est marquée supérieur ou égal à 72. Si la qualité du tissu est marquée en dessous de 60, ne poursuivez pas plus loin avec l’agarose de remplissage.
Remarque : Si le score de tissu est entre 60 et 68, le remplissage de gel d’agarose et découpage de tissus encore peuvent produire des résultats raisonnables, et une décision finale pour le prolongement de l’expérience doit être faite des cas au cas. Toutefois, les tissus pulmonaires ne répondant pas aux exigences ci-dessus, surtout échoue dans l’agarose de remplissage.
4. poumon tissu Inflation par remplissage d’Agarose
- Soulevez le tissu depuis le support de stockage et vidange excès médiatique du tissu. Transvaser le tissu pulmonaire dans la boîte de Petri de 15 cm établi au paragraphe 1.1.2.
- Remplissez une seringue de 30 mL avec l’agarose de point bas point de fusion de 1.1.3.
- Préparer un cathéter veineux périphérique en enlevant l’obturateur et l’attacher à une seringue de 30 mL
- Identifier une bronche (0,5 à 3 mm de diamètre) dans le tissu qui est ventilation une partie intacte du tissu (voir Figure 2).
- Introduire la canule dans la bronche sélectionnée (0,5 à 3 mm de diamètre).
- Poussez doucement la canule doucement vers l’avant aussi loin que possible.
- Sceller la bronche autour de la canule en compressant la paroi bronchique autour de la canule avec une pince, serrage idéalement toute artère pulmonaire adjacent en même temps.
- Occlure autres airways supplémentaires avec une pince chirurgicale afin d’éviter d’agarose fuit à travers ces voies respiratoires.
- Soulevez le tissu avec la pince de la boîte de pétri.
- Verser manuellement l’agarose avec la seringue non plus vite que 0,3 mL/s. La vitesse d’agarose de remplissage peut varier entre 0,05 et 0,3 mL/s, en raison de la résistance hétérogène des voies respiratoires et/ou atélectasie.
-
Cas de lésion haute résistance tout en remplissage ou agarose une fuite provenant du tissu, recommencer toute la procédure avec une bronche différente de l’étape 4.4. Effectuer le dépannage tel que décrit ci-dessous.
Remarque : Le degré d’agarose remplissage est fortement tributaire de la position du cathéter dans le tissu et la pénétration en profondeur des résultats cathéter en gel d’agarose remplissage du petit cône comme régions (*) du tissu pulmonaire (Figure 2).- En cas de haute résistance, essayez le positionnement du cathéter mène à remplissage adéquat de la plupart des régions du tissu (#) (Figure 2D).
- Comme fiches de début agarose solidifiée dans les bronches proximales ou autre airway obstruction (flèche) peut conduire à un remplissage incomplet du tissu (Figure 2E), ne forcez pas sur gel d’agarose de remplissage car cela pourrait conduire à des anomalies dans la zone remplie, mais pas dans un remplissage de les pièces de tissu obstruée.
- Si l’arbre respiratoire, dérivé de la bronche canulée est endommagé au cours de la résection et l’agarose remplissage entraîne une fuite constante de l’agarose liquide (flèche dans la Figure 2F), placer le cathéter dans une partie plus périphérique du système des voies de remplir au moins une petite partie du tissu (*) (Figure 2). En outre, sceller les voies périphériques endommagés avec une pince chirurgicale (flèche) (Figure 2 H).
- Appliquer l’agarose jusqu'à ce que le tissu pulmonaire est complètement rempli. Ne surgonflez pas le tissu comme ceci peut causer des dommages irréversibles à la structure du tissu et de ses cellules.
- Fixez la bronche qui a été utilisée pour le remplissage immédiatement. Retirer la canule avant serrage.
- Incuber le tissu dans le milieu de culture à 4 ° C pendant 30 min assurer la solidification de l’agarose.
- Si le tissu réséqué a plusieurs entrées bronchiques, répétez l’étape 4.2 à 4,13 jusqu'à ce que toutes les pièces de tissu sont remplis de gel d’agarose.
- Magasin l’agarose Asmund le tranchage des sections de tissu pulmonaire dans un milieu froid 4 ° C.
5. précision de coupe poumon tranchage
-
Identifier les régions dans le tissu pulmonaire qui sont remplies solidement l’agarose. Les régions solidement remplies ne s’effondrera pas lorsqu’elles sont pressées doucement avec des pincettes contre le fond de la boîte de culture cellulaire.
- L’accise un bloc de3 de 1 à 1,5 cm des régions décrite au point 5.1, considérant qu’un côté encore devrait être recouvertes de plèvre.
- Fixez chaque bloc de tissu individuels avec le côté pleural communiquant avec le titulaire de la vibratome en utilisant une colle cyanoacrylate.
Remarque : La plèvre est légèrement élastique et par conséquent empêche la coupe avec la lame vibratome. Placé sur le support papier, la plèvre n’interférera pas avec la coupe et, surtout, forme une barrière naturelle entre la colle cyanoacrylate et parenchyme de tissu permettant une diffusion minimale de la colle. - Découper le tissu pulmonaire avec le vibratome avec les paramètres suivants : épaisseur : 500 µm, fréquence : 100 Hz, amplitude du couteau : 1,2 mm, vitesse d’avancement de la lame de 3 à 12 µm/s, ce qui dépend de la rigidité des tissus. Réduire la vitesse de protrusion de la lame si la tranche n’est pas coupée correctement, ou si le bloc de tissu lui-même commence à vibrer.
- Transférer délicatement la tranche en le soulevant avec une pince à partir du tiroir vibratome dans un puits d’une plaque de 12 puits rempli de milieu de culture. Enfin, incuber les tranches de poumon dans un incubateur sous des conditions de culture cellulaire standard.
- Arrêt de trancher quand il reste 2-3 mm du bloc de tissu non découpé puisque la colle cyanoacrylate peut avoir compromis l’intégrité des tissus de cette région.
6. génération des poinçons PCLS
- Transférer les tranches de poumon d’un seul puits dans un plat de vide de 10 cm.
- Posez un perforateur de biopsie 4 mm perpendiculairement à la surface supérieure d’un CIP et commencez à déplacer le puncher dans les rotations dans le sens horaire et anti-horaire.
- Remplir le milieu de culture cellulaire dans les puits d’une plaque à 96 puits. Soulever les poinçons de tissus avec une pince et transférer les coups de poing dans les puits d’une plaque de 96 puits. Enfin, incuber les poinçons de poumon immergés dans le milieu préparé en 1.1.1. dans un incubateur de culture de cellules dans des conditions normalisées (21 % (v/v) d’oxygène, 5 % (v/v) de dioxyde de carbone et 95 % d’humidité, à 37 ° C).
7. Culture de tissus et de récolte d’échantillon
- Culture du CIP et poinçons pour la nuit dans un incubateur sous des conditions de culture cellulaire standard.
- Culture PCLS et coups de poing dans les conditions décrites pour un maximum de 120 heures après leur génération pour assurer la fonction et la viabilité cellulaire.
- Pour la récolte des protéines ainsi que RNA, laver PCLS et poinçons trois fois en solution saline tamponnée au phosphate (PBS), transférez-les dans cryovials et snap-congélation dans l’azote liquide.
-
Les poinçons de surnageant moyenne échantillon de PCLS cultivés pour l’analyse des protéines sécrétées.
- Pour les analyses histologiques, lavez le PCLS et poinçons trois fois avec du PBS et fixer avec les 4 % paraformaldéhyde en incubant pendant 30 min à 37 ° C. Enfin, rangez le PCLS dans du PBS à 4 ° C pour une coloration plus loin en aval.
Résultats
Génération de CIP
La génération de CIP peut être séparée en quatre étapes essentielles : résection du tissu pulmonaire chirurgicale, remplissage de gel d’agarose, axée sur le vibratome PCLS la génération et culture du CIP. Le tissu de poumon réséqué est rempli d’agarose point bas point de fusion, ce qui ajoute de la rigidité nécessaire pour le tissu pulmonaire pour trancher et préserve la structure du poumon natif et l’architecture. À noter, PCLS génération est très chronophage, donc souvent nuit stockage du tissu pulmonaire rempli dans un milieu DMEM F-12 peut être inclus comme une étape supplémentaire et génération PCLS est démarrée sur le lendemain. Selon la configuration expérimentale suivante, PCLS généré peut être incubées pendant la nuit dans le milieu de culture cellulaire standard contenant du sérum de veau fœtal de 0,1 % (p/v), avant l’appliquent des conditions expérimentales. 3D-OLT était viables et expose la fonctionnalité cellulaire (par exemple, la sécrétion de protéine agent tensio-actif) jusqu'à 120 h22 dans les conditions de culture décrites dans le présent protocole (Figure 1) et pourrait être optimisé à améliorer son.
Remplissage de gel d’agarose
Pour le remplissage d’agarose du tissu, une canule d’un cathéter veineux périphérique avec un diamètre de 1,3 mm, attaché à la seringue remplie de gel d’agarose a été insérée dans une bronche à la surface du tissu coupé (Figure 2 a). Bronches sont souvent localisées près d’une artère pulmonaire. Tandis que les artères ont des parois plus minces et ont tendance à s’effondrer, bronches ont montré une bonne lumière visible. Selon l’intégrité du tissu, le cathéter peut être avancé à travers plusieurs générations de l’arbre respiratoire dans la périphérie du poumon. La bronche pénétrée a été scellée autour de la canule à l’aide de la pince à épiler (Figure 2 b). L’artère pulmonaire peut être bridé avec la pince à épiler en même temps. Par la suite, le tissu est levé, et le liquide gel d’agarose est doucement instillé dans les voies respiratoires.
Selon la position du cathéter, une majorité des tissus peut être remplie de liquide d’agarose (Figure 2D). Éventuellement, cône comme parties du tissu pulmonaire, qui reflètent le parenchyme du poumon ventilé par la bronche pénétrée, pourrait se remplissent avec l’agarose (Figure 2). Dans les deux scénarios, un patron caractéristique des régions solidement rempli de tissus peut être observé : tout d’abord, une grande partie du tissu est renseignée de cales (Figure 2D), ou Deuxièmement, petite saillie autour des zones de fond tissu rempli régions apparaissent ( Figure 2). Si les parties des voies respiratoires s’obstruer en raison de caillots d’agarose ou d’autres causes, pièces du tissu ne pourraient pas être correctement remplis d’agarose. Ainsi, uniquement les parties du tissu peuvent être applicables pour trancher. En cas de fuites durant l’agarose procédure de remplissage, parties de l’arbre respiratoire rempli pourraient obtenir perforés et remplissage du tissu pulmonaire obtient presque impossible, cependant, les solutions possibles comprennent le remplissage par une bronche plus périphérique, une plus profonde pénétration de la canule dans les voies aériennes distales (Figure 2), ou de serrage potentielle de la zone de fuite (Figure 2 H).
Précision de coupe poumon tranchage
Blocs de tissu à une longueur et une largeur de 1 à 1,5 cm ont été excisés de regions tissulaires, qui ont été remplies complètement solidifié agarose ()Figure 3 a-3 b). Ensuite, les blocs de tissu individuels ont été collées sur le support papier de la vibratome (Figure 3). 500 µm PCLS épais ont été générés, tandis que le bloc de tissu à la vibratome avançait vers l’avant avec des vitesses entre 3 à 12 µm/s. (Figure 3D-3F). Enfin, les PCLS étaient immergés dans un milieu de culture cellulaire contenant du sérum de veau fœtal 0,1 % (p/v) et cultivées dans des conditions de culture cellulaire standard, comme décrit étape 7.
Afficheurs expérimentales d’humain 3D-LTC après 48h de culture
Une coloration d’immunofluorescence représentatif, comme décrit par Alsafadi Al.25, est montrée dans la Figure 4 a-4 C. Immunomarquage de la fibronectine (rouge) et des noyaux de cellules (DAPI, bleu), autorisés pour l’imagerie de la structure alvéolaire préservée dans l’humain 3D-LTC ex vivo. Traitement de l’être humain PCLS poinçons avec une cytokine profibrotic cocktail (y compris le facteur de croissance transformant bêta 1, facteur de croissance plaquettaire dérivé AB, l’acide lipophosphatidyl et le facteur de nécrose tumorale alpha) pour 48 h a entraîné des modifications de type fibrose chez les humains 3D-OLT. Par qPCR, une induction significative des propres à la fibrose de la matrice extracellulaire composants collagène type 1 et la fibronectine gènes en 3D-LTC poinçons a été observée après traitement avec le cocktail de profibrotic (Figure 4). En outre, des niveaux de protéine de la vimentine marqueur mésenchymateuses trouvées surexprimés dans 3 des 4 patients après traitement des poinçons 3D-LTC (Figure 4E).
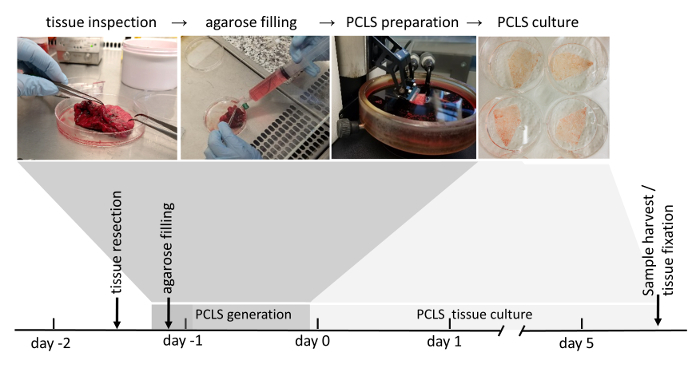
Figure 1 : flux de travail de génération PCLS. Les zones exemptes de tumeur des résections pulmonaires sont soigneusement inspectés en raison de leur intégrité des tissus. Si le tissu est marqué adapté pour une utilisation ultérieure (notation est expliquée en détail dans la section matériel et méthodes), il est ensuite rempli de liquide d’agarose. Blocs de tissus remplis de solidifiée d’agarose sont tranchés par la suite avec un vibratome. Immergé dans un milieu de culture cellulaire, 3D-LTC sont cultivés jusqu'à 120 h après leur génération. Analyses en aval de la 3D-OLT impliquent expression protéique ou RNA, vivre-tissu fluorescence imaging, ainsi que par immunofluorescence souillant après fixation du tissu. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
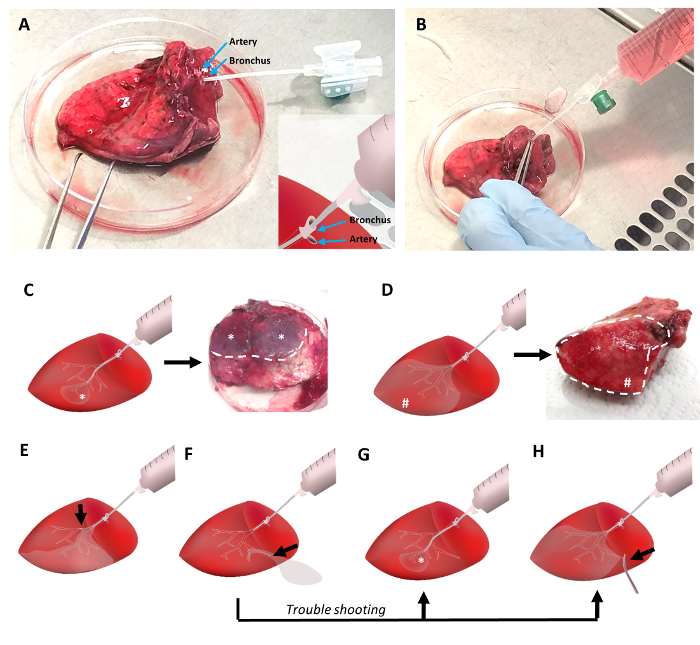
Figure 2 : le tissu pulmonaire de remplissage à bas point de fusion point agarose. Le tissu pulmonaire est canulé avec un cathéter veineux périphérique qui est inséré dans une bronche adjacente à l’artère pulmonaire (Figure 2 a). Pincettes servent à fixer la canule dans la bronche et pour bloquer l’artère pulmonaire afin d’éviter une fuite de l’agarose liquide. Liquide gel d’agarose à 42 ° C est versé dans le tissu pulmonaire avec une seringue de 30 mL (Figure 2 b). Un positionnement distale de la canule pendant le remplissage se traduira par de petites zones de tissu rempli (Figure 2), tandis que le positionnement proximale assurera le remplissage d’un plus grand volume de tissus (Figure 2D). Les obstructions des voies respiratoires réduira la quantité de tissu volume qui peut être rempli (Figure 2E). En cas de fuite de gel d’agarose, une canule distale de positionnement et/ou de serrage du côté de fuite permet d’agarose bon remplissage du tissu pulmonaire ()Figure 2F-2 H). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : coupe de précision poumon tranchage. Un tissu de poumon avec succès rempli de gel d’agarose est utilisé pour exciser un morceau d’un bloc de tissu (1 x 1,5 cm x 1 cm) avec un scalpel (Figure 3 a). Ensuite le bloc tissus excisés est collé sur le support papier, échelle graphique indique 1 cm (Figure 3 b). De préférence, le tissu est collé avec sa surface pleurale à la surface du support tissu tel qu’illustré en Figure 3. tranches de 500 µm d’épaisseur sont coupés par le vibratome avec un couteau saphir dans un angle de 10° - 15° par rapport au tissu (Figure 3D et 3F). Résultats de la procédure de coupe en tranches de 2-3 cm3 grand poumon intact, échelle bar = 5 mm (Figure 3F). En outre, à l’aide d’un perforateur de biopsie, petits poinçons reproductibles d’un diamètre de 4 mm peuvent être générés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
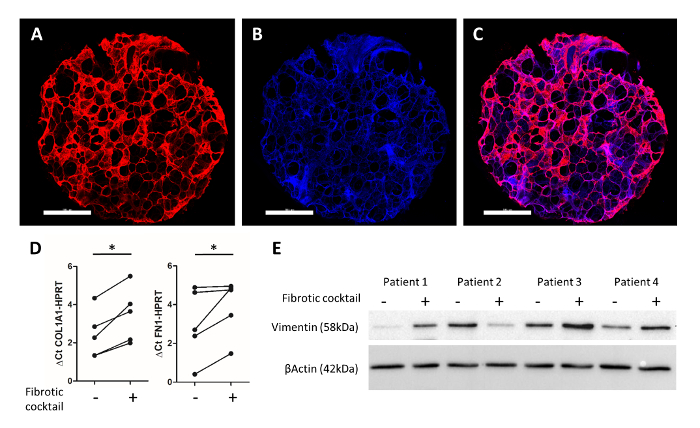
Figure 4 : afficheurs expérimentales d’humain 3D-SFLC après 48h de culture. Un coup de poing humain 3D-FLC de 4 mm de diamètre a été immunomarquées pour la fibronectine (en rouge) et au DAPI (en bleu) ()Figure 4 a-4C). Barreaux de l’échelle = 1 000 µm. la Figure 4 montre l’image fusionnée. Analyse de RNA de PCLS par RT-PCR quantitative montre une augmentation significative de l’expression du gène COL1A1 et FN1 par le cocktail de profibrotic25. Figure 4E affiche un immunoblot de lysats de protéines entières du CIP, qui ont été traités avec un cocktail fibrotique25. Sondage pour la vimentine et β-actine a démontré une expression de la protéine accrue du marqueur mésenchymateuse (vimentine) après que traitement avec profibrotic facteurs dans des échantillons de patients 1, 3 et 4. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Critère | Points |
| L’échantillon de tissu a la surface pleurale intacte. | 20 |
| L’échantillon de tissu semble macroscopiquement intact, sans incisions, écrasement, ruptures et distorsions. | 20 |
| L’échantillon de tissu contient au moins un bronches avec un diamètre > 1mm. | 20 |
| L’échantillon de tissu ne contient pas ou que peu s’élève de sang. | 4 |
| L’échantillon de tissu a été stocké entièrement dans le milieu et ne montre aucun signe évident d’une atélectasie. | 4 |
| L’échantillon de tissu a été réséquée au cours des quatre dernières heures. | 4 |
| L’échantillon de tissu est supérieure à 5cm dans son plus grand diamètre. | 4 |
| Score en somme : |
Tableau 1 : poumon Agarose remplissage Score. Le poumon d’Agarose remplissage Score (LAFS) est corrélée avec le taux de réussite pour remplir une résection de tissus avec agarose pour sa production de PCLS axée sur le vibratome ultérieure. Le score résume tous les points des conditions réunies par le tissu. Un LAFS égale ou au-dessus de 72 prédit l’agarose de bonne propriétés de remplissage, une note inférieure à 60 prédit un échec très probable de remplissage d’agarose du tissu.
Discussion
Le protocole décrit dans ce manuscrit couvre la génération de PCLS de resectates tissu de poumon humain rempli d’agarose liquide et tranchage vibratome ultérieur. Génération de tranches de tissus a été démontrée avant pour un couple des organes, comme le foie et le cerveau, tandis que la rigidité inhérente de ces organes autorisés directe trancher sans aucune modification du tissu. À noter, la bonne préparation initiale du tissu pulmonaire est l’étape plus cruciale dans la génération de CIP. Remplissage de gel d’agarose du poumon est la méthode de choix pour stabiliser sa nature douce et élastique, tout en assurant une génération PCLS homogène et reproductible. Grandes voies aériennes du tissu pulmonaire réséqués sont canulés pour permettre l’accès des petites voies aériennes, ainsi que sur le parenchyme pulmonaire intact. L’absence d’une plèvre intacte, qui rend agarose remplissant presque impossible, est des principales raisons pourquoi les tissus pulmonaires ne sont généralement pas utilisable pour trancher le poumon. Prospectivement, une plèvre synthétique initialement conçu pour effectuer des expériences fonctionnelles sur des échafauds decellularise potentiellement pourrait être appliqué que pour réaliser le remplissage d’agarose réussie des explants qui n’ont pas une plèvre intact31. Résections résultant dans un morceau de tissu de poumon humain avec plèvre intacts sont essentielles pour générer des blocs de tissus pour le tranchage. Tissu réséqué est plus disponible en raison du tissu exempt de tumeur de la résection du cancer que lobes entièrement intactes ou ensemble-poumon des explants de patients ayant subi une transplantation pulmonaire.
Deux systèmes sont généralement utilisés pour produire le CIP : la Krumdieck tissu trancheuse15 et vibratoires microtomes (vibratomes). Trancheuses de tissu génèrent des tranches en passant un bloc de tissu par un navire de métal, qui coupe le PCLS à 90° à la fin de ce navire. Vibratomes générer PCLS en déplaçant une vibrante couteau horizontalement sur un bloc ancré de tissu qui est immergé dans un bain moyen refroidi, ce qui par rapport à la trancheuse Krumdieck exerce moins force de cisaillement sur le tissu. Il en résulte un traitement moins rigoureux du tissu avant une culture. En revanche, la coupe vibratome est plus de temps et consommer des travaux. Dans nos mains, les poinçons de vibratome tranchage activé la production d’un maximum de 100 PCLS ou 500 PCLS en une seule journée, suffisante pour des études plus expérimentales. PCLS peuvent être cultivées de diverses façons : (a) jointe à Trans-Herbert George wells, générant ainsi une interface d’air liquide système (ALI), (b) en culture d’organe dynamique (DOC), ou (c) immergé dans le milieu de culture cellulaire à des conditions de culture cellulaire standard. La culture en détail du CIP a été précédemment décrit22,23,25; Cependant, une norme commune des conditions de culture entre leur utilisation dans divers laboratoires dans le monde entier est toujours porté disparue. En particulier, le temps de culture pourrait être critique : comme dans PCLS murine, une perte des cellules alvéolaires de type positif 2 SFTPC est observée après 144 h, mais pas après 120 h22. En outre, l’activité métabolique semble rester stable murine22 et humaine PCLS25 pendant 120 h.
Il y a quelques limitations techniques pour la génération de CIP : le nombre et la taille de la resectates fluctue au fil du temps ; l’efficacité de l’agarose de remplissage, qui dépend de la présence de plèvre intact dans les tissus obtenus, détermine le succès final de la génération PCLS ; et la destruction des tissus causée par des changements pathologiques dans le tissu pulmonaire (malades) obtenus risquent d’interférer avec la préparation de la CIP. Obstructions des voies aériennes et tissu fibreux, manque d’espace alvéolaire intact entravent avec agarose remplissage et rendant ainsi le tranchage du tissu fibrotique une tâche exigeante. Emphysémateuses tissus comme trouvent dans les maladies comme MPOC ou déficit en alpha-1-anti-trypsine ne pourrait pas supporter la pression d’agarose remplissage et se traduira par rupture des alvéoles et objets architectes. Dans ces cas, l’utilisation de la concentration d’agarose faible, par exemple, 1 % (p/v), peut être utile pour diminuer la pression et la vitesse pendant le remplissage de gel d’agarose. Dans l’ensemble, l’état de la maladie du tissu peut limiter considérablement l’utilisation du tissu pour la génération de la CIP. Tous ces paramètres déterminent la quantité de PCLS qui peut être généré à partir du tissu pulmonaire, et également la quantité de temps nécessaire pour produire le PCLS. Plus loin les limites de CIP sont incohérences entre les tranches de poumon différentes en ce qui concerne le contenu de taille ou d’un tissu, qui exige de nouvelles étapes de normalisation pour les expériences. Pour y remédier, poinçons de biopsie des régions similaires de la même tranche peuvent être générés. Cette procédure est susceptible de réduire la variabilité des tissus et, comme un avantage supplémentaire, augmenter le nombre d’échantillons PCLS qui peut être utilisé pour des expériences.
En conclusion, les cultures de tissus pulmonaires humains de 3D d’agarose rempli PCLS fournissent un modèle humain complex pour l’étude de la physiologie pulmonaire et les maladies. Le protocole fournit une description détaillée de la préparation de PCLS de tissu réséqué pulmonaire et de leur culture et en outre relève les défis en remplissage de gel d’agarose des résections pulmonaires humaines et des moyens de les surmonter.
Déclarations de divulgation
Tous les auteurs déclarent sans intérêts financiers concurrents.
Remerciements
Les auteurs sont reconnaissants à Marisa Neumann pour assistance technique d’experts. Tous les tissus pulmonaires ont été gracieusement fournies par le CTD-M Bio-Archive. Ce travail a été soutenu par le centre allemand de subventions de recherche de poumon (DZL), l’Association Helmholtz et CPC Research School.
matériels
| Name | Company | Catalog Number | Comments |
| Vibratome Hyrax V50 | Zeiss | - | |
| Hyrax CU 65 | Zeiss | - | |
| Vasofix Braunüle 18 G | B. Braun Melsungen AG | 4268130B | |
| 30 mL NORM-INJECT | Henke Sass Wolf | 4830001000 | |
| Guarded disposable scalpels, sterile | Swann-Morton | ||
| Loctite 406 | Henkel | LOCTITE 406 | |
| Synthetic Single Crystal Sapphire | Delaware Diamond Knives | - | |
| Dulbecco's Modified Eagle Medium F-12 Nutreient Mixture (Ham) + L-Glutamine + 15mM HEPES | Gibco | 31330-038 | |
| Penicillin Streptomycin | Gibco by Life Technologies | 15070-063 | |
| Special process fetal bovine serum (Sera Plus) | Pan Biotech | P30-3702 | |
| Disposable Biopsy Punch | pfm medical | 48401 | |
| 96 Well, Black/Clear, Tissue Culture Treated Plate, Flat Bottom with Lid, sterile | Falcon / Corning | 353219 | |
| Agarose, low geling temperature | Sigma | A9414-100G |
Références
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2095-2128 (2010).
- Rosenberg, S. R., Kalhan, R., Mannino, D. M. Epidemiology of Chronic Obstructive Pulmonary Disease: Prevalence, Morbidity, Mortality, and Risk Factors. Seminars in Respiratory and Critical Care Medicine Med. 36 (4), 457-469 (2015).
- Hekking, P. P., et al. The prevalence of severe refractory asthma. The Journal of Allergy and Clinical Immunology. 135 (4), 896-902 (2015).
- Woodard, G. A., Jones, K. D., Jablons, D. M. Lung Cancer Staging and Prognosis. Cancer Treatment and Research. 170, 47-75 (2016).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. American Journal of Respiratory and Critical Care Medicine. 183 (4), 431-440 (2011).
- Burgstaller, G., et al. The instructive extracellular matrix of the lung: basic composition and alterations in chronic lung disease. European Respiratory Journal. 50 (1), (2017).
- Degryse, A. L., Lawson, W. E. Progress toward improving animal models for idiopathic pulmonary fibrosis. The American Journal of the Medical Sciences. 341 (6), 444-449 (2011).
- Fricker, M., Deane, A., Hansbro, P. M. Animal models of chronic obstructive pulmonary disease. Expert Opinion on Drug Discovery. 9 (6), 629-645 (2014).
- Sagar, S., Akbarshahi, H., Uller, L. Translational value of animal models of asthma: Challenges and promises. European Journal of Pharmacology. 759, 272-277 (2015).
- Williamson, J. D., Sadofsky, L. R., Hart, S. P. The pathogenesis of bleomycin-induced lung injury in animals and its applicability to human idiopathic pulmonary fibrosis. Experimental Lung Research. 41 (2), 57-73 (2015).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of beta2-adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Skronska-Wasek, W., et al. Reduced Frizzled Receptor 4 Expression Prevents WNT/beta-Catenin-driven Alveolar Lung Repair in Chronic Obstructive Pulmonary Disease. American Journal of Respiratory and Critical Care Medicine. 196 (2), 172-185 (2017).
- Lehmann, M., et al. Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo. European Respiratory Journal. 50 (2), (2017).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Communication and Signaling. 12, 73 (2014).
- Ebsen, M., et al. Infection of murine precision cut lung slices (PCLS) with respiratory syncytial virus (RSV) and chlamydophila pneumoniae using the Krumdieck technique. Pathology - Research and Practice. 198 (11), 747-753 (2002).
- Kennedy, J. L., et al. Effects of rhinovirus 39 infection on airway hyperresponsiveness to carbachol in human airways precision cut lung slices. The Journal of Allergy and Clinical Immunology. 141 (5), 1887-1890 (2018).
- Royce, S. G., et al. Airway Remodeling and Hyperreactivity in a Model of Bronchopulmonary Dysplasia and Their Modulation by IL-1 Receptor Antagonist. American Journal of Respiratory Cell and Molecular Biology. 55 (6), 858-868 (2016).
- Donovan, C., et al. Rosiglitazone elicits in vitro relaxation in airways and precision cut lung slices from a mouse model of chronic allergic airways disease. American Journal of Physiology-Lung Cellular and Molecular Physiology. 309 (10), L1219-L1228 (2015).
- Zscheppang, K., et al. Human Pulmonary 3D Models For Translational Research. Biotechnology Journal. 13 (1), (2018).
- Fisher, R. L., et al. The use of human lung slices in toxicology. Human & Experimental Toxicology. 13 (7), 466-471 (1994).
- Wang, L., et al. Differences between Mice and Humans in Regulation and the Molecular Network of Collagen, Type III, Alpha-1 at the Gene Expression Level: Obstacles that Translational Research Must Overcome. International Journal of Molecular Sciences. 16 (7), 15031-15056 (2015).
- Uhl, F. E., et al. Preclinical validation and imaging of Wnt-induced repair in human 3D lung tissue cultures. European Respiratory Journal. 46 (4), 1150-1166 (2015).
- Switalla, S., et al. Natural innate cytokine response to immunomodulators and adjuvants in human precision-cut lung slices. Toxicology and Applied Pharmacology. 246 (3), 107-115 (2010).
- Banerjee, A., et al. Trichostatin A abrogates airway constriction, but not inflammation, in murine and human asthma models. American Journal of Respiratory Cell and Molecular Biology. 46 (2), 132-138 (2012).
- Alsafadi, H. N., et al. An ex vivo model to induce early fibrosis-like changes in human precision-cut lung slices. American Journal of Physiology-Lung Cellular and Molecular Physiology. 312 (6), L896-L902 (2017).
- Westra, I. M., Oosterhuis, D., Groothuis, G. M., Olinga, P. Precision-cut liver slices as a model for the early onset of liver fibrosis to test antifibrotic drugs. Toxicology and Applied Pharmacology. 274 (2), 328-338 (2014).
- Vatakuti, S., Schoonen, W. G., Elferink, M. L., Groothuis, G. M., Olinga, P. Acute toxicity of CCl4 but not of paracetamol induces a transcriptomic signature of fibrosis in precision-cut liver slices. Toxicology in Vitro. 29 (5), 1012-1020 (2015).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Disease Models & Mechanisms. 8 (10), 1227-1236 (2015).
- Li, M., de Graaf, I. A., Groothuis, G. M. Precision-cut intestinal slices: alternative model for drug transport, metabolism, and toxicology research. Expert Opinion on Drug Metabolism & Toxicology. 12 (2), 175-190 (2016).
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Wagner, D. E., et al. Design and Synthesis of an Artificial Pulmonary Pleura for High Throughput Studies in Acellular Human Lungs. Cellular and Molecular Bioengineering. 7 (2), 184-195 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon